Способ получения окислителя энергетических конденсированных систем
Иллюстрации
Показать всеИзобретение относится к области энергетических конденсированных систем, а именно окислителям твердотопливных систем на основе нитрата аммония (НА). Способ включает смешение солей нитрата аммония и хлорида калия, нагрев смеси в водной среде до полного растворения, снижение температуры до образования кристаллов без перемешивания, после чего интенсивно перемешивают смесь до установления равновесия, фильтрование образовавшихся кристаллов и сушку. Хлорид калия дозируют в исходную смесь в количестве, позволяющем получить его содержание в твердой фазе не менее 3%. Способ позволяет получить окислитель на основе НА, не имеющий фазовых превращений в интервале температур от -50 до +100°C. В полученном окислителе изменяется термическое разложение НА - наблюдается взрывной характер экзоэффекта, резко увеличивается тепловыделение. Эффект достигается за счет образования в результате ионного обмена на наноуровне равновесной твердой фазы сложного состава, обладающей новыми физико-химическими свойствами. 4 ил., 5 пр.
Реферат
Настоящее изобретение относится к области энергетических конденсированных систем (ЭКС). Окислитель, полученный по данному способу, может быть использован в твердотопливных составах газогенерирующих устройств, например в автомобильных подушках безопасности, твердотопливных огнетушителях, спасательных шлюпках, ракетных топливах и др.
Известно, что проблема снижения выбросов неблагоприятных продуктов горения ЭКС: соединений хлора (Cl2, HCl и т.д.), которые оказывают вредное воздействие на окружающую среду и на здоровье человека, вплоть до выпадения кислотных дождей и образования озоновых дыр может быть решена применением окислителей, не содержащих хлора, например дешевого нитрата аммония NH4NO3 (HA) [Синогина Е.С. Изучение воспламенения и горения высокоэнергетических материалов на основе бесхлорных окислителей / автореф. дисс. на соискание степени к.т.н., 2006 г].
Однако ЭКС на основе нитрата аммония (HA) имеют ряд недостатков, которые ограничили их использование: в первую очередь, это низкий уровень баллистических характеристик (низкая скорость горения, высокая чувствительность скорости горения к давлению), другим существенным недостатком можно считать фазовое превращение в кристаллической структуре HA в эксплуатационном Интервале температур, так как циклические изменения температуры могут сопровождаться необратимым увеличением объема кристаллов окислителя и твердотопливных газогенерирующих композиций на его основе, приводящим к растрескиванию и разрушению их структуры.
Известен способ (патент США №3018164 от 23.01.62 г.), по которому получают фазостабилизированный HA введением в расплав HA 10-15% нитрата калия (НК), охлаждением расплава, фракционированием полученного плава и добавлением его кратной порции в чистый HA, чтобы получить содержание НК менее 8%, подогрев этой смеси в трубе, помещенной в масло. Этот продукт обладает стабильностью, выраженной в отсутствии модификационного перехода IV↔III в интервале температур от -45 до +100°C.
Данный способ обладает рядом недостатков: при циклическом испытании в интервале температур от -50 до +50°C происходит распад твердого раствора и восстановление фазовых переходов, кроме того, существенный недостаток - сложная многостадийная технология при осуществлении промышленного производства окислителя.
Вторая проблема - низкая скорость горения смесей на основе HA может быть решена введением катализаторов: эффективные катализаторы - соли трех- и шестивалентного хрома, хлориды щелочных и щелочноземельных металлов, соединения меди, свинца, железа, перманганат калия, пятиокись ванадия и некоторые другие [Рубцов Ю.И., Казаков А.И., Вайс Н.Г., Алексеев И.И., Стрижевский И.И., Мошкович Е.Б. Экспериментальное исследование термического разложения закисленной аммиачной селитры // Журнал прикладной химии, 1988, т.61, вып.1, с.131-132. Архипов В.А., Горбенко Т.И., Савельева Л.А., Синогина Е.С. Термическое разложение и горение смесевых композиций, содержащих нитрат аммония // Известия ВУЗов. Физика, 2005, т.48, №11, с.11-14. Глазкова А.П. Катализ горения взрывчатых веществ / А.П. Глазкова. - М.: Наука, 1976, 264 с. Манелис Г.Б. Термическое разложение и горение взрывчатых веществ и порохов / Г.Б. Манелис, Г.М. Назин, Ю.И. Рубцов, В.А. Струнин. - М.: Наука, 1996, 400 с.].
В работе [Попок В.Н., Хмелев В.Н. Влияние оксидов и хлоридов металлов на параметры энерговыделения в энергетических материалах на основе нитрата аммония / Ползуновский Вестник, 2009, №3, c.252-264] отмечено одновременное влияние хлоридов металлов на скорость терморазложения HA и горения твердотопливной композиции.
Наиболее близким к предлагаемому изобретению по технической сущности и принятому за прототип является изобретение «Газогенерирующие композиции, обладающие низкой температурой самовоспламенения, способы генерации газов» [United States Patent 6,673,172 Wheatley et al. January 6, 2004 г.], заключающееся в получении легкоплавкого окислителя смешиванием нитрата серебра и хлорида калия, нагреве смеси до образования легкоплавкой эвтектики и/или твердого раствора и далее получение гранул с включениями спрессованных твердых порошков газогенерирующих составов.
Недостатком прототипа можно считать использование в качестве неорганической азотнокислой соли нитрата серебра в количестве 25% мас. и около 10% мас. хлорида калия (ХК). Такое содержание солей металлов приведет к образованию значительного количества конденсированной фазы и снижению объема газообразных продуктов, что приведет к снижению эффективности газогенерирующего состава. Только замена нитрата серебра на HA позволит исключить образование конденсированной фазы, увеличит объем образующейся газовой фазы и снизить стоимость конечной композиции.
Задача, решаемая предлагаемым изобретением заключается в разработке способа получения дешевого и экологически безопасного окислителя ЭКС с требуемыми физико-химическими характеристиками.
Технический результат, на достижение которого направлено настоящее изобретение, состоит в следующем: простым технологическим приемом, который легко осуществить на имеющемся промышленном оборудовании получен окислитель для ЭКС на основе HA, представляющий собой совместные кристаллы окислителя с катализатором его термического разложения - хлоридом калия, обладающие фазовой стабильностью в интервале температур от -50 до +100°C, экзотермическим разложением системы в одну стадию при минимальном содержании добавки.
Положительный результат, достигаемый в результате описанного способа, обеспечивается за счет образования равновесной сложной системы твердых растворов, двойной соли и эвтектик в конечном продукте взаимодействия за счет проведения последовательных операций и изотермической сокристаллизации (ИС).
Поставленная задача решается разработкой способа получения окислителя энергетических конденсированных систем, включающего смешение солей нитрата аммония и хлорида калия, нагрев смеси до полного растворения, причем нагрев осуществляется в водной среде, затем температуру снижают до образования кристаллов без перемешивания, после этого интенсивно перемешивают смесь до установления равновесия, отфильтровывают образовавшиеся кристаллы, сушат, а хлорид калия дозируют в исходную смесь в количестве, позволяющем получить его содержание в твердой фазе не менее 3%.
Контроль достижения состояния равновесия осуществляют по содержанию иона K+ - пламенно-фотометрическим методом.
Положительный результат связан со следующими закономерностями, протекающими в процессе кристаллизации: в результате ионного обмена между НА и добавкой образуется сложная система (1),
состоящая из солей NH4NO3, KCl, KNO3, NH4Cl, между которыми могут происходить взаимодействия с образованием двойных солей, эвтектик и твердых растворов.
Система (1) является политермическим разрезом тройной взаимной системы, в которую входят следующие двойные системы:
NH4NO3-KNO3 (2), NH4NO3-NH4Cl (3), KNO3-KCl (4) и NH4Cl-KCl (5) (Справочник по плавкости систем из безводных неорганических солей [Текст]. В 2 т., т. 2. Системы тройные, тройные взаимные и более сложные / Под ред. Н.К. Воскресенской и др. - М.-Л.: АН СССР, 1961, 585 с.). В системе (2) идентифицированы твердые растворы до содержания KNO3 40% на основе III фазы НА, эвтектика и двойная соль 2NH4NO3·KNO3 (ДС). В системе (3) обнаружена эвтектика с температурой плавления 140°C при содержании 17,6% NH4Cl, в системе (4) - эвтектика при 5% KNO3 с температурой плавления 320°C и полиморфное превращение KNO3 - 128°C, в системе (5) подтверждено образование твердых растворов с содержанием KCl до 30% с температурой плавления от 520°C. Такие сложные свойства двойных систем, входящих в состав основной, обусловливают конечные физико-химические характеристики формируемой кристаллической фазы, которые, в свою очередь, зависят от степени конверсии добавки и гомогенизации конечных продуктов.
Перед авторами стояла задача получить термодинамически устойчивую кристаллическую композицию при совмещении химических (образование двойной соли, эвтектик, твердых растворов) и физических процессов (формирование кристаллической фазы).
Предварительными исследованиями было установлено, что двойная соль 2NH4NO3·KNO3 не образуется при температуре 25°C, а образуется только при температурах более 80°C (Ворохобин И.С. Физико-химический анализ системы NH4NO3-KNO3-Н2O при 25°C / Вязенова И.А., Таранушич В.А. // Инженерный вестник Дона: [электрон. журн.] - 2014, №1, - Режим доступа: archive/nly2014/2281), поэтому для создания условий образования ДС и выделения ее в кристаллическую фазу из водного раствора пересыщение создавали за счет нагрева раствора до полного растворения (более 80°C) с дальнейшим охлаждением до 25°C.
Для оценки адсорбируемости добавки наиболее надежным считается правило Панета, согласно которому в кристалл встраиваются прочно те частицы, которые дают с основным кристаллом в результате ионного обмена наименее растворимое соединение (Петров Т.Г. Выращивание кристаллов из растворов [Текст] / Т.Г. Петров, Е.Б. Трейвус, Ю.О. Пунин, А.П. Касаткин; 2-е изд., перераб. и доп. - Л.: Недра, 1983, с. 53). Нами было установлено, что растворимость ДС в воде - 38,04 при 25°C, а НА - 67,63 при 25°C, то есть ДС, согласно правилу Панета, будет встраиваться в структуру НА.
При росте пересыщения сверх предела наступает спонтанная или самопроизвольная кристаллизация, а согласно эмпирическому правилу Вант-Гоффа соли тем легче образуют пересыщенные растворы, чем больше произведение валентности составляющих их ионов: ХК с одновалентными ионами образует растворы с малым пересыщением, а вещества, образующие несколько полиморфных модификаций могут давать сильно пересыщенные растворы (к ним можно отнести НК и НА, растворы которых могут долго существовать в пересыщенном состоянии). Устойчивость пересыщенных растворов зависит и от типа кристаллической решетки выделяющейся соли [Матусевич Л.Н. Кристаллизация из растворов в химической промышленности [Текст] / Л.Н. Матусевич. - М.: Химия, 1968, 304 с. 135, с. 68]: наиболее устойчивы растворы солей с кристаллами низкой симметрии (моноклинной или триклинной), а вещества с кубической решеткой легче кристаллизуются. То есть введение добавки будет способствовать переходу формируемой фазы в более высокую симметрию (из IV в III), что также будет приводить к росту скорости кристаллизации системы.
Выбор метода сокристаллизации исходных компонентов осуществляли на основании анализа известных технологий (Мелихов И.В. Сокристаллизация [Текст] / И.В. Мелихов, М.С. Меркулова. - М.: Химия, 1975, 280 с.): метод диффузионного отжига требует длительного времени проведения (до 10 суток); метод спонтанной перекристаллизации также связан с большими затратами по времени проведения процесса, что для крупнотоннажных производств экономически не выгодно; методы непрерывной и периодической принудительной перекристаллизации сложны, а результат практически не отличается от других методов сокристаллизации, поэтому для дальнейших исследований был выбран метод изотермического снятия пересыщения, суть которого состоит в следующем - после создания пересыщения (которое для НА создать легко в связи с его высокой растворимостью в воде) раствор с добавкой интенсивно перемешивают в течение времени, необходимого для достижения состояния равновесия. При таких условиях кристаллы выделяются в виде высокодисперсной фазы, которая подвержена ударной перекристаллизации и оствальдовому созреванию. При условии начального высокого пересыщения и интенсивного перемешивания система быстро достигает состояния равновесия, а сформированные кристаллы становятся максимально гомогенными и однородными.
Только использование метода изотермического снятия пересыщения с интенсивным перемешиванием позволит установить равновесное распределение примеси, так как при очень медленной скорости кристаллизации при малом пересыщении раствора в каждый момент времени происходит установление равновесия, а так как концентрация в растворе постоянно изменяется, то так же неравномерно изменяется состав кристаллических слоев, отлагающихся на гранях кристалла, и поэтому кристаллы растут неоднородными по составу изоморфной примеси. Исходя из этого для максимальной степени гомогенизации было необходимо одновременно использовать факторы снижения температуры с целью образования пересыщения в растворе и интенсивное перемешивание, которые позволят изменять скорость кристаллизации.
В режиме вынужденной конвекции (интенсивное перемешивание) при повышении скорости течения раствора и уменьшении толщины диффузионного слоя скорость диффузии еще более возрастает, а градиенты пересыщений вдоль грани уменьшаются, что позволяет быстро выращивать крупные однородные кристаллы, получение которых при других режимах затруднительно (Петров Т.Г. Выращивание кристаллов из растворов [Текст] / Т.Г. Петров, Е.Б. Трейвус, Ю.О. Пунин, А.П. Касаткин; 2-е изд., перераб. и доп. - Л.: Недра, 1983, с. 26).
Влияние перемешивания раствора - «механический» фактор имеет большое значение в процессах массовой кристаллизации не только потому, что в промышленной кристаллизации процесс идет при движении раствора, но и в связи с тем, что это один из немногих факторов при помощи которого можно изменять качество готового продукта (Матусевич Л.Н. Кристаллизация из растворов в химической промышленности [Текст] / Л.Н. Матусевич. - М.: Химия, 1968, с. 75).
Исследуемая система состоит из изоморфных компонентов и их вхождение в кристалл зависит от физико-химических свойств исходных веществ, степени их взаимодействия, состава раствора и условий кристаллизации: температуры, скорости кристаллизации, интенсивности перемешивания.
Рост скорости перемешивания приводит к равномерному распределению примесей в кристалле за счет того, что:
- кристаллы не сращиваются между собой (не образуют друзы);
- кристаллы становятся однородными (примесь распределяется равномерно);
- снижается возможность захвата маточного раствора за счет многократной перекристаллизации;
- изменяется скорость диффузии, которая способствует выравниванию концентрации добавки возле поверхности кристалла и в растворе.
Матусевич Л.Н. подчеркивает «иногда только подбором гидравлических условий можно получить однородный продукт» (Матусевич Л.Н. Кристаллизация из растворов в химической промышленности [Текст] / Л.Н. Матусевич. - М.: - Химия, ).
В результате использования предлагаемой технологии образуется равновесная гомогенная твердая фаза, состоящая из сложной системы твердых растворов, двойной соли и эвтектик и обладающая новыми физико-химическими свойствами: фазовой стабильностью в интервале температур от -50 до +100°C, интенсивным экзотермическим разложением системы в одну стадию при минимальном содержании добавки.
Авторами впервые установлено, что совокупность вышеназванных технологических операций позволяет решить техническую задачу за счет образования в результате ионного обмена на наноуровне равновесной твердой фазы сложного состава, обладающей новыми физико-химическими свойствами. Совокупность образовавшихся твердых фаз позволила достигнуть технического результата, заявленного в патенте.
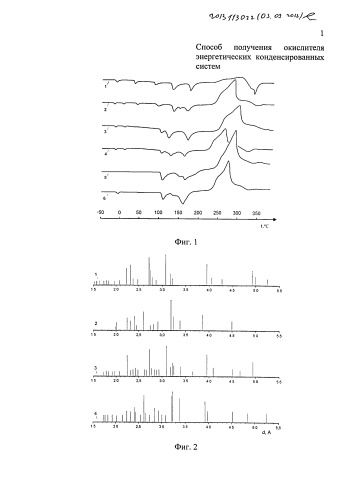
На фиг. 1 представлены кривые дифференциально-термического анализа. На фиг. 2 представлены штрих-рентгенограммы образцов. На фиг. 3 представлены кривые ИК-спектроскопического анализа. На фиг. 4 электронные фотографа и образцов.
Пример 1
Процесс осуществлен по патенту США №6673172: НА марки «чда» в количестве 4,85 г и ХК марки «ч» в количестве 0,15 г после смешения загружают в термостойкий стеклянный сосуд с регулируемым нагревом и смесь нагревают до полного растворения твердой фазы (осуществляют сокристаллизацию из расплава компонентов - CP). После завершения процесса смесь охлаждают, измельчают, при необходимости фракционируют и исследуют методами физико-химического анализа: фиг. 1 (кривая 3), фиг. 2 (кривая 4), фиг. 3 (кривая 3). Получен образец с содержанием ХК 3%.
Пример 2 (механическое смешение)
НА марки «чда» в количестве 4,85 г и ХК марки «ч» в количестве 0,15 г после смешения и механического истирания в фарфоровой ступке исследуют методом ДТА: фиг. 1 (кривая 2). Получен образец с содержанием ХК 3%.
Пример 3 (заявляемый способ)
НА марки «чда» в количестве 32,03 г, ХК в количестве 3,96 г и 15 г дистиллированной воды загружают в стеклянную установку для сокристаллизации с регулируемым нагревом (термостат) и повышают температуру до 80±2°C до полного растворения твердой фазы. После образования гомогенного раствора прекращают перемешивание и снижают температуру до 25°C, включают интенсивное перемешивание раствора и выдерживают его до достижения состояния равновесия в течение не менее 1,5 часов (метод равновесной изотермической сокристаллизации при 25°C - ИС). Образовавшиеся кристаллы отделяют от фильтрата на фильтре Шотта и сушат в вакуум-сушильном шкафу при температуре 90°C в течение 2 часов. Содержание добавки ХК в твердой фазе 2,62%: фиг. 1 (кривая 6).
Пример 4 (заявляемый способ)
НА марки «чда» в количестве 32,03 г, ХК в количестве 5,08 г и 15 г дистиллированной воды загружают в стеклянную установку для сокристаллизации с регулируемым нагревом и нагревают до полного растворения твердой фазы при температуре 80±2°C. После образования гомогенного раствора температуру снижают до 25°C и включают интенсивное перемешивание до достижения состояния равновесия (не менее 1,5 часов). Образовавшиеся кристаллы отделяют от фильтрата на фильтре Шотта и сушат в вакуум-сушильном шкафу при температуре 90°C в течение 2 часов. Содержание добавки ХК в твердой фазе 3,11%: фиг. 1 (кривая 5).
Пример 5 (сокристаллизация из воды при 90°C)
НА марки «чда» в количестве 4,85 г, ХК в количестве 0,15 г и 15 г дистиллированной воды загружают в выпарную установку, проводят процесс сокристаллизации при постоянной температуре 90±2°C и интенсивном перемешивании до полного удаления влаги (метод сокристаллизации из водного раствора при 90°C - СВР). После завершения процесса смесь охлаждают, измельчают, при необходимости фракционируют и сушат в вакуум-сушильном шкафу при температуре 90°C в течение 2 часов. Образец с содержанием ХК 3%: фиг. 1 (кривая 4), фиг. 2 (кривая 3), фиг. 3 (кривая 4).
На фиг. 1 приведены кривые дифференциально-термического анализа (ДТА) образцов (кривые 2-6) и нитрата аммония (кривая 1). По результатам ДТА можно сделать вывод, что только метод изотермической сокристаллизации (ИС), разработанный авторами, позволяет получить окислитель на основе НА при содержании ХК 3,11%, не имеющий фазовых превращений в интервале температур от -50 до +100°C (кривая 5). Одновременно изменяется характер термического разложение этого образца - наблюдается взрывной вид экзоэффекта, резко увеличивается тепловыделение. В образце с содержанием ХК 2,62% (кривая 6), полученном по заявляемому способу, в интервале температур от -50 до +100°C наблюдается полиморфный переход при температуре -20°C, т.е. данный образец не обладает фазовой стабильностью в заданном интервале температур, что свидетельствует о необходимости вводить ХК в количестве не менее 3%.
На фиг. 2 представлены результаты рентгено-фазового анализа (РФА) образцов НА без добавок III фаза (кривая 1), НА с 3,11% ХК полученный ИС (кривая 2), НА с 3% ХК полученный СВР (кривая 3), НА с 3% ХК полученный CP (кривая 4). Данные РФА показали, что образец, полученный по заявляемому способу, кристаллизуется в III фазе НА (кривая 2).
На фиг. 3 представлены результаты ИК-спектроскопического анализа: НА без добавок (кривая 1), НА с 3% ХК по примеру 1 (кривая 3), НА с 3% ХК по примеру 2 (кривая 2), НА с 3% ХК по примеру 5 (кривая 4), НА с 3,11% ХК по примеру 4 (кривая 5). Результаты ИК-спектроскопии подтвердили индивидуальность и высокую кристалличность фазы, образовавшейся при использовании предлагаемого способа ИС - кривая 5.
На фиг. 4 приведены электронные фотографии образцов НА с добавкой ХК, полученные по примеру 1, 5 и 3. Как видно из приведенных результатов исследования, равномерное распределение добавки наблюдается только в образце, полученном по заявленному способу.
Способ получения окислителя энергетических конденсированных систем, включающий смешение солей нитрата аммония и хлорида калия, нагрев смеси до полного растворения, отличающийся тем, что нагрев осуществляют в водной среде, затем снижают температуру до образования кристаллов без перемешивания, после этого интенсивно перемешивают смесь до установления равновесия, отфильтровывают образовавшиеся кристаллы, сушат, а хлорид калия дозируют в исходную смесь в количестве, позволяющем получить его содержание в твердой фазе не менее 3%.