Штамм гибридных культивируемых клеток животных mus musculus α-продуцент моноклональных антител, специфичных к гранулоцитарному колониестимулирующему фактору (gcsf) человека
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и медицины. Предложен штамм гибридных культивируемых клеток животных mus musculus α-продуцент моноклональных антител, специфичных к гранулоцитарному колониестимулирующему фактору (GCSF) человека, депонированный в Специализированной коллекции клеточных культур Института цитологии РАН под номером РККК (П) 662 Д. Изобретение позволяет расширить арсенал штаммов, продуцирующих моноклональные антитела, специфичные к GCSF, используемые для научно-исследовательских и медицинских целей. 2 ил., 2 табл., 2 пр.
Реферат
Изобретение относится к области биотехнологии, в частности, к гибридомной технологии, и касается получения штамма гибридных клеток, продуцирующих моноклональные антитела, специфичные к гранулоцитарному колониестимулирующему фактору (GCSF) человека.
Моноклональные антитела (МКА) являются высокоспецифичными антителами, образованными одной гибридной антителообразующей клеткой, иммортализованной путем слияния с миеломной линией, к определенному антигену, которые синтезируются специально создаваемыми линиями клеток-продуцентов [Кеннет Р.Г., Мак-Керн Т.Дж., Бехтол К.Б. Моноклональные антитела: Гибридомы: новый уровень биологического анализа. М.: Медицина, 1983; Ройт А., Бростофф Дж., Мейл Д. Иммунология. М.: Мир, 2000; Köhler G., Milstein С. Continuous cultures of fused cells secreting antibody of predefined specificity. Nature 256, 495-497, 1975]. В онкологии МКА широко применяются для изучения опухолевых антигенов, иммунодиагностики и иммунотерапии опухолей [Барышников А.Ю., Тоневицкий А.Г. Моноклональные антитела в лаборатории и клинике. М.: Медицина, 1997]. Следовательно, получение новых гибридов актуально.
МКА, продуцируемые гибридомами, используются для выявления основных структурно-функциональных свойств белков, в том числе и GCSF человека, который является одним из ключевых цитокинов, применяемых в онкологии [Avalos B.R. Molecular analysis of the granulocyte colony-stimulating factor receptor // Blood, 88(3). - P.761-77, 1996; Xiao BG, Lu CZ, Link H. Cell biology and clinical promise of G-CSF immunomodulation and neuroprotection. J Cell Mol Med.; 11 (6), P.1272-90, 2007]. Мониторинг концентрации GCSF в биологических жидкостях человека позволяет выявить тип иммунного ответа организма на конкретное заболевание - инфекционное, атопическое, аутоиммунное. Одним из важных подходов определения GCSF в биологических жидкостях является использование МКА, продуцируемых гибридомами.
Аналогов заявляемого штамма гибридомы не обнаружено.
Задачей изобретения является расширение арсенала штамма гибридных клеток, продуцирующих МКА, специфичных к GCSF человека.
Поставленная задача решается тем, что предложен новый штамм гибридных культивируемых клеток животных mus musculus α-продуцент моноклональных антител, специфичных к GCSF человека.
Технический результат заявляемого изобретения состоит в расширении арсенала штаммов гибридом, продуцирующих МКА, специфичных к GCSF, используемых для научно-исследовательских и медицинских целей.
Заявляемому штамму гибридных культивируемых клеток животных mus musculus α присвоено название ICO 220. Полученная новая гибридома ICO-220 - продуцент МКА, специфичных к GCSF человека, обладает стабильными культуральными и морфологическими характеристиками, хранится в Специализированной коллекции клеточных культур Института цитологии РАН под номером РККК (П) 662 Д. Полученная гибридома ICO 220 может использоваться при создании диагностических тест-систем с целью мониторинга при проводимой терапии и характеризуется следующими свойствами.
Штамм ICO 220 получали путем слияния клеток мышиной миеломы NS-1 с клетками селезенки мышей линии Balb/C, иммунизированных внутрибрюшинно рекомбинантным аналогом GCSF - препаратом граноцит. Слияние проводили с помощью полиэтиленгликоля ПЭГ-1500. Селекцию гибридных клеток проводили с помощью среды ГАТ (гипоксантин - аминоптерин - тимидин). Штамм прошел 3 клонирования, позитивных клонов не менее 85%. Штамм ICO 220 синтезирует МКА, специфически взаимодействующие в твердофазном иммуноферментном анализе с GCSF человека.
Гибридные клетки штамма ICO 220 росли в виде суспензии in vitro или в виде асцитной опухоли в перитонеальной полости после внутрибрюшинного введения гибридных клеток штамма ICO 220 сингенным мышам Balb/C.
Для культивирования использовали культуральные флаконы (25 и 75 см2), среду RPMI-1640, содержащую 20% эмбриональную телячью сыворотку (ЭТС), 5,96 г/л HEPES, 3 мМ глутамина, 0,11 г/л пирувата натрия, 40 мкг/л гентамицина. Гибридные клетки штамма ICO 220 в количестве 1×106 культивировали при температуре 37°C в атмосфере, содержащей 5% CO2. Частота пассирования - 2-3 суток. Кратность пересева - 1:2-1:4.
За 14 дней до введения гибридных клеток штамма ICO 220 мышам линии Balb/C предварительно внутрибрюшинно вводили пристан - 2,6,10,14-тетраметилпентадекан в дозе 0,3-0,5 мл, затем гибридные клетки штамма ICO 220 в дозе 5-10×106 клеток на одну мышь. Асцитную жидкость, содержащую МКА-продуценты GCSF, забирали через 9-12 дней после введения.
Секрецию МКА штамма ICO 220 определяли методом иммуноферментного анализа (ИФА). На 7 день культивирования in vitro секреция МКА-продуцентов GCSF составляла 9-5 мкг/мл. При пассировании in vivo секреция МКА в асцитной жидкости составила 5-10 мг/мл.
Получено МКА класса IgG1, легкая цепь - каппа, специфичность - GCSF.
Штамм ICO 220 сохраняли криоконсервацией 24 часа при температуре -70°C, а при длительном хранении гибридные клетки штамма ICO 220 хранили при температуре -196°C.
Для восстановления штамма ICO 220 проводили его быстрое размораживание. Жизнеспособность определяли по дифференциальной окраске гибридных клеток штамма ICO 220 с использованием 0,4% раствора трипанового синего, при pH 7,2-7,3, восстановление гибридных клеток штамма ICO 220 составляло 70-80%.
Стабильность продуцирования антител гибридными клетками штамма ICO 220 сохранялась на протяжении 30 пассажей в культуре клеток и 5 пассажей на мышах линии Balb/C.
При исследовании на контаминацию штамма ICO 220 в культуре штамма бактерий и грибов, а также заражения микоплазмой не обнаружено.
При кариологическом исследовании штамма ICO 220 модальное число хромосом составило 76. Маркерных хромосом не выявлено.
Для оценки сохранения реактивности МКА штамма ICO 220 с GCSF проводили иммуноферментный тест на связывание полученных МКА с GCSF: Стенки лунок полистиролового планшета покрывали граноцитом, вносили МКА штамма ICO 220, затем конъюгат антимышиного иммуноглобулина с пероксидазой хрена и субстрат - перекись водорода с тимедин - 3,3, 5,5 тетраметилбензидином (ТМБ). При положительной реакции появлялось голубое окрашивание.
Изобретение иллюстрируется фиг.1 и 2 и табл.1 и 2.
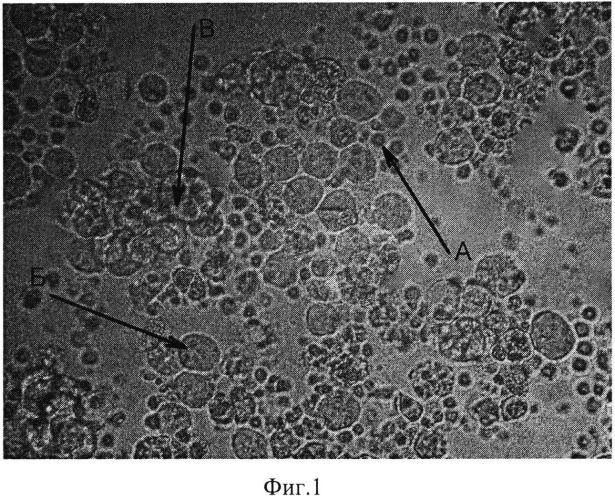
На фиг.1 представлена микроскопия гибридизации клеток мышиной миеломы NS-1 с клетками селезенки мышей линии Balb/C, иммунизированных внутрибрюшинно препаратом граноцит: А - клетки селезенки (спленоциты), Б - клетки миеломы, В - гибридизация спленоцитов с клетками миеломы.
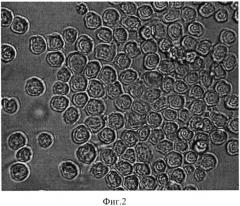
На фиг.2 показана полученная гибридома ICO 220. Гибридные клетки представляют собой крупные округлые клетки с узким ободком базофильной цитоплазмы, растут в виде конгломератов по типу «гроздьев винограда». Ядра гиперхромные, неправильно-овальной формы, крупные, с грубой структурой ядерного хроматина.
В табл.1 представлены результаты оценки связывания антител гибридомы ICO 220 с антигеном GCSF в культуральной жидкости (супернатант) методом твердофазного ИФА.
В табл.2 представлены результаты оценки связывания антител гибридомы ICO 220 с антигеном GCSF в асцитной жидкости методом твердофазного ИФА, где в качестве отрицательного контроля была использована асцитная жидкость гибридомы, специфичная к раку молочной железы (РМЖ).
Пример 1. Получение штамма гибридомы ICO 220:
Мышей линии Balb/C в возрасте 3-4 месяцев трехкратно иммунизировали препаратом граноцит по схеме: внутрибрюшинно вводили 50 мкг граноцита в полном адъюванте Фрейнда; через 28 суток повторно внутрибрюшинно вводили 40 мкг граноцита в неполном адъюванте Фрейнда; через 28 суток внутривенно вводили 60 мкг граноцита в физиологическом растворе. На третий день после последней инъекции у иммуннизированных мышей исследовали кровь для проверки на специфическую активность. Титры специфических антител в сыворотках крови определяли с помощью непрямого твердофазного ИФА, используя в качестве отрицательного контроля сыворотку крови неиммунизированной мыши в титре 1:1000.
На 4-й день после последней внутривенной инъекции извлекали селезенку мыши и проводили гибридизацию спленоцитов в количестве 107 с клетками миеломной линии в количестве 106 в присутствии 1 мл 50% раствора полиэтиленгликоля в течение 1 минуты. Для слияния использовали перевиваемую клеточную линию мышиной миеломы NS-1, дефектную по гену гипоксантин-гунинфосфорибозилтрансфераза. Миелома NS-1 синтезирует, но не секретирует легких цепей иммуноглобулинов. В результате слияния с родительскими лимфоцитами этот дефект устраняется. Только гибридные клетки способны расти в среде ГАТ. Гибридизацию проводили по методу Kohler G., Milstain С. [Kohler G., Milstain С., 1975]. Миеломные клетки дважды отмывали средой RPMI-1640 и смешивали с клетками селезенки в соотношении 1:10. Полученную смесь клеток отмывали средой RPMI-1640 и помещали в 20 мл среды RPMI-640, центрифугировали при 800 об/мин в течение 3 минут и инкубировали при температуре 37°C в течение 20 мин. Затем среду RPMI-1640 удаляли и к осажденным клеткам добавляли медленно, по каплям, в течение 1 минуты 1 мл 50% полиэтиленгликоля, предварительно прогретого при температуре 37°С и также медленно добавляли 20 мл среды RPMI-1640. Далее клетки два раза отмывали, не встряхивая, при 800 об/мин в течение 3 мин, добавляли среду ГАТ в культуральную среду с 20% ЭТС и оставляли при температуре 37°C в течение 2 часов. После этого клетки ресуспендировали и разливали по 0,2 мл в концентрации 1-1,5×105 клеток в лунки 96-луночного планшета (фиг.1). На 8-й день из среды удаляли ГАТ и далее культивировали в среде с 20% ЭТС, 2 мМ/L-глутамина, 50 мкг/мл гентамицина. Полученные гибридные клетки (гибридомы) инкубировали при температуре 37°C в атмосфере 5% CO2. Замену среды в лунках с гибридомными клонами штамма ICO 220 проводили каждые 2-3 дня. Видимые колонии появлялись через 10-14 дней.
Для отбора положительных гибридомных клонов, продуцирующих МКА штамма ICO 220, использовали непрямой твердофазный ИФА. В лунки 96-луночного полистиролового планшета вносили по 100 нг граноцита, приготовленного на 0,01 М карбонатном буфере, pH 9,6, в объеме 100 мкл, и затем выдерживали при температуре 4°C в темноте в течение 16-18 ч. Лунки отмывали фосфатно-солевым буферным раствором, содержащим 0,1% Твина-20 (ФСБ-Т) и 3% бычьего сывороточного альбумина (БСА), затем вносили по 100 мкл культуральной жидкости (супернатант) МКА и инкубировали при температуре 37°C в течение 2 часов, отмывали ФСБ-Т, добавляли пероксидазный конъюгат антител к IgG мыши в разведении 1:1000. Инкубировали при температуре 37°C в течение 1 часа. После каждого этапа несвязавшиеся реагенты отмывали ФСБ-Т. В качестве хромогена использовали ТМБ. Интенсивность окраски в лунках определяли после остановки реакции H2SO4 на спектрофотометре при длине волны 450 нм (табл.1).
Клонирование гибридом состояло из 2-х этапов: приготовление питательного слоя (фидер) с использованием тимоцитов; клонирование гибридом методом лимитирующих разведений.
Из одной вилочковой железы мыши выделяли около 106 клеток. Вносили по 100 мкл тимоцитов в концентрации 5×104 в лунки 96-луночного планшета, кроме краевых лунок. В краевые лунки вносили по 200 мкл среды RPMI-1640, содержащей антибиотики. Инкубировали клетки с фидером в CO2-инкубаторе в течение 24 часов. На 2-й день, после исключения контаминации, проводили клонирование гибридных клеток методом лимитирующих разведений. На 10-й, 14-й день проверяли надосадочную жидкость полученных гибридомных клонов на специфическую активность методом ИФА (табл.1). Отбирали колонии, выросшие в лунках, с наименьшим количеством гибридных клеток на лунку (фиг.2). Клонирование проводили дважды для стабилизации полученных гибридомных клонов. Далее гибридные клетки штамма ICO 220 переносили в флаконы (75 см2) с культуральной средой, содержащей 10% ЭТС, и помещали в CO2-инкубатор для последующего культивирования.
Пример 2. Получение МКА ICO 220
За 1-2 недели до введения гибридных клеток штамма ICO 220, выращенных в культуре, мышам линии Balb/C (возраст 3-4 мес) вводили внутрибрюшинно 0,3-0,5 мл минерального масла (пристана). Концентрация антител в асцитной жидкости составляла 7-10 мг/мл. Через 7-10 дней после введения гибридных клеток штамма ICO 220 у мышей забирали асцитную жидкость и определяли антигенсвязывающую активность полученных МКА штамма ICO 220 методом твердофазного ИФА (табл.2). Часть полученной асцитной жидкости замораживали и хранили при температуре -30°C, а осадок гибридных клеток замораживали или вводили мышам для дальнейшего пассирования и получения антител.
| Таблица 1 | ||
| Исследуемые образцы | титр | оптическая плотность (450 нм) |
| 1. Отрицательные контроли: | ||
| А) лунка, содержащая только буфер | - | 0,056 |
| Б) лунка, содержащая культуральную среду для гибридом | - | 0,071 |
| В) лунка, содержащая супернатант иммунных лимфоцитов, не подвергшихся гибридизации | - | 0,075 |
| 2. лунка, содержащая супернатант полученных гибридных клеток ICO 220 | - | 1,866 |
| Таблица 2 | ||
| Исследуемые образцы | титр | оптическая плотность (450 нм) |
| 1. Отрицательные контроли: | ||
| А) лунка, содержащая только буфер | - | 0,060 |
| Б) лунка, содержащая асцитную жидкость гибридомы, специфичную к РМЖ | 1:100 тыс. | 0,069 |
| 2. лунка, содержащая асцитную жидкость полученной гибридомы ICO 220 | 1:100 тыс | 2,791 |
Штамм гибридных культивируемых клеток животных mus musculus α-продуцент моноклональных антител, специфичных к гранулоцитарному колониестимулирующему фактору (GCSF) человека, депонированный в Специализированной коллекции клеточных культур Института цитологии РАН под номером РККК (П) 662 Д.