Димерная окклюдантная наноструктура, меченная молекулой, активной в отношении рамановского рассеяния, локализованной в межчастичном соединении, ее использование и способ ее получения
Иллюстрации
Показать всеИзобретение относится к области молекулярной биологии и биохимии. Предложена димерная наноструктура, способ её конструирования, способ детектирования аналита и набор для детектирования аналита. Изобретение позволяет повысить чувствительность и точность детектирования единичных молекул. 4 н. и 19 з.п. ф-лы, 6 ил., 4 пр.
Реферат
Область техники
Настоящее изобретение относится к окклюдантной димерной наночастице, меченной молекулой, активной в отношении рамановского рассеяния, в межчастичном соединении. Более конкретно, настоящее изобретение относится к димерной наноструктуре, содержащей две наночастицы с молекулой, активной в отношении рамановского рассеяния, локализованной в соединении между ними, в котором каждая наночастица состоит из золотого или серебряного ядра с олигонуклеотидами, прикрепленными к его поверхности, и золотой или серебряной оболочки, покрывающей ядро. Также настоящее изобретение относится к применению димерной наноструктуры и способу получения димерной наноструктуры.
Предшествующий уровень техники
Крайне чувствительное, точное детектирование единичных молекул из биологических и других образцов экстенсивно широко применяется во многих областях, включая медицинскую диагностику, патологию, токсикологию, взятие проб из окружающей среды, химический анализ и т.д.
Не так давно, в связи с этой целью, при исследовании метаболизма, распределения и связывания малых синтетических материалов и биомолекул в биолого-химической области широко применяли специфически меченые наночастицы или химические материалы. Как правило, применяли радиоактивные изотопы, органические флуоресцентные красители и квантовые точки.
Показательные примеры радиоактивных изотопов, обычно применяемых в исследовании, включают 3H, 14C, 32P, 35S и 125I, которые соответственно применяют при замене 1Н, 12C, 31P, 32S и 127I, которые широко распространены в организме. Радиоактивные изотопы долгое время применяли вследствие того, что радиоактивные и нерадиоактивные изотопы имеют почти одинаковые химические свойства и могут быть применены взаимозаменяемо, и вследствие того, что даже небольшое количество радиоактивных изотопов можно детектировать благодаря их относительно высокой энергии эмиссии. Однако с радиоактивными изотопами труднее работать вследствие того, что радиация, которую они излучают, приносит вред организму. Кроме того, хотя их энергия эмиссии высока, некоторые радиоактивные изотопы имеют короткий период полураспада, и их нельзя хранить в течение длительного периода времени, или они не пригодны для использования в длительных экспериментах.
В качестве альтернативы радиоактивным изотопам применяли органическое флуоресцентное вещество. Органическое флуоресцентное вещество поглощает энергию определенной длины волны и излучает свет при другой характерной длине волны. В частности, поскольку способы детектирования все больше упрощаются, радиоактивные вещества сталкиваются с пределами детектирования и, таким образом, требуют длительных периодов времени для детектирования. В противоположность этому органическая флуоресценция теоретически делает возможным детектирование даже единственной молекулы ввиду того, что она может излучать тысячи фотонов на молекулу при надлежащих условиях. Однако в отличие от радиоактивных изотопов, флуорофоры не могут заменять элементы активных лигандов напрямую. Вместо этого они узко предназначены быть связанными с составными группами, которые не оказывают эффекта на их активность, в свете взаимосвязи структуры и активности. Кроме того, флуоресцентные метки претерпевают со временем фотообесцвечивание. Другой проблемой, связанной с флуорофорами, является интерференция между различными флуорофорами вследствие того, что они повторно излучают широкий спектр длин световых волн, тогда как они возбуждаются крайне узким спектром длин волн. Более того, лишь небольшое число флуорофоров является доступным.
Квантовая точка является полупроводниковым наноматериалом, который составлен, как правило, из CdSe или CdS в качестве ядра и ZnS или ZnSe в качестве оболочки, и может излучать свет различных цветов в зависимости от размера частиц и вида материалов ядра. В сравнении с органическими флуоресцентными красителями квантовые точки могут возбуждаться более широким спектром длины волны возбуждения, излучать свет в более широком спектре длин волн и, таким образом, демонстрируют большее число различных цветов. Таким образом, квантовые точки привлекли большое внимание благодаря их преимуществу над органическими флуоресцентными красителями. Однако недостатком квантовых точек является высокая токсичность и трудности крупномасштабного производства. Кроме того, число доступных квантовых точек, несмотря на теоретическую вариабельность, на практике крайне ограничено.
Для преодоления этих проблем для мечения в последнее время применяли рамановскую спектрометрию и/или поверхностный плазмонный резонанс.
Поверхностно усиленное рамановское рассеяние (SERS) является спектроскопическим способом, который использует явление, в результате которого, когда молекулы абсорбируются на шероховатой поверхности металлической наноструктуры, такой как золотые или серебряные наночастицы, интенсивность рамановского рассеяния резко увеличивается до уровня 106-108 раз по сравнению с нормальными рамановскими сигналами. Когда свет проходит через прозрачную среду, молекулы или атомы среды рассеивают свет. В этом случае небольшая часть фотонов проходит неупругое рассеяние, известное как рамановское рассеяние. Например, часть падающих фотонов взаимодействует с молекулами таким образом, что высвобождается энергия, или электроны возбуждаются до более высоких энергетических уровней, так что рассеянные фотоны обладают частотой, отличной от той, что бывает у падающих фотонов. Вследствие того, что частоты спектра рамановского рассеяния обуславливают химические составы и структурные свойства абсорбирующих свет молекул в образце, рамановскую спектроскопию совместно с нанотехнологией, которая непрерывно развивается в настоящее время, можно дополнительно развивать в направлении высокочувствительного детектирования единичной молекулы. Кроме того, существует серьезное ожидание, что сенсор SERS можно использовать в значительной мере в качестве медицинского датчика. Эффект SERS взаимосвязан с плазмонным резонансом. В этом контексте металлические наночастицы демонстрируют очевидный оптический резонанс в ответ на падающее электромагнитное излучение вследствие коллективного связывания электронов проводимости в металле. Таким образом, наночастицы золота, серебра, меди и других конкретных металлов могут быть основой наноразмерной антенны для расширения локализации электромагнитных лучей. Молекулы, локализованные вблизи этих частиц, обнаруживают гораздо большую чувствительность к рамановской спектроскопии.
Таким образом, в дополнение к крайне чувствительному анализу ДНК, проводится много исследований, связанных с применением сенсоров SERS для детектирования биомаркеров, включающих гены и белки, в целях ранней диагностики различных заболеваний. Рамановская спектроскопия обладает различными преимуществами перед другими способами (инфракрасная спектроскопия). Тогда как инфракрасная спектроскопия может детектировать сильные сигналы от молекул, которые имеют дипольный момент, рамановская спектроскопия позволяет детектировать сигналы даже от неполярных молекул, в которых индуцированная поляризуемость снижена. Таким образом, почти все органические молекулы имеют свои собственные смещения частоты при рамановском рассеянии (см-1). Кроме того, будучи свободной от интерференции молекул воды, рамановская спектроскопия пригодна для использования в детектировании биомолекул, включая белки, гены и т.д. Однако вследствие низкой интенсивности сигнала развитие рамановской спектроскопии еще не достигло уровня, при котором его можно было бы практически применять, несмотря на то, что исследования охватывают значительный период времени. После своего открытия поверхностно-усиленное рамановское рассеяние (SERS) постоянно развивалось до такого уровня, который позволяет детектировать сигналы на молекулярном уровне от рандомизированных скоплений наночастиц, абсорбировавших флуоресцентные красители (Science 1997, 275(5303), 1102; Phys rev lett 1997, 78(9), 1667). После этого сообщалось о многих исследованиях оптимизации SERS различными наноструктурами (наночастицы, нанооблочки, нанопровода). Для того чтобы применять SERS в качестве высокочувствительного способа детектирования для биодатчика, Mirkin et al. сообщали о высокочувствительном ДНК анализе с использованием ДНК-модифицированных золотых наночастиц, с пределом детектирования 20 fM (2002, science, 297, 1536). Однако не было почти никаких успехов в приготовлении SERS-активных субстратов из единичных молекул на основе индуцированной солью агрегации серебряных (Ag) наночастиц, несущих молекулы, активные в отношении рамановского рассеяния (например, Родамин 6G) после первого исследования. В одном отчете сообщали, что только одна часть (менее чем 1%) гетерогенно агрегированных коллоидов имеет SERS-активность единичной молекулы (J Phys Chem B 2002, 106(2), 311). Подобно этому, произвольно шероховатые поверхности обеспечивают множество интересных существенных данных, связанных с SERS, но эту стратегию принципиально невозможно воспроизвести, так как даже малое изменение морфологии поверхности ведет к значительному изменению усиления. Недавно Fang et al. сообщили о количественном измерении распределения центров усиления при SERS. Самые горячие SERS-активные центры (EF>109) насчитывали только 63 центра из общего количества 1000000 центров, но составили 24% от общей интенсивности SERS (Science, 2008, 321, 388). В связи с этим объединение SERS-активных наночастиц в хорошо определенные и воспроизводимые горячие SERS наночастицы привело бы к высоконадежному, чувствительному анализу биомолекул и было бы очень полезным для применения в ксенодиагностике и методах визуализации in vivo.
Однако общепринятые способы детектирования для различных аналитов, как правило, используют коллоидные частицы металлов на субстратах и/или подложках, например, агрегированные наночастицы Ag. Это устройство часто способствует SERS-детектированию с чувствительностью, повышенной до порядка 106-108, но не может быть применено для детектирования единичных молекул малых аналитов, таких как нуклеотиды. Несмотря на достоинства SERS механизмы, стоящие за SERS, еще недостаточно поняты. Дополнительно, детектирование единичных молекул, основанное на SERS, обычно сталкивается со многими проблемами структурной воспроизводимости и надежности вследствие не только трудности в синтезе и контроле хорошо определенных наноструктур, но также и изменений увеличения выхода при длине волны и направлении поляризации излучения возбуждения, применяемого для измерения спектра. Такие проблемы остаются громадной помехой в применении SERS в попытке достичь развития и коммерциализации нанобиосенсоров. Чтобы решить вышеизложенные проблемы, сейчас, более чем когда-либо ранее, необходимы исследования оптических свойств и точные измерения SERS-усиления хорошо определенных наноструктур.
Исследования SERS-усиления, сообщенные Jeong, Proke, Schneider, и Lee, et. al., и с димером металлических частиц, поддерживают теоретические SERS-исследования по SERS-усилению, где SERS является результатом очень сильного электрического поля (т.е. горячая точка или интерстициальное поле), которое образуется, по меньшей мере, между двумя наночастицами. В соответствии с теоретическими вычислениями, основанными на электромагнитном принципе, в «горячей точке» ожидается усиление SERS в примерно 1012 раз. В силу этого увеличенная чувствительность детектирования рамановского рассеяния, хотя, по-видимому, не являющаяся гомогенной внутри агрегатов коллоидных частиц, варьирует в зависимости от наличия «горячих точек». Однако информация о физической структуре «горячих точек», диапазоне расстояний от наночастиц, где достигается повышенная чувствительность, и увеличивающей чувствительность пространственной взаимосвязи между аналитами и агрегированными наночастицами еще нигде ранее не сообщалась. Кроме того, агрегированные наночастицы являются нестабильными в растворах, таким образом, оказывая противоположный эффект на воспроизводимость детектирования аналитов из единичных частиц.
Кроме того, хотя создавались теоретические имитационные модели и проводили экспериментальную проверку концепции димерных структур золота и серебра, о получении единичной молекулы, локализованной в соединении между наночастицами, еще не сообщалось. Синтез прочных SERS-активных наноструктур золота или серебра до сих пор остается нерешенной проблемой.
Ведущие к настоящему изобретению интенсивные и полные исследования развития наноструктур, способных к детектированию единичной ДНК с высокой чувствительностью и воспроизводимостью, проведенные авторами настоящего изобретения, имели результатом открытие того, что димерная окклюдантная наночастица, меченная молекулой, активной в отношении рамановского рассеяния, локализованной в межчастичном соединении, в котором расстояние между димерными наночастицами подогнано под желаемый диапазон посредством контроля толщины оболочки, показывает очень сильные сигналы поверхностно-усиленного рамановского рассеяния (SERS) с фактором усиления SERS (EF) до ~2,7×1012, и, как доказано, является высоковоспроизводимой частицей - «горячей точкой».
Раскрытие сущности изобретения
Техническая проблема
Таким образом, предмет настоящего изобретения относится к димерной окклюдантной наноструктуре, в которой молекула, активная в отношении рамановского рассеяния, локализована в межчастичном соединении.
Другой предмет настоящего изобретения относится к способу конструирования димерной наноструктуры.
Дополнительно, предмет настоящего изобретения относится к способу детектирования аналита с применением димерной наноструктуры.
Еще один дополнительный предмет настоящего изобретения относится к набору для детектирования аналита, содержащему димерную наноструктуру.
Техническое решение
В соответствии с вышеизложенным аспектом, настоящее изобретение относится к димерной окклюдантной наноструктуре, меченной молекулой, активной в отношении рамановского рассеяния, локализованной в межчастичном соединении.
Более подробно, димерная окклюдантная наноструктура по настоящему изобретению содержит две наночастицы, каждая из которых состоит из ядра (золотого или серебряного) и оболочки (золотой или серебряной), покрывающей ядро, где олигонуклеотиды прикреплены к поверхности каждой наночастицы, и части олигонуклеотидов выходят на внешнюю сторону оболочки, при этом частицы соединены друг с другом посредством прямой или непрямой гибридизации между двумя олигонуклеотидами. В каждой наночастице олигонуклеотид прикреплен одним концом к поверхности ядра, и в то же время частично выходит на наружную сторону оболочки. Экспонированные олигонуклеотидные последовательности двух наночастиц могут быть гибридизированы непосредственно одна с другой, когда они комплементарны одна с другой, или косвенно через олигонуклеотидную последовательность, комплементарную обеим экспонированным олигонуклеотидным последовательностям.
Как его применяют в настоящем документе, термин "ядро" относится к металлической частице, к поверхности которой непосредственно прикреплен олигонуклеотид. Предпочтительно, применяют золотую или серебряную частицу. Термин "оболочка" относится к металлическому, покрывающему ядро слою. Часть олигонуклеотида, прикрепленного к ядру, находится внутри оболочки. Предпочтительно, оболочка изготовлена из золота или серебра.
Таким образом, в предпочтительном варианте осуществления настоящего изобретения димерная окклюдантная наноструктура выбрана из группы, состоящей из i) димерной наноструктуры, состоящей из двух наночастиц, каждая из которых состоит из золотого ядра и серебряной оболочки, ii) димерной наноструктуры, состоящей из двух наночастиц, каждая из которых состоит из серебряного ядра и золотой оболочки, iii) димерной наноструктуры, состоящей из двух наночастиц, каждая из которых состоит из золотого ядра и золотой оболочки, и iv) димерной наноструктуры, состоящей из двух наночастиц, каждая из которых состоит из серебряного ядра и серебряной оболочки, и v) димерной наноструктуры, состоящей из двух наночастиц, одна из которых состоит из золотого ядра и серебряной оболочки, и другая частица состоит из серебряного ядра и золотой оболочки. Наиболее предпочтительно, димерная окклюдантная наноструктура по настоящему изобретению состоит из двух наночастиц, каждая из которых состоит из золотого ядра и серебряной оболочки.
Окклюдантная наноструктура по настоящему изобретению может быть в форме гомодимера или гетеродимера. Как он применяется в настоящем документе, термин "гомодимер" относится к димерной сруктуре, содержащей две наночастицы, идентичные по размеру и структуре друг другу, а термин "гетеродимер" относится к димерной структуре, содержащей две наночастицы, отличающиеся по размеру и структуре друг от друга.
Диаметр частицы ядра димерной окклюдантной наноструктуры для наномечения посредством поверхностно-усиленного рамановского рассеяния в соответствии с настоящим изобретением составляет предпочтительно порядка от 5 нм до 300 нм. Когда диаметр ядра менее чем 5 нм, получается эффект пониженного SERS-усиления. С другой стороны, диаметр ядра, превышающий 300 нм, накладывал бы много ограничений на биологическое применение наноструктуры. Более предпочтительно, размер диаметра ядра находится в диапазоне от 10 нм до 40 нм. Наночастицы могут быть приблизительно сферическими, но также могут иметь неправильную форму или какой-либо другой вид формы.
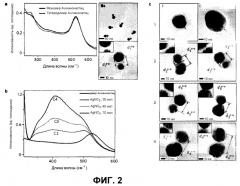
Нанооболочка наносится на поверхность частицы ядра. Будучи адаптированной к тому, чтобы обеспечивать поверхность частицы ядра эффектом усиленного рамановского рассеяния, нанооболочка облегчает спектроскопический анализ рамановского рассеяния. То есть частица ядра, покрытая нанооболочкой, увеличивает поверхность усиленного рамановского рассеяния, таким образом, гарантируя уравнивание сигналов от каких-либо химических веществ. Предпочтительно, оболочка имеет толщину от 1 нм до 300 нм и более предпочтительно от 1 нм до 20 нм. Кроме того, толщина оболочки может увеличиваться пропорционально диаметру ядра и длине используемой ДНК.
Ядро характеризуется присутствием там, по меньшей мере, одного функционального олигонуклеотида, прикрепленного к его поверхности. Например, ядро A может быть функционализировано защитной олигонуклеотидной последовательностью, модифицированной тиольной группой на 3'-конце и захватывающей мишень олигонуклеотидной последовательностью, модифицированной тиольной группой на 3'-конце. С другой стороны, ядро B может быть функционализировано двумя различными видами олигонуклеотидных последовательностей (защитная последовательность и захватывающая мишень последовательность - обе модифицированные тиольной группой на соответствующих 5'-концах). Кроме того, захватывающие мишень олигонуклеотиды, прикрепленные к ядру A или к ядру B, модифицированы молекулой, активной в отношении рамановского рассеяния. Альтернативно, олигонуклеотиды могут быть прикреплены к 5'-модифицированному концу ядра A в то время как ядро B функционализировано 3'-модифицированными олигонуклеотидами в соответствии с настоящим изобретением.
Как он применяется в настоящем документе, термин "защищитный олигонуклеотид" относится к олигонуклеотиду, который прикреплен к поверхности частицы ядра, стабилизируя частицу ядра с целью способствовать захватывающему мишень олигонуклеотиду прикрепляться должным образом к поверхности ядра и защищать его.
Как он применяется в настоящем документе, термин "захватывающий мишень олигонуклеотид" относится к олигонуклеотиду, имеющему последовательность, комплементарную последовательности таргетного олигонуклеотида. Оба соответствующих захватывающих мишень олигонуклеотида для ядра A и ядра B гибридизуются с общим таргетным олигонуклеотидом для образования димерной наноструктуры.
Как он применяется в настоящем документе, термин "таргетный олигонуклеотид" относится к олигонуклеотиду, который содержит последовательность, комплементарную обоим захватывающим мишень олигонуклеотидам для ядер A и B, и, таким образом, пригодную в качестве линкера, с которым эти два захватывающих мишень олигонуклеотида гибридизуются для образования димерной наноструктуры. Следует понимать, что "таргетный олигонуклеотид" не означает конечного таргетного аналита для анализа с использованием димерной наноструктуры.
Как защитный олигонуклеотид, так и захватывающий мишень олигонуклеотид можно модифицировать на их 3'- или 5'-концах поверхностно-связанной функциональной группой, которой они прикреплены к поверхности частицы ядра.
Как он применяется в настоящем документе, термин "поверхностно связанная функциональная группа" относится к соединению, которое связано с 3'- или 5'-концами каждого олигонуклеотида, и которая служит для прикрепления олигонуклеотида к частице ядра. Можно использовать без ограничений любую поверхностно-связанную функциональную группу при условии, что она способствует образованию такого малого агрегата наноструктур, что агрегат не осаждается. Поверхностно-связанную функциональную группу можно использовать для сшивания наноструктур, как описано ранее в данной области (Feldheim, The Electrochemical Society Interface, Fall, 2001, pp. 22-25). Соединение, имеющее поверхностно-связанную функциональную группу, пригодную в настоящем изобретении, содержит на его одном конце поверхностно-связанную функциональную группу, которая связана с поверхностью частицы ядра. Предпочтительно, поверхностно-связанная функциональная группа является серосодержащей группой, такой как тиольная или сульфгидрильная (HS). Таким образом, функциональная группа может быть соединением, представленным RSH, и являющимся производным спирта или фенола, в котором атом серы присутствует вместо атома кислорода. Альтернативно функциональная группа может быть группой тиолового сложного эфира или дитиолового сложного эфира, соответственно представленной как RSSR' и RSR', или аминогруппой (-NH2). Кроме того, соединение, имеющее поверхностно-связанную функциональную группу, можно связать с рядом реакционноспособных групп, например -NH2,-COOH, -CHO, -NCO, и эпоксидной группой, которая может реагировать с биомолекулами, такими как ДНК-зонды, антитела, олигонуклеозиды и аминокислоты. Эти реакционноспособные группы хорошо известны в данной области, и их можно применять к способу и аппаратуре по настоящему изобретению.
С другой стороны, олигонуклеотид может содержать спейсерную область на конце, противоположном линкерному соединению. Спейсерная область не только предохраняет оболочку, покрывающую ядро, от перекрывания таргетной распознающей последовательности захватывающего мишень олигонуклеотида, но также обеспечивает пространство для подходящей толщины оболочки. Примером спейсерной области является A10-PEG.
Как он применяется в настоящем документе, термин "молекула, активная в отношении рамановского рассеяния", относится к молекуле, которая облегчает детектирование и измерение аналита посредством рамановского детектора, когда димерная наноструктура по настоящему изобретению применяется к одному или нескольким аналитам. Захватывающий мишень олигонуклеотид либо на ядре A, либо на ядре B модифицирован молекулой, активной в отношении рамановского рассеяния. Молекула, активная в отношении рамановского рассеяния, создает специфический рамановский спектр и обладает преимуществом способствовать эффективному анализу последующих биомолекул.
В качестве молекул, активных в отношении рамановского рассеяния, пригодных в рамановской спектроскопии, можно применять органические или неорганические молекулы, атомы, комплексы или синтетические молекулы, красители, натуральные красители (фикоэритрин и т.д.), органические наноструктуры, такие как С60, бакиболы, углеродные нанотрубки, квантовые точки и органические флуоресцентные молекулы. Конкретные примеры молекул, активных в отношении рамановского рассеяния, включают FAM, Dabcyl, TRITC (тетраметил родамин-5-изотиоцианат), MGITC (малахитовый зеленый изотиоцианат), XRITC (X-родамин-5-изотиоцианат), DTDC (3,3-диэтилтиадикарбоцианин иодид), TRIT (тетраметил родамин изотиол), NBD (7-нитробенз-2-1,3-диазол), фталевую кислоту, терефталевую кислоту, изофталевую кислоту, пара-аминобензойную кислоту, эритрозин, биотин, дигоксигенин, 5-карбокси-4',5'-дихлор-2',7'-диметокси, флуоресцеин, 5-карбокси-2',4',5',7'-тетрахлорфлуоресцеин, 5-карбоксифлуоресцеин, 5-карбоксиродамин, 6-карбоксиродамин, 6-карбокситетраметил аминофталоцианин, азометин, цианин (Cy3, Cy3,5, Cy5), ксантин, сукцинилфлуоресцеин, аминоакридин, квантовые точки, аллотропы углерода, цианиды, тиол, хлор, бром, метил, фосфор и серу, но не ограниченные этим. Для применения в димерной наноструктуре по настоящему изобретению от молекулы, активной в отношении рамановского рассеяния, требуется продемонстрировать отчетливый спектр рамановского рассеяния, и она должна быть связана различными видами аналитов или иметь сродство с ним. Предпочтительными являются флуоресцентные красители цианинового типа, такие как Cy3, Cy3,5 и Cy5, или органические флуоресцентные молекулы, такие как FAM, Dabcyl, молекулы родамина и т.д. Эти органические флуоресцентные молекулы обладают преимуществом детектирования более высоких рамановских сигналов, резонируя под действием возбуждения лазерных длин волн, пригодных для рамановского анализа. Молекулы, активные в отношении рамановского рассеяния, могут быть прикреплены к аналитам прямо или через линкерное соединение.
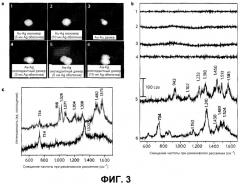
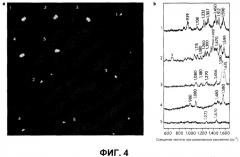
В соответствии с аспектом настоящего изобретения, выявлено, что наноструктура может детектировать SERS сигналы, только когда молекула, активная в отношении рамановского рассеяния, локализована на междучастичном стыке. Например, никакие SERS сигналы не могли быть детектированы для окклюдантных мономеров вследствие того, что они не обладали горячими точками, и присутствовала только одна молекула, активная в отношении рамановского рассеяния (фиг.3A-1, 2).
По другому аспекту, настоящее изобретение относится к способу конструирования димерной окклюдантной наноструктуры, меченной молекулой, активной в отношении рамановского рассеяния.
Более подробно, способ конструирования димерной окклюдантной наноструктуры, меченной молекулой, активной в отношении рамановского рассеяния, включает: 1) синтезирование ядра A и ядра B, соответственно, причем ядро A имеет защитный олигонуклеотид и захватывающий мишень олигонуклеотид, которые связаны с его поверхностью, а ядро B имеет защитный олигонуклеотид и захватывающий мишень олигонуклеотид, модифицированные на одном конце молекулой, активной в отношении рамановского рассеяния, которая связана с его поверхностью, 2) гибридизование ядра A и ядра B с таргетным олигонуклеотидом для образования димерной структуры, и 3) нанесение оболочки на ядро A и ядро B.
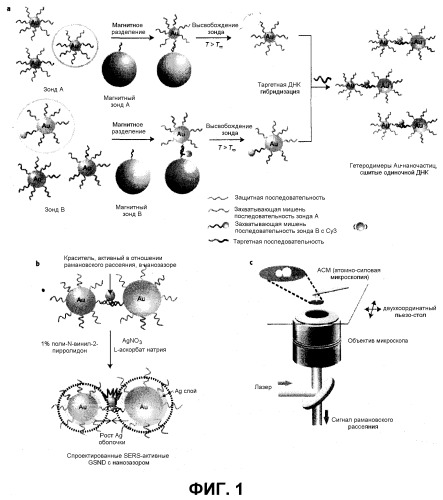
На первом этапе синтезируют ядро A и ядро B, каждое из которых обладает защитным олигонуклеотидом и захватывающим мишень олигонуклеотидом, связанными с их поверхностью. При синтезе частиц ядра по варианту осуществления настоящего изобретения золотое ядро A функционализировано двумя типами последовательностей ДНК, модифицированных тиольной группой на 3'-концах (защитная олигонуклеотидная последовательность и захватывающая мишень олигонуклеотидная последовательность). Аналогично, золотое ядро B функционализировано двумя типами ДНК-последовательностей, модифицированных тиольной группой на 5'-концах. Молярные отношения этих двух типов последовательностей (защитная последовательность/захватывающая мишень последовательность) составляют 99:1 для ядра A и 199:1 для ядра B. Эти соотношения были приняты такими, чтобы модифицировать один захватывающий мишень олигонуклеотид на зонд с учетом емкости загрузки по ДНК, зависящей от размера наночастиц (фиг.1A). Важно отметить, что Cy3, FAM или краситель Dabcyl, активные в отношении рамановского рассеяния, предварительно конъюгируют с захватывающим мишень олигонуклеотидом, связанным с ядром B.
Чтобы удалить мономер наночастицы, с которым не связаны захватывающие мишень последовательности, ядра, модифицированные олигонуклеотидами, можно очищать посредством процесса магнитного разделения. Тозил-модифицированные магнитные частицы (диаметр 1 мкм, Invitrogen) можно функционализировать аминомодифицированными таргетными олигонуклеотидными последовательностями, комплементарными к захватывающим мишень последовательностям для ядер A и B, соответственно. Только частицы ядра, имеющие захватывающие мишень последовательности, связанные с ними, образуют комплексы с магнитными частицами посредством гибридизации. После реакции гибридизации к реакционному раствору применяется наружное магнитное поле для разделения комплексов ядер и магнитных частиц. Ядра освобождаются от магнитных частиц посредством нагревания комплексов до температуры выше температуры плавления (Tm) гибридизированных двухцепочечных ДНК последовательностей.
На втором этапе ядрам A и B дают возможность образовывать димер посредством гибридизации с таргетной олигонуклеотидной последовательностью. На первом этапе частицы ядра A и B, разделенные и изолированные от магнитных частиц в буфере, например, 0,3M PBS, гибридизуются с достаточным количеством таргетной олигонуклеотидной последовательности для образования желаемой димерной наноструктуры. Таким образом, способ по настоящему изобретению дает возможность производить димер с высоким выходом продукта (70-80%).
На третьем этапе нанесение нанооболочки на частицы ядра можно предпочтительно проводить посредством реакции предшественника золотой частицы ядра с предшественником серебряной наночастицы при 10-100°C в растворителе. Предпочтительно, предшественник серебряной наночастицы выбран из AgNO3 и AgClO4. Любое соединение можно использовать в качестве предшественника золотых частиц ядра при условии, что оно содержит ионы Au. Предпочтительным является HAuCl4. Серебряные ионы или золотые ионы можно превратить в золотые или серебряные наночастицы посредством восстановителя. Примеры восстановителя, пригодного в настоящем изобретении, включают гидрохинон, борогидрид натрия (NaBH4) и аскорбат натрия, но не ограничены ими. Растворитель, пригодный для использования в образовании нанооболочки, является предпочтительно водным раствором (чистая вода или фосфатный буфер). Дополнительно, можно использовать стабилизатор для точного контроля толщины нанооболочки. Реакция при температуре менее чем 10°C занимает слишком много времени на образование серебряных наночастиц. С другой стороны, когда температура реакции превышает 100°C, образуются искривленные серебряные наночастицы. Таким образом, предшественники предпочтительно реагируют в пределах данного диапазона температур. Реакцию можно проводить в течение от 10 до 24 часов в зависимости от температуры реакции.
Димерная окклюдантная наноструктура, меченная молекулой, активной в отношении рамановского рассеяния, в межчастичном соединении, в соответствии с настоящим изобретением является функционализированной на ее поверхности или поверхности ядра молекулой зонда, способного распознавать аналит, так что она может быть применена для детектирования различных биомолекул.
Примерами аналитов являются аминокислоты, пептиды, полипептиды, белки, гликопротеины, липопротеины, нуклеозиды, нуклеотиды, олигонуклеотиды, нуклеиновые кислоты, сахариды, углеводы, олигосахариды, полисахариды, жирные кислоты, липиды, гормоны, метаболиты, цитокины, хемокины, рецепторы, нейромедиаторы, антигены, аллергены, антитела, субстраты, кофакторы, ингибиторы, лекарственные средства, фармацевтические вещества, нутриенты, прионы, токсины, токсические вещества, взрывчатые вещества, пестициды, вещества для химического оружия, биологические вредновоздействующие вещества, радиоактивные изотопы, витамины, гетероциклические ароматические соединения, онкогенные средства, мутагенные факторы, анестетики, амфетамин, барбитурат, галлюциногены, отходы и примеси. Когда аналитами являются нуклеиновые кислоты, они включают гены, вирусную РНК и ДНК, бактериальную ДНК, грибную ДНК, ДНК млекопитающих, кДНК, мРНК, РНК и фрагменты ДНК, олигонуклеотиды, синтетические олигонуклеотиды, модифицированные олигонуклеотиды, одно- и двухцепочечные нуклеиновые кислоты и природные или синтетические нуклеиновые кислоты.
Неограничивающие примеры распознающих аналиты молекул-зондов, связанных с поверхностью димерной наноструктуры, включают антитела, фрагменты антител, антитела, созданные методами генной инженерии, одноцепочечные антитела, белки рецепторов, белки лигандов, ферменты, ингибиторные белки, лектины, белки клеточной адгезии, олигонуклеотиды, полинуклеотиды, нуклеиновые кислоты и аптамеры.
Полную димерную наноструктуру по настоящему изобретению можно покрывать неорганическим веществом. После полного покрытия неорганическим веществом димерная наноструктура по настоящему изобретению может выдерживать более значительные воздействия структурной деформации. Таким образом, полное неорганическое покрытие стабилизирует димерную наноструктуру и является преимущественным для хранения и применения димерной наноструктуры. Можно использовать любое неорганическое вещество при условии, что оно не оказывает влияния на сигналы рамановского рассеяния. Предпочтительным неорганическим веществом является диоксид кремния.
По дополнительному аспекту, настоящее изобретение относится к способу детектирования аналита с применением димерной наноструктуры по настоящему изобретению.
Более подробно, способ включает 1) синтезирование димерной наноструктуры по настоящему изобретению; 2) функционализирование поверхности димерной наноструктуры или ядра молекулой-зондом, способной детектировать аналит; 3) воздействие на димерную наноструктуру образца, содержащего, по меньшей мере, один аналит; и 4) детектирование и идентификацию аналита посредством лазерного возбуждения и рамановской спектроскопии.
Предпочтительно, аналиты детектируются и идентифицируются с применением любой хорошо известной рамановской спектроскопии. Примеры рамановской спектроскопии, пригодной в настоящем изобретении, включают SERS (поверхностно-усиленная рамановская спектроскопия), SERRS (резонансная поверхностно-усиленная рамановская спектроскопия), гиперрамановская и/или CARS (когерентная антистоксовая рамановская спектроскопия).
Термин "поверхностно-усиленная рамановская спектроскопия" (SERS) относится к спектроскопическому способу, который использует явление, при котором, когда молекулы адсорбированы на шероховатой поверхности металлической наноструктуры, такой как золотые или серебряные наночастицы, или присутствуют в пределах расстояния в сотни нанометров от поверхности, интенсивность рамановского рассеяния существенно увеличивается до уровня 106-108 раз по сравнению с нормальными сигналами рамановского рассеяния. Термин "резонансная поверхностно-усиленная рамановская спектроскопия" (SERRS) относится к комбинации SERS и резонансной рамановской спектроскопии, которая использует пространственную близость к поверхности для усиления рамановской интенсивности, и длины волны возбуждения, подходящей для максимальной поглощающей способности анализируемой молекулы. Термин "когерентная антистоксовая рамановская спекроскопия" (CARS) относится к спектроскопическому способу, в котором два лазерных луча - переменный и фиксированный, падают на рамановскую активную среду, генерируя когерентный антистоксовый частотный луч.
В варианте осуществления способ детектирования аналитов в соответствии с настоящим изобретением включает 1) синтезирование димерной наноструктуры по настоящему изобретению; 2) функционализирование поверхности димерной наноструктуры или ядра молекулой зонда, комплементарного детектируем