Способ эрадикации стволовых инициирующих раковых клеток
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к онкологии, и касается эрадикации стволовых инициирующих раковых клеток. Для этого экспериментальным животным, несущим развитый асцит, парентерально вводят циклофосфан в дозе 200 мг/кг. Затем в течение 12 часов каждый час после введения циклофосфана вводят препарат ДНК интраперитонеально. При этом препарат ДНК состоит из смеси препаратов фрагментированной ДНК человека и кросс-линкированной ДНК человека, обработанной нитроген-мустардом. Способ обеспечивает эффективную эрадикацию стволовых раковых клеток за счет синергетического действия цитостатика и препарата ДНК. 2 з.п. ф-лы, 5 ил.
Реферат
Изобретение относится к медицине, в частности к онкологии и молекулярной биологии, и может быть использовано для эрадикации (уничтожения) популяции раковых клеток, обладающих инициирующими свойствами (стволовые-туморогенные раковые клетки).
Онкологические заболевания занимают второе место по общей смертности после сердечно-сосудистых заболеваний, а страх перед возможностью возникновения злокачественного новообразования имеет глубокий социальный резонанс. Статистические данные свидетельствуют о том, что заболеваемость онкологическими заболеваниями ежегодно растет, при этом прослеживается явная тенденция к «омоложению рака».
Недавние статистические исследования демонстрируют, что смертность от рака в США в последнее время снизилась [1-3]. Подобное снижение отмечается и в странах ЕС [3-5]. Тем не менее причиной этого снижения являются главным образом ранний диагноз и начало лечения, резкое снижение курения и потребления алкоголя, и незначительную долю в этом снижении играют улучшение терапевтических результатов в лечении отдельных видов рака [6]. В целом смертность от рака в 21 веке такая же, как и 50 лет назад, тогда как смертность от сердечных, церебрососудистых и инфекционных болезней уменьшилась за это время на 2/3 [7].
В мировой практике разработаны и переведены в стандарты основные способы лечения больных со злокачественными новообразованиями.
Общепринятой терапией, вне зависимости от происхождения рака, является использование различных схем циторедуцирующего воздействия. В случае солидных опухолей применяют хирургическое удаление опухолевого очага с последующим продолжением химиотерапии. В последние годы бурно развиваются подходы иммунотерапии рака с использованием противораковых вакцин различного происхождения (дендритноклеточные вакцины, вакцины на основе вирусов, размножающихся в раковых клетках, вакцины на основе чистых раковых антигенов (например, Her-2), ДНК-вакцины) и методов in vivo вакцинации с применением мощных адъювантов, стимулирующих развитие адаптивного противоракового иммунитета непосредственно в организме больного (CpG ODN, Panagen) [8-11]. Широко используется облучение и терапия гормонами в случае гормонозависимых опухолей.
Методы неиммунной и не гормонзависимой противораковой терапии могут быть разделены на две широкие категории: традиционные методы химиотерапии и методы молекулярной терапии, в которых действие лекарства направлено на определенную молекулярную мишень, которая, как предполагается, важна для жизнеспособности раковой клетки и опухоли в целом [12].
Циторедуцирующая терапия с применение цитостатиков, являющаяся основой лечения раков, направлена на удаление видимой массы опухоли. Как следует из огромной клинической практики, угроза рецидивов в ближайшие 5 лет при такой терапии достигает 30-50%. Этот факт связан с присутствием в неотрансформированной ткани популяции клеток, обладающих потенциалом стволовых клеток [13, 14].
За последние годы описано много различных молекулярных факторов, определяющих превращение нераковой клетки в раковую. С этим связано развитие направления так называемой таргетной терапии, направленной на определенный специфический фактор раковой клетки. Тем не менее доведение до клинического применения с сохранением эффективности лечения человека таргетных препаратов, направленных на определенную мишень, важную для существования ракового потенциала, оказывается в высшей степени сложной задачей, связанной с огромной дистанцией между модельными системами и реальной болезнью.
Как показывают исследования последних лет, болезнь гораздо более сложна, чем представлялось ранее. Основное в непредсказуемости ответа болезни на различные терапевтические воздействия связано с существованием, как уже отмечалось выше, стволовых инициирующих раковых клеток [13, 14]. Свойства этих клеток таковы, что с трудом просматривается эффективная терапия, способная преодолеть «видимую неубиваемость» этого типа клеток (циркулирующие опухолевые клетки, диссеминированные раковые клетки, визикулярные щиты, обратный эффект Варбурга) [15, 16]. Раковые стволовые клетки, как полагают, участвуют в повторном появлении рака благодаря своим туморогенным свойствам и поддержании резистентности ко многим обычным терапевтическим воздействиям. Это подкрепляет предположение, что они могут не реагировать на традиционную терапию и вызывать постоянное появление рака. Показано, что стволовые клетки рака груди, растущие в культуре, оказались резистентными к химиотерапевтическим агентам [17], а раковые стволовые клетки из лейкемии оказались резистентными к химиотерапевтическим лекарствам, daunorubicin и Ara-C [18]. Раковые стволовые клетки из поджелудочной железы и толстого кишечника также резистентны к химиотерапии [19, 20], а некоторые раковые стволовые клетки резистентны к радиации [21, 22]. Более того, пациенты с раком груди обнаруживали более высокий процент клеток со свойствами стволовых клеток рака груди после химиотерапии [23], указывая тем самым, что терапия может оказаться менее эффективной в отношении убийства раковых стволовых клеток, хотя она элиминирует остальные раковые клетки. Механизмы резистентности к лекарствам у раковых стволовых клеток изучены недостаточно, но возможные объяснения включают избыточную экспрессию белков, которые откачивают лекарство из клеток, энзимы, которые метаболизируют лекарства, или антиапоптические белки [24].
В этой связи разработка таргетных, направленных на стволовые инициирующие раковые клетки способов, и создание новых препаратов, позволяющих провести конечную эрадикацию стволовых раковых клеток, является актуальной задачей, а нахождение адекватных методов терапии позволит сделать скачок в лечении злокачественных раков.
В клинической практике известны лекарства, которые находят раковые стволовые клетки, указывая тем самым, что эти клетки могут быть элиминированы у пациентов. Например, parthenolide и rapamycin, по-видимому, убивают раковые стволовые клетки при острой миелоидной лейкемии [25, 26]. Также temozolomide преимущественно элиминирует раковые стволовые клетки в glioblastoma [27], а стволовые клетки рака мозга под воздействием bevacizumab снижают свою туморогенность [28, 29]. Ограниченность применения этих лекарств связана, в первую очередь, с их специфичностью к определенным строго детермепированным опухолям.
Известен способ лечения, основанный на применении препарата тиоридазина (который блокирует рост стволовых клеток острой миелоидной лейкимии) в сочетании со стандартной химиотерапией [30]. Тиоридазин, известный как препарат нейролептического или антипсихотического действия, взаимодействует с рецепторами нейротрапсмитора допамина. Эти рецепторы находятся на стволовых лейкозных клетках и стволовых клетках рака молочной железы, что ограничивает область применения этого способа, поскольку он может быть использован, если на клетках опухоли присутствуют допаминовые рецепторы. В случае их отсутствия стволовые раковые клетки будут резистентны к проводимому лечению тиридазином.
Известен способ уничтожения стволовых раковых клеток с использованием генномодифицированных бактерий [31]. Установлено, что при данном способе происходит взаимодействие измененных бактерий и стволовой раковой клетки таким образом, что в раковую клетку доставляются специфические белковые факторы бактерий, снимающие устойчивость раковых клеток к медикаментозной терапии.
Указанный способ имеет ограниченную область применения, поскольку не для всех опухолей известны адекватные лекарственные средства, которые будут действовать синергично в ассоциации с генномодифицированным штаммом бактерий.
Другой способ основан на применении специфических антител Н90, блокирующий CD44v на раковых клетках острого миелолейкоза [32]. CD44 является ключевым регулятором, необходимым для хоуминга стволовых клеток опухоли и их дальнейшего поддержания и недифференцированном состоянии. Н90 влияет на обе функции этой молекулы, нарушая как хоуминг, так и приводя к дифференцировке лейкемических бластов и их последующей гибели. Н90 блокирует хоуминг примитивных CD34+CD38-клеток как в костный мозг, так и в селезенку, а также препятствует трансмиграции лейкемических клеток через стенки капилляров.
Недостаточная эффективность данного способа связана с тем, что указанный маркер CD44 специфичен для узкого круга опухолей и, следовательно, его антагонист Н90 будет неэффективен для лечения множества других раков. В силу указанных причин этот способ также обладает относительно узкой областью применения.
Наиболее близким к предложенному является способ избирательного убийства раковых, но не нормальных клеток [33], приводящий к синтезу токсинов внутри раковых клеток, включающий доставку в опухоль генной конструкции, состоящей из гена фермента, способного превращать внутри раковой клетки нетоксическое соединение - пролекарство в токсин, и многопрофильного промотора, обеспечивающего внутри раковых клеток экспрессию гена фермента, способного превращать внутри раковых клеток, но не в нормальных клетках, нетоксичное соединение - пролекарство в токсин, содержащий измененную или расширенную, по сравнению с известными промоторами, совокупность участков узнавания белков-факторов транскрипции, необходимый набор которых существует в большинстве раковых, но не в нормальных клетках, и представляющий тандемную комбинацию BIRC5 и TERT промогоров или производное тандемной комбинации BIRC5 и TERT промоторов, образованное в результате делеции, замены, инсерции или иной мутации промотора, не влияющих на активность промотора, но при этом меняющих его структуру, или доставку двух генных конструкций, одна из которых состоит из гена фермента, способного превращать внутри раковой клетки нетоксичное соединение - пролекарство в токсин, и блокированного промотора, при деблокировании обеспечивающего экспрессию этого гена, а вторая является деблокирующей конструкцией, содержащей охарактеризованный выше многопрофильный промотор, присоединенный к гену деблокатора, кодирующего белок деблокатора и способный деблокировать неактивный блокированный промотор, при этом синтезируемый внутри раковой клетки токсин диффундирует в окружающие раковые клетки. Там же предложен экспрессирующий вектор, содержащий описанный выше многофункциональный промотор, соединенный с транскрибируемой последовательностью, которая при транскрипции продуцирует информационную РНК, кодирующую фермент, превращающий нетоксичное - пролекарство во внутриклеточный токсин.
Изобретение обеспечивает системы транскрипционного контроля экспрессии генов-убийц, позволяющие создавать новые технологии генной терапии рака.
Однако этот способ обладает относительно низкой эффективностью, поскольку при его использовании отсутствуют гарантии доставки вектора, содержащего ген-убийцу, к стволовой раковой клетке и, более того, нет никаких проявлений того, что генные конструкции доставлены к клетке мишени и производят эффективный транзитный трансгенез или вирусную инфекцию раковых клеток.
В описании известного способа приведен пример, предполагающий использование генов, экспрессирующих токсины, направленные на ингибирование системы репликации. Однако помимо активно пролиферирующих раковых клеток существуют клетки спящих метастазов, которые сами могут являться спящими метастазами. Клетки спящих метастазов не пролиферируют, что делает предлагаемый способ неэффективным по отношению к таким клеткам. Кроме того, уровень транскрипции в этих клетках полностью не изучен, а «законсервированное» состояние спящих метастазов и образующих их клеток подвергает сомнению эффективную транскрипцию в таких клетках искусственных генноинжененрных конструкций.
Задача, решаемая в настоящем изобретении, направлена на повышение эффективности эрадикации стволовых инициирующих раковых клеток с целью повышения эффективности лечения раковых заболеваний.
Требуемый технический результат заключается в повышении эффективности эрадикации стволовых инициирующих раковых клеток.
Поставленная задача решается, а требуемый технический результат достигается в способе эрадикации стволовых инициирующих раковых клеток, основанном на совместном воздействии цитостатика циклофосфана (ЦФ) и препарата двуцепочечной ДНК (дцДНК), при котором мышам линии СВА весом 20-35 г, несущим развитый асцит, парентерально вводится цитостатик ЦФ в дозе 200 мг/кг и далее в течение 12 часов каждый час после введения ЦФ мыши получают интраперитониальные инъекции препарата ДНК, состоящего из смеси препаратов дцДНК и кросс-линкированной дцДНК в соотношении 3:1 в количестве 0.5 мг на инъекцию, независимо от веса мышей-опухоленосов, суммарно 6 мг.
Кроме того, требуемый технический результат достигается тем, что в качестве препарата ДНК используется смесь препаратов дцДНК и кросс-линкированной ДНК размером 300-6000 пар оснований, при этом в препарате кросслинкированной дцДНК на 1000 пар оснований приходится 80-120 межцепочечных сшивок.
Предложенный способ основан на естественной способности стволовых (инициирующих) раковых клеток интернализовать экзогенные экстраклеточные не объединенные в компартменты фрагменты двуцепочечной ДНК и на участии интернализованных фрагментов в репаративном процессе при репарации межцепочечных сшивок в фазе NER после действия цитостатических препаратов кросслинкирующего ряда.
В современной литературе отсутствуют указания на предлагаемый способ убийства стволовых раковых клеток. Следовательно, предложение отвечает критериям новизны и изобретательского уровня.
Ниже приводятся теоретические и экспериментальные данные, подтверждающие, что изобретение отвечает критерию практической (промышленной) применимости.
На чертеже представлены:
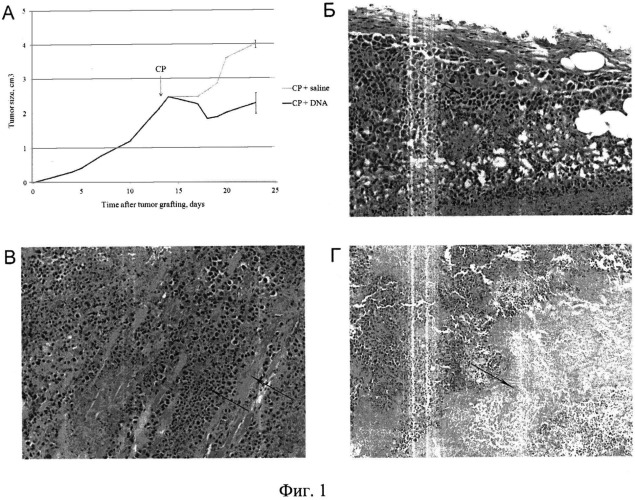
на фиг.1 - результаты патологоанатомичсского анализа органов и тканей экспериментальных мышей в агонистической фазе развития симптома. А) График динамики роста солидной опухоли в группах после обработки ЦФ+ДНК (18-30 часов) и физ. раствором. На 25 сутки эксперимента экспериментальные мыши, находящиеся в агонистической фазе развития симптома, и контрольные мыши были забиты для патологоанатомического исследования. На рисунке приведены характерные срезы опухолевой ткани, а также области с обширными некротическими зонами. Б) Ткань опухоли (стрелка) отчетливо выявляется среди элементов дермы и подкожной клетчатки благодаря выраженной клеточной атипии и агрессивному характеру роста. Увеличение ×200. В) Перемежение клеточных тяжей опухоли с профилями фрагментов мышечных волокон (отмечено стрелками). Увеличение ×200. Г) Обширный некроз опухолевой ткани. Увеличение ×100.
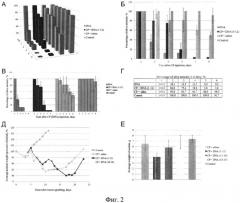
на фиг.2 - обобщенная характеристика гибели мышей при различных обработках и сравнение эффектов различных обработок на развитие перевитого асцитного трансплантата. Динамика гибели животных с асцитной опухолью Кребс-2 после обкалывания их препаратом дцДНК, ЦФ, физ. раствором или дцДНК в сочетании с ЦФ в режиме 1-12 (1-12 часов после инъекции ЦФ). Приведены три графика: общий вид гибели мышей при различных обработках (А), сравнение по группам (Б), сравнение по дням в каждой группе (В). Приведены обобщенные результаты по 5 экспериментам (Г, таблица). Отсутствие доверительного интервала свидетельствует о том, что во всех экспериментах в рассматриваемой точке всегда выживала одна или две мыши, что не позволило провести статистический обсчет. Тем не менее эти точки взяты в рассмотрение, так как они характеризуют максимальный токсический эффект проведенных обработок. Д) Динамика изменения веса животных с асцитной формой опухоли Кребс-2 после обработки ЦФ и препаратом дцДНК. 100% - исходный вес животных. Приводится средний вес в расчете на одну мышь после общего взвешивания. Е) Вес асцита у животных с асцитной формой опухоли Кребс-2 после обработки ЦФ и препаратом дцДНК в различные промежутки времени. Полученные графики демонстрируют, что введение препарата дцДНК в режиме 1-12 часов после инъекции ЦФ является наиболее эффективным режимом, максимально тормозящим рост перевитого графта. Также из полученных результатов следует, что наиболее эффективный режим приводит к длительной ремиссии в развитии опухолевого трансплантата (Д, красная линия).
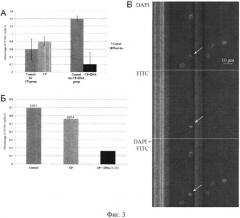
на фиг.3 - результаты анализа эффективности элиминации CD34+ клеток асцита Кребс-2, одновременно характеризующихся способностью интернализовать фрагменты экстраклеточной дцДНК. Цитологический анализ и анализ в проточной цитометрии. А) Количество (%) CD34+ клеток в асците Кребс-2 у мышей в контроле (до инъекций) и на 3-и сутки после инъекций цитостатика (СР) и цитостатика совместно с препаратом дцДНК (CP+DNA). Результаты получены при помощи проточного цитофотометра. Б) Количество (%) CD34+ клеток в асците Кребс-2 у мышей в контроле (до инъекций) и через 24 часа после инъекций цитостатнка (СР) или цитостатика совместно с ДНК человека (CP+DNA). Результаты получены при анализе цитологических препаратов. В) Общий цитологический план препаратов клеток асцита Кребс-2, окрашенных антителами против CD34+. DAPI - окраска на хроматин, FITC - маркер CD34+ клеток, DAPI+FITC - наложение двух (DAPI+FITC) изображений.
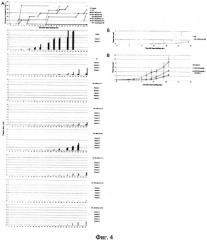
на фиг.4 - in vivo анализ эффективности элиминации CD34+ клеток асцита Кребс-2, одновременно характеризующихся способностью интернализовать фрагменты экстраклеточной дцДНК. Выбранным группам мышей внутримышечно перевивались асцитные клетки, взятые из асцита мышей, обработанных ЦФ в сочетании с различными препаратами дцДПК. Клетки асцита забирались и перевивались немедленно после проведенных обработок. Каждой мыши было привито 1.5×106 асцитных клеток, взятых от обработанных мышей. На графиках приведена динамика появления опухоли и динамика изменения размера трансплантата (А). 13 группе ЦФ+ДНК (1-12) трансплантат не прижился. Б) Сравнение динамики развития опухолевого графта в группах мышей, обработанных одним ЦФ и ЦФ+ДМК (18-30). Из сравнения удалены выпадающие точки. Четко прослеживается эффект положительного влияния указанного режима на рост экспериментальной опухоли. В) Динамика развития опухолевого трансплантата, обработанного ЦФ и препаратом кросс-линкированной дцДНК (1-12) немедленно после инокуляции клеток. В эксперимент были взяты 250 тысяч клеток асцита. Прослеживается достоверная задержка в росте опухолевого графта в группе кросс-линкированной дцДНК (1-12).
на фиг.5 - результаты анализа динамики появления и исчезновения двуцепочечных разрывов в асцитных клетках опухоли Кребс-2, индуцированных обработкой экспериментальных мышей цитостатиком ЦФ. А) Результаты трех независимых экспериментов (1, 2, 3) по оценке количества фокусов репарации, образованных гистоном γН2Х и характеризующих присутствие двуцепочечных разрывов. Оценка проводилась как с помощью проточной цитомегрии, так и с помощью анализа цитологических препаратов. 4 - сравнение схематичных графиков динамики формирования и репарации двуцепочечных разрывов в стволовых клетках крови (красная линия [34]) и в клетках асцита Кребс-2 (синяя линия). Б) Характерная цитологическая картина клеток асцита Кребс-2, окрашенных антителами к гистону γН2Х (1). (2) Контрольные клетки, обработанные вторичными антителами, мечеными FITC. В) Результаты дополнительных экспериментов с использованием метода комет по оценке времени появления и исчезновения двуцепочечных разрывов в асцитных клетках Кребс-2. Прослеживается соответствие времени появления и исчезновения характерного шлейфа и времени максимального и минимального количества двуцепочечных разрывов, обозначенных на обобщенном графике.
Актуальность данного изобретения подтверждается описанными в современной научной литературе свойствами нуклеиновых кислот принимать участие в разнообразных клеточных и молекулярных процессах.
Двуцепочечная фрагментированная экстраклеточная экзогенная и эндогенная ДНК является участником, индуктором и индикатором различных процессов, протекающих в организме. В первую очередь, экзогенные нуклеиновые кислоты являются патоген-ассоциированными молекулярными паттернами, активирующими различные звенья иммунной системы, направленные на удаление патогена. Экстраклеточная дцДНК эндогенного происхождения также может выступать в качестве активатора адаптивного иммунного ответа организма [11, 35-41]. Кроме этого количество эндогенной экстраклеточной дцДНК, присутствующей в плазме крови и интерстициальных жидкостях, отражает функциональное состояние организма и может являться индикатором патологических процессов [42-45]. Известно, что дцДНК является индуктором аутоиммунных процессов [46-51] и представляет собой один из сигналов эффекта свидетеля [52]. Также показано, что катастрофическое увеличение концентрации ДНК в плазме крови сопровождает системную воспалительную реакцию и сепсис [51, 53-58]. На клеточном уровне фрагменты дцДНК, доставляемые во внутренние компартменты клетки, принимают участие в различных клеточных процессах. В первую очередь, присутствие фрагментов экстраклеточной ДНК в клетке активирует арест клеточного цикла и индуцирует репаративные процессы [59-61]. Фрагменты дцДНК при определенных условиях становятся участниками репаративного процесса, интерферируя его корректное прохождение [34]. Фрагменты дцДНК, доставленные в цитоплазму соматических клеток, активируют палитру цитозольных сенсоров и индуцируют начальные этапы развития адаптивного иммунного ответа [62-65]. Представлены данные, что за счет экзогенной ДНК может осуществляться перенос генетического материала разрушенных раковых клеток другим клеткам организма, в результате чего происходит раковая трансформация этих клеток. Процесс назван «генометастазирование» [66, 67]. Показано, что нуклеиновые кислоты, включая дцДНК, входят в состав экзосом и, как предполагается, могут являться камертоном функционального состояния организма, по которому определенные популяции клеток настраивают свои физиологические и молекулярные процессы. В настоящее время формируется позиция, предполагающая, что экстраклеточные нуклеиновые кислоты, включая дцДНК, представляют собой новый тип регуляторной системы организма со сложными механизмами регуляции клеточных процессов [68-78].
Предлагаемый способ прямого цитотоксического действия препарата дцДНК в синергизме с цитостатиком ЦФ на стволовые инициирующие раковые клетки на примере асцитных клеток экспериментальной опухоли мыши Кребс-2 реализуется следующим образом.
Основываясь на обнаруженном свойстве стволовых (инициирующих) раковых клеток интернализовать экзогенные экстраклеточные фрагменты двуцепочечной ДНК [79] и основываясь на данных, полученных в источнике [34] о способности фрагментов дцДНК интерферировать процесс репарации межцепочечных сшивок, проводится сочетанное воздействие цитостатика ЦФ и препарата дцДНК таким образом, что экспериментальные мыши, несущие развитый асцит, обрабатываются цитостатиком ЦФ в дозе 200 мг/кг и далее в течение 12 часов каждый час после введения ЦФ мыши получают интраперитонеальные инъекции препарата ДНК и количестве 0.5 мг на инъекцию, суммарно 6 мг. В качестве препарата ДНК используется смесь препаратов дцДНК и кросс-линкированной ДНК в соотношении 3:1. При указанном способе обеспечивается интернализация фрагментов ДНК препарата в стволовые инициирующие раковые клетки вследствие их естественного свойства захватывать экстраклеточную дцДНК [79], что создает непрерывную интерференцию репаративного процесса фазы NER репарации индуцированных ЦФ межцепочечных сшивок, приводящую к гибели стволовых раковых клеток.
Ниже приводятся экспериментальные доказательства обнаружения прямого цитотоксического действия препарата дцДНК в синергизме с цитостатиком ЦФ на стволовые инициирующие раковые клетки на примере асцитных клеток экспериментальной опухоли мыши Кребс-2.
Используемые методики.
Гистологоанатомический анализ тканей и органов мышей
Кусочки органов фиксировали в 4% параформ альдегиде, обезвоживали в спиртах возрастающей концентрации, просветляли ксилолом, заливали в парафин. Парафиновые срезы толщиной до 5 мкм окрашивали гематоксилином и эозином. Просмотр препаратов и микрофотосъемку проводили на световом микроскопе AxioImager ZI (Zeiss, Германия).
Экспериментальные животные
В экспериментах использовались мыши линии CBA/Lac, которые разводились в условиях вивария при Институте цитологии и генетики СО РАН. Животные содержались в клетках, по 5-10 особей в каждой и имели свободный доступ к воде и пище.
Опухолевая модель
В экспериментах была использована опухоль Кребс-2. Для получения асцитной формы опухоли клетки перевивали мышам внутрибрюшинно (в/б), по 200 мкл, в разведении физиологическим раствором 1:15. Для получения солидной опухоли Кребс-2 клетки перевивали внутримышечно в количестве 1,5 млн. Измерение размера солидной опухоли в см3 производили стандартным способом, измеряя три параметра штангенциркулем и перемножая полученные значения между собой.
Введение препаратов ЦФ и экзогенной ДНК
Цитостатик ЦФ вводился мышам внутрибрюшинно (в/б) в дозе 200 мг/кг массы тела. Затем в зависимости от эксперимента в/б вводили препараты фрагментированной ДНК человека и кросс-линкированной ДНК человека, обработанной нитроген-мустардом в дозе 0,5 мг на инъекцию. Использовали следующие схемы введения: каждый час в промежуток времени 1-12, 12-24 и 18-30 часов после инъекции ЦФ (суммарно по 6 мг ДНК на мышь). В качестве контроля вводили физиологический раствор в таком же объеме, как и экзогенную ДНК (200 мкл на инъекцию).
Анализ количества двуцепочечных разрывов в клетках асцита Кребс-2
Мышам с нарощенным асцитом Кребс-2 делали инъекцию ЦФ (200 мг/кг). В дальнейшем через каждые 6 часов производился забор клеток асцита. Клетки дважды промывали фосфатно-солевым буфером (PBS, Медиген), затем часть клеток наносили на чистые обезжиренные стекла, часть клеток фиксировали в суспензии 2%-ного раствора параформальдегида в PBS. Клетки, нанесенные на стекла, также предварительно фиксировали 15 мин в 2%-ном растворе параформальдегида в PBS. Затем отмывали 0,5% бычьим сывороточным альбумином (BSA) в PBS.
В дальнейшем обработки проводили либо на цитологическом стекле во влажной камере (для получения цитологических препаратов), либо в пробирке в объеме жидкости (для анализа на проточном цитофотометре). Клетки обрабатывали 2 мин 0,1%-ным Тритоном Х-100 в PBS. Промывали 0,5% БСА в PBS. Затем клетки обрабатывали кроличьими антителами к модифицированному гистону (anti-phospho-histone Sigma, США) γН2АХ в разведении 1:1000 в PBS, рН 7,4, с 0,15%-ным глицином (Sigma, США) и 0,5% BSA в течение часа при комнатной температуре. Клетки промывали PBS с 0,5% BSA и обрабатывали меченными FITC козьими антителами против IgG кролика (goat anti rabbit IgG FITC-conjugate Sigma, США) в течение часа при комнатной температуре в разведении 1:500 в таком же растворе, что и предыдущие антитела. Обработку проводили в темноте. Затем клетки еще раз промывали PBS с 0,5% BSA. После отмывки клетки либо ресуспендировали в небольшом объеме PBS и анализировали на проточном цитофотометре BD FACSAria (Becton Dickinson, США), либо на препарат наносили ~10 мкл Antifade DABCO, покрывали покровным стеклом и анализировали при помощи флюоресцентного микроскопа Axioskop 2 Plus с использованием программы AxioVision.
Метод комет для оценки количества клеток, содержащих двуцепочечные разрывы
Мышам с нарощенным асцитом Кребс-2 делали инъекцию ЦФ (200 мг/кг). В дальнейшем в контрольные точки (0,24, 30, 42 часа после инъекции цитостатика) производили забор клеток асцита. Клетки промывали PBS и заливали в блоки легкоплавкой агарозы (Low Melt Ultra-Pure DNA Grade Agarose, Bio-Rad) в PBS объемом 80 мкл и в количестве 1000 клеток на блок. Затем блоки обрабатывали лизирующим буфером (50 мМ ЭДТА, 1% N-Lauroylsarcosine (Serva) и 1 мг/мл протеиназы К) в течение 30 мин при 50°С и переносили в 0,5 М ЭДТА. Перед дальнейшими обработками клетки, фиксированные в агарозе, отмывали в ТЕ буфере (10 мМ Tris-HCl, pH 7,6; 1 мМ ЭДТА) в течение 15-30 мин. Затем блоки устанавливали в одинаковом направлении и проводили электрофорез (30 мин, 1 В/см). Затем блоки окрашивали DAPI, помещая их в 500 мкл раствора DAPI (0,5 мкг/мл) в дистиллированной воде, помещали на предметное стекло и анализировали при помощи инвертированного флюоресцентного микроскопа.
Анализ количества CD34+ клеток в асците Кребс-2 при помощи проточной цитометрии и анализа цитологических препаратов
Отобранные клетки асцита промывали PBS и осаждали при 4°С, 400 g в течение 5 мин. После осаждения центрифугированием клетки ресуспендировали в PBS с 0,1% NaN3, 1% FBS (Fetal Bovine Serum). К 1 млн клеток добавляли 4 мкг антител (FITC Rat anti-Mouse CD34, BD Pharmingen) и, соответственно, 4 мкг изотип контроля (FITC Ral IgG2a, к Isotype Control, BD Pharmingen) и инкубировали в течение 40 мин при 4°С. Процент клеток CD34+ определяли либо при помощи проточного цитофотометра BD FACSAria относительно результатов изотип контроля в каждом образце либо обработанные указанным выше способом клетки асцита Кребс-2 промывали PBS и наносили цитоспином на предметное стекло (1000 об/мин в течение 1 мин). Затем на полученный препарат капали ~10 мкл Antifade DABCO, покрывали покровным стеклом и анализировали при помощи флуоресцентного микроскопа Axioskop 2 Plus с использованием программы AxioVision.
Рассмотрим более подробно первый поисковый этап, где было показано существование прямого цитотоксического действия препарата дцДНК в синергизме с цитостатиком ЦФ на экспериментальную опухоль Кребс-2.
В наших исследованиях при анализе воздействия экстраклеточной экзогенной дцДНК на активацию профессиональных свойств антигенпрезентирующих дендритных клеток и формирования противоракового CD8+ опосредованного иммунного ответа были зафиксированы труднообъяснимые эффекты (не связанные с развитием иммунного ответа) задержки роста опухолевого трансплантата, перевитого как в солидной, так и в асцитной формах [80-84]. Наблюдалось, что при совместном введении ЦФ и препарата дцДНК существует ранний и средний промежутки времени после введения ЦФ (введение препарата дцДНК осуществлялось сразу после введения ЦФ каждый час на протяжении 1-12 часов или 18-30 часов), когда препарат ДНК, по-видимому, оказывает прямое токсическое действие на клетки сформированного графта. Два основных предположения могли объяснить прямое токсическое действие дцДНК и связанную с этим задержку роста перевитой опухоли. Первое, прямой токсический эффект связан с участием дцДНК в репаративном процессе при репарации межцепочечных сшивок, как это наблюдалось для стволовых клеток крови мыши [34]. Второе, эффектором прямого токсического действия на развитие опухоли является не исходный препарат дцДНК, а дцДНК, подвергающаяся кросслинкирующему действию фосфорамид мустарда во время ее нахождения в мышином организме. Фосфорамид мустард является алкилирующим производным ЦФ, который образуется в результате гидролиза цитостатика в печени на протяжении того же промежутка времени, что и ранний промежуток времени введения препарата дцДНК (1-12 часов). Также прямое токсическое действие ДНК на клетки опухоли могло быть связано с неизвестным типом воздействия ДНК на эукариотическую клетку.
Была проведена серия пилотных экспериментов. Первоначально на солидной форме опухоли Кребс-2 был оценен прямой токсический эффект синергичного действия ЦФ и препарата дцДНК при инъекциях препарата ДНК непосредственно в опухоль в промежутки времени 1-12 и 18-30 часов после инъекции ЦФ. Клиническая картина действия такой обработки на протяжении последующих 7 суток после проведенных обработок характеризовалась четкой регрессией размеров опухоли (с ~3.0 см3 до ~1.0 см3) при обработке ЦФ в сочетании с препаратом дцДНК и ростом физических размеров опухоли при обработке одним цитостатиком (~4.0 см3) (фиг.1А). Уменьшение размеров опухоли сопровождалось лизисом опухолевой и прилегающих тканей и обильными гнойными выделениями. Был отмечен случай отмирания конечности, в которую был привит трансплантат. У животного через 7 суток лапка отсохла, а опухоль превратилась в небольшой валик, который прекратил свой рост. Также в группах ЦФ+дцДНК в различных экспериментах наблюдался массовый падеж животных в течение 1-3 суток после проведенной терапии ЦФ и препаратом дцДНК. Клиническая картина свидетельствовала о том, что в области инъекций ДНК идут процессы разложения тканей и, в первую очередь, ткани опухоли, что может сопровождаться интоксикацией, несопоставимой с жизнью.
Для определения возможных причин наблюдаемых эффектов и причины массовой одновременной гибели экспериментальных животных был проведен патологоанатомический анализ внутренних органов и ткани очага опухолевого роста солидной опухоли животных, обработанных ЦФ и физ. раствором и ЦФ и препаратом дцДНК, находящихся в агонистической фазе. Животные с опухолью размером 2.5 см3 получали инъекции ЦФ в дозе 200 мг/кг, после чего в интервал времени 18-30 часов им вводился либо препарат дцДНК (по 250 мкг 12 раз), либо физ. раствор непосредственно в опухолевый трансплантат. На 3 сутки после инъекции цитостатика и препарата ДНК было забито одно животное, на следующие сутки еще 2, на следующие - одно. Все животные были забиты в предсмертном состоянии. Одновременно были забиты контрольные животные, получавшие инъекции физ. раствора. У всех мышей были забраны практически все органы, а также образцы ткани опухоли из мест предположительного некроза.
Патологоанатомическое заключение вскрытия мышей.
У всех обследованных животных отмечены изменения со стороны печени и селезенки.
В печени наблюдалась очаговая дистрофия гепатоцитов по типу зернистой или баллонной. Воспалительно-клеточная реакция проявлялась, главным образом, в увеличении количества лимфоцитов в просветах гемокапилляров. У отдельных животных формировались преимущественно круглоклеточные инфильтраты в области портальных трактов и центральных вен. Некроза печеночной паренхимы не выявлено ни у одного из животных.
Со стороны селезенки у всех животных стабильно прослеживалась резко выраженная редукция лимфоидных фолликулов.
Отдельно следует отметить умеренно выраженную дистрофию миокарда у одной мыши-опухоленосителя в группе ЦФ+ДНК, а также наличие предположительно метастаза опухоли под эпикардом у другой мыши из той же группы. У других животных подобных находок в миокарде или других внутренних органах не обнаружено.
Ткань опухоли отчетливо выявлялась среди элементов дермы и подкожной клетчатки благодаря выраженной клеточной атипии и агрессивному характеру роста. Последнее было особенно заметно в местах, где клеточные тяжи опухоли перемежались с профилями фрагментов мышечных волокон. Для группы ЦФ+ДНК характерным явлением были обширные некрозы опухолевой ткани, что соответствовало клинической картине симптомов. Зона демаркации была представлена узким ободком полиморфноклеточного инфильтрата (фиг.1, Б-Г).
Чтобы избежать эффекта гибели экспериментальных животных и определить временные промежутки наиболее эффективного синергичного редуцирующего действия ЦФ и препарата дцДНК на опухолевый трансплантат, была проведена серия экспериментов, где терапия препаратами проводилась при размере опухолевого графта ~0.25 см3. Наибольшее редуцирующее действие оказала обработка ЦФ в сочетании с введением препарата дцДНК в промежуток времени 1-12 часов после инъекции цитостатика.
Анализ результатов проведенных экспериментов, выполненных на солидной опухоли Кребс-2, предполагал, что наибольший редуцирующий эффект на развитие солидной перевитой опухоли обнаруживается при введении препарата дцДНК в промежуток времени 1-12 часов после введения ЦФ. Кроме этого четко прослеживались некротические процессы в области опухоли после обработки ЦФ и препаратом дцДНК. Также в проведенных экспериментах был выявлен эффект быстрой синхронной гибели опытных животных после обработки ЦФ и препаратом дцДНК.
Солидная опухоль Кребс-2 имеет плотную структуру, покрыта соединительнотканной капсулой и имеет не развитую сеть капиллярных сосудов. В связи с этим доставка любых высокомолекулярных соединений (в частности, молекул дцДНК) непосредственно в опухоль затруднена [85]. Невозможность равномерного воздействия на все клетки опухоли в солидной форме и связанная с этим сложность оценки за