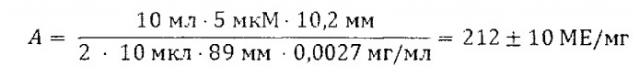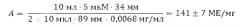Конъюгат наноалмаза с пирофосфатазой и способ его получения
Иллюстрации
Показать всеИзобретение относится к области фармации и медицины и касается конъюгата наноалмаза с пирофосфатазой для доставки пирофосфатазы в организм и способа его получения. Конъюгат представляет собой частицы наноалмаза размером 2-10 нм с иммобилизованной на них посредством линкера, содержащего амино- или амидные группы, пирофосфатазой. Содержание пирофосфатазы составляет 0,1-1 мг на 1 мг наноалмаза, и удельная активность пирофосфатазы составляет до 95±5% от активности нативной пирофосфатазы. Способ получения конъюгата включает растворение наноалмаза с привитым гексаметилендиамином и/или аминированного аммиаком наноалмаза в воде, последовательное добавление водного буферного раствора HEPES с рН 7-8, хлорида магния, фторида натрия, пирофосфата натрия, пирофосфатазы; и глутарового альдегида. Далее выдерживают полученную смесь в течение 0,5-12 ч, центрифугируют, промывают водным буферным раствором Tris-HCl и сушат. Изобретение обеспечивает получение конъюгата наноалмаза с пирофосфатазой, обладающего повышенной стабильностью. 2 н. и 1 з.п. ф-лы, 1 табл., 2 ил., 2 пр.
Реферат
Изобретение относится к области фармации и медицины, конкретно, к фармацевтической нанотехнологии ферментов и касается конъюгата наноалмаза с пирофосфатазой для доставки фермента в организм, а также способа получения этого конъюгата и его варианта.
Проблема лечения пирофосфатной артропатии (общее название псевдоподагра) на протяжении многих лет является чрезвычайно актуальной в медицине. Заболевание относится к группе микрокристаллических артритов, характеризуется множественным обызвествлением суставных и околосуставных тканей, главным образом, суставного хряща (хондрокальциноз) вследствие отложения в них микрокристаллов пирофосфата кальция. Болезнь часто развивается у лиц старше 55 лет и одинаково встречается как у мужчин, так и у женщин; ей подвержено 5% населения Земли, а в возрасте от 70 лет - до 27% и сопровождается острыми болезненными приступами [1]. Характерное острое воспаление обусловлено ответом нейтрофилов, реагирующих на кристаллы пирофосфата кальция [2].
Одной из наиболее значимых причин возникновения пирофосфатной артропатии является нарушение продукции ферментов, отвечающих за синтез и/или транспорт анионов пирофосфата P2O7 2- в межклеточный матрикс, например, гиперпродукция транспортного белка ANK или увеличение активности пирофосфат-продуцирующих ферментов NPP (нуклеотидилпирофосфорилаз) [3].
Специфических средств лечения псевдоподагры до настоящего времени не существует. Лечение сопутствующих заболеваний, таких как гемохроматоз, гиперпаратиреоз и гипотиреоз не приводит к рассасыванию кристаллов пирофосфата кальция, в редких случаях отмечают сокращение числа приступов. В медицинской практике для терапии пирофосфатной артропатии пытаются использовать препараты для лечения подагры, которые при пирофосфатной артропатии только облегчают боль [4].
Известно применение добавок ионов магния, в том числе карбоната магния, в качестве профилактического средства для уменьшения частоты острых приступов пирофосфатной артропатии [5-6]. При этом изменений биохимических показателей и изменения состава синовиальной жидкости зафиксировано не было и показано лишь незначительное улучшение состояния больных. Результаты исследований на практике не используются.
Известно применение в клинике для лечения острой псевдоподагры и эпизодического воспалительного артрита противовоспалительных препаратов, в том числе нестероидных противовоспалительных препаратов, кортикостероидов и колхицина. Нестероидные противовоспалительные препараты являются основными в лечении заболевания, снижая частоту приступов. В то же время они неспособны изменить динамику течения болезни, недостаточно эффективны и противопоказаны для отдельных групп больных [7]. Кортикостероиды значительно облегчают симптоматику при применении внутрисуставных инъекций, однако после применения умеренной или высокой доз также проявляют серьезные побочные реакции, такие как гипертензия, гипергликемия, задержка жидкости и нервно-психические изменения [7]. Колхицин полезен при рецидивирующей псевдоподагре и в низких дозах для предотвращения кризисов [8], но при этом часто оказывается неэффективным и вызывает множество побочных эффектов: понос, угнетение костного мозга, невропатию, миопатию, кожную сыпь, подобную токсическому эпидермальному некролизу, и обратимую азооспермию [7].
Известна способность лекарственного препарата пробенецида подавлять рост кристаллов пирофосфата кальция in vitro [9]. Однако он вызывает серьезные побочные эффекты: анорексию, крапивницу, некроз печени, нефротический синдром, лейкопению и др. Изучение влияния препарата пробенецида на кристаллы пирофосфата кальция в организме человека не проводилось [10].
Известно применение фосфоцитрата для подавления роста кристаллов пирофосфата кальция in vivo [11-12]. Фосфоцитрат является интрацеллзолярным регулятором кальцификации и способен блокировать патологическую кальцификацию [13]. При этом его функционирование на моделях in vivo не изучено, а данные о токсичности фосфоцитрата и безопасности его применения отсутствуют [10].
Известно использование препаратов метотрексата и анакинры, воздействующих на инфламмасому, для подавления иммунитета и облегчения болей. Метотрексат способен уменьшать частоту и интенсивность повторяющихся приступов псевдоподагры [14], а также быть альтернативным лекарственным средством в профилактике гемохроматоз-связанной артропатии. Однако при этом у пациентов повышается риск проявления побочных эффектов, приводящих к заболеваниям печени [8]. Действие анакинры связано с антагонизмом рецептора интерлейкина 1, оказывающего провоспалительное действие при псевдоподагре [15]. Однако препарат борется лишь с симптомами болезни. Кроме того, анакинра обладает иммунодепрессивным эффектом и высокой себестоимостью, что затрудняет ее использование в медицинской практике [8].
Вышеперечисленные препараты и вещества можно разделить на две группы. Первая группа - не влияющие на рост кристаллов пирофосфата кальция и снимающие только болевые симптомы. Вторая группа - ингибирующие рост кристаллов пирофосфата кальция, но не снижающие концентрацию этого вещества. При этом используемые вещества и препараты имеют ряд серьезных побочных эффектов, что до сих пор не привело к их внедрению в медицинскую практику.
Поэтому поиск и разработка новых высокоэффективных и малотоксичных средств для лечения пирофосфатной артропатии является важной и крайне актуальной медицинской и социально-значимой задачей.
Новым перспективным направлением терапии этого заболевания может стать введение в ткани организма экзогенной пирофосфатазы - внутриклеточного фермента, катализирующего гидролиз пирофосфата до фосфата. Это могло бы позволить труднорастворимый пирофосфат кальция перевести в более растворимый фосфат кальция и, тем самым, напрямую уменьшить отложение солей пирофосфата кальция при пирофосфатной артропатии.
Пирофосфатаза - это магний-зависимый фермент, представляющий из себя глобулярный белок и состоящий из нескольких идентичных субъединиц, имеющих активный центр [16].
Однако при введении пирофосфатазы в пораженные ткани происходит быстрая инактивация фермента протеазами и его дальнейшее выведение из организма. Это связано с антигенностью экзогенновводимых ферментов, в частности, пирофосфатазы и невозможностью создания высокой локальной концентрации препарата без повышения его общей концентрации.
Известно также, что углеродные наночастицы детонационного наноалмаза имеют функционализированную поверхность, пригодную для ковалентной прививки ферментов, являются нетоксичными и биосовместимы с организмом [17].
Известно применение наноалмаза для иммобилизации ряда веществ белковой природы, в том числе ферментов, для применения в медицине и биологии как носителя в системах доставки лекарственных веществ, биосенсоров, для адсорбционного обнаружения биологически активных веществ, люминесцентных маркеров для изучения клеточных взаимодействий и т.д. [18].
Известна ковалентная прививка лошадиного цитохрома С на наноалмаз, покрытый поли-L-лизином. В работе был сделан вывод о том, что наноалмаз является прекрасным материалом для сохранения стабильности веществ белковой природы [19].
Известен конъюгат наноалмаза с трансферрином для рецептор-опосредованного нацеливания на раковые клетки для биомедицинского применения [20]. В работе указывается, что, проникая в клетки, конъюгат наноалмаза с трансферрином может иметь более направленное действие по сравнению с нативным трансферрином.
Известно, что связывание трипсина и аспарагинамидазы F с наноалмазом приводит к повышению их термической и химической устойчивости [21].
Иммобилизация фермента пирофосфатазы на наноалмазах в патентной и научной литературе не описано.
Задачей настоящего изобретения является разработка средства на основе пирофосфатазы, обладающего повышенной стабильностью.
В соответствии с изобретением описывается конъюгат наноалмаза с пирофосфатазой, представляющий собой частицы наноалмаза размером 2-10 нм с иммобилизованной на них посредством линкера, содержащего амидные- или амино- и амидные группы, пирофосфатазой, при содержании пирофосфатазы 0,1-1 мг на 1 мг наноалмаза и удельной активностью пирофосфатазы до 95±5% от активности нативной пирофосфатазы.
В качестве линкера может быть использован глутаровый альдегид и/или гексаметилендиамин. Линкер преимущественно представляет собой NH-C(O)-(CH2)2-C(O)- или -NH(CH2)6-NH-C(O)-(CH2)2-C(O)-.
Описывается также способ получения конъюгата наноалмаза с пирофосфатазой, характеризующийся тем, что наноалмаз с привитым гексаметилендиамином или аминированный аммиаком наноалмаз с размером частиц 2-10 нм растворяют в воде с образованием суспензии и последовательно добавляют водный буферный раствор HEPES гидроксиэтил-пиперазин-N-2-этансульфокислота) с pH 7-8, хлорид магния, фторид натрия, пирофосфат натрия, пирофосфатазу и глутаровый альдегид с последующим выдерживанием полученной смеси в течение 0,5-12 ч, центрифугированием, промывкой водным буферным раствором Tris-HCl с pH 7-8 и сушкой.
Процесс ведут при весовом соотношении пирофосфатаза: наноалмаз с привитым гексаметилендиамином или аминированный наноалмаз: глутаровый альдегид 1:1-10:5-50, соответственно.
Способ получения описываемого конъюгата заключается в иммобилизации на наноалмазе пирофосфатазы путем ковалентного связывания пирофосфатазы с первичной аминогруппой линкера, привитого на поверхность наноалмаза.
Более подробно способ заключается в следующем. Для получения наноалмаза, содержащего первичные аминогруппы, его отжигают в токе газообразного водорода при температуре 500-1200°C в течение 1-8 ч, затем подвергают жидкофазному хлорированию молекулярным хлором при фотохимическом воздействии видимым светом при температуре 50-70°C в течение 36-60 ч с последующей промывкой четыреххлористым углеродом, центрифугированием и сушкой под вакуумом. Модифицированный хлором наноалмаз суспензируют в абсолютированном спирте, добавляют гексаметилендиамин и в присутствии реактива Хунига кипятят в течение 24 ч с последующей промывкой абсолютированным спиртом и сушкой под вакуумом. Полученный наноалмаз с привитым гексаметилендиамином (содержащим первичные аминогруппы) растворяют в воде с образованием суспензии и последовательно добавляют буферный раствор HEPES с pH 7-8, хлорид магния до концентрации 2 мМ, фторид натрия до концентрации 10 мМ, пирофосфат натрия до концентрации 100 мкМ, пирофосфатазу до концентрации 0,1-1 мг/мл и глутаровый альдегид до концентрации 50-500 мкМ и выдерживают полученную смесь в течение от 30 мин до 12 ч с последующим центрифугированием, промывкой буферным раствором Tris-HCl с pH 7-8, повторным центрифугированием суспензии, декантацией надосадочного раствора и сушкой.
Вариант описываемого способа получения иммобилизованной пирофосфатазы отличается подготовкой наноалмаза, содержащего первичные аминогруппы, и отсутствием дополнительного линкера между наноалмазом и ферментом. Для этого модифицированный хлором наноалмаз, полученный описанным выше способом, подвергают аминированию в токе газообразного аммиака при температуре 400-500°C в течение 2-4 ч. Полученный аминированный наноалмаз (содержащий первичные аминогруппы) химически связывают непосредственно с пирофосфатазой аналогично способу, описанному выше.
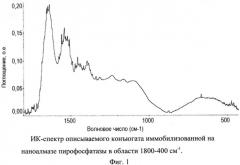
На Фиг.1 приведен ИК-спектр конъюгата иммобилизованной на наноалмазе пирофосфатазы в диапазоне 1800-400 см-1. На спектре присутствуют две полосы средней интенсивности с максимумами при 1660-1630 и 1560-1510 см-1 и слабые сигналы с максимумами при 1458, 1184 см-1, а также две широкие полосы от 1320 до 900 см-1 и от 870 до 400 см-1.
ИК-спектры регистрировали на приборе FTIRS IR200 Thermonicolet с разрешением 2 см-1, количество сканов 100. Для анализа навески смешивали с порошком KBr и прессовали в таблетку.
Оценку количества фермента при его иммобилизации на наноалмазе определяли по разности концентрации фермента в растворе до и после иммобилизации.
Концентрацию пирофосфатазы в растворе определяли на спектрофотометре Ultrospec 3000 (Pharmacia Biotech, Швеция), измеряя поглощение при длине волны 280 нм и сравнивая интенсивность с интенсивностью раствора пирофосфатазы с известной концентрацией.
Оценку ферментативной активности пирофосфатазы осуществляли по скорости образования фосфата из пирофосфата путем непрерывного измерения его концентрации на «Полуавтоматическом анализаторе фосфата» [22]. Определение основано на сдвиге максимума поглощения раствора метилового зеленого (632 нм) в более длинноволновую область (656 нм), происходящем при связывании молибдат-иона.
Стабильность полученного конъюгата оценивали по изменению его активности выдерживанием при 75°C в течение 4,5 ч.
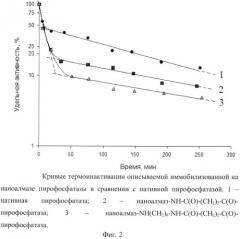
На Фиг.2 приведены кривые термоинактивации конъюгата иммобилизованной на наноалмазе пирофосфатазы, имеющие двухфазовый характер зависимости. Для нативной пирофосфатазы характер кривой объясняется олигомерным характером белка: первая фаза инактивации соответствует диссоциации олигомерного белка, а вторая - денатурации. По оси абсцисс отложена логарифмическая шкала времени инкубирования композиций, мин. По оси ординат - их удельная активность в момент времени, % от первоначальной. Сравнение констант скоростей денатурации (табл.1) показывает, что скорость денатурации нативной пирофосфатазы выше, следовательно, стабильность образцов иммобилизованной на наноалмазе пирофосфатазы выше и превосходит нативный фермент в 1,5 раза.
| Таблица 1. | |||
| Константы скорости термоинактивации нативной и иммобилизованной на наноалмазе (НА) пирофосфатазы. | |||
| Параметры | Образец | ||
| Пирофосфатаза | НА-NH(CH2)6NH-E-пирофосфатаза | HA-NH-пирофосфатаза | |
| Константа скорости, мин-1 | |||
| I фаза | 0,31±0,05 | 0,15±0,01 | 0,15±0,01 |
| II фаза | (56±5)·10-4 | (39±4)·10-4 | (38±4)·10-4 |
| Примечание*: Е=-С(O)-(СН2)2-С(O)-. |
Полученный конъюгат иммобилизованной на наноалмазе пирофосфатазы обладает повышенной стабильностью и может найти применение в медицине в качестве системы доставки фермента в организм.
Краткое описание графических материалов.
Фиг.1. ИК-спектр описываемого конъюгата иммобилизованной на наноалмазе пирофосфатазы в области 1800-400 см-1.
Фиг.2. Кривые термоинактивации описываемой иммобилизованной на наноалмазе пирофосфатазы в сравнении с нативной пирофосфатазой. 1 - нативная пирофосфатаза; 2 - наноалмаз-NH-С(O)-(СН2)2-С(O)-пирофосфатаза; 3 - наноалмаз-NH(СН2)6-NH-С(O)-(СН2)2-С(O)-пирофосфатаза.
Изобретение иллюстрируется следующими примерами.
Пример 1.
Навеску исходного наноалмаза массой 500 мг отжигают в токе газообразного водорода со скоростью 3,0 л/ч при температуре 800°C в течение 6 ч. Затем отожженный наноалмаз подвергают жидкофазному хлорированию молекулярным хлором, растворенном в 250 мл CCl4 до 5,6% масс. Cl2. Реакцию хлорирования проводят при фотохимическом воздействии видимым светом в течение 48 ч при температуре 60°C. Затем образец промывают CCl4 с центрифугированием суспензии при 6000 об/мин и высушивают под давлением 0,1 мм. рт.ст. до постоянного веса. Навеску хлорированного наноалмаза массой 400 мг растворяют в 50 мл абсолютированного спирта, добавляют навеску гексаметилендиамина (800 мг) и 5 капель реактива Хунига (N,N-диизопропилэтиламина). Смесь кипятят в течение 24 ч при 80°C и затем многократно промывают водой и абсолютированным спиртом и высушивают под давлением до постоянного веса. Навеску полученного наноалмаза с привитым гексаметилендиамином массой 25 мг растворяют в 25 мл воды с образованием суспензии и последовательно добавляют буферный раствор HEPES с pH 7-8, хлорид магния до концентрации 2 мМ, фторид натрия до концентрации 10 мМ, пирофосфат натрия до концентрации 100 мкМ, пирофосфатазу, выделенную из Е. Coli, до концентрации 1 мг/мл и глутаровый альдегид до концентрации 500 мкМ и выдерживают полученную смесь при комнатной температуре при постоянном перемешивании в течение 6 ч с последующим центрифугированием, промывкой буферным раствором 50 мМ Tris-HCl, содержащим 2 мМ MgCl2, повторным центрифугированием суспензий при 14000 об/мин, декантацией надосадочного раствора и сушкой.
Полученный продукт представляет собой порошок серого цвета с влажностью 4,5%, характеризующийся ПК-спектром в диапазоне 1800-400 см-1: две полосы средней интенсивности с максимумами при 1660-1630 и 1560-1510 см-1 и слабые сигналы с максимумами при 1458, 1184 см-1, две широкие полосы от 1320 до 900 см-1 и от 870 до 400 см-1 (Фиг.1).
Количество иммобилизованной на наноалмазе пирофосфатазы определяют по разности концентраций фермента в растворе до и после иммобилизации. Концентрацию иммобилизованной на наноалмазе пирофосфатазы определяют спектрофотометрически, измеряя поглощение при длине волны 280 нм. Стандартный раствор пирофосфатазы с концентрацией 1 мг/мл при длине оптического пути 1 см имеет поглощение 1,18 ОЕ. Раствор после проведения процесса иммобилизации при длине оптического пути 1 см имеет поглощение 1,18 ОЕ. Следовательно, количество иммобилизованной на наноалмазе пирофосфатазы составляет 1 мг пирофосфатазы на 1 мг наноалмаза.
Получение иммобилизованной на наноалмазе пирофосфатазы по описанной выше методике при концентрации глутарового альдегида 50 мкМ в течение 30 мин приводит к содержанию иммобилизованной пирофосфатазы 0,1 мг на 1 мг наноалмаза.
Определение активности пирофосфатазы основано на сдвиге максимума поглощения раствора метилового зеленого (632 нм) в более длинноволновую область (656 нм), происходящем при связывании фосфомолибдат-иона, образующегося при взаимодействии молибдата и фосфата, синтезирующегося из пирофосфата.
Активность пирофосфатазы определяют при температуре 20°C по скорости образования фосфата из пирофосфата путем непрерывного измерения концентрации фосфата на «Полуавтоматическом анализаторе фосфата» [22] и вычисляют по формуле
,
где А - активность пирофосфатазы в МЕ/мг;
Vяч - объем реакционной смеси (мл);
VE - объем добавляемой в ячейку аликвоты фермента (мкл);
[Е] - концентрация фермента (мг/мл);
k - определяемый в отдельном опыте коэффициент пересчета, равный концентрации фосфата (в мкМ), которая дает отклик самописца на 1 мм;
tgα - измеряемая начальная скорость накопления фосфат-иона (мм/мин).
Удельную активность фермента выражали в международных единицах (МЕ/мг). 1 МЕ/мг соответствует скорости превращения 1 микромоля субстрата за 1 минуту под действием 1 мг фермента.
Активность нативного фермента, рассчитанная формуле (1), составила 222 МЕ/мг.
Для определения активности иммобилизованной на наноалмазе пирофосфатазы перед подачей на анализатор фосфата анализируемый раствор, содержащий иммобилизованную на наноалмазе пирофосфатазу, разбавляли до концентрация фермента 2,7 мкг/мл и добавляли аликвоту объемом 5 мкл к реакционной смеси объемом 10 мл при постоянном перемешивании на магнитной мешалке. Реакционная смесь содержала буфер 50 мМ Трис-HCl, 100 мкМ пирофосфат магния и 5 мМ MgCl2. После введения в нее аликвоты фермента реакционную смесь подавали в «Полуавтоматический анализатор фосфата», где она смешивалась с раствором молибдата аммония и серной кислоты ((NH4)6Mo7O24·4H2O - 24 г, H2SO4конц. - 77 мл, вода - 2 л), а затем с раствором метилового зеленого с Triton Х-305 (метиловый зеленый - 150 мг, Triton Х-305 - 6,8 г, вода - до 2
Для определения активности иммобилизованной на наноалмазе пирофосфатазы перед подачей на анализатор фосфата анализируемый раствор, содержащий иммобилизованную на наноалмазе пирофосфатазу, разбавляли до концентрация фермента 2,7 мкг/мл и добавляли аликвоту объемом 5 мкл к реакционной смеси объемом 10 мл при постоянном перемешивании на магнитной мешалке. Реакционная смесь содержала буфер 50 мМ Трис-HCl, 100 мкМ пирофосфат магния и 5 мМ MgCl2. После введения в нее аликвоты фермента реакционную смесь подавали в «Полуавтоматический анализатор фосфата», где она смешивалась с раствором молибдата аммония и серной кислоты ((NH4)6Mo7O24·4H2O - 24 г, H2SO4конц. - 77 мл, вода - 2 л), а затем с раствором метилового зеленого с Triton Х-305 (метиловый зеленый - 150 мг, Triton Х-305 - 6,8 г, вода - до 2 л). Оптическую плотность полученного раствора фосфомолибдатного комплекса измеряли в проточной кювете и регистрировали на самописце. Скорость гидролиза определяли по тангенсу угла наклона прямой, отражающей накопление фосфата в ячейке от времени (tgα). Концентрацию фосфата определяли по предварительно построенной калибровочной кривой, которая для 5 мкМ раствора фосфата составляла 89 мм длины линии самописца. Активность иммобилизованной на наноалмазе пирофосфатазы вычисляли по формуле (1)
Активность иммобилизованной на наноалмазе пирофосфатазы вычисляли по формуле
Активность иммобилизованной на наноалмазе пирофосфатазы составила 212 МЕ/мг или 95±5% от активности нативной (несвязанной) пирофосфатазы.
Для изучения стабильности иммобилизованной на наноалмазе пирофосфатазы в сравнении с нативной пирофосфатазой 1 мл буферного раствора, содержащего 50 мМ Tris-HCl и иммобилизованную на наноалмазе пирофосфатазу с концентрацией 8 мкг/мл выдерживали в термостате при температуре 75°C в течение 4,5 ч и через определенные промежутки времени (от 10 мин до 1 ч) отбирали аликвоту раствора и измеряли активность иммобилизованной на наноалмазе пирофосфатазе по описанной выше методике. В контрольном опыте использовали 1 мл буферного раствора 50 мМ Tris-HCl и нативную пирофосфатазу в той же концентрации (8 мкг/мл). Для определения кинетических параметров температурной инактивации проводили нелинейную регрессию с помощью программы SigmaPlot по уравнению
Где a и c - падение каталитической активности в I и II фазах, соответственно;
b и d - константы скоростей I и II фазы, соответственно.
Стабильность иммобилизованной на наноалмазе пирофосфаты оценивали по константе скорости денатурации, равной (39±4)·104, что в 1,5 раза ниже константы скорости денатурации нативной пирофосфатазы (56±5)·10-4. Таким образом, стабильность иммобилизованной на наноалмазе пирофосфатазы в 1,5 раза выше стабильности нативной пирофосфатазы.
Пример 2.
Навеску исходного наноалмаза массой 500 мг отжигают в токе газообразного водорода со скоростью 3,0 л/ч при температуре 800°C в течение 6 ч. Затем отожженный наноалмаз подвергают жидкофазному хлорированию молекулярным хлором, растворенном в 250 мл CCl4 до 5,6% масс. Cl2. Реакцию хлорирования проводят при фотохимическом воздействии видимым светом в течение 48 ч при температуре 60°C. Затем образец промывают CCl4 с центрифугированием суспензии при 6000 об/мин и высушивают под давлением 0,1 мм. рт.ст. до постоянного веса. Навеску хлорированного наноалмаза массой 250 мг отжигают в токе газообразного аммиака со скоростью 3,0 л/ч при температуре 350°C в течение 4 ч. Навеску полученного аминированного наноалмаза массой 25 мг растворяют в 25 мл воды с образованием суспензии и последовательно добавляют буферный раствор HEPES с pH 7-8, хлорид магния до концентрации 2 мМ, фторид натрия до концентрации 10 мМ, пирофосфат натрия до концентрации 100 мкМ, пирофосфатазу, выделенную из Е. Coli, до концентрации 1 мг/мл и глутаровый альдегид до концентрации 50 мкМ и выдерживают полученную смесь при комнатной температуре при постоянном перемешивании в течение 6 ч с последующим центрифугированием, промывкой буферным раствором 50 мМ Tris-HCl, содержащим 2 мМ MgCl2, повторным центрифугированием суспензий при 14000 об/мин, декантацией надосадочного раствора и сушкой.
Полученный продукт представлял собой порошок серого цвета с влажностью 4,7%, характеризующийся ИК-спектром в диапазоне 1800-400 см-1: две полосы средней интенсивности с максимумами при 1660-1630 и 1560-1510 см-1 и слабые сигналы с максимумами при 1458, 1184 см-1, две широкие полосы от 1320 до 900 см-1 и от 870 до 400 см-1 (Фиг.1).
Количество иммобилизованной на наноалмазе пирофосфатазы определяют по разности концентраций фермента в растворе до и после иммобилизации аналогично примеру 1. Стандартный раствор пирофосфатазы с концентрацией 1 мг/мл при длине оптического пути 1 см имеет поглощение 1,18 ОЕ. Раствор после проведения процесса иммобилизации при длине оптического пути 1 см имеет поглощение 0,73 ОЕ. Следовательно, количество иммобилизованной на наноалмазе пирофосфатазы составляет 0,62 мг пирофосфатазы на 1 мг наноалмаза.
Определение активности пирофосфатазы выполнялось по методике примера 1. Активность нативного фермента, рассчитанная формуле (1) составила 222 МЕ/мг.
Для определения активности иммобилизованной на наноалмазе пирофосфатазы перед подачей на анализатор фосфата анализируемый раствор, содержащий иммобилизованную на наноалмазе пирофосфатазу, разбавляли до концентрация фермента 6,8 мкг/мл и добавляли аликвоту объемом 10 мкл к реакционной смеси объемом 10 мл при постоянном перемешивании на магнитной мешалке.
Активность иммобилизованной на наноалмазе пирофосфатазы вычисляли по формуле
Активность иммобилизованной на наноалмазе пирофосфатазы составила 141 МЕ/мг или 62±5% от активности нативной (несвязанной) пирофосфатазы.
Изучение стабильности иммобилизованной на наноалмазе пирофосфатазы проводили по методике примера 1.
Стабильность иммобилизованной на наноалмазе пирофосфаты оценивали по константе скорости денатурации, равной (38±4)·104, что в 1,5 раза ниже константы скорости денатурации нативной пирофосфатазы (56±5)·10-4. Таким образом, стабильность иммобилизованной на наноалмазе пирофосфатазы в 1,5 раза выше стабильности нативной пирофосфатазы.
Список литературы:
1. Richette P., Bardin Т., Doherty M. An update on the epidemiology of calcium pyrophosphate dihydrate crystal deposition disease // Rheumatology. 2009. V.48. P.711-715.
2. Фармакология: клинический подход / Пейдж К., Кертис М., Уокер М., Хоффман Б.; пер. с англ. под ред. Романова Б.К. - М.: Изд. Логосфера, 2012. - С.500.
3. Harmey D., Hessle L., Narisawa S. et al. Concerted regulation of inorganic pyrophosphate and osteopontin by akp2, enpp1, and ank: an integrated model of the pathogenesis of mineralization disorders // Am. J. Pathol. 2004. V.164. №4. P.1199-1209.
4. Барскова В.Г., Ильина A.E., Семенова Л.А., Раденска-Лоповок С.Г., Осипянц М.А., Смирнов А.В., Макаров М.А. Пирофосфатная артропатия - ревматологический синдром «айсберга»: время для переоценки значения в патологии суставов. // Современная ревматология. 2010. №2. С.5-11.
5. Punzi L., Calo L., Schiavon F., Pianon M., Rosada M., Todesco S. Chondrocalcinosis is a feature of Gitelman's variant of Bartter's syndrome. A new look at the hypomagnesemia associated with calcium pyrophosphate dihydrate crystal deposition disease. // Rev Rhum Engl Ed. 1998. V.65. P.571-574.
6. Doherty M., Dieppe P.A.: Double blind, placebo controlled trial of magnesium carbonate in chronic pyrophosphate arthropathy. // Ann. Rheum. Dis. 1983. V.42 (Suppl.1). P.106.
7. Choy G. An update on the treatment options for gout and calcium pyrophosphate deposition. // Expert Opin Pharmacother. 2005. V.6. P.2443-2453.
8. Announ N., Guerne P.A. Treating difficult crystal pyrophosphate dihydrate deposition disease. // Curr Rheumatol Rep. 2008. V.10. P.228-234.
9. Rosenthal A.K., Ryan L.M. Probenecid inhibits transforming growth factor-beta 1 induced pyrophosphate elaboration by chondrocytes. // J Rheumatol. 1994. V.21. P.896-900.
10. MacMullan P., McCarthy G. Treatment and management of pseudogout: insights for the clinician. // Ther Adv Musculoskel Dis. 2012. V.4. №2. P.121-131.
11. Sun Y, Reuben P, Wenger L et al. Inhibition of calcium phosphate-DNA coprecipitates induced cell death by phosphocitrates. // Front Biosci. 2005. V.10. P.803-808.
12. Sun Y., Mauerhan D.R., Honeycutt P.R., Kneisl J.S., Norton H.J., Zinchenko N. et al. Calcium deposition in osteoarthritic meniscus and meniscal cell culture. // Arthritis Res Ther. 2010. V.12. P.R56.
13. Shankar R., Crowden S., Sallis J.D. Phosphocitrate and its analogue N-sulpho-2-amino tricarballylate inhibit aortic calcification. // Atherosclerosis. 1984. V.52. №2. P.191-198.
14. Chollet-Janin A., Finckh A., Dudler J., Guerne P.A. Methotrexate as an alternative therapy for chronic calcium pyrophosphate deposition disease: an exploratory analysis. // Arthritis Rheum. 2007. V.56. P.688-692.
15. McGonagle D., Tan A.L., Madden J., Emery P., McDermott M.F. Successful treatment of resistant pseudogout with anakinra. // Arthritis Rheum. 2008. V.58. P.631-633.
16. Teplyakov A., Oblomova G., Wilson K.S. et al. Crystal structure of inorganic pyrophosphatase from Thermus thermophiles // Protein Science. 1994. V.3. P.1098-1107.
17. Долматов В.Ю. Детонационные наноалмазы. Получение, свойства, применение. СПб: Изд. НПО «Профессионал», 2011. С.446-470.
18. Krueger A. Carbon Materials and Nanotechnology. Wiley-VCH. 2010. C.374.
19. Huang L.-C.L., Chang H.-Ch. Adsorption and Immobilization of Cytochrome с on Nanodiamonds // Langmur. 2004. V.20. №14. P.5879-5884.
20. Li Y-Q., Zhou X.-P. Transferrin-coupled fluorescence nanodiamonds as targeting intracellular transporters: An investigation of the uptake mechanism // Diamond Relat. Mater. 2010. V.19. P.1163-1167.
21. Wei L., Wei Z., H. Lu et al. Immobilization of enzyme on detonation nanodiamond for highly efficient proteolysis // Talanta. 2009. V.80. №3. P.1298-1304.
22. Baykov A.A., Avaeva S.M. A simple and sensitive apparatus for continuous monitoring of orthophosphate in the presence of acid-labile compounds, Anal. Biochem. 1981, V.116, p.1-4
1. Конъюгат наноалмаза с пирофосфатазой для доставки пирофосфатазы в организм, представляющий собой частицы наноалмаза размером 2-10 нм с иммобилизованной на них посредством линкера, содержащего амидные- или амино- и амидные группы, пирофосфатазой, при содержании пирофосфатазы 0,1-1 мг на 1 мг наноалмаза и удельной активностью пирофосфатазы до 95±5% от активности нативной пирофосфатазы.
2. Конъюгат по п.1, где линкер представляет собой -NH-C(O)-(CH2)2-C(O)- или -NH(CH2)6-NH-C(O)-(CH2)2-C(O)-.
3. Способ получения конъюгата по п.1, характеризующийся тем, что наноалмаз с привитым гексаметилендиамином или аминированный аммиаком наноалмаз с размером частиц 2-10 нм растворяют в воде с образованием суспензии и последовательно добавляют водный буферный раствор HEPES с рН 7-8, хлорид магния, фторид натрия, пирофосфат натрия, пирофосфатазу и глутаровый альдегид при весовом соотношении пирофосфатаза:наноалмаз с привитым гексаметилендиамином или аминированный наноалмаз:глутаровый альдегид 1:1-10:5-50, соответственно с последующим выдерживанием полученной смеси в течение 0,5-12 ч, центрифугированием, промывкой водным буферным раствором Tris-HCl с рН 7-8 и сушкой.