Биомаркер для мониторинга пациентов
Иллюстрации
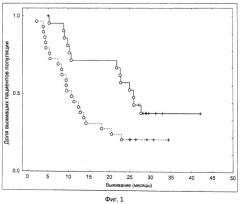
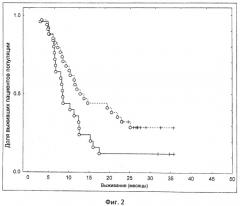
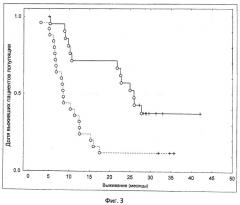
Показать всеИзобретение относится к медицине, а именно к иммунотерапии, и может быть использовано для оценки эффективности лечения у пациента с раком. Для этого пациенту вводят иммуногенную композицию, которая содержит рекомбинантный вирусный вектор, экспрессирующий in vivo весь или часть MUC-1 антигена. При этом способ анализа включает получение биологического образца от пациента после введения указанной иммуногенной композиции и измерение уровней интерферона γ в образце. Уровни интерферона γ свыше приблизительно 4 пг/мл свидетельствуют о том, что пациент демонстрирует успешный клинический выход для лечения. Изобретение позволяет оценить клинический результат лечения рака у пациента.14 з.п. ф-лы., 3 ил., 1 пр.
Реферат
Настоящее изобретение принадлежит к области иммунотерапии и относится к способам определения эффективности известных иммунотерапевтических способов лечения. Способы в соответствии с изобретением включают измерение специального биомаркера через некоторое время после инициации иммунотерапевтического лечения для оценки клинического результата указанного лечения. Изобретение, таким образом, имеет применения в области медицины.
Традиционные методики вакцинации, вовлекающие введение в систему животного антигена (например, пептидов, белков), который может индуцировать иммунный ответ и, таким образом, защищать указанное животное, например, от инфекции, являются известными в течение многих лет. Такие методики дополнительно включают разработку как живых, так и инактивированных вакцин. Живые вакцины типично представляют собой аттенуированные непатогенные варианты инфекционного агента, которые являются способными стимулировать иммунный ответ, направленный против патогенного варианта инфекционного агента.
В последние годы были достигнуты успехи в разработке рекомбинантных вакцин, в частности, рекомбинантных живых вакцин, в которых чужеродные антигены, представляющие интерес, кодируются и экспрессируются из вектора. Среди них векторы на основе рекомбинантных вирусов были продемонстрированы как многообещающие и такие, которые играют важную роль в разработке вакцин. Многие вирусы были исследованы на их способность экспрессировать белки из чужеродных патогенов или опухолевой ткани, а также индуцировать специфические иммунологические ответы против этих антигенов in vivo. В общем случае, такие основанные на генах вакцины могут стимулировать мощные гуморальный и клеточный иммунные ответы, вирусные векторы могут также представлять собой эффективную стратегию как для доставки генов, кодирующих антиген, так и для того, чтобы способствовать и усиливать презентацию антигена. Для того чтобы использоваться в качестве носителя вакцины, идеальный вирусный вектор должен быть безопасным и позволять осуществлять эффективную презентацию необходимых специфических для патогена антигенов иммуной системе. Кроме того, векторная система должна соответствовать критерию, который позволяет осуществлять ее воспроизведение на промышленной основе. Таким образом, на сегодняшний день было получено несколько вирусных вакцинных векторов, все они обладают относительными преимуществами и ограничениями в зависимости от предложенного применения (для обзора рекомбинантных вирусных вакцин смотри, например, Harrop и Carroll, 2006, Front Biosci., 11, 804-817; Yokoyama и др., 1997, J Vet Med Sci., 59, 311-322). Применение указанных рекомбинантных вакцин обычно называется нацеленной иммунотерапией или специфической для антигена и активной иммунотерапией.
После наблюдения, сделанного в ранние 1990-ые, что векторы на основе плазмидной ДНК могут непосредственно трансфицировать клетки животных in vivo, значительные усилия исследователей были предприняты для разработки методик иммунотерапии, которые основываются на применении ДНК плазмид для индукции иммунного ответа, путем непосредственного введения в животных ДНК, которая кодирует антигены. Такие методики, которые также упоминаются как ДНК вакцинация или ДНК иммунотерапия, сейчас используются для того, чтобы вызвать протективный иммунный ответ в большом количестве моделей болезней. Для обзора ДНК вакцин смотри Reyes-Sandoval и Ertl, 2001 (Current Molecular Medicine, 1, 217-243).
Однако общая проблема в области иммунотерапии представляла собой идентификацию средств для индукции достаточно сильного иммунного ответа у подвергнутых лечению индивидуумов для защиты их от инфекции и заболевания.
Таким образом, например, основное усилие в последние годы было направлено на открытие новых лекарственных соединений, которые действуют путем стимуляции определенных ключевых аспектов иммунной системы и которые будут служить для повышения иммунного ответа, индуцированного вакцинами. Большинство из этих соединений, называемых модификаторами иммунного ответа (IRM) или адъювантами, как выяснилось, оказывают воздействие посредством основных механизмов иммунной системы с помощью Toll-подобных рецепторов (TLR) для индукции биосинтеза различных важных цитокинов (например, интерферонов, интерлейкинов, фактора некроза опухоли, и т.д., смотри, например, Schiller и др., 2006, Exp Dermatol., 15, 331-341). Эти соединения были продемонстрированы как такие, которые стимулируют быстрое высвобождение определенных цитокинов, имеющих происхождение от дендритных клеток, моноцитов/макрофагов, а также являются способными стимулировать В-клетки для секреции антител, которые играют важную роль в антивирусной и противоопухолевой активности IRM соединений.
Альтернативно, были предложены стратегии вакцинации, большинство из которых являются основанными на режиме вакцинации примирования - повторной иммунизации. В соответствии с этими прописями вакцинации "примирования - повторной иммунизации" иммунная система сначала подвергается индукции путем введения пациенту примирующей композиции, а потом подвергается стимуляции путем введения второй композиции для повторной вакцинации (смотри, например, ЕР 1411974 или US 20030191076).
Кроме того, было продемонстрировано, что в контексте здравоохранения одна обработка может быть эффективной только в специфической группе пациентов. Таким образом, является желательным обеспечить врачей средствами и способами, которые будут позволять им сократить оптимальные персонализированные способы терапии пациента, то есть назначать правильную терапию правильному пациенту в правильное время для обеспечения более высокого успеха лечения, для мониторинга ответа на такое лечение, для повышения эффективности лекарственного средства и безопасности, для устранения лечения, не являющегося необходимым для пациентов, для которых терапия не является приемлемой, для того, чтобы уберечь пациента от токсичности, не являющейся необходимой, а также побочных эффектов, для снижения затрат пациентов и страховых агентств на не являющееся необходимым или опасное неэффективное лечение, а также для повышения качества жизни пациентов, в конечном счете, сделав рак контролируемым заболеванием, путем последовательного осуществления анализов в зависимости от конкретного случая.
В это связи в литературе предлагаются различные средства и способы, такие, как например:
- Фармакогенетика, которая заключается в исследовании индивидуального ответа на лекарственные средства в качестве функции генетических различий. Эти ответы относятся к тому, как лекарственное средство функционирует у какого-либо данного индивидуума, как оно метаболизируется, его токсичность и необходимые дозировки. С исследованиями в области генома человека фармакогенетика развилась в фармакогеномику. Фармакогеномика выходит за рамки фармакогенетик, и имеет потенциал для обнаружения применений от открытия лекарственного средства, разработки, выявления цели и апробации до клинических испытаний;
- Метаболомика может также применяться в области предсказательной медицины. В отличие от фармакогенетики, которая является ограниченной генетическими факторами, фармакометаболомика является способной предсказать ответ индивидуума на лекарственное средство, основываясь не только на генетических факторах, но также и на негенетических факторах, таких, как другие лекарственные средства в организме пациента, состояние здоровья пациента в данный момент времени и т.д.;
- Роль биомаркеров становится все более важной в клинической разработке терапевтических средств. Биомаркер может представлять собой индикатор нормальных биологических процессов, процессов заболевания или фармакологических ответов на терапевтическое вмешательство. Их роль колеблется от разделении популяции пациентов в отношении оказании помощи для идентификации пациентов, которые отвечают на лечение, против пациентов, не отвечающих на лечение, для определения эффективности терапевтического средства. Биомаркеры могут быть ценным средством в принятии лучших решений, которые будут снижать затраты на разработку лекарственного средства и позволят терапевтическим методам достичь правильной популяции пациентов быстрее.
Изобретение обеспечивает материалы и способы для оценки эффективности лечения, вовлекающего введение иммуногенной композиции пациенту (то есть, терапевтическое лечение) при использовании биологических маркеров (биомаркеров), которые были определены как существенно надежная характеристика, которая коррелирует с желаемым иммунным ответом. Биомаркеры являются присутствующими в биологических образцах, полученных от пациента. Способность предсказания клинического выхода лечения вскоре после его начала позволит клиническим врачам и пациентам идентифицировать неэффективную терапию, принимать основанные на достоверной информации решения, относящиеся к курсу лечения, включая стоит ли отказаться от или позволить осуществить альтернативное терапевтическое вмешательство.
Как используется в данном случае по всей заявке, термины "любой" или "какой-либо" используются в смысле того, что они означают "по крайней мере, один", "по крайней мере, первый", "один или более" или "множество" из указанных соединений или этапов, если в контексте не указывается иное. Например, термин "любая клетка" включает множество клеток, включая их смеси. В частности, "по крайней мере, один" и "один или более" означает количество, которое составляет один или более одного, с особым предпочтением для одного, двух или трех.
Термин "и/или" при использовании где-либо в данной заявке включает значение "и", "или" и "все или какая-либо другая комбинация элементов, связанных с указанным термином".
Термин "приблизительно" или "около", как используется в данной заявке, имеет значение в пределах 20%, предпочтительно в пределах 10% и более предпочтительно в пределах 5%.
Термины "пациент", "субъект" относятся к позвоночному животному, в частности, представителю видов млекопитающих, и включают, но без ограничения, домашних животных, спортивных животных, приматов, включая людей.
Как используется в данной заявке, термин "лечение" или "процесс лечения" охватывает профилактику и/или терапию. В соответствии с этим иммуногенные комбинации или способы настоящего изобретения не являются ограниченными терапевтическими применениями и могут использоваться для профилактики. Это охватывается в данной заявке термином "для развития профилактического или терапевтического ответа, предпочтительно иммунного ответа". "Профилактика" не является ограниченной предотвращением немедленного заболевания (например, инфекционного заболевания), этот термин дополнительно охватывает предотвращение долгосрочных последствий этих инфекций, таких как цирроз или рак.
"Эффективное количество" или "достаточное количество" активного соединения представляет собой количество, достаточное для достижения выгодных или желательных результатов, включая клинические результаты. Эффективное количество может вводиться в один или более приемов. "Терапевтически эффективное количество" представляет собой количество, достаточное для достижения выгодных клинических результатов, включая, но без ограничения, ослабление одного или более симптомов, ассоциированных с развитием опухоли, вирусной инфекцией, а также предотвращение заболевания (например, предотвращение одного или более симптомов инфекции).
В соответствии с первым воплощением настоящее изобретение относится к материалам и способам для мониторинга, модификации или корректировки лечения, вовлекающего введение иммуногенной композиции пациенту. Эти материалы и способы основываются на уровнях, по крайней мере, одного биомаркера у пациента, и включают этапы измерения в биологическом образце пациента (например, сыворотке или плазме) уровней, по крайней мере, одного биомаркера, по крайней мере, один раз после начала лечения. В соответствии с предпочтительным воплощением указанный биомаркер представляет собой гамма интерферон (интерферон γ или INF γ).
Изобретение обеспечивает ex-vivo способ для оценки эффективности лечения, вовлекающего введение иммуногенной композиции пациенту (то есть, иммунотерапевтического лечения).
В соответствии с изобретением термин "оценка" будет пониматься как "мониторинг, модификация или корректировка" лечения, вовлекающего введение иммуногенной композиции пациенту.
В некоторых аспектах способ включает оценку эффективности иммунотерапевтического лечения на основе уровней интерферона γ у пациента после иммунотерапевтического лечения.
В некоторых воплощениях способ включает измерение уровней интерферона γ у пациента после иммунотерапевтического лечения; и оценку эффективности иммунотерапевтического лечения на основе уровней интерферона γ.
В некоторых воплощениях способ включает измерение уровней интерферона γ пациента, по крайней мере, один раз через несколько недель осуществления иммунотерапевтического лечения; и оценку эффективности иммунотерапевтического лечения на основе уровней интерферона γ.
В некоторых воплощениях способ может дополнительно включать измерение уровней интерферон γ у пациента перед осуществлением иммунотерапевтического лечения.
Время от начала иммунотерапевтического лечения до измерения уровней интерферона γ может составлять от 1 дня до приблизительно 48 недель или более (например, от приблизительно 1 дня до приблизительно 1 недели, от приблизительно 1 недели до приблизительно 2 недель, от приблизительно 2 недель до приблизительно 4 недель, от приблизительно 4 недель до приблизительно 8 недель, от приблизительно 8 недель до приблизительно 12 недель, от приблизительно 12 недель до приблизительно 16 недель, от приблизительно 16 недель до приблизительно 24 недель, от приблизительно 24 недель до приблизительно 48 недель, или более). В предпочтительном воплощении изобретения временной интервал составляет 5 недель. Подобно этому, могут быть проведены дополнительные измерения (то есть, третье, четвертое, пятое и т.д. измерения) с подобными временными интервалами после второго измерения.
В соответствии со специальным воплощением изобретения "иммунотерапевтическое лечение" состоит из, по крайней мере, одного введения иммуногенной композиции пациенту. В соответствии со специальным воплощением "иммунотерапевтическое лечение" состоит из последовательных введений иммуногенной композиции пациенту, при этом оно включает еженедельные введения в течение, по крайней мере, 2 недель, предпочтительно в течение, по крайней мере, 6 недель.
В близких аспектах способ включает определение уровней интерферона γ у пациента после введения иммуногенной композиций пациенту; сравнение указанных уровней с пороговым значением; и оценку эффективности иммунотерапевтического лечения на основе уровней интерферон γ по сравнению с пороговым значением.
В соответствии со специальным воплощением изобретения "уровень интерферона γ" означают способный к определению уровень интерферона γ, "способный к определению" определяется как такой, который является ≥ границы определения, более предпочтительно, границы определения используемого анализа/метода для измерения уровня интерферона γ (Luminex, Elisa и т.д.). Эта граница определения для одного из указанных анализа/способа легко определяется традиционным способом.
В соответствии со специальным воплощением пороговое значение и/или предел определения составляет приблизительно 4 пг/мл (например, 4,6 пг/мл в плазме крови), предпочтительно измеренное с помощью профиля для измерения белка плазмы крови Multi-analyte при использовании Luminex® системы (смотри Пример 1). Для квалифицированного специалиста при использовании другого анализа/способа (например, Elisa) не будет составлять сложности определить для специфического анализа эквивалент указанного порогового значения и/или границы определения, составляющей приблизительно 4 пг/мл при измерении с помощью профиля для измерения белка плазмы крови Multi-analyte при использовании Luminex® системы. В соответствии со специальными воплощениями указанное пороговое значение в соответствии с изобретением может быть определено как пороговое значение, эквивалентное пороговому значению, измеренному с помощью профиля для измерения белка плазмы крови Multi-analyte при использовании Luminex® системы. Под "пороговым значением, эквивалентным пороговому значению, измеренному с помощью профиля для измерения белка плазмы крови Multi-analyte при использовании Luminex® системы" понимают пороговое значение, которое идентифицирует тех же пациентов, как было идентифицировано с помощью порогового значения, измеренного с помощью профиля для измерения белка плазмы крови Multi-analyte при использовании Luminex® системы.
В соответствии со специальным воплощением изобретение относится к способу оценки эффективности лечения, вовлекающему введение иммуногенной композиции пациенту, который включает:
(i) введение одной или более доз указанной иммуногенной композиции указанному субъекту;
(ii) измерение уровня интерферона γ в организме указанного субъекта, по крайней мере, после одного из указанных введений.
В соответствии со специальным воплощением изобретение касается способа оценки эффективности лечения, вовлекающего введение иммуногенной композиции пациенту, который включает:
(i) введение одной или более доз указанной иммуногенной композиции указанному субъекту;
(ii) измерение уровня интерферона γ в организме указанного субъекта, по крайней мере, после одного из указанного(ых) введения(ий);
(iii) где уровни интерферона γ выше приблизительно 4 пг/мл (например, 4,6 пг/мл), измеренные с помощью профиля для измерения белка плазмы крови Multi-analyte при использовании Luminex® системы, свидетельствуют о том, что субъект является таким, который демонстрирует успешный клинический выход для лечения, то есть повышение коэффициента выживания.
В соответствии с альтернативным воплощением изобретения способ в соответствии с изобретением дополнительно включает начальный этап, состоящий из измерения уровней интерферона γ уровни в организме пациента перед введением иммуногенной композиции.
В соответствии с настоящим изобретением уровень интерферона γ измеряется в биологическом образце, полученном от пациента. Биологические образцы включают, но не являются ограниченными таковыми, кровь и другие жидкие образцы биологического происхождения, твердые образцы тканей, такие, как кусочки биопсии. В предпочтительном воплощении биологический образец представляет собой кровь, плазму или сыворотку, в случае которых получение образца от пациента представляет собой относительно простую и неинвазивную процедуру. Способы получения крови или сыворотки являются хорошо известными в области техники и не являются частью изобретения.
Кроме того, являются известными многочисленные способы для определения и количественной оценки полипептидов, включая биомаркеры в соответствии с настоящим изобретением. Такие способы включают, но без ограничения, способы при использовании антител, в частности способы на основе моноклональных антител. Частные способы для определения и количественной оценки биомаркеров не являются важными для данного изобретения. Например, материалы и способы настоящего изобретение могут использоваться с методикой Luminex (Luminex Corporation, Austin, Тех.) или иммуносорбентным ферментным анализом (ELISA, многочисленные наборы ELISA являются коммерчески доступными, например, от CliniScience, Diaclone, Biosource).
Как используется в данной заявке, термины "иммуногенная композиция" "вакцинная композиция", "вакцина" или подобные термины могут использоваться попеременно и означают агент, приемлемый для стимуляции/индукции/усиления иммунной системы субъекта для облегчения существующего состояния или для защиты от, или для снижения настоящего или будущего вреда или инфекций (включая вирусные, бактериальные, паразитарные инфекции), например, сниженную пролиферацию опухолевых клеток или выживание, сниженную репликацию патогена или распространение в организме субъекта или способное к определению снижение нежелательного(ых) симптома(ов), ассоциированного(ых) с состоянием, продление выживания пациента. Указанная иммуногенная композиция может содержать (i) весь или часть, по крайней мере, одного целевого антигена и/или (ii) по крайней мере, один рекомбинантный вектор экспрессирующий in vivo всю или часть, по крайней мере, одной гетерологичной нуклеотидной последовательности, в частности, гетерологичной нуклеотидной последовательности, кодирующей весь или часть, по крайней мере, одного целевого антигена. В соответствии с альтернативным воплощением иммуногенная композиция в соответствии с изобретением включает (iii) по крайней мере, один модификатор иммунного ответа, самостоятельно или в комбинации с (i) и/или (ii). Примеры таких модификаторов иммунного ответа (IRM), включают CpG олигонуклеотиды (смотри US 6,194,388; US 2006094683; WO 2004039829, например), липополисахариды, комплексы полиинозиновой : полицитидиловой кислоты (Kadowaki, и др., 2001, J. Immunol. 166, 2291-2295), полипептиды и белки, известные для индукции продукции цитокинов из дендритных клеток и/или моноцитов/макрофагов. Другие примеры таких модификаторов иммунного ответа (IRM) представляют собой малые органические молекулы, такие, как имидазохинолинамины, имидазопиридинамины, 6,7-слитые циклоалкилимидазопиридинамины, имидазонафтиридинамины, оксазолхинолинамины, тиазолхинолинамины и 1,2-соединенные мостиковой связью имидазолхинолинамины (смотри, например, US 4,689,338; US 5,389,640; US 6,110,929 и US 6,331,539).
Как используется в данной заявке, термин "антиген" относится к любому веществу, включая комплексные антигены (например, опухолевых клеток, инфицированных вирусом клеток и т.д.), которые являются способными быть мишенью иммунного ответа. Антиген может быть мишенью, например, для клеточного и/или гуморального иммунного ответа, возникающего у пациента. Термин "антиген" охватывает, например, все или часть вирусных антигенов, специфические для опухоли или связанные с опухолью антигены, бактериальные антигены, паразитарные антигены, аллергены и подобные им:
- Вирусные антигены включают, например, антигены из вирусов гепатита А, В, С, D и Е, ВИЧ, вирусов герпеса, цитомегаловируса, вируса ветряной оспы, папилломавирусов, вируса Эпштейна-Барра, вирусов гриппа, вирусов парагриппа, аденовирусов, вирусов коксаки, пикорнавирусов, ротавирусов, респираторно-синцитиальных вирусов, вирусов оспы, риновирусов, вируса краснухи, паповавируса, вируса эпидемического паротита, вируса кори; некоторые неограничивающие примеры известных вирусных антигенов включают следующие: антигены, имеющие происхождение от ВИЧ-1, такие, как tat, nef, gp120 или gp160, gp40, p24, gag, env, vif, vpr, vpu, rev или их часть и/или комбинации; антигены, имеющие происхождение от вирусов герпеса человека, такие, как gH, gL gM gB gC gK. gE или gD или их часть и/или комбинации или предранний белок, такой, как asICP27, ICP47, ICP4, ICP36 из HSV1 или HSV2; антигены, имеющие происхождение от цитомегаловируса, в частности цитомегаловируса человека, такие, как gB или его производные; антигены, имеющие происхождение от вируса Эпштейна-Барра, такие, как gp350 или его производные; антигены, имеющие происхождение от вируса ветряной оспы, такие, как gp1, 11, 111 и IE63; антигены, имеющие происхождение от вируса гепатита, такие, как антиген вируса гепатита В, гепатита С или гепатита Е (например, env белок Е1 или Е2, сердцевинный белок, NS2, NS3, NS4a, NS4b, NS5a, NS5b, p7, или их части и/или комбинации HCV); антигены, имеющие происхождение от папилломавирусов человека (например, HPV6, 11, 16, 18, например, L1, L2, Е1, Е2, Е3, Е4, Е5, Е6, Е7, или их части и/или комбинации); антигены, имеющие происхождение от других вирусных патогенов, таких, как респираторно-синцитиальный вирус (например, F и G белки или их производные), вируса парагриппа, вируса кори, вируса эпидемического паротита, флавивирусов (например, вируса желтой лихорадки, вируса Денге, вируса клещевого энцефалита, вируса японского энцефалита) или вируса гриппа (например, НА, NP, NA, или М белки, или их части и/или комбинации);
- Специфические для опухоли или родственные антигены включают, но без ограничения, такие карциномы, лимфомы, бластомы, саркомы и лейкемии. В частности, примеры видов рака включают рак молочной железы, рак предстательной железы, рак толстого кишечника, рак чешуйчатых клеток, мелкоклеточный рак легких, немелкоклеточный рак легких, желудочно-кишечный рак, рак поджелудочной железы, глиобластому, рак шейки матки, рак яичника, рак печени, рак желчного пузыря, гепатому, колоректальный рак, эндометриальную карциному, карциному слюнных желез, рак почки, рак печени, рак женских наружных половых органов, рак щитовидной железы, печеночную карциному и различные типы рака головы и шеи, ренальный рак, злокачественную меланому, ларингеальный рак, рак предстательной железы. Раковые антигены представляют собой антигены, которые могут потенциально стимулировать очевидные специфические для опухоли иммунные ответы. Некоторые из этих антигенов кодируются, несмотря на то что с необходимостью не экспрессируются, нормальными клетками. Эти антигены могут характеризоваться как такие, которые в норме являются молчащими (то есть, не экспрессируются) в нормальных клетках, такими, которые экспрессируются только на низких уровнях или на определенных стадиях дифференциации, и те, которые экспрессируются временно, такие, как эмбриогенные и фетальные антигены. Другие раковые антигены кодируются мутантными клеточными генами, такими как онкогены (например, активированный ras онкоген), супрессорные гены (например, мутант р53), слитые белки, возникающие в результате внутренних делеций или хромосомных транслокаций. Другие раковые антигены могут кодироваться вирусными генами, например, такие, как те, которые имеют происхождение от РНК и ДНК опухолевых вирусов. Некоторые неограничивающие примеры специфических для опухоли или связанных с опухолью антигенов включают MART-1/Melan-A, gp100, дипептидилпептидазу IV (DPPIV), белок, связывающий аденозиндезаминазу (ADAbp), циклофилин b, колоректальный ассоциированный антиген (CRC)-C017-1A/GA733, карциноэмбриональный антиген (СЕА) и его иммуногенные эпитопы САР-1 и CAP-2, etv6, ami1, специфический антиген простаты (PSA) и его иммуногенные эпитопы PSA-1, PSA-2, и PSA-3, специфический мембранный антиген простаты (PSMA), Т-клеточный рецептор/СЭ3-дзета цепь, MAGE-семейство опухолевых антигенов (например, MAGE-A1, MAGE-A2, MAGE-A3, MAGE-A4, MAGE-A5, MAGE-A6, MAGE-A7, MAGE-A8, MAGE-A9, MAGE-A10, MAGE-АН, MAGE-A12, MAGE-Xp2 (MAGE-B2), MAGE-Хр3 (MAGE-В3), MAGE-Xp4 (MAGE-B4), MAGE-C1, MAGE-C2, MAGE-C3, MAGE-C4, MAGE-C5), GAGE-семейство опухолевых антигенов (например, GAGE-1, GAGE-2, GAGE-3, GAGE-4, GAGE-5, GAGE-6, GAGE-7, GAGE-8, GAGE-9), BAGE, RAGE, LAGE-1, NAG, GnT-V, MUM-1, CDK4, тирозиназа, p53, MUC семейство (например, MUC-1), HER2/neu, p21ras, RCAS1, альфа-фетобелок, Е-кадгерин, альфа-катенин, бета-катенин и гамма-катенин, p120ctn, gp100.sup.Pmel117, FRAME, NY-ESO-1, cdc27, белок, характерный для аденоматозного полипоза толстой кишки (АРС), фодрин, коннексин 37, Ig-идиотип, р15, gp75, GM2 и GD2 ганглиозиды, вирусные продукты, такие, как белки вируса папилломы человека, Smad семейство опухолевых антигенов, Imp-1, PI А, кодируемый EBV ядерный антиген (EBNA)-1, гликогенфосфорилаза мозга, SSX-1, SSX-2 (HOM-MEL-40), SSX-1, SSX-4, SSX-5, SCP-1 и СТ-7 и с-erbB-2;
- бактериальные антигены включают, например, антигены, имеющие происхождение от Mycobacteria, которые вызывают ТВ и проказу, пневмококков, аэробных грам-негативных бацилл, микоплазм, стафилококковых инфекций, стрептококковых инфекций, сальмонеллы, хламидий, нейссерии;
- другие антигены включают, например, антигены, имеющие происхождение от возбудителей малярии, лейшманиоза, трипаносомоза, токсоплазмоза, шистосомоза, филяриоза;
В соответствии со специальным воплощением указанный антиген кодируется гетерологичной нуклеотидной последовательностью и экспрессируется in vivo с помощью рекомбинантного вектора.
В особенно предпочтительном воплощении гетерологичная нуклеотидная последовательность в соответствии с настоящим изобретением кодирует один или более из всего или части следующих антигенов HBV-PreSI PreS2 и поверхностных env белков, сердцевинного и polHIV-gp120 gp40, gp160, p24, gag, pol, env, vif, vpr, vpu, tat, rev, nef; HPV-E1, E2, E3, E4, E5, E6, E7, E8, LI, L2 (смотри, например, WO 90/10459, WO 98/04705, WO 99/03885); HCV env белка E1 или E2, сердцевинного белка, NS2, NS3, NS4a, NS4b, NS5a, NS5b, p7 (смотри, например, WO 2004111082, WO 2005051420); Muc-1 (смотри, например, US 5,861,381; US6,054,438; WO 98/04727; WO 98/37095).
В соответствии с вариантами данного изобретения иммуногенная композиция содержит, по крайней мере, два антигена или гетерологичную нуклеотидную последовательность, которая кодирует, по крайней мере, два антигена, или, по крайней мере, гетерологичные нуклеотидные последовательности, которые кодируют, по крайней мере, два антигена, или любую их комбинацию.
В соответствии с другим специальным воплощением указанная гетерологичная нуклеотидная последовательность в соответствии с настоящим изобретением кодирует все или часть HPV антигены(ов), выбранных из группы, состоящей из Е6 раннего кодирующего участка HPV, E7 раннего кодирующего участка HPV, их производных и комбинаций.
HPV антиген, кодируемый рекомбинантным вектором в соответствии с изобретением, является выбранным из группы, состоящей из Е6 полипептида HPV, E7 полипептида HPV или как Е6 полипептида HPV, так и E7 полипептида HPV. Настоящее изобретение охватывает применение любого Е6 полипептида HPV, связывание которого с р53 изменяется или, по крайней мере, значительно снижается, и/или применение любого E7 полипептида HPV, связывание которого с Rb изменяется или, по крайней мере, значительно снижается (Munger и др., 1989, ЕМВО J. 8, 4099-4105; Crook и др., 1991, Cell 67, 547-556; Heck и др., 1992, Proc. Natl. Acad. Sci. USA 89, 4442-4446; Phelps и др., 1992, J. Virol. 66, 2148-2427). Неонкогенный Е6 вариант HPV-16, который является приемлемым для цели настоящего изобретения, имеет делецию одного или более аминокислотных остатков, которые размещаются от приблизительно положения 118 до приблизительно положения 122 (+1, который представляет собой первый остаток метионина нативного Е6 полипептида HPV-16), с особым предпочтение для полной делении остатков от 118 до 122 (СРЕЕК). Неонкогенный E7 HPV-16 вариант, который является приемлемым для цели настоящего изобретения, имеет делецию одного или более аминокислотных остатков, которые размещаются от приблизительно положения 21 до приблизительно положения 26 (+1 который представляет собой первый остаток метионина нативного E7 полипептида HPV-16), с особым предпочтение для полной делеции остатков от 21 до 26 (DLYCYE). В соответствии с предпочтительным воплощением один или более ранний(их) полипептид(ов) HPV-16, которые используются в изобретении, является(являются) дополнительно модифицированным(и) так, что улучшают презентацию МНС класса I и/или МНС класса II, и/или стимулируют анти-HPV иммунитет. Е6 и E7 полипептиды HPV представляют собой ядерные белки, и ранее было продемонстрировано, что мембранная презентация позволяет улучшить их терапевтическую эффективность (смотри, например, WO 99/03885). Таким образом, может быть желательным модифицировать, по крайней мере, один из ранних полипептидов HPV так, чтобы прикрепить его к клеточной мембране. Прикрепление к мембране может быть легко достигнуто путем встраивания в ранний полипептид HPV последовательности прикрепления к мембране, и если в нативном полипептиде она отсутствует, то и последовательности секреции (то есть, сигнального пептида). Последовательности прикрепления к мембране и секреторные последовательности являются известными в области техники. Кратко, секреторные последовательности присутствуют на N-терминальном конце презентируемых на мембране или секретируемых полипептидов и инициируют их поступление в эндоплазматический ретикулум (ER). Они обычно включают от 15 до 35 существенно гидрофобных аминокислот, которые потом удаляются с помощью специфической размещенной на ER эндопептидазы с получением зрелого полипептида. Последовательности прикрепления к мембране обычно являются высоко гидрофобными по своей природе и служат для прикрепления полипептидов к клеточной мембране (смотри, например Branden и Tooze, 1991, в Introduction to Protein Structure стр.202-214, NY Garland).
Выбор последовательностей прикрепления к мембране и секреторных последовательностей, которые могут использоваться в контексте настоящего изобретения, является обширным. Они могут быть получены из любого прикрепленного к мембране и/или секретируемого полипептида, включающего их (например, клеточных или вирусных полипептидов), таких, как гликопротеин вируса бешенства, гликопротеин оболочки ВИЧ или F белок вируса кори, или могут быть синтетическими. Последовательности прикрепления к мембране и/или секреторные последовательности, встроенные в каждый из ранних полипептидов HPV-16, используемых в соответствии с изобретением, могут иметь общее или отличное происхождение. Предпочтительный сайт встраивания секреторной последовательности представляет собой N-терминальный конец ниже от кодона инициации трансляции, а таковой для последовательности прикрепления к мембране представляет собой С-терминальный конец, например, непосредственно выше от стоп-кодона.
HPV Е6 полипептид для применения в настоящем изобретении предпочтительно является модифицированным путем встраивания секреторных сигналов и сигналов связывания с мембраной F белка вируса кори. Необязательно или в комбинации, HPV E7 полипептид для применения в настоящем изобретении предпочтительно является модифицированным путем встраивания секреторных сигналов и сигналов связывания с мембраной гликопротеина вируса бешенства.
Терапевтическая эффективность рекомбинантных векторов может также быть улучшена путем использования одной или более нуклеиновой кислоты, кодирующей иммуностимуляторный(ые) полипептид(ы). Например, может быть предпочтительным связывать ранний(е) полипептид(ы) HPV с полипептидом, таким, как кальретикулин (Cheng и др., 2001, J. Clin. Invest. 108, 669-678), белок теплового шока 70 Mycobacterium tuberculosis (HSP70) (Chen и др., 2000, Cancer Res. 60, 1035-1042), убиквитин (Rodriguez и др., 1997, J. Virol. 71, 8497-8503) или транслокационный домен бактериального токсина, такой, как экзотоксин А Pseudomonas aeruginosa (ETA(dIII)) (Hung и др., 2001 Cancer Res. 61, 3698-3703).
В соответствии с другим воплощением рекомбинантный вектор в соответствии с изобретением включает нуклеиновую кислоту, кодирующую один или более ранний(их) полипептид(ов), как определено выше, и в частности, ранние полипептиды Е6 и/или E7 HPV-16 и/или HPV-18.
В соответствии с другим специальным и предпочтительным воплощением указанная гетерологичная нуклеотидная последовательность в соответствии с настоящим изобретением кодирует весь или часть MUC 1 антигена или его производной.
В соответствии с другим специальным воплощением указанная гетерологичная нуклеотидная последовательность в соответствии с настоящим изобретением кодирует один или более из всех или части из приведенных ниже: белок оболочки Е1 или Е2 HCV, сердцевинный белок, NS2, NS3, NS4a, NS4b, NS5a, NS5b, p7 или их производные, В соответствии с другим специальным воплощением указанная гетерологичная нуклеотидная последовательность в соответствии с настоящим изобретением кодирует один или более слитых белков, в которых конфигурация не является нативной в смысле того, что, по крайней мере, один из NS полипептидов оказывается расположенным в таком порядке, который отличается от такого для нативной конфигурации. Таким образом, если слитый белок включает NS3 полипептид, NS4A полипептид и NS5B полипептид, то нативная конфигурация будет представлять собой NS3-NS4A-NS5B с NS3 на N-терминальном конце и NS5B на С-терминальном конце. В противовес этому, ненативная конфигурация может представлять собой NS5B-NS3-NS4A, NS5B-NS4A-NS3, NS4A-NS3-NS5B, NS4A-NS5B-NS3 или NS3-NS5B-NS4A. В частности, слитый белок в соответствии с изобретением включает, по крайней мере, один из следующих:
- NS4A полипептид, слитый непосредственно или через линкер с N-терминальным концом NS3 полипептида;
- NS3 полипептид, слитый непосредственно или через линкер с N-терминальным концом NS5B полипептида;
- NS4B полипептид, слитый непосредственно или через линкер с N-терминальным концом NS5B полипептида;
- NS4A полипептид, слитый непосредственно или через линкер с N-терминальным концом NS3 полипептида, который сливается непосредственно или с помощью линкера с N-терминальным концом NS4B полипептида; и/или
- NS3 полипептид, слитый непосредственно или через линкер с N-терминальным концом NS4B полипептида, кото