Композиции и способы лечения рака мочевого пузыря
Иллюстрации
Показать всеИзобретение относится к фармацевтической композиции для лечения рака мочевого пузыря. Указанная композиция содержит эффективное количество валрубицина и диметилсульфоксида, а также полиэтоксилированное касторовое масло или одно или более веществ, выбранных из триметилхитозана, моно-N-карбоксиметилхитозана, N-диэтилметилхитозана, натрий каприновокислого, цитохалазина В, IL-1, поликарбофила, карбопола 934Р, N-сульфат-N,O-карбоксиметилхитозана, токсина Zonula occludens, 1-пальмитоил-2-глутароил-sn-глицеро-3-фосфохолина, и представлена в дозированной форме для внутрипузырного введения путем инстилляции. Также изобретение относится к липосомальным фармацевтическим композициям, содержащим валрубицин, и способам лечения рака мочевого пузыря, включающим введение указанных композиций. Заявленное изобретение уменьшает раздражение мочевого пузыря и повышает эффективность лечения рака мочевого пузыря. 4 н. и 8 з.п. ф-лы, 3 ил., 3 табл., 1 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится в основном к области терапии рака. Конкретно, представлены терапии злокачественных новообразований, развивающихся в полой структуре тела пациента, такой как мочевой пузырь, толстая кишка, рот и желудок.
Уровень техники
Новообразования в мочевом пузыре, как правило, развиваются как предраковые повреждения и могут превратиться в инвазивный рак. Некоторые переходят к метастатическому росту. Наиболее широко распространенное новообразование мочевого пузыря представляет собой переходно-клеточную карциному эпителиального происхождения. Пациенты с поверхностной злокачественной опухолью мочевого пузыря имеют благоприятный прогноз, но глубокая инвазия в нижележащую мускулатуру снижает пятилетнюю выживаемость примерно на 50%.
Хирургическое вмешательство является главным методом лечения. Степень хирургического вмешательства зависит от патологической стадии заболевания. Заболевание на ранней стадии, как правило, подвергается лечению с помощью внутрипузырной химиотерапии и трансуретральной резекции. Местно-инвазивное заболевание можно подвергать лечению только с помощью радикальной цистэктомии и мочеотведения. Хирургическое вмешательство часто сопровождают вспомогательным внутрипузырным введением химиотерапевтического или иммунотерапевтического агента для снижения частоты возникновения и тяжести рецидива рака или в том же или в другом месте стенки мочевого пузыря. Радикальная (лечебная) лучевая терапия, как правило, применяется к пациентам с раком мочевого пузыря, которые не являются кандидатами для хирургического вмешательства. Для поверхностного заболевания на ранней стадии химиотерапию применяют внутрипузырно (непосредственно в мочевом пузыре) для концентрирования лекарственного средства в месте опухоли и для того, чтобы исключить наличие любой оставшейся после резекции опухолевой массы. Химиотерапия также может использоваться при лечении запущенной стадии рака мочевого пузыря.
Одним таким химиотерапевтическим агентом, используемым для лечения рака мочевого пузыря, является Валстар® (Valstar®). Валстар® представляет собой композицию валрубицина в этаноле, которую инсталлируют в мочевой пузырь при лечении злокачественных новообразований мочевого пузыря. Для поражения опухолевых клеток препарат может использоваться вместо или после трансуретральной резекции мочевого пузыря. Однако известно, что такие композиции являются раздражающими для некоторых пациентов, поэтому они удаляются из мочевого пузыря до достижения достаточной эффективности. Таким образом, для введения валрубицина необходимы носители, снижающие раздражение и повышающие эффективность лечения.
Сущность изобретения
В одном аспекте, композиции и способы лечения рака мочевого пузыря содержат внутрипузырные дозированные формы противоопухолевого агента. В другом аспекте, предлагается фармацевтическая композиция, включающая эффективное количество противоопухолевого агента и диметилсульфоксида во внутрипузырной дозированной форме. В некоторых воплощениях, эффективное количество валрубицина составляет около 5-100 мг/мл, около 10-90 мг/мл, около 15-80 мг/мл, около 20-70 мг/мл, около 25-70 мг/мл, около 30-60 мг/мл, около 35-50 мг/мл, или около 35 45 мг/мл. В некоторых воплощениях, фармацевтическая композиция дополнительно включает один или более усилителей химического проникновения, выбранных из этанола, изопропанола, диметилацетамида, диметилформамида, децилметилсульфоксида, 2-пирролидона, N-этил-2-пирролидона, каприновой кислоты, линолевой кислоты, мочевин, додецилсульфата натрия, лаурилсульфата натрия и смесей из двух или более этих соединений. В других воплощениях, эффективного количества валрубицина и диметилсульфоксида достаточно для лечения рака мочевого пузыря.
В ряде воплощений, фармацевтические композиции включают вещество для открытия контактов. В некоторых воплощениях, вещество для открытия контактов может представлять собой триметил-хитозан, moho-N-карбоксиметилхитозан, N-диэтилметилхитозан, натрий каприновокислый, цитохалазин B, IL-1, поликарбофил, карбопол 934P, N-сульфат-N,O-карбоксиметилхитозан, токсин Zonula occludens, 1-пальмитоил-2-глутароил-sn-глицеро-3-фосфохолин, и смеси из любых двух или более из этих соединений. Вещество для открытия контактов может присутствовать в композиции в количестве около 1-15 масс.% по объему дозированной формы.
В некоторых воплощениях, фармацевтические композиции включают полиэтоксилированное касторовое масло. Согласно другим воплощениям полиэтоксилированным касторовым маслом может быть кремофор. В некоторых воплощениях, кремофор и диметилсульфоксид представлены в равных количествах. В некоторых воплощениях, фармацевтические композиции включают вещество для открытия контактов. Вещество для открытия контактов может представлять собой триметил-хитозан, моно-N-карбоксиметилхитозан, N-диэтил-метилхитозан, натрий каприновокислый, цитохалазин B, IL-I, поликарбофил, карбопол 934P, N-сульфат-N,O-карбоксиметилхитозан, токсин Zonula occludens, 1-пальмитоил-2-глутароил-sn-глицеро-3-фосфохолин, и смеси из любых двух или более из этих соединений.
В ряде воплощений, фармацевтические композиции включают муцин-деградирующее соединение. В некоторых воплощениях, муцин-деградирующее соединение выбрано из группы, состоящей из: трипсина, гиалуронидазы, протаминсульфата и норэпинефрина.
В некоторых воплощениях, фармацевтическая композиция включает биоадгезивный или мукоадгезивный агент. В ряде воплощений, мукоадгезивный агент представляет собой полиакриловую кислоту. В некоторых воплощениях, фармацевтическая композиция дополнительно включает ионное или не ионное поверхностно-активное вещество, поливинилпирролидон, альгинаты, полиакриловую кислоту или смеси из любых двух или более из этих соединений. Типичные ионные и не ионные поверхностно-активные вещества включают полиоксиэтиленовые производные касторового масла, блок-сополимеры этиленкосида и пропиленоксида, эфиры сорбита и жирной кислоты или смеси из любых двух или более из этих соединений. Типичные полиакриловые кислоты включают карбомер 934P, карбомер 940, карбомер 941, карбомер 974P, карбомер 980, карбомер 1342, поликарбофил, поликарбофил кальция или смесь из любых двух или более из этих соединений.
В другом аспекте, предлагается фармацевтическая композиция, включающая эффективное количество валрубицина и 2-гидрокси-пропил-β-циклодекстрана во внутрипузырной дозированной форме. В некоторых воплощениях, количество 2-гидрокси-пропил-β-циклодекстрана составляет около 1-5 масс.% по объему дозированной формы. В ряде воплощений, фармацевтическая композиция дополнительно включает вещество для открытия плотных контактов. В некоторых воплощениях, вещество для открытия контактов представляет собой триметил-хитозан, моно-N-карбоксиметилхитозан, N-диэтил-метилхитозан, натрий каприновокислый, цитохалазин B, IL-I, поликарбофил, карбопол 934P, N-сульфат-N,O-карбоксиметилхитозан, токсин Zonula occludens, 1-пальмитоил-2-глутароил-sn-глицеро-3-фосфохолин, или смесь из любых двух или более из этих соединений. В некоторых воплощениях, фармацевтическая композиция также включает биоадгезивный или мукоадгезивный агент. В ряде воплощений, мукоадгезивный агент представляет собой полиакриловую кислоту.
В другом аспекте, предлагается фармацевтическая композиция, включающая липосомную дозированную форму, содержащая эффективное количество включенного в липосому валрубицина, при этом липосома содержит, по меньшей мере, одно липосомообразующее вещество, выбранное из группы, состоящей из: фосфатидилхолина и фосфатидилэтаноламина. В некоторых воплощениях, липосомообразующее вещество содержит фосфатидилхолин в количестве около 4-8 масс.%. В других воплощениях, фармацевтическая композиция включает холестерин в количестве около 0,5-2 масс.%. В ряде воплощений, фармацевтическая композиция включает один или более сфинголипидов, которые представляют собой D-глюкозил-β1-1'церамид (C8); D-глюкозил-β1-1'-Гцерамид (С12); D-глюкозил-β1,1'N-пальмитоил-D-эритросфингозин; D-галактозил-β1-1'церамид (C8); D-галактозил-β1-1'церамид (12); D-галактозил-β1-1'-N-нервонил-D-эритросфингозин; или D-glactose-β1-1' церамид (С8); и D-glactose-β1-1'церамид (C12), в количестве около 1-6 масс.%. В некоторых воплощениях, липосомообразующее вещество содержит фосфатидилэтаноламин в количестве около 2-8 масс.%. В других воплощениях, фармацевтическая композиция включает фосфатидилинозитол в количестве около 1-5 масс.%, в ряде других воплощений, фармацевтическая композиция включает олеиновую кислоту в количестве около 0,5-1 масс.%. В других воплощениях, фармацевтическая композиция включает холестерин в количестве около 0,5-2 масс.%. В ряде воплощений, фармацевтическая композиция включает диглицерид янтарной кислоты в количестве около 3-4 масс.%. В некоторых воплощениях, фармацевтическая композиция включает масло. Такое масло может включать в качестве неограничивающих примеров картамин, триацетилглицерин и хлопковое масло. В ряде воплощений, фармацевтическая композиция включает усилитель проникновения. В ряде воплощений, усилитель проникновения представляет собой олеиновую кислоту, каприновую кислоту, линолевую кислоту, мочевины, додецилсульфат натрия, лаурилсульфат натрия или смесь любых двух или более из этих соединений.
В другом аспекте, предлагается фармацевтическая композиция, включающая эффективное количество включенного в эмульсию валрубицина; где эмульсия включает, по меньшей мере, одно образующее эмульсию вещество, выбранное из фосфатидилхолина, фосфатидилэтаноламина и масла. В некоторых воплощениях, масло выбрано из группы, состоящей из: картамина, триацетилглицерина и хлопкового масла. В других воплощениях, фармацевтическая композиция дополнительно включает усилитель проникновения. В некоторых воплощениях, усилитель проникновения представляет собой диметилсульфоксид, олеиновую кислоту, каприновую кислоту, линолевую кислоту, мочевины, додецилсульфат натрия, лаурилсульфат натрия или смесь любых двух или более из этих соединений.
В другом аспекте, предлагается способ лечения рака мочевого пузыря, включающий введение композиции, содержащей эффективное количество валрубицина и диметилсульфоксид. В некоторых воплощениях, композицию вводят внутрипузырно после трансуретальной резекции мочевого пузыря.
В другом аспекте, предлагается способ лечения рака мочевого пузыря, включающий введение липосомной дозированной формы, включающей эффективное количество включенного в липосому валрубицина, где липосома включает, по меньшей мере, одно липосомообразующее вещество, выбранное из фосфатидилхолина и фосфатидилэтаноламина.
В другом аспекте, предлагается способ лечения рака мочевого пузыря, включающий введение эмульсионной дозированной формы, содержащей эффективное количество включенного в эмульсию валрубицина; где эмульсия включает, по меньшей мере, одно образующее эмульсию вещество, выбранное из фосфатидилхолина, фосфатидилэтаноламина и масла. В некоторых воплощениях, масло выбирают из группы, состоящей из: картамина, триацетилглицерина и хлопкового масла. В других воплощениях, фармацевтическая композиция дополнительно включает усилитель проникновения. В ряде воплощений, усилитель проникновения представляет собой диметилсульфоксид, олеиновую кислоту, каприновую кислоту, линолевую кислоту, мочевины, додецилсульфат натрия, лаурилсульфат натрия или смесь любых двух или более из этих соединений.
Краткое описание чертежей
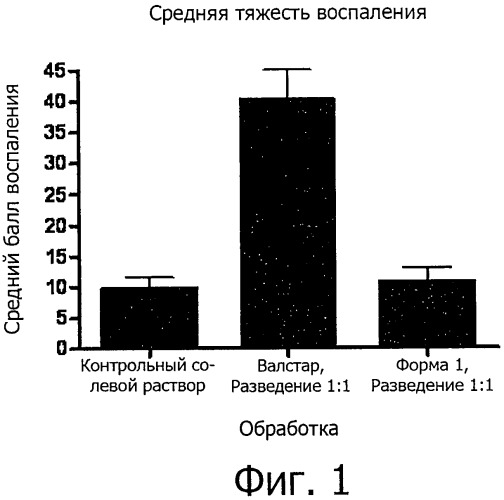
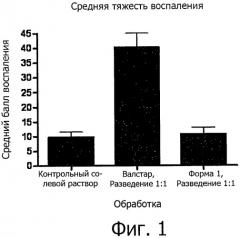
Фиг.1 представляет собой график, сравнивающий средние показатели воспаления в результате действия отрицательного контроля в виде композиции солевого раствора, положительного контроля в виде композиции Валстара и композиции согласно одному воплощению в виде валрубицина/DMSO.
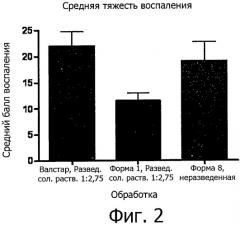
Фиг.2 представляет собой график, сравнивающий средние показатели воспаления в результате действия композиции Валстара, композиции валрубицин/DMSO и валрубицин/липосомальной композиции согласно некоторым воплощениям.
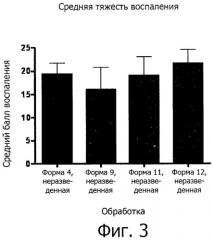
Фиг.3 представляет собой график, сравнивающий средние показатели воспаления в результате действия композиций 4, 9, 11 и 12 согласно некоторым воплощениям.
Осуществление изобретения
Перед тем как будут описаны настоящие композиции и способы, следует иметь в виду, что они не ограничиваются конкретным способом, композицией или методологией, поскольку могут изменяться. Также следует иметь в виду, что используемая в описании терминология предназначена исключительно для целей описания конкретных вариантов воплощений и не должна рассматриваться как ограничение. Пока не определено иначе, все технические и научные термины, используемые в настоящем документе, имеют те же значения, которые обычно подразумеваются специалистом в данной области. Все публикации, патентные заявки, выданные патенты и другие документы, на которые есть ссылки в данном описании, включены в настоящий документ путем ссылки, что каждая индивидуальная публикация, патентная заявка, выданный патент или другой документ в полном объеме. Определения, которые содержатся в тексте, включенном с помощью ссылки, не могут быть расширены при условии, если это противоречит определениям в настоящем описании.
Соединения, описанные в настоящей заявке, могут содержать асимметричный центр и, таким образом, могут существовать в виде энантиомеров. В случае, когда соединения обладают двумя или более асимметричными центрами, они могут дополнительно существовать в виде диастереомеров. Соединения включают все такие возможные стереоизомеры в виде, по существу, чистых, разделенных энантиомеров, их рацемических смесей, а также смесей диастереомеров. Формулы продемонстрированы без определительной стереохимии в конкретных положениях. Соединения включают все стереоизомеры таких формул и их фармацевтически приемлемые соли. Диастереоизомерные пары энантиомеров могут быть разделены, например, с помощью фракционной кристаллизации из приемлемого растворителя, и полученные таким образом пары энантиомеров могут быть разделены на индивидуальные стереоизомеры с помощью соответствующих способов, например, путем использования оптически активной кислоты или основания в качестве разделяющего агента или на хиральной ВЭЖХ-колонке. Кроме того, любой энантиомер или диастереомер соединения общей формулы может быть получен с помощью стереоспецифичного синтеза с использованием оптически чистых исходных веществ известной конфигурации.
В описании, которое приводится далее, широко используется ряд терминов.
В настоящей заявке предлагаются определения для облегчения понимания различных воплощений. Термины, определенные ниже, наиболее полно определяются путем ссылки на описание в целом. Единицы, приставки и символы могут быть обозначены в их принятой в системе СИ форме.
Использованный (применяемый) здесь термин «примерно» обозначает плюс или минус 10% числового значения числа, вместе с которым используется термин.
Использованный здесь термин «введение» или «введение» в сочетании с лекарственным средством, обозначает введение лекарственного средства непосредственно в или на ткань-мишень или введение лекарственного средства пациенту, посредством чего лекарственное средство положительно влияет на ткань, которой оно предназначается. Таким образом, использованный здесь термин «введение» в сочетании с противоопухолевым агентом, может включать в качестве неограничивающих примеров обеспечение присутствия противоопухолевого агента в или на ткани-мишени, или обеспечение присутствия противоопухолевого агента в организме субъекта, например, путем внутрипузырного введения.
Использованный здесь термин «контролируемое высвобождение» обозначает композицию или средство, разработанное для постоянного высвобождения определенного, терапевтически эффективного лекарственного средства или другого активного агента, такого как противоопухолевый агент, в течение продолжительного периода времени, с получением результата в виде сокращения длительности лечения, необходимого для достижения желаемого терапевтического эффекта. Как таковая, композиция с контролируемым высвобождением будет сокращать длительность лечения, необходимую для достижения целевого терапевтического эффекта при лечении рака или предотвращения рецидива рака. Композиции с контролируемым высвобождением достигают необходимого фармакокинетического профиля у пациента, предпочтительно когда начало высвобождения активного агента, по существу, происходит немедленно после помещения в среду доставки, с последующим постоянным, замедленным, предпочтительно, нулевого порядка или, приблизительно, нулевого порядка, высвобождением активного агента. Контролируемое высвобождение включает определенное, постоянное высвобождение активного агента из дозированной композиции в такой степени, чтобы терапевтически благоприятный уровень активного агента поддерживался в течение продолжительного периода около одного дня до около одной недели, от одной недели до около одного месяца, более предпочтительно от около одного месяца до около двух месяцев.
Термин «ингибирование» включает введение соединения для предотвращения появления симптомов, или улучшения симптомов, или устранения заболевания, патологического состояния или расстройства.
Термины «пациент» и «объект» обозначают всех животных, включая людей.
Примеры пациентов или объектов лечения включают людей, коров, собак, кошек, коз, овец и свиней.
С помощью словосочетания «фармацевтически приемлемый» обозначают, что носитель, разбавитель или вспомогательное вещество должны быть совместимы с другими ингредиентами композиции и не должны вредить их реципиенту.
Термин «фармацевтически приемлемые соли, эфиры, амиды и пролекарственные средства» при использовании в настоящей заявке обозначают такие карбоксилатные соли, соли аминокислот, эфиры, амиды и пролекарственные средства соединения, которые, в пределах разумного медицинского решения, являются подходящими для использования в контакте с тканями пациентов без неспецифической токсичности, раздражения, аллергической реакции и тому подобного, в соответствии с разумным соотношением пользы/риска, и являются эффективными для их целевого использования, также как цвиттер-ионные формы соединений там, где это возможно.
Термин «пролекарственное средство» обозначает соединения, которые быстро трансформируются in vivo с получением родительских соединений формулы, приведенной выше, например, с помощью гидролиза в крови. Полное обсуждение представлено в публикациях Т.Higuchi and V.Stella, "Pro-drugs as Novel Delivery Systems," Vol.14 of the A.C.S. Symposium Series, и в Bioreversible Carriers in Drug Design, ed. Edward B.Roche, American Pharmaceutical Association and Pergamon Press, 1987, каждая из которых включена в настоящий документ с помощью ссылки.
Кроме того, соединения могут существовать в несольватированных, а также в сольватированных формах с фармацевтически приемлемыми растворителями, такими как вода, этанол и тому подобное. Вообще, сольватированные формы рассматриваются как эквивалентные несольватированным формам.
Термин «соли» обозначает относительно нетоксичные соли соединений, полученные добавлением не органических и органических кислот. Эти соли могут быть получены in situ во время конечного выделения и очистки соединений или путем отдельного вступления в реакцию очищенного соединения в его форме свободного основания с подходящей органической или не органической кислотой и путем выделения образованной таким образом соли. Характерные соли включают соли в виде ацетата, гидробромида, гидрохлорида, сульфата, бисульфата, нитрата, ацетата, оксалата, валерианата, олеата, пальмитата, стеарата, лаурата, бората, бензоата, лактата, фосфата, тозилата, цитрата, малеата, фумарата, сукцината, тартрата, нафтилата, мезилата, глюкогептоната, лпктобионата и лаурилсульфоната и тому подобных. Они могут включать катионы на основе щелочных и щелочноземельных металлов, таких как натрий, литий, калий, кальций, магний и тому подобные, а также не токсичный аммоний, тетраметиламмоний, тетраэтил аммоний, метиламин, диметиламин, триметиламин, триэтиламин, этиламин и тому подобное. (См., например, публикацию S. М. Berge et al., "Pharmaceutical Salts," J. Pharm. ScL, 1977, 66:1-19, которая включена в настоящий документ посредством ссылки).
Использованный здесь термин «лекарственное средство» обозначает агент, используемый для лечения, борьбы, улучшения симптомов, предотвращения или улучшения нежелательного патологического состояния или заболевания пациента. Отчасти, воплощения относятся к лечению рака мочевого пузыря или к уменьшению рецидивов рака мочевого пузыря по сравнению с субъектами, которым лекарственное средство не вводилось.
«Терапевтически эффективное количество» или «эффективное количество» композиции представляет собой определенное количество, рассчитанное для достижения целевого эффекта, т.е. для снижения степени или предотвращения рака мочевого пузыря или рецидива рака мочевого пузыря. Предусмотренная активность включает и медицинское терапевтическое и/или профилактическое лечение, по необходимости. Специфическая доза соединения, вводимого для получения терапевтического и/или профилактического эффектов, конечно же будет определяться конкретными обстоятельствами, относящимися к пациенту, включающими, например, вводимое соединение, путь введения и подвергаемое лечению патологическое состояние. Хотя понятно, что вводимое эффективное количество будет определяться врачом в свете соответствующих обстоятельств, включая подвергаемое лечению патологическое состояние, выбор вводимого соединения, выбранный путь введения, и, следовательно, вышеописанные интервалы дозирования ни в коем случае не предназначены для ограничения диапазона дозирования. Терапевтически эффективное количество соединения обычно представляет собой такое количество, которого, при введении с физиологически приемлемой вспомогательной композицией, достаточно для достижения эффективной общей концентрации или местной концентрации в ткани.
Термины «лечить», «подвергнутый лечению» или «лечение» при использовании в настоящей заявке обозначают терапевтическое лечение и профилактические или предотвращающие меры, целью которых является предотвращение или ослабление нежелательного физиологического патологического состояния, расстройства или заболевания, или получение полезных или целевых клинических результатов. Полезные или целевые клинические результаты включают в качестве неограничивающих примеров улучшение симптомов; уменьшение степени патологического состояния, расстройства или заболевания; стабилизацию (т.е. не ухудшение) патологического состояния, расстройства или заболевания; задержку проявления или замедление прогрессии патологического состояния, расстройства или заболевания; улучшение статуса патологического состояния, расстройства или заболевания; ремиссию (частичную или полную), детектируемую или не детектируемую, или оздоровление или улучшение патологического состояния, расстройства или заболевания. Лечение включает вызов клинически значимой реакции без излишнего уровня побочных эффектов. Лечение также включает продление выживаемости по сравнению с ожидаемой выживаемостью при отсутствии лечения.
Композиции и способы
Предлагаемые фармацевтические композиции обладают активностью как противоопухолевые агенты для способов лечения рака мочевого пузыря у пациентов. В одном аспекте, фармацевтические композиции содержат противоопухолевый агент (neoplastic agent - NA) и усилитель проникновения. В одном воплощении, композиция содержит эффективное количество валрубицина и усилитель проникновения в виде диметилсульфоксида (DMSO). В других воплощениях, композиция содержит эффективное количество валрубицина, усилитель проникновения и добавку.
Предлагаемые способы преодолевают ряд барьеров, препятствующих эффективной доставке противоопухолевого агента к стенке мочевого пузыря. Конкретно, барьеры для эффективной доставки включают (a) муциновый слой, который окружает стенку мочевого пузыря, (b) кратковременный интервал, за который противоопухолевый агент способен вступить в контакт со стенкой, и (c) проникновение противоопухолевого агента сквозь стенку мочевого пузыря. Композиции и способы адекватно подвергают обработке опухолевые клетки в том случае, когда могут внедряться в нижележащую мускулатуру.
В различных воплощениях, противоопухолевый агент или химиотерапевтический агент включает антипролиферативные агенты, митомицин С, валрубицин и доксорубицин, таксол и BCG. В предпочтительном воплощении, противоопухолевый агент является валрубицином. Валрубицин (N-трифторацетиладриамицин-14-валерианат, Валстар®) является химиотерапевтическим лекарственным средством, используемым при лечении рака мочевого пузыря. Валрубицин представляет собой полусинтетический аналог антрациклина доксорубицина и вводится путем инфузии непосредственно в мочевой пузырь.
В одном воплощении, фармацевтическая композиция содержит противоопухолевый агент и приемлемый усилитель химического проникновения через кожу. Усилители химического проникновения разрушают упорядоченную структуру внутриклеточных липидных бислоев (липофильный путь), а также внутриклеточную среду (гидрофильный путь). Существует множество семейств химических усилителей, включающих спирты (этанол, изопропанол), амины и амиды (диметилацетамид, диметилформамид), сульфоксиды (децилметилсульфоксид, диметилсульфоксид (DMSO)), пирролидоны (2-пирролидон, N-этил-2-пирролидон), жирные кислоты (каприновая кислота, линолевая кислота), мочевины и ненасыщенные циклические мочевины, поверхностно-активные вещества (додецилсульфат натрия, лаурилсульфат натрия) и другие (см. Percutaneous Permeation Enhancers, CRC Press, 1995).
В конкретных воплощениях, усилитель химического проникновения совместим с валрубицином. В определенном воплощении, DMSO представляет собой приемлемый усилитель химического проникновения через кожу. DMSO является предпочтительным усилителем проникновения через кожу, так как (а) он был одобрен для использования для инсталляции в мочевой пузырь (Rimso 50, PDR, 58th Edition, 2004, p.1215), и (b) он может снижать дискомфорт, ассоциированный с быстро испаряющимся этанолом в композициях, доступных в настоящее время. Кроме того, DMSO будет переносить какое-то количество валрубицина в нижележащую мускулатуру, не влияя на количество, достигающее общего кровообращения. Благодаря гидрофильной природе тканей мочевого пузыря, валрубицин будет осаждаться при контакте с ними. Соответственно, ожидается, что композиции, содержащие валрубицин и DMSO, будут убивать опухолевые клетки, внедрившиеся в нижележащую мышцу.
Как замечено выше, композиция также может содержать добавку в дополнение к валрубицину и DMSO. В некоторых воплощениях, такие добавки включают ионные и не ионные поверхностно-активные вещества, такие как полиоксиэтиленовые производные касторового масла, блок-сополимеры этиленкосида и пропиленоксида, эфиры сорбита и жирной кислоты; поливинилпирролидон; альгинаты; и полиакриловые кислоты.
Полиоксиэтиленовые производные касторового масла включают в качестве неограничивающих примеров полиоксиэтиленглицеринтрицинолеат или касторовое масло полиоксил 35 (Кремофор®EL, BASF Corp.), полиоксиэтиленглицериноксистеарат (Кремофор®RH 40 (полиэтиленгликоль 40 гидрогенизированное касторовое масло), и Кремофор®RH 60 (полиэтиленгликоль 60 гидрогенизированное касторовое масло), BASF Corp). Блок-сополимеры этиленкосида и пропиленоксида включают в качестве неограничивающих примеров полиоксиэтилен-полиоксипропилен блок-сополимеры или полиоксиэтилен-полиоксипропиленгликоль, такие как Полоксамер®124, Полоксамер®188, Полоксамер®237, Полоксамер®388, Полоксамер®407 (BASF Wyandotte Corp.), и тому подобное. Эфиры сорбита и жирной кислоты включают в качестве неограничивающих примеров моноэфиры жирной кислоты и полиоксиэтилен (20) сорбитана, например, полиоксиэтилен (20) сорбитан-моноолеат (Tween®80, и Полисорбат®80), полиоксиэтилен (20) сорбитан-моностеарат (Tween®60), полиоксиэтилен (20) сорбитан-монопальминат (Tween®40), полиоксиэтилен (20) сорбитан-монолаурат (Tween®20), и тому подобные. Полиакриловые кислоты могут быть альтернативно известны как Карбомер 934P, 940, 941, 974Р, 980, 1342, поликарбофил и кальций поликарбофил (BF Goodrich).
DMSO использовали для усиления проникновения агентов в стенку мочевого пузыря, однако состояние уровня техники таково, что до момента подачи настоящей заявки считалось, что введение DMSO приводит в результате к клеточной смерти или к фиксации клеток, которая может снизить эффективность любого химиотерапевтического лечения, которое вводится посредством DMSO. Например, Borzelleca et al. (Investigative Urology 6(7), 43-52 (1968)) описывает использование DMSO для введения салицилата натрия в мочевые пузыри кроликов. Однако Borzelleca продемонстрировал, что эпителий мочевого пузыря чувствителен даже к пятипроцентным растворам DMSO в воде, а двадцатипроцентные растворы DMSO в воде приводили к тяжелым реакциям таким, как потеря эпителиальных клеток. Id. В стопроцентном DMSO, клетки, все еще оставаясь нормальными, фиксировались как будто к клеткам был применен гистологический фиксатор. Id. Таким образом, на тот момент ожидалось, что DMSO будет оказывать противоположные целевым эффекты.
В одном воплощении, фармацевтическая композиция включает противоопухолевый агент и фермент или соединение, которое деградирует муциновый слой, покрывающий стенку мочевого пузыря. Муциновый слой, покрывающий стенку мочевого пузыря, состоит из глюкозаминогликанов, гиалуроновой кислоты и хондроитин-сульфата, повышенный уровень которых наблюдается у пациентов с раком мочевого пузыря. Не желая ограничиваться каким-либо конкретным механизмом, предполагается, что если муциновый слой удаляется, то химиотерапевтический агент может достичь слоя просвета стенки мочевого пузыря и стать более эффективным при лечении заболевания. Ферменты, также как и другие соединения, могут деградировать муциновый слой. Примеры включают трипсин и ферменты-гиалуронидазы животного происхождения и рекомбинантные. Протаминсульфат и норэпинефрин представляют собой другие соединения, которые также можно использовать.
В одном воплощении, фармацевтическая композиция содержит противоопухолевый агент и биоадгезивный или мукоадгезивный агент, который будет способствовать образованию, по меньшей мере, мономолекулярного слоя композиции на стенках мочевого пузыря в течение продолжительного периода времени. Биоадгезивные агенты используются для повышения времени удержания дозированной формы, а также для улучшения контакта с различными абсорбирующими мембранами, такими как слизистая ткань стенки мочевого пузыря. Кроме действия в качестве платформ для контролируемого высвобождения, биоадгезивные полимеры сами могут осуществлять некоторый контроль скорости и количества высвобождения лекарственного средства и, таким образом, способствовать терапевтическому преимуществу таких систем (Bioadhesive Drug Delivery Systems, CRC Press, p.66 (1990)). Характерные природные полимеры включают белки, такие как зеин, модифицированный зеин, казеин, желатин, глютен, сывороточный альбумин и коллаген; полисахариды, такие как целлюлоза, декстраны и полигиалуроновая кислота. Характерные синтетические полимеры включают полифосфазены, поли(виниловые спирты), полиамиды, поликарбонаты, полиакрилаты, полиалкилены, полиакриламиды, полиалкиленгликоли, полиалкиленоксиды, полиалкилентерефталаты, простые поливиниловые эфиры, сложные поливиниловые эфиры, поливинил галогениды, поливинилпирролидон, полигликолиды, полисилоксаны, полиуретаны и их сополимеры. Примеры подходящих полиакрилатов включают поли(метилметакрилат), поли(этилметакрилат), поли(бутилметакрилат), поли(изобутилметакрилат), поли(гексилметакрилат), поли(изодецилметакрилат), поли(лаурилметакрилат), поли(фенилметакрилат), поли(метилакрилат), поли(изопропилакрилат), поли(изобутилакрилат) и поли(октадецилакрилат).
Полимеры, описанные выше, могут быть охарактеризованы по отдельности как биодеградируемые, не биодеградируемые и биоадгезивные, полимеры, что более подробно обсуждается ниже. Характерные синтетические деградируемые полимеры включают полигидроксикислоты, такие как полилактиды, полигликолиды и их сополимеры, поли(этилентерефталат), поли(бутановая кислота), поли(валериановая кислота), поли(лактидкокапролактон), полиангидриды, полиортоэфиры и их смеси и сополимеры. Характерные природные биодеградируемые полимеры включают полисахариды, такие как альгинат, декстран, целлюлоза, коллаген и их химические производные (замены, добавления химических групп, например, алкилов, алкиленов, реакции гидроксилирования, окисления, и другие модификации, обычно производимые специалистами в данной области), и белки, такие как альбумин, зеин, их смеси и сополимеры, как индивидуальные, так и в комбинации с синтетическими полимерами. Как правило, in vivo эти вещества деградируют либо с помощью ферментативного гидролиза, либо под воздействием воды, посредством поверхностной или внутренней эрозии. Примеры не биодеградируемых полимеров включают этиленвинилацетат, поли(мет)акриловую кислоту, полиамиды, полиэтилен, полипропилен, полистирол, поливинилхлорид, поливинилфенол, и их сополимеры и смеси. Гидрофильные полимеры и гидрогели имеют тенденцию к обладанию биоадгезивными свойствами. Гидрофильные полимеры, которые содержат карбоксильные группы (например, поли[акриловая кислота]) имеют тенденцию к проявлению лучших биоадгезивных свойств. Полимеры с самыми высокими концентрациями карбоксильных групп являются предпочтительными в случае, когда целевой является биоадгезия на мягких тканях. Различные производные целлюлозы, такие альгинат натрия, карбоксиметилцеллюлоза, гидроксиметилцеллюлоза и метилцеллюлоза, также обладают биоадгезивными свойствами. Некоторые из этих биоадгезивных веществ являются водорастворимыми, в то время как другие являются гидрогелями. Полимеры, такие как сукцинат ацетата гидроксипропилметилцеллюлозы (HPMCAS), тримеллитат ацетата целлюлозы (CAT), фталат ацетата целлюлозы (CAP), фталат ацетата гидроксипропилцеллюлозы (НРСАР), фталат ацетата гидроксипропилметилцеллюлозы (НРМСАР), и фталат ацетата метилцеллюлозы (МСАР), могут использоваться для усиления биодоступности лекарственных средств, с которыми они составляют комплекс. Также в качестве биоадгезивных веществ для доставки противоопухолевых агентов могут использоваться быстро биодеградируемые полимеры, такие как поли(лактидкогликолид), полиангидриды и полиортоэфиры, чьи карбоксильные группы экспонированы на внешней поверхности, поскольку их внешняя поверхность подвергается эрозии.
В одном воплощении, фармацевтическая композиция содержит противоопухолевый агент и одно или более соединений, открывающих плотный контакт, чтобы дать возможность неопластическому агенту проникнуть в лежащую ниже мускулатуру. Соединения, открывающие плотный контакт, регулируют параклеточный транспорт лекарственного средства, давая возможность временной, быстрой и обратимой проницаемости плотного контакта в эпителиальной ткани. Один из примеров таких модификаторов является 1-пальмитоил-2-глутароил-sy-глицеро-3-фосфохолин (Nastech Pharmaceutical). Другие примеры включают N-диэтилметилхитозан (International Journal of Pharmaceutics 293:83, 2005); капрат натрия и цитохалазин В (Digestive Diseases and Sciences A3: 1547, 1998); IL-1 (J. Immunology 178:4641, 2007); поликарбофил, карбопол 934P, карбомеры и триметилхитозан (Biomaterials 23 (1): 153, 2002 and Pharm. Res 18 (11): 1638, 2001); монокарбоксилированный хитозан (Adv. Drug Delivery Reviews 52 (2): 117, 2001); N-сульфат-N,O-карбоксиметилхитозан (Патент США No. 7265097); и токсин Zonula occludens и фрагменты (Adv. Drug Delivery Reviews 58:15, 2006). Соответственно, в некоторые воплощения также включены модуляторы плотного контакта в сочетании с химическими усилителями и другими вспомогательными веществами, воздействующими на три барьера, упомянутых выше.
В одном воплощении, фармацевтическая композиция содержит противоопухолевый агент в комплексе с липосомами для стабилизации и солюбилизации противоопухолевого агента и для возможности его проникновения в стенку мочевог