Способ количественного определения видового состава пропионовых бактерий, обитающих на коже человека
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и микробиологии. Предложен способ количественного определения видового состава пропионовых бактерий, обитающих на коже человека. Способ предусматривает получение образца, выделение из него ДНК и проводение количественной ПЦР-реакции. Реакцию осуществляют с праймерами GCG TGA GTG ACG GTA ATG GGT A, TTC CGA CGC GAT САА ССА, FAM-AGC GTT GTC CGG АТТ TAT TGG GCG-BHQ1, АСА TGG АТС CGG GAG СТТ С, АСС САА CAT CTC ACG АСА CG, R6G-CGG TTC АСА GGT GGT GCA TTG GC-BHQ2, GTC TGC AAC TCG АСС ССА Т, AGT ССТ ААТ ТАС CAG ТСС САС, ROX-ACC TGT GTG GGG GAG CCG TCG AAG-BHQ2, AGA ACT CTG AGC GCT AGC TGT AG, CGT AGA ACT AGC TGT AGC GCA, Cy5-AG CGG CTC СТА СТТ CTG CAG GGG-BHQ2. Способ позволяет сократить время исследований и дать количественную оценку видового разнообразия пропионовых бактерий, присутствующих на коже человека. Изобретение может быть использовано в медицине. 2 табл.
Реферат
Изобретение относится к области медицины, в частности к микробиологии, и может найти применение для определения степени готовности спортсменов.
Наиболее многочисленной группой микроорганизмов, населяющих кожу человека, являются пропионовые бактерии, причем они представлены тремя видами рода Propionibacterium - Р. acnes, P. granulosum и Р. avidum [Нобл У.К. (1986) Микробиология кожи человека (пер. с англ.). М.: Медицина]. Р. acnes в единичных количествах обитают на коже новорожденных, но в период полового созревания их количество резко возрастает до 1 млн на 1 см2. В основном они живут на лице и открытых частях тела. В богатой липидами микросреде волосяных фолликулов Р. acnes могут индуцировать медиаторы воспаления. Как следствие, возникают папулы, пустулы или узловатые высыпания, характерные для угревой сыпи. Р. granulosum обнаруживается на тех же участках тела, что и Propionibacterium acnes, но в количестве примерно в 10 раз меньшем. Оба типа бактерий можно обнаружить в желудочно-кишечном тракте. Р. avidum обитают в подмышечных впадинах и других участках тела с повышенной влажностью, их количество возрастает в период половой зрелости. Пропионовые бактерии наиболее изучены из-за их способности вызывать заболевание кожи - акне вульгарис, однако имеются сведения, что эти бактерии могут участвовать в возникновении и других инфекционных заболеваний, таких как абсцессы легких [Mandell G.L, Bennett.JE., Dolin R. (2005) Principles and Practice of Infectious Diseases. 6th ed. NY:Churchill Livingstone, New York.], стоматологические инфекции, эндокардиты, олигоартриты [Delyle L.G., Vittecoq О., Bourdel A., Duparc F., Michot C., Le Loet X. (2000) Arthritis Rheum., 43(12), 2843-2847.] и др.
Пропионовые бактерии - это медленнорастущие неспорообразующие грамм-положительные анаэробные бактерии, для идентификации которых используется метод выращивания в культуре (Levy P.Y., Fenollar F., Stein A.. (2008), Clin Infect Dis., 46(12), 1884-1886).
Недостатком способа является длительность определения (как минимум, шесть дней) и отсутствие селективности в выделении чистых культур (пропионовые бактерии образуют агломераты).
Задачей изобретения является способ количественного определения видового состава пропионовых бактерий, обитающих на коже человека, позволяющий сократить время исследований и возможность количественной оценки видового разнообразия пропионовых бактерий, присутствующих на коже человека.
Поставленная задача решается способом количественного определения видового состава пропионовых бактерий, обитающих на коже человека, заключающимся в том, что из образца, полученного растиранием участка кожи стерильным ватным тампоном, смоченным щелочным фосфатным буфером, выделяют ДНК с использованием набора ДНК-экстран ЕХ-509, 100 мкл исследуемой суспензии бактериальных клеток помещают в пластиковые контейнеры, перед началом выделения для контроля степени выхода РНК в образцы вносят 5×104 копий плазмиды Ptgt 2 в 5 мкл 10 мМ Трис-HCl буфера (рН 8.0), лизис клеток осуществляют 300 мкл 1% раствора SDS, содержащего 20 мМ Трис-HCl буфера (рН 8.0), 75 мМ NaCl и 25 мМ Na2EDTA в течение 10 минут при комнатной температуре, белки осаждают 100 мкл 7,5 М NH4(CH3COO) с последующим центрифугированием 12000g×2 мин, супернатант переносят в пластиковые пробирки, ДНК осаждают равным объемом изопропанола при комнатной температуре, центрифугируют при 12000g×2 мин, осадок ДНК промывают 75% этанолом и высушивают в пробирках на воздухе при комнатной температуре до полного испарения спирта, ДНК растворяют в 100 мкл 10 мМ Трис-НСl буфера (рН 8.0) при 65°C в течение 5 минут и затем проводят количественную ПЦР-реакцию с праймерами GCG TGA GTG ACG GTA ATG GGT А, ТТС CGA CGC GAT САА CCA, FAM-AGC GTT GTC CGG ATT TAT TGG GCG-BHQ1, АСА TGG АТС CGG GAG СТТ С, АСС САА CAT СТС ACG АСА CG, R6G-CGG ТТС АСА GGT GGT GCA TTG GC-BHQ2, GTC TGC AAC TCG АСС CCA Т, AGT ССТ ААТ ТАС CAG ТСС САС, ROX-ACC TGT GTG GGG GAG CCG TCG AAG-BHQ2, AGA ACT CTG AGC GCT AGC TGT AG, CGT AGA ACT AGC TGT AGC GCA, Cy5-AG CGG СТС СТА СТТ CTG CAG GGG-BHQ2, данные по цветовым каналам прибора, соответствующим красителям FAM, R6G, ROX и Су5, отражают количество соответствующего вида пропионовых бактерий из числа Propionibacterium acne, Propionibacterium granulosum, Propionibacterium avidum.
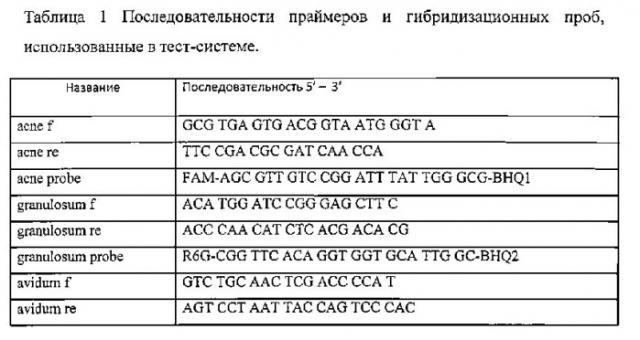
Подбор праймеров и гибридизационных проб TagMan осуществлялся с использованием ресурсов NCBI. Были выявлены отличия в последовательностях фрагментов 16s РНК соответственно для Propionibacterium acnes, granulosum и avidum. Далее с помощью поисковой программ Primer-Blast и Primer 3 Input были подобраны праймеры и пробы с последовательностями, исключающими перекрывание и перекрестную амплификацию (таблица 1). Использование различных флюоресцентных красителей позволяло одновременно количественно определять все три типа пропионовых бактерий (таблица 2). Для количественного определения плазмиды Ptgt 2 со вставкой уникальной последовательности использовались специфические праймеры и проба, меченная флюоресцентным красителем Су5. Необходимые олигонуклеотиды были синтезированы фирмой ′′СИНТОЛ′′ (Россия).
ПНР с детекцией продуктов в режиме реального времени.
Для проведения реакции готовят основную смесь, содержащую следующие компоненты: 100 мкл 2,5-кратного буфера для ПНР (500 мМ KCl, 150 мМ Трис-HCl, рН 8,8, 0,5% глицерин, 0,1% Tween 20, 2,5 мМ смеси дезоксинуклеозидтрифосфатов dNTP, 6,25 мМ MgCl2), 5 мкл Taq-полимеразы с ингибирующими активность антителами 5 Ед/мкл, по 10 мкл праймеров (финальная концентрация 0,20 mkM) и 5 мкл зондов (финальная концентрация 012 mkM) и деионизированной воды до общего объема 200. В пробирки для ПЦР объемом 200 мкл помещали по 5 мкл образцов ДНК и 20 мкл основной смеси. ПЦР РВ осуществляли в приборе АНК-32 (Институт аналитического приборостроения РАН, Россия) в следующих условиях: плавление ДНК и активация Taq-полимеразы - 950 С, 180 сек - 1 цикл; (отжиг праймеров и элонгация цепей ДНК - 600 С, 40 сек + плавление - 950 С, 15 сек) - 45 циклов. Критический цикл и исходное количество копий ДНК определяли с помощью компьютерной программы, поставляемой вместе с прибором. Для построения калибровочных прямых использовались растворы олигонуклеотидов-ампликонов, синтезированные для каждого типа исследуемых бактерий, имеющие известные концентрации 103-106 копий/мкл. Полученные результаты нормировались по проценту выхода РНК, который определялся исходя из выхода плазмиды Ptgt-2, исходно добавленной в образцы. Количество бактериальных клеток в образце рассчитывалось с учетом известного количества копий оперона 16s РНК (3 копии на клетку) и представлялось в виде количества клеток в 100 мкл образца. Для определения состояния барьерной функции кожи были измерены уровень влажности поверхностных слоев кожи и определено содержание липидов на поверхности кожи с помощью прибора «Skin-o-mat» производства фирмы «Cosmomed GmbH», Германия.
Объектом исследования были образцы смывов с участков кожи 17 спортсменов-пятиборцев в возрасте 23,1±2,6 лет и группы контроля, состоящей из 16 студентов в возрасте 22,9±0,8 лет. Сбор образцов проводили с участка кожи середины груди площадью 9 см2 путем растирания этого участка стерильным ватным тампоном, смоченным щелочным фосфатным буфером.
Выделение бактериальной ДНК осуществляли с использованием набора ДНК-экстран ЕХ-509 (Синтол, Россия). 100 мкл исследуемой суспензии бактериальных клеток помещали в пластиковые пробирки объемом 1,5 мл. Перед началом выделения для контроля степени выхода РНК в образцы вносили 5×104 копий плазмиды Ptgt 2 в 5 мкл 10 мМ Трис-HCl буфера (рН 8.0). Лизис клеток осуществляли с помощью 300 мкл 1% раствора SDS, содержащего 20 мМ Трис-HCl буфера (рН 8.0), 75 мМ NaCl и 25 мМ Na2EDTA в течение 10 минут при комнатной температуре. Осаждение белков производили 100 мкл 7,5 М NH4(CH3COO) с последующим центрифугированием 12000g×2 мин. Супернатант переносили в чистые пластиковые пробирки,и ДНК осаждали равным объемом изопропанола при комнатной температуре центрифугированием при 12000g×2 мин. Осадок ДНК промывали 75% этанолом (12000g×2 мин) и высушивали в пробирках на воздухе при комнатной температуре до полного испарения спирта. ДНК растворяли в 100 мкл 10 мМ Трис-HCl буфера (рН 8.0) при 65°C в течение 5 минут. Полученный раствор ДНК использовали для количественного ПЦР.
Частота выявления всех трех видов пропионовых бактерий в указанной зоне кожи как у спортсменов, так и в контрольной группе составила 100% (таблица 3). Это не согласуется с данными литературы, полученными традиционными методами, где данный показатель для P. acnes варьировал от 46 до 100%, для P. granulosum - от 0 до 85%, а P. avidum - от 0 до 52%,. Подобное несоответствие объясняется тем, что традиционные методы базируются на культивировании, то есть определяют только живые, колониеобразующие бактерии. Предлагаемый же метод определяет геном как живых, так и погибших микроорганизмов. По нашим данным обсемененность (медианы) составляла: в группе спортсменов - P. acnes - 1,6*105 клеток/см2, P. granulosum - 9,4*102 клеток/см2, P. avidum - 5,8*104 клеток/см2, в группе контроля - P. acnes - 3,8*105 клеток/см2, P. granulosum - 9,4*102 клеток/см2, P. avidum - 7,7*104 клеток/см2. В контрольной группе данный показатель превосходил таковой в группе спортсменов в 2 раза только в случае P. acnes. Важно, что, в отличие от данных литературы, разброс значений по сравнению с медианой был незначительным. Никаких значимых корреляционных зависимостей между обилием пропионовых бактерий и влажностью/себумом в обеих группах отмечено не было.
Полученные результаты подтверждают достижение задачи изобретения.
Способ количественного определения видового состава пропионовых бактерий, обитающих на коже человека, заключающийся в том, что из образца, полученного растиранием участка кожи стерильным ватным тампоном, смоченным щелочным фосфатным буфером, выделяют ДНК с использованием набора ДНК-экстран ЕХ-509, 100 мкл исследуемой суспензии бактериальных клеток помещают в пластиковые контейнеры, перед началом выделения для контроля степени выхода РНК в образцы вносят 5×104 копий плазмиды Ptgt 2 в 5 мкл 10 мМ Трис-HCl буфера (рН 8.0), лизис клеток осуществляют 300 мкл 1% раствора SDS, содержащего 20 мМ Трис-HCl буфера (рН 8.0), 75 мМ NaCl и 25 мМ Na2EDTA в течение 10 минут при комнатной температуре, белки осаждают 100 мкл 7,5 М NH4(CH3COO) с последующим центрифугированием 12000g×2 мин, супернатант переносят в пластиковые пробирки, ДНК осаждают равным объемом изопропанола при комнатной температуре, центрифугируют при 12000g×2 мин, осадок ДНК промывают 75% этанолом и высушивают в пробирках на воздухе при комнатной температуре до полного испарения спирта, ДНК растворяют в 100 мкл 10 мМ Трис-HCl буфера (рН 8.0) при 65°C в течение 5 минут и затем проводят количественную ПЦР-реакцию с праймерами GCG TGA GTG ACG GTA ATG GGT А, ТТС CGA CGC GAT САА CCA, FAM-AGC GTT GTC CGG ATT TAT TGG GCG-BHQ1, АСА TGG АТС CGG GAG СТТ С, АСС САА CAT СТС ACG АСА CG, R6G-CGG ТТС АСА GGT GGT GCA TTG GC-BHQ2, GTC TGC AAC TCG АСС CCA Т, AGT ССТ ААТ ТАС CAG ТСС САС, ROX-ACC TGT GTG GGG GAG CCG TCG AAG-BHQ2, AGA ACT CTG AGC GCT AGC TGT AG, CGT AGA ACT AGC TGT AGC GCA, Cy5-AG CGG СТС СТА СТТ CTG CAG GGG-BHQ2, данные по цветовым каналам прибора, соответствующим красителям FAM, R6G, ROX и Су5, отражают количество соответствующего вида пропионовых бактерий из числа Propionibacterium acne, Propionibacterium granulosum, Propionibacterium avidum.