Штамм бактерии esherichia coli ex pqe30, продуцент эндоксиланазы бактерии geobacillus stearothermophillus 22
Иллюстрации
Показать всеИзобретение относится к области биотехнологии. Предлагаемый штамм Esherichia coli EX pQE30 получен трансформацией клеток бактерии E.coli XL1-blue плазмидой pQE30-endo-xylanase-lx1, разработанной на основе вектора pQE30. Изобретение позволяет получить штамм, который будет продуцировать эндоксиланазу со стабильностью при температуре выше 55°С, что позволяет использовать ее в составе комплексных ферментных препаратов для гидролиза растительной биомассы. 4 ил., 3 пр.
Реферат
Изобретение относится к области биотехнологии и может быть использовано для получения эндоксиланазы (эндо-β-1,4-ксиланазы), применимой в технологических процессах ферментативного гидролиза растительной биомассы.
Эндоксиланазы (EC 3.2.1.8) относятся к обширному классу гликозид гидролаз - большому классу ферментов, осуществляющих широкий спектр реакций, включая расщепление целлюлозы и гемицеллюлозы до моносахаридов. В частности, ферменты класса ксиланаз катализируют распад ксилана до ксилоолигосахаридов. Биологической функцией эндоксиланазы является расщепление ксиланов по 1-4 бета-ксилозидазным связям.
В промышленности используются в основном целлюлазы грибного происхождения. Существуют и перспективные термостабильные экзоглюканазы, выделенные из геномов бактерий рода Clostridium. Экзоглюканазы клостридий наиболее активны при температурах 60-75°C и pH 5.0-6.5. Кристаллическая целлюлоза в растительной биомассе в значительной степени покрыта гемицеллюлозой и лигнином, в связи с чем для гидролиза растительной биомассы важно использование не только комплекса целлюлозолитических ферментов, но и ферментов, способных к деградации гемицеллюлозы. В работе Moraïs было показано значительное увеличение ферментативной активности комплекса эндоглюканазы и экзоглюканазы добавлением эндоксиланазы и экзоксиланазы по сравнению как со свободными ферментами, так и с отдельно собранными целлюлазным и ксиланазным комплексами [1].
Известны коммерчески доступные препараты, содержащие комплекс целлюлаз: "ЦеллолюксА" производства ОАО Сиббиофарм на основе гриба Trichoderma reesei и Viscozyme L производства Novozyme на основе гриба Aspergillus sp. Недостатком обоих препаратов следует признать низкую эффективность гидролиза гемицеллюлозной компоненты растительной биомассы, что приводит к потере части целевого продукта.
Известен рекомбинантный штамм Aspergillus aculeatus, продуцирующий ферменты, имеющие ксиланазную активность и применяемые в хлебопечении [2].
Известен штамм Penicillium verruculosum ВКМ F-3972D, продуцент комплекса целлюлаз, ксиланазы и ксилоглюканазы, для гидролиза целлюлозы и гемицеллюлозы [3]. Штамм P.verruculosum PV2007 ВКМ F-3972D получают с помощью многоступенчатого мутагенеза и селекции из исходной культуры P.verruculosum 28К ВКМ F-3764D. Суспензию спор исходного штамма облучают ультрафиолетом. Облученные споры высевают на чашки Петри с селективными средами, культивируют при 28°C в течение 2 суток и проводят окрашивание Конго Красным. Мутанты с улучшенной продукцией отбирают визуально по увеличенным зонам просветления вокруг колоний. Наиболее активные мутанты, отобранные на чашках, проверяют на продуктивность синтеза целлюлаз, целлобиаз (бета-глюкозидаз), ксиланаз и ксилоглюканаз при культивировании в жидкой среде в колбах. Отобранные при культивировании в колбах наиболее активные варианты снова (многократно) подвергают облучению и селекции на чашках и колбах, как описано выше.
Наиболее близким к заявляемому штамму - прототипом, является штамм гриба Penicillium canescens - продуцент секретируемой эндо-(1-4)-бета-ксиланазы, сконструированный методами трансформации и генетической инженерии [4]. Данный штамм за 120-144 часов ферментации на средах со свекловичным жомом позволяет накапливать до 800 единиц активности секретируемой эндо-(1-4)-бета-ксиланазы и не более 0.13 единиц целлюлазной активности в 1 мл культуральной жидкости.
Недостатком известного штамма является низкая термостабильность получаемой эндоксиланазы а также наличие большого количества побочных активностей.
Задачей изобретения является получение бактериального штамма - продуцента эндоксиланазы, обладающей высокой термостабильностью, продуцирующего чистую эндоксиланазу без примеси целлюлаз для применения в составе комплексных биокатализаторов в процессах гидролиза растительной биомассы.
Поставленная задача решается предлагаемым штаммом Esherichia coli EX pQE30, содержащим рекомбинантную плазмиду pQE30-endo-xylanase-lxl, продуцирующим эндоксиланазу бактерий Geobacillus stearothermophilus 22, выделенных из горячего источника Северного Прибайкалья.
Эндоксиланаза обладает высокой термостабильностью (выше 55°С), что позволяет использовать ее в составе биокатализаторов для гидролиза растительной биомассы. Штамм получают трансформацией клеток бактерии E. coli XL1-blue ДНК плазмиды pQE30-endo-xylanase-lxl с использованием стандартных процедур [5]. Отбор трансформантов осуществляют на среде LB с ампициллином (100 мг/л). Плазмида pQE30-endo-xylanase-lxl собрана на основе вектора pQE30 и содержит ориджин репликации рМВ1, ген устойчивости к ампициллину bla (кодирующий β-лактамазу), обеспечивающий отбор клеток с плазмидой, промотор фага Т5 под регулированием оператора лактозного оперона, а также сконструированный ген, кодирующий гибридный белок, содержащий последовательность 6 гистидинов и последовательность эндоксиланазы Geobacillus stearothermophilus 22.
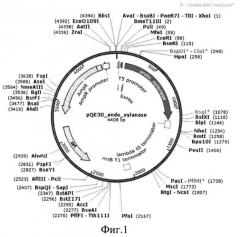
Генетическая и физическая карта экспрессирующей конструкции pQE30-endo-xylanase-lxl, несущей ген, кодирующий фермент эндоксиланазу, приведена на фиг.1, где: endo-xylanase - последовательность, кодирующая эндоксиланазу штамма Geobacillus stearothermophillus 22; AmpR - ген устойчивости к ампициллину (бета-лактамаза), Т5 - промотор фага Т5, ORI - точка начала репликации.
На фиг.2 приведена аминокислотная последовательность эндоксиланазы штамма Geobacillus stearothermophillus 22 и нуклеотидная последовательность гена, ее кодирующего.
Штамм Esherichia coli EX pQE30 имеет следующие характеристики.
Культурально-морфологические признаки.
Штамм является факультативным аэробом. При росте на LB-агаре колонии гладкие, круглые, блестящие, сероватые, мутные, край ровный. При росте в жидких средах LB образуют интенсивную муть. Клетки прямые, палочковидной формы, подвижные, грамотрицательные. Штамм устойчив к ампициллину.
Генетические признаки, устойчивость к антибиотикам.
Штамм устойчив к ампициллину благодаря наличию в клетке плазмиды pQE30-endo-xylanase-lxl, несущей ген устойчивости к ампициллину.
Условия хранения штамма.
Штамм Escherichia coli EX pQE30 хранят в среде Luria Bertani с глицерином (t=-70°С) не менее года или на агаризованной среде Luria Bertani (t=+8°С) со 100 мкг/мл ампициллина на чашках Петри или в стеклянных пробирках со скошенным агаром при 4°С. Пересевы на свежие среды делают один раз в месяц.
Изобретение иллюстрируется следующими примерами.
Пример 1. Получение плазмиды pQE30-endo-xylanase-lxl и штамма Esherichia coli EX pQE30.
Клонирование ферментов эндоксиланазы, найденной в геноме штамма 22 бактерий рода Geobacillus из коллекции лаборатории, проводили в E. coli. Клонирование генов в экспрессирующую конструкцию проводили с использованием праймеров, содержащих урацил. Амплификацию фрагментов встройки и векторной конструкции проводили с применением фермента pfr turbocx (Stratagene). Обработку фрагментов гена и векторной конструкции проводили при помощи комплекса ферментов USERtm и метилзависимой рестриктазы MalI (SibEnzyme Новосибирск). Ферментативная реакция проводилась в буфере фермента taqSE полимераза (SibEnzyme Новосибирск) при 37°С в течение 30 минут. Для лигирования смешивали обработанные фрагменты встройки и фрагмент векторной конструкции, прогревали до 43°С. К смеси добавляли прогретый равный объем однократного лигазного буфера, содержащего лигазу и dATP. Лигирование проводили в амплификаторе с применением следующей температурной программы: 43°С - 2 минуты, 30 циклов (43°С - 10 секунд, 37°С - 5 секунд, 32°С - 5 секунд, 27°С - 10 секунд, 22°С - 15 секунд), 25°С хранение.
Полученные в результате лигирования продукты осаждали равным объемом изопропанола и растворяли в 8 мкл деионизованной воды.
Методом электропорации получали рекомбинантный штамм Esherichia coli EX pQE30, несущий плазмиду pQE30-endo-xylanase-lxl.
Пример 2. Идентификация рекомбинантной эндоксиланазы
Была исследована экспрессия белка рекомбинантным штаммом Esherichia coli EX pQE30. Для исследования проводили наработку биомассы и индукцию экспрессии клонированного гена.
Наработку и индукцию биомассы проводили следующим образом. Колонию рекомбинантного штамма засевали в 20 мл среды LB (дрожжевой экстракт 5 г/л, триптон 10 г/л, NaCl 10 г/л), содержащей ампициллин 100 мкг/мл в 100 мл конической колбе, культивировали ночь на орбитальном шейке BioSan ES-20/60 при 37°С и 200 оборотах в минуту.
1/20 часть ночной культуры вносили в 20 мл среды LB в конической колбе. Культивировали на орбитальном шейке BioSan ES-20/60 при 37°С и 250 оборотах в минуту до достижения оптической плотности OD600=0-6. По достижении необходимой оптической плотности к культуре добавляли следующие компоненты: ампициллин 200 мкг/мл, ИПТП (Изопропил-β-D-1-тиогалактопиранозид) 0.5 ммоль/литр. Дальнейшее культивирование проводили на орбитальном шейке BioSan ES-20/60 при 37°С и 250 оборотах в минуту в течение 5 часов.
Белковый экстракт разделяли при помощи SDS-PAGE (sodium dodecyl sulfate - polyacrylamide gel electrophoresis). Для этого 150 мкл клеточной культуры клонов E. coli, несущих экспрессирующие векторы pQE30 со встроенным ферментом эндоксиланазой, осаждали центрифугированием на 16100 g в течение 2 мин. К осадку добавляли 30 мкл лизирующего буфера, содержащего 0,05 M Трис-HCl рН, 6.8; 2%-ный ДСН (додецилсульфат натрия), 0,002%-ный бромфеноловый синий, 10%-ный глицерин, 5%-ный меркаптоэтанол, смесь ресуспендировали и озвучивали на ультразвуковой бане в течение 15 мин. Полученный лизат центрифугировали 2 мин на 16100 g, супернатант кипятили 5 мин при 95°С и наносили на полиакриламидный ДСН-гель для проведения электрофореза по методу Лэммли [6] в мини-геле (8×10 см, толщиной 0,75 мм). Для проведения электрофореза белков после хроматографической очистки образцы смешивали в соотношении 1:1 с буфером для нанесения (0,05 M Трис-HCl рН 6,8; 2%-ный ДСН); 0,002%-ный бромфеноловый синий; 10%-ный глицерин; 5%-ный меркаптоэтанол), затем кипятили в течение 5 минут. На дорожку наносили по 20 мкл каждого образца, белки концентрировали в 4%-ном ПААГ-ДСН (акриламид/бисакриламд в соотношении 37,5:1, 0,1% ДСН, 0,125 мМ Трис-HCl рН 6,8, 0,1% ТЕМЕД, 0,05% ПСА) при силе тока 10 мА на гель и разделяли в 12%-ном ПААГ-ДСН (акриламид/бисакриламд в соотношении 37,5:1, 0,1% ДСН, 0,375 мМ Трис-HCl рН 8,8, 0,05% ТЕМЕД, 0,05% ПСА) при силе тока 15 мА на гель в электрофоретической камере Mini-PROTEAN® Tetra Cell (Bio-Rad, США). Гели окрашивали Coomassie Brilliant Blue G-250 и фотографировали при помощи гельдокументирующей системы VersaDoc МР4000 (Bio-Rad, США).
На фиг. 3 приведена электрофореграмма белков клонов E. coli, несущих экспрессирующий вектор pQE30 со встроенным ферментом эндоксиланазой (LX1). 12% ДСН-ПААГ, краситель Coomassie Brilliant Blue G-250. 1-3, 5 - нет экспрессии; 4 - LX1; 6 - маркер молекулярного веса широкого спектра SDS-PAGE Molecular Weight Standards, Broad Range(Bio-Rad, USA). Стрелкой отмечена фракция, вырезанная для проведения масс-спектрометрического анализа.
Белок был идентифицирован по триптической карте масс с использованием поискового алгоритма Mascot (http://matrixscience.com/home.html). Параметры поиска выставлялись следующим образом: ошибка масс ±0.05 Да, число сайтов недорезки трипсином - 1, возможные модификации- окисление метионинов и карбамидометилирование цистеинов, база данных - NCBI. Спектр триптического гидролизата эндоксиланазы представлен на фиг.4.
Пример 3. Определение оптимумов рН и температуры для проявления ксилозидазной активности эндоксиланазы
Определение оптимумов рН и температуры для проявления ксилозидазной активности эндоксиланазы проводили с использованием синтетического субстрата 4-нитрофенил-β-D-ксилопиранозида, одним из продуктов ферментативного расщепления которого является п-нитрофенол.
Для определения активности фермента при различных значениях рН и температуры были приготовлены реакционные смеси, содержащие по 8 мкл 10 мМ водного раствора 4-нитрофенил-β-D-ксилопиранозида и по 72 мкл 0,02М фосфатного буфера со значениями рН от 4 до 8 с шагом в 0,5.
Все реакционные смеси готовили в охлаждаемых во люду ячейках 96-луночного планшета для ПЦР. Для каждого значения рН было приготовлено по 6 повторов каждой точки из выбранного диапазона значений рН. Затем в каждую ячейку добавили 10 мкл раствора фермента в 0.01 M фосфатно-солевом буфере. Планшет инкубировали в течение 15 мин в амплификаторе iCycler (BioRad) в режиме стабильного поддержания температурного градиента 45-70°С, затем реакцию останавливали добавлением 200 мкл 1М водного раствора карбоната натрия и 10 мкл 0,5М водного раствора цитрата натрия в каждую ячейку. Количество образовавшегося в результате реакции п-нитрофенола определяли на спектрофотометре Epoch (BioTek) на длине волны 420 нм. На основании количества образовавшегося продукта и времени проведения реакции были рассчитаны относительные значения активности ферментов. Данные представлены на фиг.4, из которой видно, что в диапазоне рН от 4.5 до 5.5 и при температуре от 55 до 65°С наблюдается стабильное плато, в данном диапазоне фермент стабилен, хоть и проявляет низкий уровень активности. При сдвиге значений рН в сторону нейтрального и слабощелочного диапазона (от 6.0 до 7.5) наблюдается выраженный рост активности фермента при относительно низких температурах (от 45 до 55°С). Оптимальные значения температуры и рН для эндоксиланазы при работе с 4-нитрофенил-β-D-ксилопиранозидом составили рН=5.5-6.0 при 55°С.
Предлагаемый штамм обладает способностью продуцировать термостабильную чистую эндоксиланазу без примеси целлюлаз.
Источники информации
1. Moraïs S., Barak Y., Caspi J., Hadar Y., Lamed R., Shoham Y., Wilson D.B., Bayer E.A. Cellulase-xylanase synergy in designer cellulosomes for enhanced degradation of a complex cellulosic substrate // MBio. 2010. 1(5). doi:pii: e0028510.10.1128/mBio.00285-10.
2. Патент US 6197564 B1, опубл. 06.03.2001 г.
3. Патент RU 2361918 C1, опубл. 20.07.2009 г.
4. Патент RU 2293115 C1, опубл. 10.02.2007 г.
5. Miller E.M., Nickoloff J.A. Escherichia coli Electrotransformation // Methods in Molecular Biology. 1995. V.47. P.105-113.
6. Laemmli, U.K., Nature 1970, 227, 680-685.
<110> Федеральное Государственное бюджетное учреждение науки Институт цитологии и генетики Сибирского отделения Российской академии наук (ИЦиГ СО РАН)
<120> Штамм бактерии Esherichia coli ЕХ PQE30, продуцент эндоксиланазы бактерии Geobacillus stearothermophillus 22
<160> Номер SEQ ID NO
<210> 1
<211> 1026
<212> DNA
<213> Geobacillus stearothermophillus 22
<400> 1
Штамм бактерии Esherichia coli EX PQE30, полученный трансформацией штамма E.coli XL1-blue плазмидой pQE30-endo-xylanase-lxl, продуцирующий термостабильную эндоксиланазу бактерии Geobacillus stearothermophillus 22.