Способ определения содержания грамотрицательных патогенных бактерий в анализируемой среде
Иллюстрации
Показать всеИзобретение относится к электрохимическим методам анализа, а именно к иммуноанализу, в частности к определению содержания патогенных микроорганизмов в различных объектах и средах. Изобретение может быть использовано в микробиологии, медицине, экологии для мониторинга содержания микроорганизмов в природных объектах и дифференциальной диагностики инфекционных заболеваний. Электрохимический способ определения содержания грамотрицательных патогенных бактерий предполагает использование в качестве сигналообразующей метки электроактивных магнитных нанокомпозитных частиц, которые перед стадией конъюгирования получают путем создания на поверхности магнитных наночастиц переходных металлов или их соединений электроактивного полимерного покрытия. Концентрацию патогенных микроорганизмов определяют путем получения электрохимического отклика, регистрируемого напрямую в результате электропревращения электроактивного полимерного покрытия. Изобретение направлено на упрощение анализа, увеличение чувствительности, экспрессности, воспроизводимости, а также на расширение круга электрохимически активных меток. Использование полимерного покрытия позволяет добиться высокой чувствительности и воспроизводимости анализа. 7 ил. 6 пр.
Реферат
Изобретение относится к электрохимическим методам анализа, а именно к иммуноанализу, в частности к определению содержания патогенных микроорганизмов в различных объектах и средах. Изобретение может быть использовано в микробиологии, медицине, экологии для мониторинга содержания патогенных микроорганизмов в природных объектах и дифференциальной диагностики инфекционных заболеваний.
Недостатками используемых в настоящее время методов являются: низкая чувствительность (реакции агглютинации), высокая стоимость используемых реагентов и оборудования (иммуноферментный анализ), необходимость создания специальных условий (метод анализа, основанный на полимеразной цепной реакции) и длительность проведения анализа (бактериальный посев).
Для мониторинга колиформных бактерий, продуцирующих в результате своей жизнедеятельности фенол, предлагают использовать амперометрический тирозиназный сенсор и аминомодифицированный магнетит, осажденный на углеродных нанотрубках. Эту систему используют для детектирования фенола. Тирозиназа катализирует окисление фенольных соединений в присутствии кислорода с получением о-хинонов, которые могут быть восстановлены электрохимически при низких потенциалах без медиаторов. Однако в данном методе требуется ≈4 часа для предварительной активации β-D-галактрозидазы и другие длительные подготовительные процедуры. Отсутствие специфичности реакции также является недостатком данного метода (Amperometric tyrosinase biosensor based on Fe3O4 nanoparticles-coated carbon nanotubes nanocomposite for rapid detection of coliforms/Yuxiao Cheng, Yajun Liu, Jingjing Huang et all//Electrochimica Acta, 2009, V.54, P.2588-2594).
Предложен метод обнаружения бактерий E.Coli при помощи кварцевого сенсора с использованием наночастиц магнетита, покрытых декстраном, и наночастиц золота, покрытых стрептавидином. Данный метод до момента непосредственного детектирования включает в себя 7 предварительных стадий (таких как инкубирование, сепарирование, декантирование). Помимо значительного увеличения продолжительности анализа, все эти стадии вносят огромный вклад в погрешность измерения (QCM immunosensor detection of Escherichia coli O157:H7 based on beacon immunomagnetic nanoparticles and catalytic growth of colloidal gold/Zhi-Qiang Shen, Jing-Feng Wang, Zhi-Gang Qiu et all/Biosensors and Bioelectronics, 2011, V.26, P.3376-3381).
Также для детектирования бактерий E.Coli предложено использовать магнитоэластичный сенсор, модифицированный полиуретаном и наночастицы магнетита модифицированные хитозаном. Подготовленный сенсор помещается в кювету с суспензией магнетита, модифицированного хитозаном, и E.Coli. Затем вся система помещается в катушку соленоида, от которой получают сигнал. Измеряется резонансная частота сенсора. При pH 5-6.5 бактерии электростатически притягиваются к наночастицам, затем наночастицы примагничиваются к сенсору, уменьшая его резонансную частоту. Однако данный метод также лишен специфичности (Detection of pathogen Escherichia coli O157:H7 with a wireless magnetoelastic-sensing device amplified by using chitosan-modified magnetic Fe3O4 nanoparticles/Hailan Lin, Qingzhu Lu, Shutian Ge, Qingyun Cai et all//Sensors and Actuators B, 2010, V.147, P.343-349).
Наиболее близким техническим решением, выбранным в качестве прототипа, служит способ определения патогенных микроорганизмов, включающий конъюгацию патогенного микроорганизма с магнитными наночастицами в анализируемой среде с последующим концентрированием конъюгатов и определением наличия и концентрации патогенных микроорганизмов с помощью электроактивной сигналообразующей метки. В качестве магнитных наночастиц и, одновременно, электроактивной сигналообразующей метки авторы использовали наночастицы переходного металла. Перед концентрированием меченых конъюгатов наночастицы, несвязанные с патогенными микроорганизмами, выводили из анализируемой среды. Концентрирование меченого конъюгата осуществляли путем формирования на электроде иммунокомлекса «меченный магнитной меткой патогенный микроорганизм - антитело» с последующим изъятием иммунокомплекса из среды на электроде. Далее проводили кислотную обработку электрода, содержащего меченый иммунокомплекс. Определение наличия и концентрации патогенных микроорганизмов осуществляли по сигналу, генерируемому ионами переходного металла, получаемых путем кислотного разрушения иммунокомплекса (Патент РФ №2397243 от 20.08.2010).
К недостаткам данного способа следует отнести многостадийность процесса анализа, низкий предел обнаружения, высокую трудоемкость процесса, большие временные затраты, а также высокие требования к квалификации операторов.
Предлагаемое техническое решение направлено на упрощение анализа, увеличение чувствительности, экспрессности, воспроизводимости, а также на расширение круга электрохимически активных меток.
Указанный технический эффект достигается тем? что предлагаемый способ электрохимического иммуноанализа включает в себя конъюгацию патогенных микроорганизмов с электроактивными магнитными нанокомпозитными частицами, магнитную сепарацию с последующим концентрированием конъюгатов и определением наличия и концентрации патогенных микроорганизмов с помощью сигналобразующей метки, локализованной путем образования иммунокомплекса на поверхности электрода, в качестве которой выступают электроактивные магнитные нанокомпозитные частицы. Концентрацию патогенных микроорганизмов определяют путем получения прямого электрохимического отклика от электроактивных магнитных нанокомпозитных частиц, регистрируемого в результате электрохимического превращения электроактивного полимерного покрытия (полимерного покрытия, модифицированного электроактивными соединениями) наночастиц.
Указанные отличительные признаки существенны. Получение электрохимического отклика от метки в результате разряда непосредственно электроактивного полимерного покрытия (полимерного покрытия, модифицированного электроактивными соединениями) электроактивных магнитных нанокомпозитных частиц позволит исключить из процедуры иммуноанализа стадию кислотного разложения иммунокомплекса и увеличить экспрессность и чувствительность способа определения патогенных микроорганизмов.
Кроме того, создание на поверхности магнитных наночастиц электроактивного полимерного покрытия (полимерного покрытия, модифицированного электроактивными соединениями) приводит к уменьшению поверхностной энергии наночастиц и позволит предотвратить их агрегацию, в результате чего размер частиц не изменяется в течение эксперимента. Таким образом, использование полимерного покрытия позволит добиться высокой чувствительности и воспроизводимости анализа.
Использование магнитных нанокомпозитных частиц с электроактивным полимерным покрытием (полимерным покрытием, модифицированным электроактивными соединениями) позволит расширить круг потенциальных электрохимически активных меток
Предложенный способ иммуноанализа позволит существенно снизить материало- и трудозатраты на проведение анализа, увеличить производительность и уменьшить себестоимость определения.
Таким образом, из патентной и научно-технической литературы не известен способ определения патогенных микроорганизмов заявляемой совокупности признаков.
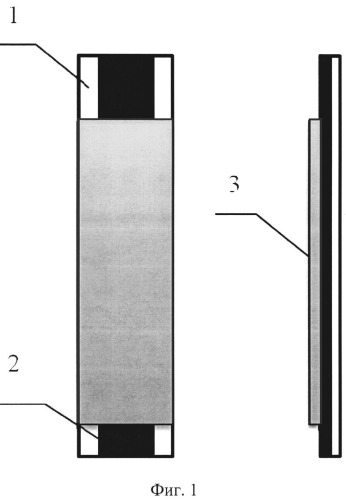
На фигуре 1 изображен общий вид рабочего электрода, где 1 - подложка из стеклотекстолита, 2 - дорожка из токопроводящего материала (графитовая композиция, углеродные чернила), 3 - слой изолятора или цементита.
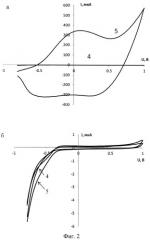
На фигуре 2 представлены циклические вольтамперограммы, зарегистрированные в модельных растворах, содержащих (а, 4-5) и не содержащих (б, 4-5) микроорганизмы Е.Coli (штамм O-12).
4 - вольтамперограмма фонового электролита, 5 - вольтамперограмма модельного раствора.
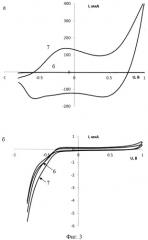
На фигуре 3 представлены циклические вольтамперограммы, зарегистрированные в пробах, содержащих (а, 6-7) и не содержащих (б, 6-7) микроорганизмы Е.Coli (штамм O-12).
6 - вольтамперограмма фонового электролита, 7 - вольтамперограмма пробы.
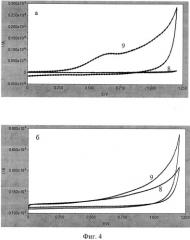
На фигуре 4 представлены циклические вольтамперограммы, зарегистрированные в пробах, содержащих (а, 8-9) и не содержащих (б, 8-9) микроорганизмы Е.Coli (штамм O-12).
8 - вольтамперограмма фонового электролита, 9 - вольтамперограмма пробы.
На фигуре 5 представлены циклические вольтамперограммы, зарегистрированные в пробах, содержащих (а, 10-11) и не содержащих (б, 10-11) микроорганизмы Е.Coli (штамм O-12).
10 - вольтамперограмма фонового электролита, 11 - вольтамперограмма пробы.
На фигуре 6 представлены циклические вольтамперограммы, зарегистрированные в модельных растворах, содержащих (а, 12-13) и не содержащих (б, 12-13) микроорганизмы Salmonella typhimurium (штамм SL 7207).
12 - вольтамперограмма фонового электролита, 13 - вольтамперограмма модельного раствора.
На фигуре 7 представлены циклические вольтамперограммы, зарегистрированные в пробах, содержащих (а, 14-15) и не содержащих (б, 14-15) микроорганизмы Salmonella typhimurium (штамм SL 7207).
14 - вольтамперограмма фонового электролита, 15 - вольтамперограмма пробы.
Способ иллюстрируется следующими примерами.
Пример 1.
Вытяжку анализируемой среды (модельного раствора) инкубируют в течение 30 минут с электроактивными магнитными нанокомпозитными частицами Fe3O4-полипиррол при температуре 37°С. После инкубации несвязавшиеся электроактивные магнитные нанокомпозитные частицы отделяют с использованием магнитного поля. В подготовленную таким образом вытяжку помещают ТГЭ (фиг.1), модифицированный антителами против Е.Coli (штамм O-12), и выдерживают в течение 20 минут при температуре 37°С. Для ускорения доставки меченых микроорганизмов к поверхности сенсора используют магнитное поле. Затем электрод промывают буферным раствором, содержащим нормальную лошадиную сыворотку (НЛС) и твин-20. Извлеченный из анализируемого раствора электрод помещают в электрохимическую ячейку. В качестве фонового электролита используют раствор KNO3 в воде. В качестве аналитического сигнала используют электрохимический отклик окисления полипиррольного покрытия электроактивных магнитных нанокомпозитных частиц, локализованных в иммунокомплексе на поверхности ТГЭ. Для проведения холостого опыта используют раствор, не содержащий микроорганизмы Е.Coli (штамм O-12) (фиг.2). В модельном растворе обнаружили 5×103 клеток/мл микроорганизма Е.Coli (штамм O-12).
Пример 2.
Вытяжку анализируемой среды инкубируют в течение 30 минут с электроактивными магнитными нанокомпозитными частицами Fe-полипиррол при температуре 37°С. После инкубации несвязавшиеся электроактивные магнитные нанокомпозитные частицы отделяют с использованием магнитного поля. В подготовленную таким образом вытяжку помещают ТУЭ (фиг.1), модифицированный антителами против Е.Coli (штамм O-12), и выдерживают в течение 20 минут при температуре 37°С. Для ускорения доставки меченых микроорганизмов к поверхности сенсора используют магнитное поле. Затем электрод промывают буферным раствором, содержащим нормальную лошадиную сыворотку (НЛС) и твин-20. Извлеченный из анализируемого раствора электрод помещают в электрохимическую ячейку. В качестве фонового электролита используют 0,1 М раствор KNO3 в воде. В качестве аналитического сигнала используют электрохимический отклик окисления полипиррольного покрытия электроактивных магнитных нанокомпозитных частиц, локализованных в иммунокомплексе на поверхности ТУЭ. Для проведения холостого опыта используют раствор, не содержащий микроорганизмы Е.Coli (штамм O-12) (фиг.3). В пробе, взятой у пациента, обнаружили 2×104 клеток/мл микроорганизма Е.Coli (штамм O-12).
Пример 3.
Вытяжку анализируемой среды инкубируют в течение 30 минут с электроактивными магнитными нанокомпозитными частицами Fe3O4-модифицированный ферроценом оксид кремния при температуре 37°С. После инкубации несвязавшиеся электроактивные магнитные нанокомпозитные частицы отделяют с использованием магнитного поля. В подготовленную таким образом вытяжку помещают ТГЭ (фиг.1), модифицированный антителами против Е.Coli (штамм O-12), и выдерживают в течение 20 минут при температуре 37°С. Для ускорения доставки меченых микроорганизмов к поверхности сенсора используют магнитное поле. Затем электрод промывают буферным раствором, содержащим нормальную лошадиную сыворотку (НЛС) и твин-20. Извлеченный из анализируемого раствора электрод помещают в электрохимическую ячейку. В качестве фонового электролита используют раствор KNO3 в воде. В качестве аналитического сигнала используют электрохимический отклик окисления ферроценовых групп полимерного покрытия электроактивных магнитных нанокомпозитных частиц, локализованных в иммунокомплексе на поверхности ТГЭ. Для проведения холостого опыта используют раствор, не содержащий микроорганизмы Е.Coli (штамм O-12) (фиг.2). В пробе, взятой у пациента, обнаружили 1,5×103 клеток/мл микроорганизма Е.Coli (штамм O-12).
Пример 4.
Пробу воды инкубируют в течение 30 минут с электроактивными магнитными нанокомпозитными частицами Fe3O4-модифицированный ферроценом оксид кремния при температуре 37°С. После инкубации несвязавшиеся электроактивные магнитные нанокомпозитные частицы отделяют с использованием магнитного поля. В подготовленную таким образом вытяжку помещают ТУЭ (фиг.1), модифицированный антителами против Е.Coli (штамм O-12), и выдерживают в течение 20 минут при температуре 37°С. Для ускорения доставки меченых микроорганизмов к поверхности сенсора используют магнитное поле. Затем электрод промывают буферным раствором, содержащим нормальную лошадиную сыворотку (НЛС) и твин-20. Извлеченный из анализируемого раствора электрод помещают в электрохимическую ячейку. В качестве фонового электролита используют 0,1 М раствор KNO3 в воде. В качестве аналитического сигнала используют электрохимический отклик окисления ферроценовых групп полимерного покрытия электроактивных магнитных нанокомпозитных частиц, локализованных в иммунокомплексе на поверхности ТУЭ. Для проведения холостого опыта используют раствор, не содержащий микроорганизмы Е.Coli (штамм O-12) (фиг.3). В пробе обнаружили 2,3×102 клеток/мл микроорганизма Е.Coli (штамм O-12).
Пример 5.
Вытяжку анализируемой среды (модельный раствор) инкубируют в течение 30 минут с электроактивными магнитными нанокомпозитными частицами Fe-модифицированный хинолином поливинилбензилхлорид при температуре 37°С. После инкубации несвязавшиеся электроактивные магнитные нанокомпозитные частицы отделяют с использованием магнитного поля. В подготовленную таким образом вытяжку помещают ТГЭ (фиг.1), модифицированный антителами против Salmonella typhimurium (штамм SL 7207), и выдерживают в течение 20 минут при температуре 37°С. Для ускорения доставки меченых микроорганизмов к поверхности сенсора используют магнитное поле. Затем электрод промывают буферным раствором, содержащим нормальную лошадиную сыворотку (НЛС) и твин-20. Извлеченный из анализируемого раствора электрод помещают в электрохимическую ячейку. В качестве фонового электролита используют раствор KNO3 в воде. В качестве аналитического сигнала используют электрохимический отклик восстановления хинолиновых групп полимерного покрытия электроактивных магнитных нанокомпозитных частиц, локализованных в иммунокомплексе на поверхности ТГЭ. Для проведения холостого опыта используют раствор, не содержащий микроорганизмы Salmonella typhimurium (штамм SL 7207) (фиг.2). В модельном растворе обнаружили 6×103 клеток/мл микроорганизма Salmonella typhimurium (штамм SL 7207).
Пример 6.
Вытяжку анализируемой среды инкубируют в течение 30 минут с электроактивными магнитными нанокомпозитными частицами Fe3O4-модифицированный хинолином поливинилбензилхлорид при температуре 37°С. После инкубации несвязавшиеся электроактивные магнитные нанокомпозитные частицы отделяют с использованием магнитного поля. В подготовленную таким образом вытяжку помещают ТУЭ (фиг.1), модифицированный антителами против Salmonella typhimurium (штамм SL 7207), и выдерживают в течение 20 минут при температуре 37°С. Для ускорения доставки меченых микроорганизмов к поверхности сенсора используют магнитное поле. Затем электрод промывают буферным раствором, содержащим нормальную лошадиную сыворотку (НЛС) и твин-20. Извлеченный из анализируемого раствора электрод помещают в электрохимическую ячейку. В качестве фонового электролита используют раствор KNO3 в воде. В качестве аналитического сигнала используют электрохимический отклик восстановления хинолиновых групп полимерного покрытия электроактивных магнитных нанокомпозитных частиц, локализованных в иммунокомплексе на поверхности ТУЭ. Для проведения холостого опыта используют раствор, не содержащий микроорганизмы Salmonella typhimurium (штамм SL 7207) (фиг.2). В пробе, взятой у пациента, обнаружили 3,7×102 клеток/мл микроорганизма Salmonella typhimurium (штамм SL 7207).
Способ определения содержания грамотрицательных патогенных бактерий в анализируемой среде, характеризующийся конъюгированием бактерий с электрохимической меткой, в качестве которой используют магнитные нанокомпозитные частицы на основе Fe, Fe3O4 с электроактивным полимерным покрытием из полипиррола, модифицированного хинолином поливинилбензилхлорида либо модифицированного ферроценом оксида кремния, осуществляемым в водной среде в течение 30 минут при температуре 37°С, отделением несвязавшихся нанокомпозитных частиц с использованием магнитного поля, помещением в среду рабочего электрода, изготовленного из графитсодержащих материалов, поверхность которого предварительно модифицируют антителами, специфичными к определяемому штамму бактерий, образованием иммунокомплекса на поверхности электрода в течение 20 минут при температуре 37°С с использованием магнитного поля, промыванием электрода буферным раствором, содержащим нормальную лошадиную сыворотку и твин-20, помещением извлеченного из анализируемой среды рабочего электрода в электрохимическую ячейку, содержащую фоновый электролит KNO3, растворенный в воде, и определением содержания определяемых бактерий по величине аналитического сигнала, в качестве которого используют электрохимический отклик окисления/восстановления нанокомпозитных частиц, локализованных в иммунокомплексе на поверхности рабочего электрода.