Композиционный костно-керамический имплантат на основе керамического материала системы оксид циркония - оксид алюминия
Иллюстрации
Показать всеИзобретение относится к медицине, в частности к травматологии, ортопедии, регенеративной медицине, стоматологии и челюстно-лицевой хирургии для восстановления структуры и функции костной ткани и описывает композиционный костно-керамический имплантат, содержащий пористый керамический носитель на основе оксид циркония - оксид алюминия, на носитель нанесен слой гидроксиапатита и обогащенный тромбоцитами плазмы, при этом носитель получен путем приготовления смеси из керамического порошка на основе ZrO2 (Mg, Y) или Al2О3 и добавки пластификатора и порообразователя Al(OH)3 или Zr(OH)4, с последующим добавлением дистиллированной воды для придания смеси формовочных свойств и спеканием готового изделия. Композиционный костно-керамический имплантат на основе керамического материала системы оксид циркония - оксид алюминия, эффективен и пригоден в медицине для восстановления анатомической целостности и функций костной ткани. 1 пр., 14 ил.
Реферат
Изобретение относится к медицине, в частности к травматологии, ортопедии, регенеративной медицине, стоматологии и челюстно-лицевой хирургии для восстановления структуры и функции костной ткани.
Актуальной проблемой в медицине является восстановление анатомической целостности и функции костной ткани. Одной из причин потери трудоспособности населения являются заболевания и посттравматические состояния, сопряженные с необходимостью реконструкции и замещения участков костной ткани, протезирования фрагментов опорно-двигательного аппарата. Костные дефекты, образовавшиеся после травм, оперативных вмешательств, опухолей, требуют применения полноценных пластических материалов. При этом длительность лечения пациентов и их нетрудоспособность колеблется от 6-8 месяцев до 2-3 лет, а 6-8% случаев заканчиваются стойкой инвалидностью, что влечет за собой существенные экономические затраты и социальную значимость. Отсюда следует важность раннего изыскания возможности управления репаративными процессами. Сокращением сроков перестройки за счет адекватного выбора материалов или создания и использования материалов с заданными набором свойств.
В настоящее время в медицине известен широкий спектр остеопластических матриц. Наибольший интерес для тканевой инженерии представляют мультипотентные стромальные клетки костного мозга (МСК), способные к дифференцировке в остеогенном, хондрогенном и адипогенном направлениях [1]. Введение клеток приводит к замещению утраченных клеточных элементов, индукции регенерации за счет выделения факторов роста и дифференцировки, формированию внеклеточного матрикса, что значительно ускоряет восстановление поврежденной ткани [2]. Иммобилизация культивированных клеток на матрице-носителе обеспечивает максимально высокую концентрацию клеток в области повреждения, дифференцировку в заданном направлении и повышает выживаемость клеток при трансплантации.
Деминерализованный костный матрикс (ДКМ) благодаря естественной архитектонике, остеогенному потенциалу, обусловленному наличием биологически активных веществ, является одним из наиболее популярных материалов для остеопластики. Показана эффективность применения носителей на основе ДКМ с иммобилизованными МСК при восстановлении дефектов теменных костей у крыс и собак [3]. Запатентована технология лечения ложных суставов с использованием биотрансплантата на основе ДКМ и аутологичных МСК [4]. Недостатками данного ксеногенного материала являются необходимость обработки агрессивными жидкостями (снижающими клеточную адгезию), потенциальная иммуногенность и возможность переноса возбудителей инфекционных заболеваний.
Широко используемые синтетические биодеградируемые носители на основе полимолочной и полигликолевой кислот и их сополимеров в сочетании с МСК также демонстрируют индукцию остеогенеза in vitro и формирование костной ткани через 6-9 недель в экспериментах на животных [5]. Мембраны из полилактидов и/или полигликолидов, импрегнированные хондроцитами или МСК костного мозга, запатентованы как способ лечения костных и хрящевых дефектов человека и животных [6]. Минусами таких носителей является быстрая и не всегда предсказуемая деградация матриц, которая сопровождается локальным понижением рН в области имплантата, что снижает эффективность их применения [7].
Известен биотрансплантат на основе высокопористого керамического материала системы оксид циркония - оксид алюминия и мультипотентных стромальных клеток костного мозга человека для восстановления протяженных дефектов костной ткани (патент РФ № 2386453, 2008), принятый за прототип, характеризующийся тем, что содержит аутологичные или донорские мультипотентные мезенхимальные стромальные клетки (ММСК) из костного мозга и носитель, созданный на основе высокопористого керамического материала системы оксид циркония - оксид алюминия по технологии дублирования пенополиуретановой основы, при этом носитель плотно засевают ММСК, культивированными от 1 до 3 пассажей, при этом на одном носителе иммобилизовано от 200 до 500 тысяч клеток, витальность которых составляет не менее 90%, а функциональная направленность подтверждается способностью к направленной дифференцировке в мезодермальные линии и демонстрируется экспрессия стромальных маркеров CD 90 и CD 105 у 60-90% клеток и отсутствие экспрессии маркера CD 34.
Однако работа с мультипотентными мезенхимальными стромальными клетками (ММСК) очень кропотлива и требует значительного периода времени от 2-3 недель до 1 месяца от периода забора от пациента до периода имплантации. Кроме того, при увеличении количества пассажей культуры клеток, увеличивается количество мутаций.
Раскрытие изобретения.
Техническим результатом предлагаемого изобретения является создание композиционного костно-керамического имплантата, на основе керамического материала системы оксид циркония - оксид алюминия, который осуществляет оптимизацию процессов репарации и восстановления поврежденной костной структуры. Увеличивает биологическую совместимость, прочностные свойства. Обеспечивает отсутствие иммунных реакций организма. Усиливает репаративные процессы в поврежденных тканях. Осуществляет быстрое заживление и восстановление костной структуры.
Указанный технический результат достигается тем, что композиционный костно-керамический имплантат, содержащий пористый керамический носитель на основе оксид циркония - оксид алюминия на носитель нанесен слой гидроксиапатита и обогащенный тромбоцитами плазмы, при этом носитель получен путем приготовления смеси из керамического порошка на основе ZrO2 (Mg, Y) или Al2О3 и добавки пластификатора и порообразователя Al(ОН)3 или Zr(OH)4, с последующим добавлением дистиллированной воды для придания смеси формовочных свойств и спеканием готового изделия.
Изобретение поясняется следующими графическими материалами, где на фиг.1 - общий вид изделия.
Вариант осуществления изобретения.
Этап 1. Изготовление пористого керамического материала. Изготовление пористого керамического материала осуществляют известным способом по патенту РФ № 2476406, 2008, путем приготовления смеси из керамического порошка и добавки, выполняющей функцию пластификатора и порообразователя, формованием из нее изделия требуемой конфигурации и последующее спекание, в качестве керамического порошка используют ультрадисперсный порошок твердых растворов на основе ZrO2 (Mg, Y) или ультрадисперсный порошок Al2O3, а в качестве пластификатора и порообразователя используют гидрозоль Al(ОН)3 или Zr(OH)4 в количестве от 1 до 50% в объеме смеси, добавляют, перемешивая, дистиллированную воду для придания смеси формовочных свойств, далее проводят формование изделия прессованием под давлением от 12 до 25 кН, а спекание изделия осуществляют при температуре 1450-1600°C.
Этап 2. Изготовление ДПК - опилок далее биологического гидроксиапатита. Изготавливают биологический гидроксиапатит известным способом по патенту РФ № 2232585, 2001 путем очистки кости, распилки на фрагменты, промывки водой и депротеинизации при 37°С 0,01%-ным раствором химопсина в течение 72 ч и 10%-ным раствором перекиси водорода в течение 48 ч, обработки жидким эфиром, 10%-ным раствором хлористого лития в течение 16 ч и промывки стерильной дистиллированной водой, депротеинизированную кость после промывки стерильной дистиллированной водой измельчают до размера частиц 0,1-0,5 мм, полученную депротеинизированную костную муку соединяют при температуре 38-40°C с 9% желатином, приготовленным на консервирующем растворе с добавлением антибактериального препарата, консервируют при температуре -20°C и стерилизуют.
Этап 3. Нанесение покрытия биологического гидроксиапатита. На композиционные костно-керамические имплантаты производится холодное газодинамическое напыление биологического гидроксиапатита с помощью установки холодного газового напыления (ХГН) при следующих параметрах: Рабочий газ-воздух; давление в форкамере 0,3-5 МПа; Температура в форкамере 0-1000°C; Расход газа ≤1,5 м3/мин; Потребляемая мощность ≤20 кВт.
Этап 4. Нанесение обогащенной тромбоцитами плазмы на композиционный костно-керамический имплантат с напылением биологического гидроксиапатита. За 20-30 минут до операции производят забор крови 10-15 мл у пациента в вакуумную пробирку. Пробирку с кровью центрифугируют на медицинской центрифуге при 1500 об/мин в течение 15 минут. В процессе центрифугирования происходит расслоение крови на фракции с образованием срединной фракции на границе между эритроцитами и плазмой. Полученные тромбоциты извлекают с помощью шприца на стерильную чашку Петри, куда непосредственно погружают имплантат.
Экспериментальное исследование. Имплантацию экспериментальных образцов материалов проводили в дефекте компактной кости половозрелых крыс-самцов линии Вистар в возрасте 5-6 месяцев, с массой тела 260-320 граммов. Модель перфорационного дефекта нижней челюсти с последующим заполнением дефекта материалами использовали для изучения биологического отклика на экспериментальный образец.
Композиционные костно-керамические имплантаты на основе Al2О3- и ZrO2-керамики, цилиндрической формы высотой 2-3 мм, диаметром 2 мм и с напылением биологического гидроксиапата. Для стимуляции костеобразования применялась богатая тромбоцитами плазма (БоТП). Животных выводили из эксперимента на 15-е и 30-е сутки. Таким образом, были сформированы следующие группы/
В первой серии - изучали биологический отклик при имплантации в компактную кость экспериментальных образцов костно-керамических имплантатов, т.е. циркониевой керамики с поверхностным покрытием депротеинизированным аллокостным порошком. Количество животных - 6, количество операций - 12. Сроки наблюдения составляли 15 и 30 суток после имплантации.
Во второй серии изучали биологический отклик при имплантации в компактную кость экспериментальных модифицированных образцов костно-керамических имплантатов, т.е. образцов, модифицированных обогащенной тромбоцитами плазмой. Количество животных - 6, количество операций - 12. Сроки наблюдения составляли 15 и 30 суток после имплантации.
Экспериментальные исследования производились согласно разработанным методикам и протоколам ФГБУ «ННИИТО им. Я.Л. Цивьяна» Минздрава России.
Результаты первой серии экспериментов через 15 и 30 суток после имплантации.
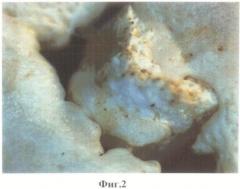
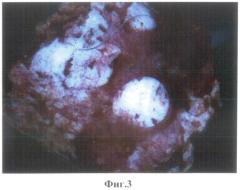
1.1. Композиционные костно-керамические имплантаты через 15 суток после имплантации. На фиг.2 представлен композиционный костно-керамический имплантат в перфорационном дефекте нижней челюсти через 15 суток после имплантации. Белыми стрелками обозначена костная ткань на поверхности образца, черными - мостики между краем костного дефекта и вновь образованной костью. На фиг.3 представлен извлеченный из кости животного костно-керамический имплантат. На поверхности костно-керамического имплантата - новообразованная костная ткань, окрашенная в фиолетовый цвет. Достаточно большой массив новообразованной кости с формированием молодых костных балок.
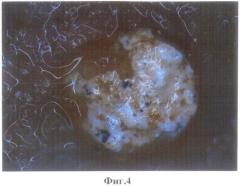
1.2. Композиционный костно-керамический имплантат через 30 суток после имплантации. Композиционный костно-керамический имплантат через 30 суток после имплантации представлен на фиг.3, фиг.4, фиг.5. На фиг.4 представлен внешний вид композиционного костно-керамического имплантата имплантированного в нижнюю челюсть экспериментального животного. Наблюдается формирование вновь образованной кости по периферии имплантата и на его поверхности. На фиг.5 представлен внешний вид композиционного костно-керамического имплантата извлеченного из кости челюсти экспериментального животного. Сам композиционный костно-керамический имплантат представлен белым. На его поверхности имеют место темные вкрапления соответствующие вновь формирующейся костной ткани на пористой поверхности имплантата. На фиг.6 представлен внешний вид дефекта кости после извлечения из нее имплантата. Края костного дефекта достаточно округлые, соответствуют форме имплантированного композиционного костно-керамического имплантата. Местами встречаются небольшие неровности, соответствующие формирующимся костным «мостикам» к порам композиционного костно-керамического имплантата. В нижней части отмечается изменение конфигурации костного дефекта за счет формирования поверхностных напластований на имплантат, направленных от периферии к центру сформированного костного дефекта.
Результаты второй серии экспериментов через 15 и 30 суток после имплантации.
2.1. Композиционный костно-керамический имплантат с модифицированной обогащенной фомбоцитами плазмой через 15 суток после имплантации. Внешний вид композиционного костно-керамического имплантата с модифицированной обогащенной тромбоцитами плазмой, через 15 суток после имплантации в кость нижней челюсти экспериментального животного (крысы) выглядит так, как представлено на фиг.7 и фиг.8. Местами встречаются участки резорбции костной ткани, местами участки напластования вновь образованной кости на композиционном костно-керамическом имплантате с модифицированной обогащенной тромбоцитами плазмой. Напластования тянуться со стороны кости нижней челюсти к центру имплантата. На фиг.9 и фиг.10 представлен извлеченный из кости нижней челюсти композиционный костно-керамический имплантат с модифицированной обогащенной тромбоцитами плазмой. Наблюдаются отчетливые признаки биологической совместимости имплантата, выражающиеся в способности к образованию на его поверхности молодой костной ткани, окрашенной в фиолетовый цвет при докрашивании гематоксилином и эозином
2.2. Композиционные костно-керамические имплантаты с модифицированной обогащенной тромбоцитами плазмой через 30 суток после имплантации. Внешний вид композиционного костно-керамического имплантата с модифицированной обогащенной тромбоцитами плазмой после имплантации в кость нижней челюсти экспериментального животного (крысы) выглядит так, как представлено на фиг.11 и фиг.12. Вновь образованная кость, почти полностью покрывает поверхность имплантата. Напластования тянуться со стороны кости нижней челюсти к центру имплантата. Композиционный костно-керамический имплантат с модифицированной обогащенной тромбоцитами плазмой, извлеченный из нижней челюсти экспериментального животного через 30 суток после имплантации представлен на фиг.13 и фиг.14. Новообразованная кость формируется непосредственно на поверхности имплантата. Большой массив ткани окрашенной представляет собой напластования вновь образованной кости. Наблюдается формирование остеоида на поверхности имплантата и в зоне кость-имплантат. Формирование идет со стороны костного ложа к центру имплантата. По периферии имплантата строение костной ткани идентично интактной кости челюсти, по мере удаления от костного ложа строение вновь образованной кости бесструктурно, что характерно для стадии формирования остеоида.
Таким образом, результаты экспериментального исследования показали, что признаков воспалительной реакции, вызванной имплантированными материалами ни в одной серии эксперимента, не наблюдалось. Костеобразование идет путем напластования, в некоторых участках масса новообразованной кости на имплантате большая, но всегда наблюдается связь с материнской костью. Пролиферация и миграция костных клеток приводит к аппозиционному росту кости на поверхности имплантата. На всех сроках эксперимента наблюдается выраженная минерализация межклеточного матрикса ионами кальция. При применении модифицированной обогащенной тромбоцитами плазмой происходит активация как стромального, так и гемопоэтического компонента костеобразования (развивается строма костного мозга и присутствуют гемопоэтические клетки). На поздних сроках (30 суток) применения модифицированной обогащенной тромбоцитами плазмы извлечь имплантат из кости челюсти не представилось возможным в связи с замуровыванием имплантата новообразованной костной тканью. На поздних сроках (30 суток) наблюдаются признаки биодеградации материала имплантата, более выраженные в случае применения обогащенной тромбоцитами плазмы. Резорбция материала имплантата происходит без видимого участия гистиоцитов и остеокластов.
Результаты исследований заявляемого изобретения демонстрируют возможность эффективного применения в медицинской практике, для восстановления поврежденной костной структуру, так как композиционный костно-керамический имплантат на основе керамического материала системы оксид циркония - оксид алюминия осуществляет оптимизацию процессов репарации и восстановления поврежденной костной структуры, быстрое заживление и восстановление костной структуры. Увеличивает биологическую совместимость и прочностные свойства, обеспечивает отсутствие иммунных реакций организма, усиливает репаративные процессы в поврежденных тканях.
Результаты исследований свидетельствуют о том, что композиционный костно-керамический имплантат на основе керамического материала системы оксид циркония - оксид алюминия, эффективен и пригоден в медицине для восстановления анатомической целостности и функций костной ткани.
Заявляемое изобретение может быть изготовлено с применением высокотехнологичного оборудования, современных технологий и материалов.
Использованная литература
1. Pittenger M.F., Mosca J.D., McIntosh K.R., Human mesenhymal stem cells: progenitor cells for cartilage, bone, fat and stroma. Curr Top Microbiol Immunol. 2000; 251:3-11.
2. Salgado A.J., Oliveira J.Т., Pedro A.J., Reis R.L. Adult stem cells in bone and cartilage tissue engineering. Curr. Stem Cell. Res. http://Ther.2006.sep; 1(3):345-64.
3. Liu W., Cui L., Cao Y. Mesenhymal stem cells and tissue engineering. Methods in enzimology. 2006. Vol. 420. P. 339-361.
4. Патент РФ № 2309756 от 10.11.2007.
5. Yao J., Radin S., Leboy P., Ducheyne P. The effect of bioactive glass content on synthesis and bioactivity of composite poly (lactic-co-glycolic acid)/ bioactive glass substrate for tissue engineering. Biomaterials. 2005 May; 26(14):1935-43.
6. Bostman O., Paivarinta U., Partio E., Vasenius J., Manninen M., Rokkanen P. Degradation and tissue replacement of an absorbable polyglycolide screwin the fixation of rabbit femoral osteotomies. J. Bone Joint. Surg. Am. 1992. Aug; 74(4): 1021-31.
7. Заявка РФ № 2000109319 от 20.02.2003.
Композиционный костно-керамический имплантат, содержащий пористый керамический носитель на основе оксид циркония - оксид алюминия, отличающийся тем, что на носитель нанесен слой гидроксиапатита и обогащенный тромбоцитами плазмы, при этом носитель получен путем приготовления смеси из керамического порошка на основе ZrO2 (Mg, Y) или Al2О3 и добавки пластификатора и порообразователя Al(OH)3 или Zr(OH)4, с последующим добавлением дистиллированной воды для придания смеси формовочных свойств и спеканием готового изделия.