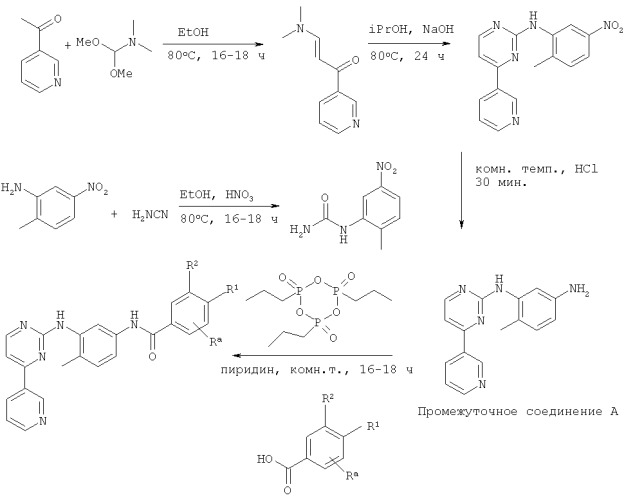
Способ определения ингибитора, ковалентно связывающего целевой полипептид
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и может быть использовано для разработки необратимого ингибитора, ковалентно связывающего целевой полипептид. Указанный способ включает: а) представление структурной модели обратимого ингибитора или модели сайта связывания в целевом полипептиде, b) идентификацию Цис-остатка в сайте связывания целевого полипептида, с) предоставление структурной модели предполагаемого необратимого ингибитора, который потенциально ковалентно связывается с целевым полипептидом, где ингибитор содержит «боеголовку», или предоставление структурной модели группы-«боеголовки», d) определение, находится ли реакционноспособная группа «боеголовки» предполагаемого ингибитора в пределах расстояния образования связи с Цис-остатком в сайте связывания целевого полипептида, или идентификацию замещаемой позиции обратимого ингибитора, к которой может быть присоединена группа-«боеголовка», способная образовывать ковалентную связь с Цис-остатком в сайте связывания целевого полипептида, e) формирование ковалентной связи между атомом серы Цис-остатка в сайте связывания целевого полипептида и реакционноспособной группой «боеголовки» или присоединение группы-«боеголовки» к замещаемой позиции обратимого ингибитора. Изобретение позволяет снизить финансовые и временные трудозатраты при разработке структуры необратимого ингибитора. 3 н. и 38 з.п. ф-лы, 11 ил., 12 табл., 8 пр.
Реферат
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Соединения, ингибирующие активность полипептидов, такие как ферменты, являются важными терапевтическими средствами. Большинство ингибиторов обратимо связываются со своими целевыми полипептидами и обратимо подавляют активность последних. И хотя было разработано много обратимо действующих ингибиторов, которые стали эффективными терапевтическими средствами, им присущи определенные недостатки. Так, многие обратимо действующие ингибиторы киназ взаимодействуют с сайтом связывания АТФ (аденозинтрифосфата). Поскольку структура сайта связывания АТФ довольно консервативна среди киназ, было бы очень заманчиво создать ингибиторы, которые избирательно подавляли бы какую-либо одну или несколько определенных киназ. Кроме того, обратимо действующие ингибиторы впоследствии отъединяются от своих целевых полипептидов, поэтому продолжительность ингибирования может быть меньше, чем это необходимо. Таким образом, при использовании обратимо действующих ингибиторов в качестве терапевтических агентов, для достижения надлежащего биологического эффекта могут потребоваться повышенное количество препарата и/или более частая дозировка. А это, в свою очередь, может вызвать токсичность или другие нежелательные эффекты.
В литературе уже встречаются описания необратимо действующих ингибиторов, которые ковалентно связываются со своими целевыми полипептидами. Ковалентные необратимые ингибиторы определенных мишеней обладают многими важными преимуществами по сравнению со своими обратимыми аналогами. Пролонгированное угнетение мишеней, преследуемых лекарственными препаратами, необходимо для максимального фармакодинамического эффекта, и необратимо действующий ингибитор может помочь в достижении этой цели, так как он постоянно (стабильно) подавляет активность, которая восстанавливается, только когда синтезируется новый целевой полипептид. После введения необратимо действующего ингибитора его терапевтическую концентрацию в плазме необходимо будет поддерживать лишь до того момента, пока целевые полипептиды хотя бы слегка подвергнутся действию ингибитора, который будет необратимо подавлять деятельность мишени. Даже если после этого содержание ингибиторов в плазме будет быстро снижаться, на это можно не обращать внимания,: целевой полипептид все равно будет оставаться инактивированным. В перспективе это открывает возможность снизить минимальную концентрацию в плазме, при которой наблюдается терапевтический эффект, минимизировать введение множественных доз и избавиться он необходимости добиваться длительного времени полужизни без потери эффективности. Все это позволяет снизить токсичность препарата, обусловленную неспецифическими нецелевыми взаимодействиями, которые могут иметь место при высоких или пролонгированных концентрациях в плазме. Еще одним преимуществом необратимо действующих ингибиторов может стать возможность преодолеть резистентность к лекарственным препаратам.
В патентной заявке US 2007/0082884 описано применение способов структурной биоинформатики для идентификации цистеина (Цис) в сайте связывания нескольких киназ, которые поддаются модифицированию с помощью низкомолекулярных ингибиторов. Кроме того, в заявке описываются способы получения соединений, образующих ковалентную связь с идентифицированным Цис. В статье Pan et, al. ChemMedChem 2(1):58-61 (2007) рассмотрены идентификация остова, способного ингибировать тирозинкиназу Брутона (ВТК), путем просеивания; приготовление серий соединений на основе остова, а также идентификация ковалентных ингибиторов ВТК. В работе Wissner et al., J. Med. Chem. 48(24):7560-81 (2005) освещено приготовление серий соединений, являющихся необратимо действующими ингибиторами киназы рецептора-2 фактора роста эндотелия сосудов (VEGFR2). Такие соединения содержат квиназолиновый фибриллярный центр и высокоактивный хинон. Однако ни одна из перечисленных работ не дает ни какого-либо обобщенного/универсального способа создания необратимо действующих ингибиторов, ни способа разработки необратимо действующего ингибитора на основе его обратимого аналога. Существование таких способов позволило бы заметно сократить временные и материальные затраты на разработку необратимо действующих ингибиторов.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение относится к алгоритму и способу создания необратимо действующих ингибиторов целевых полипептидов. Необратимо действующие ингибиторы, созданные по описанным здесь алгоритму и способу, образуют ковалентную связь с аминокислотной боковой цепью в целевом полипептиде. Теперь, при использовании данного изобретения, становится возможной эффективная разработка необратимо действующего ингибитора на базе уже известного обратимого ингибитора. Такой подход позволяет сократить время и денежные средства, затрачиваемые обычно при традиционном просеивании и проработке связи активность-структура - подходах, обычно применяемых при изобретении и развитии лекарственных препаратов. Алгоритм и способ включают формирование связи между предполагаемым необратимо действующим ингибитором и целевым полипептидом.
Алгоритм и способ содержат: А) представленную структурную модель обратимого ингибитора, связанного с сайтом связывания в целевом полипептиде, где обратимый ингибитор образует не-ковалентную связь с сайтом связывания; В) идентификацию Цис-остатка в сайте связывания целевого полипептида, который является смежным с обратимым ингибитором, когда обратимый ингибитор связан с сайтом связывания; С) производство структурных моделей предполагаемых ингибиторов, которые ковалентно связаны с целевым полипептидом, где каждый предполагаемый ингибитор содержит «боеголовку», привязанную к замещаемой позиции обратимого ингибитора; «боеголовка» содержит активную химическую функциональность и - опционально - линкер, позиционирующий активную химическую функциональность в пределах длины связи Цис-остатка в сайте связывания целевого полипептида; D) определение замещаемых позиций обратимого ингибитора, что отражается на активной химической функциональности «боеголовки», находящейся в пределах длины связи Цис-остатка в сайте связывания целевого полипептида, когда предполагаемый ингибитор связан с сайтом связывания; Е) для предполагаемого ингибитора, содержащего «боеголовку», Которая находится в пределах длины связи Цис-остатка в сайте связывания целевого полипептида, когда предполагаемый ингибитор связан с сайтом связывания, - формирование ковалентной связи между атомом серы Цис-остатка в сайте связывания и активной химической функциональностью реакционного химического функционала «боеголовки», когда предполагаемый ингибитор связан с сайтом связывания. Длина ковалентной связи менее 2 ангстремов для связи, образовавшейся между атомом серы Цис-остатка в сайте связывания и активной химической функциональностью «боеголовки», указывает на то, что предполагаемый ингибитор является ингибитором, который ковалентно свяжется с целевым полипептидом.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
ФИГ. 1A-1Q иллюстрируют структуру 114-ти примеров «боеголовок», которые могут быть использованы в изобретении, и тиоловые аддукты, которые каждая «боеголовка» образует с Цис-остатком в целевом полипептиде. В тиоловых аддуктах атом серы Боковой цепи цистеина связан с «боеголовкой» и с β-углеродом Цис-остатка, и β-углерод Цис-остатка связан с R. R представляет собой остаток целевого полипептида.
ФИГ.2А изображает модель Соединения 1 в сайте связывания АТФ полипептида c-KIT. Также показан целевой Цис-остаток, Cys788 полипептида c-KIT.
ФИГ.2В отображает модель Соединения 1 в сайте связывания АТФ полипептида с-KIT. Согласно данному рисунку, в Соединении 1 сформирована ковалентная связь с Cys788 c-KIT.
ФИГ.3А изображает модель Соединения 4 в сайте связывания АТФ полипептида FLT3. Также показан целевой Цис-остаток, Cys828 FLT3.
ФИГ.3В изображает модель Соединения 4 в сайте связывания АТФ полипептида FLT3. Согласно данному рисунку, в Соединении 4 сформирована ковалентная связь с Cys828 FLT3.
ФИГ.4А изображает модель Соединения 5 в сайте связывания протеазы вируса гепатита С (ВГС), а именно компонент протеазы вируса NS3/4A ВГС.Также показан целевой Цис-остаток, Cysl59 протеазы ВГС.
ФИГ.4В изображает модель Соединения 5 в сайте связывания протеазы ВГС. Согласно данному рисунку, в Соединении 5 сформирована ковалентная связь с Cysl59 протеазы ВГС.
ФИГ.5 демонстрирует ингибирование в зависимости от дозы в пролиферации клеток EOL-1 по сравнению с эталонным соединением и Соединением 2.
ФИГ.6 демонстрирует результаты ингибирования PDGFR по сравнению с эталонным соединением и Соединением 2, полученные в ходе эксперимента с «вымыванием» на клетках EOL-1.
ФИГ.7 демонстрирует результаты масс-спектрального анализа триптического гидролизата PDGFR, обработанного Соединением 3. Результаты подтверждают, что Соединение 3 сформировало связь с Cys814.
ФИГ.8 демонстрирует результаты масс-спектрального анализа протеазы NS3/4A ВГС, обработанной Соединением 5. Результаты показывают, что протеаза ВГС, обработанная Соединением 5, увеличилась в массе, что обусловлено формированием аддукта между белком и Соединением 5. Формирования аддукта не происходило при использовании мутантной формы протеазы ВГС, в которой Cysl59 замещен Ser.
ФИГ.9 демонстрирует результаты масс-спектрального анализа протеазы ВГС NS3/4A, обработанной Соединением 6. Результаты показывают, что протеаза ВГС, обработанная Соединением 6, увеличилась в массе, что обусловлено формированием аддукта между белком и Соединением 6. Формирования аддукта не происходило при использовании мутантной формы протеазы ВГС, в которой Cysl59 замещен Ser.
ФИГ.10А и 10В представляют собой гистограммы, на которых показано пролонгированное ингибирование активности cKIT в результате воздействия на него необратимым ингибитором Соединения 7, по сравнению с сорафенибом, согласно результатам количественного анализа на основе фосфорилирования (10А), а также анализа клеточной сигнализации «downstream» (от первичного сигнала - через рецептор - к вторичному мессенджеру и далее к внутриклеточной мишени), при котором измеряли фосфорилирование регулируемой внеклеточными сигналами киназы (ERK) (10В).
ФИГ.11 демонстрирует результаты масс-спектрального анализа протеазы ВГС NS3/4A, обработанной Соединением 8. Результаты показывают, что протеаза ВГС, обработанная Соединением 8, увеличилась в массе, что обусловлено формированием аддукта между белком и Соединением 8.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения
В данном контексте, термин "смежный" относится к аминокислотному остатку в целевом полипептиде, находящемуся рядом с обратимым ингибитором, когда обратимый ингибитор связан с целевым полипептидом. Например, аминокислотный остаток в целевом полипептиде является смежным по отношению к обратимому ингибитору, когда любой не-водородный атом аминокислотного остатка находится в пределах около 20Å, около 18 Å, около 16Å, около 14Å, около 12Å, около 10Å, около 8Å, около 6Å, около 4Å или около 2Å, любого не-водородного атома обратимого ингибитора, когда обратимый ингибитор связан с целевым полипептидом. Аминокислотный остаток в целевом полипептиде, который контактирует с обратимым ингибитором, когда обратимый ингибитор связан с целевым полипептидом, является смежным по отношению к обратимому ингибитору.
В данном контексте, "замещаемая позиция" относится к не-водородным атомам в обратимом ингибиторе, связанным с другими атомами или химическими группами (напр., водород), которые могут быть замещены и/или удалены, не нарушая связывания обратимого ингибитора с целевым полипептидом.
В данном контексте, связывание обратимого ингибитора "не нарушено", если способ связывания и время удержания обратимого ингибитора в целевом сайте связывания не претерпевает существенных изменений. Связывание обратимого ингибитора не нарушено, например, если активность ингибитора по результатам соответствующего количественного анализа (напр., IC50, Ki) изменяется на величину, меньшую, чем на три порядка, меньше чем на два порядка или меньше чем на порядок.
В данном контексте, "длина связи" относится к расстоянию, составляющему не более чем около 6Å, не более 4Å, не более 2Å.
В данном контексте, термины "ковалентная связь" и "валентная связь" относятся к химической связи между двумя атомами, образованной обобщением электронов, обычно пар электронов у связанных атомов.
В данном контексте, "не-ковалентная связь" относится к взаимодействию между атомами и/или молекулами, при котором не происходит образование ковалентной связи между ними.
В данном контексте, "необратимый ингибитор" представляет собой соединение, которое ковалентно связывается с целевым полипептидом практически постоянной ковалентной связью и ингибирует активность целевого полипептида на время, более длительное, чем функциональная жизнь белка. Необратимые ингибиторы обычно характеризуются зависимостью от времени, т.е., степень ингибирования целевого полипептида возрастает, пока его активность полностью не будет прекращена, по мере того как целевой полипептид находится в контакте с необратимо действующим ингибитором. Восстановление активности целевого полипептида после ее подавления необратимьм ингибитором зависит от начала синтеза новых белков. Активность целевого полипептида, подавленная необратимьм ингибитором, остается в значительной степени угнетенной в исследовании по "вымыванию". Профильным специалистам известны многие подходящие способы, позволяющие определить, является ли данное соединение необратимо действующим ингибитором. Например, необратимо действующее ингибирование можно идентифицировать или подтвердить при помощи кинетического анализа (напр., конкурентного, бесконкурентного, не-конкурентного) профиля ингибирования соединения с целевым полипептидом; либо масс-спектрометрии мишени лекарственного белка, модифицированного в присутствии соединения ингибитора; либо с использованием прерывистого воздействия, известного также как исследование по "вымыванию"; а также с помощью меток, например ингибитор, меченный радиоактивным изотопом, для того чтобы убедиться в наличии ковалентной модификации белка; либо воспользоваться любым другим общепринятым в данной научной области способом. В некоторых предпочтительных вариантах осуществления изобретения, целевой полипептид обладает каталитической активностью, а необратимый ингибитор формирует ковалентную связь с Цис-остатком, не являющимся каталитическим остатком.
В данном контексте, "обратимый ингибитор" - соединение, которое обратимо связывается с целевым полипептидом и угнетает активность целевого полипептида. Обратимый ингибитор может связывать свой целевой полипептид не-ковалентно или посредством механизма, включающего временную ковалентную связь. Восстановление активности целевого полипептида после ее подавления необратимым ингибитором может происходить путем отъединения обратимого ингибитора от целевого полипептида. Активность целевого полипептида можно считать восстановленной, если обратимый ингибитор "вымывается" в исследовании по вымыванию. Предпочтительные обратимые ингибиторы являются "сильными" ингибиторами активности своих целевых полипептидов. "Сильный" обратимый ингибитор подавляет активность своего целевого полипептида при значениях IC50 около 50 µМ и менее, около 1 µМ и менее, около 100 нМ и менее, или около 1 нМ и менее; и/или при Кi около 50 µМ и менее, около 1 µМ и менее, около 100 нМ, и менее, или около 1 нМ и менее.
Термины "1050" и "ингибирующая концентрация 50" - широко известные и общеупотребительные термины, обозначающие концентрацию молекул, которая подавляет на 50% активность исследуемого биологического процесса, включая, но не ограничиваясь ими, каталитическую активность, жизнеспособность клеток, активность по транслированию белков и т.п.
Термины "Кi" и "константа ингибирования" - общеупотребительные термины, обозначающие константу диссоциации комплекса полипептид (напр., белок) - ингибитор.
В данном контексте, "практически постоянная ковалентная связь" - это ковалентная связь между ингибитором и целевым полипептидом, которая сохраняется при физиологических условиях на время, более длительное, чем функциональная жизнь целевого полипептида.
В данном контексте, "временная ковалентная связь" - ковалентная связь между ингибитором и целевым полипептидом, которая сохраняется при физиологических условиях на время, меньшее, чем функциональная жизнь целевого полипептида.
В данном контексте, "боеголовкой" называется химическая группа, содержащая реакционный химический функционал или функциональную группу и - опционально-содержащая линкерную часть. Реакционноспособная химическая группа может формировать ковалентную связь с аминокислотными остатками, такими как цистеин (т.е. -SH группа в боковой цепи цистеина), или другими аминокислотными остатками, поддающимися ковалентной модификации, присутствующими в связывающем кармане целевого белка, и таким образом необратимо подавлять целевой полипептид. Следует понимать, что группа -L-Y, определение и описание которой дано ниже, дает такие группы боеголовок для ковалентного и необратимого ингибирования белка.
Термин "in silico" употребляется по отношению к компьютерным способам и процессам, например, таким как программы компьютерного моделирования, вычислительная химия, молекулярная графика, молекулярное моделирование и другие техники компьютерного моделирования.
В данном контексте, термин "программы компьютерного моделирования" относится к программному обеспечению, предназначенному для визуализации и проектирования малых молекул, включая, но не ограничиваясь ими, вычислительную химию, химическую информатику, расчеты энергии, моделирование белков и т.п. Профильным специалистам хорошо известны такие программы, некоторые из них упоминаются в данном документе.
В данном контексте, термин "выравнивание последовательностей" относится к такому расположению двух или более последовательностей белков или нуклеиновых кислот, которое позволяет сравнить их и установить их подобие (или различия). Способы и компьютерные программы для выравнивания последовательностей хорошо известны (напр., BLAST). Последовательности могут заполняться разрывами (как правило, обозначаются знаком тире) так, чтобы, где это возможно, колонки содержали идентичные или подобные знаки из последовательностей, которые подлежат выравниванию.
В данном контексте, термин "кристалл" относится к любой трехмерной упорядоченной последовательности/матрице молекул, которая преломляет рентгеновские лучи.
В данном контексте, термины "атомная система координат" и "структурная система координат" относятся к математической системе координат (представленной осями "X," "Y" и "Z"), с помощью которой описывается положение атомов в трехмерной модели/структуре model/structure или в экспериментальной структуре белка.
В данном контексте, термин "гомологичное моделирование" относится к методике производства моделей для трехмерных структур макромолекул на основе имеющихся трехмерных структур их гомологов. Гомологичные модели получают при помощи компьютерных программ, позволяющих изменять тип остатка в позиции, где последовательность исследуемой молекулы не совпадает с последовательностью молекулы с изученной / известной в науке структурой.
В данном контексте, "вычислительная химия" относится к расчетам физических и химических свойств молекул.
В данном контексте, "молекулярная графика" относится к двух- или трехмерным изображениям атомов, преимущественно на экране компьютера.
В данном контексте, "молекулярное моделирование" относится к способам и процедурам, которые могут быть воплощены на компьютере или без него, для создания одной или более моделей и, опционально, для прогнозирования связи структура-активность лигандов. Способы, применяемые при молекулярном моделировании, варьируются от молекулярной графики до вычислительной химии.
Изобретение касается алгоритмов и способов разработки необратимо действующих ингибиторов целевых полипептидов, таких как ферменты. Необратимые ингибиторы, разработанные с использованием настоящего изобретения, способны к сильному и избирательному ингибированию целевого полипептида. В целом, изобретение представляет собой рациональный алгоритм и способ разработки, в котором выбор разработки продиктован структурой целевого полипептида, структурой обратимого ингибитора целевого полипептида, а также особенностями взаимодействия обратимого ингибитора с целевым полипептидом. Необратимые ингибиторы, или предполагаемые необратимые ингибиторы, разработанные с использованием способов изобретения, включают матрицу или остов, к которому привязаны одна или более «боеголовок». Полученное соединение обладает связывающей способностью к целевому полипептиду и, однажды связавшись с ним, «боеголовка» реагирует с Цис-остатком в сайте связывания целевого полипептида и образует с ним ковалентную связь, что приводит к необратимому ингибированию целевого полипептида.
Изобретение содержит способ разработки ингибитора, который ковалентно связывает целевой полипептид. Способ содержит предоставление структурной модели обратимого ингибитора, привязанного к сайту связывания в целевом полипептиде. Обратимый ингибитор образует не-ковалентные контакты с сайтом связывания. В данном Изобретении при помощи структурной модели определен Цис-остаток в сайте связывания целевого полипептида, смежный с обратимым ингибитором, когда обратимый ингибитор связан с сайтом связывания. Также могут быть определены единичный Цис-остаток, все Цис-остатки или необходимое количество Цис-остатков, являющихся смежными с обратимым ингибитором, когда обратимый ингибитор связан с сайтом связывания.
В настоящем изобретении представлены структурные модели одного или более предполагаемых ингибиторов, разработанных для ковалентного связывания с целевым полипептидом. Предполагаемые ингибиторы содержат «боеголовку», которая связана с замещаемой позицией обратимого ингибитора. «Боеголовка» содержит реакционный химический функционал, способный или вступающий в реакцию и образующий ковалентную связь с тиоловой группой в боковой цепи Цис-остатка, и опционально -линкер, который позиционирует реакционный химический функционал в пределах длины связи одного из идентифицированных Цис-остатков в сайте связывания целевого полипептида. Определены замещаемые позиции обратимого ингибитора, результатом чего стало то, что реакционный химический функционал «боеголовки» располагается в пределах длины связи идентифицированного Цис-остатка в сайте связывания целевого полипептида, когда предполагаемый ингибитор связан с сайтом связывания.
Определение/установление, является ли предполагаемый необратимый ингибитор,содержащий «боеголовку», которая прикреплена к идентифицированной замещаемой позиции и находится в пределах длины связи идентифицированного Цис-остатка в сайте связывания целевого полипептида, когда предполагаемый ингибитор связан с сайтом связывания, вероятно, является ингибитором, который ковалентно связывает целевой полипептид, и предпочтительно является необратимым ингибитором целевого полипептида, производится путем формирования ковалентной связи между атомом серы Цис-остатка в сайте связывания и реакционным химическим функционалом «боеголовки», когда предполагаемый ингибитор связан с сайтом связывания. Длина ковалентной связи в пределах от приблизительно 2,1 ангстремов до около 1,5 ангстремов, или менее 2 ангстремов для связи, образованной между атомом серы Цис-остатка в сайте связывания и реакционным химическим функционалом «боеголовки», указывает на то, что предполагаемый ингибитор является ингибитором, который ковалентно связывает целевой полипептид.
Способ изобретения может применяться с использованием любых подходящих структурных моделей, таких как физические модели или, предпочтительнее, модели, полученные с помощью компьютерной графики. Способ можно применять с использованием ручного труда или автоматизированных процессов. Желательно, чтобы способ применялся in silico.
Как будет видно из более подробного описания, приведенного ниже, концептуально алгоритм и способ изобретения включают: А) предоставление мишени и обратимого ингибитора. В) идентификацию целевого цистеина. С) производство структурных моделей предполагаемых ингибиторов, содержащих «боеголовку», D) определение достижимости боеголовкой целевого цистеина и Е) формирование ковалентной связи.
А) Предоставление мишени и обратимого ингибитора
Изобретение включает предоставление структурной модели обратимого ингибитора, привязанного к сайту связывания в целевом полипептиде, в котором обратимый ингибитор образует не-ковалентные контакты с сайтом связывания. Может быть представлена и использована любая подходящая структурная модель обратимого ингибитора, привязанного к сайту связывания в целевом полипептиде. В общем, известный или уже существующий сильный обратимый ингибитор целевого полипептида используется для получения отправной точки (напр., матрицу или остов) для разработки ингибитора, который ковалентно связывает целевой полипептид с использованием настоящего изобретения. Например, если обратимый ингибитор целевого белка ранее был идентифицирован {напр., на основе научной литературы или при помощи любого общепринятого способа), известный обратимый ингибитор может использоваться для создания структурной модели целевого полипептида, образующего комплекс с ингибитором. Тем не менее, если потребуется, новый или ранее неизвестный обратимый ингибитор может использоваться для создания структурной модели целевого полипептида, образующего комплекс с ингибитором.
Алгоритм и способ настоящего изобретения может использоваться для разработки необратимых ингибиторов на основе любых подходящих обратимых ингибиторов, таких как сильные обратимые ингибиторы, слабые обратимые ингибиторы или обратимые ингибиторы умеренной силы. Например, как описано в Примере 8, алгоритм и способ изобретения может использоваться для увеличения силы обратимых ингибиторов путем разработки способности ковалентно связываться с целевым белком. В некоторых вариантах осуществления изобретения, алгоритм и способ задействуют структуру сильного обратимого ингибитора. В других вариантах осуществления изобретения, алгоритм и способ используются для улучшения силы путем разработки ковалентного связывания, и задействуют структуру ингибитора низкой или умеренной силы, такого как ингибитор с показателями IC50 или Кi на уровне ≥10 нМ, ≥100 нМ, между 1 мМ и около 10 нМ, между около 1 мМ и около 100 нМ, между около 100 мМ и 1 мМ, или между около 1 мМ и около 1 мМ.
Трехмерные структуры многих подходящих целевых полипептидов хорошо изучены и всегда доступны из открытых источников, таких как База данных белковых структур в Исследовательской коллаборатории структурной биоинформатики (RCSB PDB), доступная в режиме онлайн: www.pdb.org; см. также Н.М.Berman et al.,: Nucleic Acids Research, 28 pp.235-242 (2000) и www.rcsb.org), а также всемирная База данных белковых структур (wwPDB; Berman et al, Nature Structural Biology 10(12):980 (2003)). Неполный список подходящих целевых полипептидов, структуры которых имеются в Базе данных белковых структур, представлены в Табл. 1. Если необходимо, трехмерная структура целевого белка может быть получена при помощи любого приемлемого способа. Приемлемые способы определения структуры хорошо известны профильным специалистам, например спектроскопия ядерно-магнитного резонанса (ЯМР) жидкой фазы, спектроскопия ЯМР твердой фазы, рентгенокристаллография и т.п. (См., напр., Blow, D, Outline of Crystallography for Biologists. Oxford: Oxford University Press. ISBN 0-19-851051-9(2002)).
Структурные модели целевых полипептидов также могут быть получены при помощи общепринятых способов компьютерного моделирования, таких как гомологичное моделирование, или исследование фолдинга, основанное, например, на первичной и вторичной структурах белка. Приемлемые способы получения гомологичных моделей хорошо известны специалистам. (См., напр., John, В. and Sali, A. Nucleic Acids Res 31(14):3982-92 (2003)). Приемлемые программы для гомологичного моделирования включают, например, Modeler (компания Accelrys, Inc., Сан-Диего, США) и Prime (компания Schrodinger Inc., Нью-Йорк). Например, как описано в настоящем документе в Примере 3, гомологичная модель FLT3-киназы была получена на основе уже известной структуры киназы Авроры. Неполный список подходящих целевых полипептидов, информация о последовательностях которых общедоступна и которые могут быть использованы для получения гомологичных моделей, приведен в Табл. 2. Предпочтительные структурные модели производятся с использованием атомной системы координат для целевого полипептида, или, по крайней мере, сайта связывания целевого полипептида, в комплексе с обратимым ингибитором. Такие атомные координаты доступны в Базе данных белковых структур для многих целевых полипептидов, образующих комплекс с обратимыми ингибиторами, и могут определяться при помощи рентгенокристаллографии, спектроскопии ЯМР, с использованием гомологичного моделирования и т.п.
Таким же образом структурные модели обратимых ингибиторов - отдельно взятых или в комплексе с целевыми полипептидами, могут быть созданы на основе уже известных атомных координат или с использованием других приемлемых способов. Приемлемые способы и программы для «стыковки» (докинга) ингибиторов к целевым белкам хорошо известны специалистам. (См., напр., Perola et al., Proteins: Structure, Function и Bioinformatics 56:235-249 (2004).) В общем, если структура обратимого ингибитора, образующего комплекс с целевым полипептидом, неизвестна, то модель этого комплекса можно составить на основе возможного или предположительного типа связывания обратимого ингибитора. Профильный специалист без труда сможет назвать возможные или предположительные типы связывания для обратимых ингибиторов, например, основываясь на подобии структур обратимого ингибитора и другого ингибитора в уже известных типах связывания. Например, как описано в Примере 5, известна структура комплексов протеазы ВГС с боле чем 10-ю различными ингибиторами, кроме того, было обнаружено, что все ингибиторы имеют структурное сходство в своем типе связывания с протеазой. Основываясь на этих данных о вероятном типе связывания обратимого ингибитора V-1, авторы изобретения создали структурную модель комплекса ингибитора V-1 и протеазы ВГС, которая была успешно использована для разработки необратимо действующего ингибитора, который ковалентно связывается с Cysl 59 протеазой ВГС.
Структурная модель обратимого ингибитора, привязанного к сайту связывания в целевом полипептиде, является преимущественно компьютерной моделью. Компьютерные модели могут быть получены и визуализированы с помощью любого приемлемого программного обеспечения (ПО), например, VIDA™, ПО для визуализации, (компания OpenEye Scientific Software, Нью-Мексико, США), Insight II® или Discovery Studio®, программа для графического молекулярного моделирования (Accelrys Software Inc., Сан-Диего, Калифорния, США).
| Таблица 1 . | |
| Примеры целевых полипептидов, структура которых получена в Базе данных белковых структур (PDB) | |
| Целевой полипептид | Код PDB |
| ПРОТЕАЗА | |
| ПРОТЕАЗА ЧЕЛОВЕЧЕСКОГО ЦИТОМЕГАЛОВИРУСА | 2WPO |
| ПРОТЕАЗА ВИРУСА ГЕПАТИТА С NS3/4A | 2OС8 |
| ПРОТЕАЗА ГЕРПЕСА | 1АТ3 |
| ПРОТЕАЗА ГЕРПЕСВИРУСА, АССОЦИИРУЕМОГО С САРКОМОЙ КАПОШИ (KSHV) | 1FL1 |
| ПРОТЕАЗА ВИРУСА ВЕТРЯНОЙ ОСПЫ | 1VZV |
| ПРОТЕАЗА ВИРУСА ЭПШТЕЙНА-БАРР | 1O6Е |
| ПРОТЕОСОМА | 1JD2 |
| КАСПАЗА-1 | 1RWK |
| ПРОТЕИНКИНАЗЫ | |
| МЕК | 1S9J |
| ВТК | 1К2Р |
| CKIT | 1Т46 |
| FLT3 | 1RJB |
| VEGFR2 | 1YWN |
| ZAP70 | 1U59 |
| C-SRC | 2SRC |
| JAK3 | 1YVJ |
| FAK | 1МР8 |
| EGFR | 1М17 |
| FGFR | 2FG1 |
| GSK3B | 1R0E |
| JNK3 | 1PMQ |
| ЛИПИДКИНАЗЫ | |
| PI-3 киназа | 2CHW |
| ФОСФОДИЭСТЕРАЗЫ | |
| PDE5 | 1TBF |
| ДЕЗАЦЕТИЛАЗЫ | |
| HDAC8 | 1VKG |
| БЕЛКИ ТЕПЛОВОГО ШОКА | |
| HSP70 | 1S3X |
| СОПРЯЖЕННЫЕ С G-БЕЛКОМ РЕЦЕПТОРЫ | |
| БЕТА-АДРЕНЕРГИЧЕСКИЙ РЕЦЕПТОР | 2VT4 |
| ТРАНСФЕРАЗЫ | |
| ФАРНЕЗИЛТРАНСФЕРАЗА | 1JCQ |
| МЕТАЛЛОФЕРМЕНТЫ | |
| КАРБОАНГИДРАЗА | 1А42 |
| ЯДЕРНЫЕ ГОРМОНАЛЬНЫЕ РЕЦЕПТОРЫ | |
| АНДРОГЕННЫЙ РЕЦЕПТОР | 2АМВ |
| АЛЬФА ЭСТРОГЕННЫИ РЕЦЕПТОР | 1R5K |
| ДЕЛЬТА РЕЦЕПТОР, АКТИВИРУЕМЫЙ ПРОЛИФЕРАТОРОМ ПЕРОКСИСОМ | 1Y0S |
| Таблица 2. | |
| Примеры целевых полипептидов и номера доступа их последовательностей | |
| Целевой полипептид | Номер доступа последовательности |
| ZAP70 | P43403 |
| C-SRC | P12931 |
| ITK | NM_005546 |
| ВТК | SWS:BTK_HUMAN |
| RON | Q04912 |
| JNK3 | SWS:MK10_HUMAN |
| FGFR1 | NM_000604 |
| FGFR2 | NM_000141 |
| FGFR3 | M58051 |
| FGFR4 | L03840 |
| KDR(FLK1,VEGFR, VEGFR2) | NM_002253 |
| FLT1 | AF063657 |
| FLT3 | NM_004119 |
| C-KIT | X06182 |
| EGFR | SWS:EGRF_HUMAN |
| PDFGR-A | M21574 |
| PDGFR-B | J03278 |
| GSK3A | NM_019884 |
| GSK3B | P49841 |
| RON | NM_002447 |
| C-YES | M15990 |
| luka | AF012890 |
| Icky | AF080158 |
| ALK | NM_004304 |
| JAK1 | Р23458 |
| JAK2 | NM_004972 |
| JAK3 | AF513860 |
| TYK2 | Р29597 |
| JNK1 | L26318 |
| JNK3 | Р45984 |
| FAK | Q05397 |
| LIMK | NM_002314 |
| MEK1 | Q02750 |
| MEK2 | P36507 |
| MELK | NM_014791 |
| PBK | Q96KB5 |
| PDK2 | NM_016457 |
| PKR | P19525 |
| PLK | NM_004073 |
| Р13-КИНАЗА | Q9BZC8 |
| Протеаза вируса NS3/4A гепатита С | SWS:POLG_HCVJA |
| Протеаза вируса простого герпеса | GB:AAA92139 |
| Протеаза KSHV | GB:AAC05223 |
| Протеаза вируса ветряной оспы | SWS:VP40_VZVD |
| Протеаза вируса Эпштейна-Барр | SWS:VP40_EBV |
| Протеаза человеческого цитомегаловируса | SWS:VP40_HCMVA |
В) Идентификация целевого цистеина
Данное изобретение включает идентификацию Цис-остатка в сайте связывания целевого полипептида, смежного с обратимьм ингибитором, когда обратимый ингибитор связан с сайтом связывания. При помощи структурной модели целевого полипептида, образующего комплекс с обратимым ингибитором, идентифицируются Цис-остатки целевого полипептида, подходящие в качестве мишени для формирования ковалентной связи с «боеголовкой». Цис-остатки, подходящие в качестве мишени для формирования ковалентной связи с «боеголовкой», являются смежными по отношению к обратимому ингибитору в структурной модели. Цис-остатки, смежные с обратимым ингибитором в структурной модели, могут быть идентифицированы любым приемлемым способом для определения межмолекулярных расстояний. Профильным специалистам хорошо известны программные продукты для измерения межмолекулярных расстояний в компьютерных моделях, например, VIDA™, ПО для визуализации (OpenEye Scientific Software, Нью-Мексико, США), Discovery Studio, программа для визуализации (Accelrys, Inc., Сан-Диего, Калифорния, США) и т.п.
В одном примере определяется межмолекулярное расстояние {напр., в ангстремах) между всеми не-водородными атомами Цис-остатков в сайте связывания целевого полипептида и всеми не-водородными атомами обратимого ингибитора. Цис-остатки, смежные с обратимым ингибитором, хорошо поддаются идентификации по этим межмолекулярным расстояниям. Желательно, чтобы смежный Цис-остаток находился на расстоянии в пределах около 10 ангстремов, около 8 ангстремов или около 6 ангстремов от обратимого ингибитора.
При необходимости, Цис-остатки, смежные с обратимым ингибитором, можно идентифицировать, проведя анализ изменений на доступной поверхности Цис-остатков в целевых полипептидах. Сделать это можно, например, рассчитав площадь доступной поверхности Цис-остатков в целевых полипептидах (напр., сайт связ