Нитроимидазооксазины и их применения при противотуберкулезной терапии
Иллюстрации
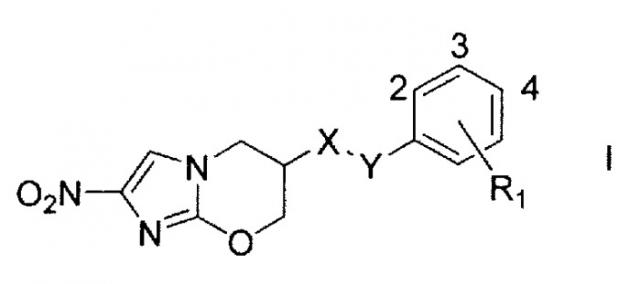
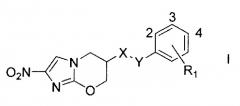
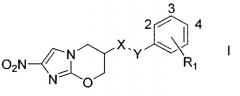
Показать всеИзобретение относится к области органической химии, а именно к производным нитроимидазооксазинам формулы I, где Х представляет собой О, ОСН2, ОСН2СН=СН или ОСН2С≡С; Y представляет собой группу любой из формул IIa-IIc, где означает место присоединения к X, и Z в формулах IIa-IIc представляет собой СН2, СН=СН, С≡С или прямую связь, числа 2, 3 и 4 являются положениями концевого кольца, имеющего R1 в качестве заместителя, концевое кольцо формулы I содержит С, СН или один атом азота в каждом положении кольца, и каждый из R1 и R2 в формулах I и IIa представляет собой один или два заместителя, расположенные в любом доступном положении кольца и независимо представляет собой Н, F, Cl, CF3, OCF2H, OCF3 или их комбинации. Также изобретение относится к фармацевтической композиции на основе соединения формулы I, способу лечения микробной инфекции, конкретным соединениям. Технический результат: получены новые соединения, полезные при лечении микробных инфекций, в т.ч. и при лечении заболеваний, вызванных Mycobacterium tuberculosis. 5 н. и 3 з.п. ф-лы, 28 ил., 3 табл., 3 пр.
Реферат
Предшествующий уровень техники
По данной заявке испрашивается приоритет на основании предварительной заявки на патент США с регистрационным № 61/230396, озаглавленной “Нитроимидазооксазины и их применения при противотуберкулезной терапии”, поданной 31 июля 2009 г., полное содержание которой таким образом включено посредством ссылки.
Изобретение относится к новым нитроимидазооксазинам, их получению и их применению в качестве лекарственных средств для лечения заболеваний, вызванных Mycobacterium tuberculosis и другими микробными инфекциями, либо отдельно, либо в комбинации с другими противоинфекционными лечениями.
Туберкулез остается основной инфекционной причиной смерти во всем мире (подсчитано, что смертность составляла 1,3 миллиона в 2008 г.) с недавним возрождением интереса к этому заболеванию в связи с повышенной восприимчивостью к нему у ВИЧ-пациентов, возрастающим распространением штаммов с множественной лекарственной резистентностью и появлением экстенсивно резистентных к лекарственным средствам штаммов. Современная лекарственная терапия туберкулеза является длительной и сложной, включающей комбинации многих лекарственных средств (обычно изониазида, рифампина, пиразинамида и этамбутола), даваемых пациенту ежедневно в течение свыше 6 месяцев. Кроме того, эти лекарственные средства являются относительно неэффективными против устойчивой формы данного заболевания, которая, как предполагается, имеет место в значительной части случаев (Ferrara et al., 2006). Лекарственные средства второго ряда, применяемые в продолжительных комбинированных терапиях для заболевания с множественной лекарственной резистентностью (обычно на протяжении 2 лет), большей частью имеют пониженную эффективность или более высокую токсичность, чем существующие средства первого ряда. Часто проводят незавершенное лечение, что приводит к высоким показателям рецидива и повышенной резистентности к лекарственному средству, поэтому существует настоятельная потребность в новых, более эффективных лекарственных средствах.
Задачей настоящего изобретения является обеспечение новых нитроимидазооксазинов с неожиданно высокой эффективностью против как аэробных (реплицирующих), так и гипоксических (латентных или персистентных) культур Mycobacterium tuberculosis и неожиданно высокой эффективностью на мышиных моделях инфицирования Mycobacterium tuberculosis для применения в качестве противотуберкулезных лекарственных средств и для лечения других болезней, вызванных микробными инфекциями.
Сущность изобретения
Данное изобретение относится к соединениям нитроимидазооксазина, способам их получения и применениям соединений для лечения туберкулеза и других болезней, вызванных микробными инфекциями.
Недавнее введение нитроимидазооксазина РА-824 в клиническое испытание является значимым, поскольку данное соединение проявляет хорошую активность in vitro и in vivo против Mycobacterium tuberculosis как в его активной, так и устойчивой формах (Tyagi et al., 2005). Родственный 2-нитроимидазо[2,1-b]оксазол, ОРС-67683, также находится в процессе клинического испытания (Sasaki et al., 2006). Структуры этих соединений показаны на фигуре 1. Без желания быть связанным с теорией, предполагают, что механизм действия РА-824 включает высвобождение оксида азота (Singh et al., 2008), последующую восстановительную стадию в процессе, зависящем от бактериальной глюкоза-6-фосфатдегидрогеназы (FGD1) и ее кофактора F420 (Stover et al., 2000). Исследования с микроанализами на мутантных штаммах дикого типа как FGD1, так и F420 показывают, что, как оказывается, белок с 151 аминокислотами (17,37 кДа) неизвестной функции, Rv3547, является критическим для этой активации (Manjunatha et al., 2006). Недавние механистические исследования восстановительной химии РА-824 поддерживают это утверждение (Anderson et al., 2008). Аналоги нитроимидазооксазина и их применение при туберкулезе были ранее описаны (патенты США №№ 5668127 (1997) и 6087358 (2000); Jiricek et al., WO 2007075872A2 (2007); Li et al., 2008; Kim et al., 2009).
В первом аспекте настоящее изобретение относится к соединению, имеющему общую структуру формулы I
где Х представляет собой O, OCH2, OCH2CH=CH или OCH2C≡C;
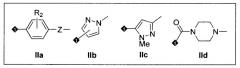
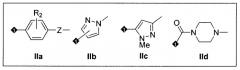
Y представляет собой группу любой из формул IIa-IId, показанных ниже, где означает место присоединения к Х;
Z в формуле IIa представляет собой CH2, CH=CH, С≡С или прямую связь; и
каждый из R1 и R2 в формулах I и IIa представляет собой один, два или три заместителя из H, F, Cl, CF3, OCF2H, OCF3, аза (-CH= заменен на -N=), или диаза (-CH=CH- заменен на -N=N-, -CH=CH-CH= заменен на -N=CH-N= или -CH=CH-CH=CH- заменен на -N=CH-CH=N-) в любом из доступных положений кольца.
Предпочтительный подкласс соединений имеет общую структуру указанной выше формулы I, где
Х представляет собой O, OCH2, OCH2CH=CH или OCH2C≡C;
Y представляет собой группу любой из формул IIa-IId, показанных ниже, где означает место присоединения к Х;
Z в формуле IIa представляет собой CH2, CH=CH, С≡С или прямую связь;
R1 в формуле I представляет собой 4-F или 4-OCF3 или 2-Cl, 4-OCF3 или 3-Cl, 4-OCF3 или 3-F, 4-OCF3 или 2-аза, 4-CF3 или 3-аза, 4-CF3 или 2-аза, 4-F;
R2 в формуле IIa представляет собой любую одну или две группы из Н, F или аза (-CH= заменен на -N=) в любом из доступных положений кольца.
Указанные соединения, а также их смеси, их изомеры, физиологические функциональные производные в форме солей и пролекарства являются применимыми при предотвращении или терапии для лечения заболеваний, вызванных Mycobacterium tuberculosis и другими микробными инфекциями.
Краткое описание чертежей
На фигуре 1 показаны структуры соединений РА-824 и ОРС-67683.
На фигуре 2 показаны общие структуры репрезентативных соединений, относящихся к таблице 1.
На фигуре 3 показана общая синтетическая схема получения репрезентативных соединений.
На фигуре 4 показана общая синтетическая схема получения репрезентативных соединений.
На фигуре 5 показана общая синтетическая схема получения репрезентативных соединений.
На фигуре 6 показана общая синтетическая схема получения репрезентативных соединений.
На фигуре 7 показана общая синтетическая схема получения репрезентативных соединений.
На фигуре 8 показана общая синтетическая схема получения репрезентативных соединений.
На фигуре 9 показана общая синтетическая схема получения репрезентативных соединений.
На фигуре 10 показана общая синтетическая схема получения репрезентативных соединений.
На фигуре 11 показана общая синтетическая схема получения репрезентативных соединений.
На фигуре 12 показана общая синтетическая схема получения репрезентативных соединений.
На фигуре 13 показана общая синтетическая схема получения репрезентативных соединений.
На фигуре 14 показана общая синтетическая схема получения репрезентативных соединений.
На фигуре 15 показана общая синтетическая схема получения репрезентативных соединений.
На фигуре 16 показана общая синтетическая схема получения репрезентативных соединений.
На фигуре 17 показана общая синтетическая схема получения репрезентативных соединений.
На фигуре 18 показана общая синтетическая схема получения репрезентативных соединений.
На фигуре 19 показана общая синтетическая схема получения репрезентативных соединений.
На фигуре 20 показана общая синтетическая схема получения репрезентативных соединений.
На фигуре 21 показана общая синтетическая схема получения репрезентативных соединений.
На фигуре 22 показана общая синтетическая схема получения репрезентативных соединений.
На фигуре 23 показана общая синтетическая схема получения репрезентативных соединений.
На фигуре 24 показана общая синтетическая схема получения репрезентативных соединений.
На фигуре 25 показана общая синтетическая схема получения репрезентативных соединений.
На фигуре 26 показана общая синтетическая схема получения репрезентативных соединений.
На фигуре 27 показаны структуры репрезентативных соединений 1-18, относящихся к таблице 1 и примерам 1-3.
На фигуре 28 показаны структуры репрезентативных соединений 19-33, относящихся к таблице 1 и примерам 1-3.
Подробное описание
Настоящее изобретение относится к соединениям нитроимидазооксазола, способам их получения и применению соединений для лечения туберкулеза и других микробных инфекций.
В первом аспекте настоящее изобретение относится к соединению, имеющему общую структуру формулы I
где Х представляет собой O, OCH2, OCH2CH=CH или OCH2C≡C;
Y представляет собой группу любой из формул IIa-IId, показанных ниже, где означает место присоединения к Х;
Z в формуле IIa представляет собой CH2, CH=CH, С≡С или прямую связь; и
каждый из R1 и R2 в формулах I и IIa представляет собой любой один, два или три заместителя из H, F, Cl, CF3, OCF2H, OCF3, аза (-CH= заменен на -N=), или диаза (-CH=CH- заменен на -N=N-, -CH=CH-CH= заменен на -N=CH-N= или -CH=CH-CH=CH- заменен на -N=CH-CH=N-) в любом из доступных положений кольца.
Предпочтительный подкласс соединений имеет общую структуру указанной выше формулы I, где
Х представляет собой O, OCH2, OCH2CH=CH или OCH2C≡C;
Y представляет собой группу любой из формул IIa-IId, показанных ниже, где означает место присоединения к Х;
Z в формуле IIa представляет собой CH2, CH=CH, С≡С или прямую связь;
R1 в формуле I представляет собой 4-F или 4-OCF3 или 2-Cl, 4-OCF3 или 3-Cl, 4-OCF3 или 3-F, 4-OCF3 или 2-аза, 4-CF3 или 3-аза, 4-CF3 или 2-аза, 4-F;
R2 в формуле IIa представляет собой любую одну или две группы из Н, F или аза (-CH= заменен на -N=) в любом из доступных положений кольца.
Наиболее предпочтительными соединениями, описываемыми формулой I, являются
А. (6S)-6-{[2'-хлор-4'-(трифторметокси)[1,1'-бифенил]-4-ил]метокси}-2-нитро-6,7-дигидро-5H-имидазо[2,1-b][1,3]оксазин (соединение 1 таблицы 1 и фигуры 27);
В. (6S)-6-{[3'-фтор-4'-(трифторметокси)[1,1'-бифенил]-4-ил]метокси}-2-нитро-6,7-дигидро-5Н-имидазо[2,1-b][1,3]оксазин (соединение 2 таблицы 1 и фигуры 27);
С. (6S)-2-нитро-6-{[4'-(трифторметокси)[1,1'-бифенил]-4-ил]метокси}-6,7-дигидро-5Н-имидазо[2,1-b][1,3]оксазин (соединение 3 таблицы 1 и фигуры 27);
D. (6S)-2-нитро-6-({5-[4-(трифторметокси)фенил]-2-пиразинил}метокси)-6,7-дигидро-5H-имидазо[2,1-b][1,3]оксазин (соединение 4 таблицы 1 и фигуры 27);
E. (6S)-6-{[6-(4-фторфенил)-3-пиридинил]метокси}-2-нитро-6,7-дигидро-5Н-имидазо[2,1-b][1,3]оксазин (соединение 5 таблицы 1 и фигуры 27);
F. (6S)-2-нитро-6-({6-[4-(трифторметокси)фенил]-3-пиридинил}метокси)-6,7-дигидро-5Н-имидазо[2,1-b][1,3]оксазин (соединение 6 таблицы 1 и фигуры 27);
G. (6S)-2-нитро-6({5-[4-(трифторметокси)фенил]-2-пиридинил}метокси)-6,7-дигидро-5Н-имидазо[2,1-b][1,3]оксазин (соединение 7 таблицы 1 и фигуры 27);
H. (6S)-2-нитро-6-({4-[5-(трифторметил)-2-пиридинил]бензил}окси)-6,7-дигидро-5Н-имидазо[2,1-b][1,3]оксазин (соединение 8 таблицы 1 и фигуры 27);
I. (6S)-2-нитро-6-({4-[6-(трифторметил)-3-пиридинил]бензил}окси)-6,7-дигидро-5Н-имидазо[2,1-b][1,3]оксазин (соединение 9 таблицы 1 и фигуры 27);
J. (6S)-2-нитро-6-({1-[4-(трифторметокси)фенил]-1H-пиразол-3-ил}метокси)-6,7-дигидро-5Н-имидазо[2,1-b][1,3]оксазин (соединение 10 таблицы 1 и фигуры 27);
K. (6S)-6-({1-метил-3-[4-(трифторметокси)фенил]-1H-пиразол-5-ил}метокси)-2-нитро-6,7-дигидро-5H-имидазо[2,1-b][1,3]оксазин (соединение 11 таблицы 1 и фигуры 27);
L. (6S)-6-{[3-Фтор-4'-(трифторметокси)[1,1'-бифенил]-4-ил]метокси}-2-нитро-6,7-дигидро-5H-имидазо[2,1-b][1,3]оксазин (соединение 12 таблицы 1 и фигуры 27);
M. (6S)-2-нитро-6-{[4'-(трифторметокси)[1,1'-бифенил]-4-ил]окси}-6,7-дигидро-5H-имидазо[2,1-b][1,3]оксазин (соединение 13 таблицы 1 и фигуры 27);
N. (6S)-6-({2-фтор-4-[5-(трифторметил)-2-пиридинил]бензил}окси)-2-нитро-6,7-дигидро-5Н-имидазо[2,1-b][1,3]оксазин (соединение 14 таблицы 1 и фигуры 27);
O. (6S)-6-{[2-фтор-4'-(трифторметокси)[1,1'-бифенил]-4-ил]метокси}-2-нитро-6,7-дигидро-5Н-имидазо[2,1-b][1,3]оксазин (соединение 15 таблицы 1 и фигуры 27);
P. (6S)-2-нитро-6-({2-[4-(трифторметокси)фенил]-5-пиримидинил}метокси)-6,7-дигидро-5H-имидазо[2,1-b][1,3]оксазин (соединение 16 таблицы 1 и фигуры 27);
Q. (6S)-2-нитро-6-({4-[4-(трифторметокси)бензил]бензил}окси)-6,7-дигидро-5Н-имидазо[2,1-b][1,3]оксазин (соединение 17 таблицы 1 и фигуры 27);
R. (6S)-2-нитро-6-[(5-{[4-(трифторметокси)фенил]этинил}-2-пиридинил)метокси]-6,7-дигидро-5H-имидазо[2,1-b][1,3]оксазин (соединение 18 таблицы 1 и фигуры 27);
S. (6S)-2-нитро-6-({(2E)-3-[4'-(трифторметокси)[1,1'-бифенил]-4-ил]-2-пропенил}окси)-6,7-дигидро-5Н-имидазо[2,1-b][1,3]оксазин (соединение 19 таблицы 1 и фигуры 28);
T. (6S)-2-нитро-6,7-дигидро-5Н-имидазо[2,1-b][1,3]оксазин-6-ил-4-[4-(трифторметокси)фенил]-1-пиперазинкарбоксилат (соединение 20 таблицы 1 и фигуры 28);
U. (6S)-6-({6-[3-фтор-4-(трифторметокси)фенил]-3-пиридинил}метокси)-2-нитро-6,7-дигидро-5H-имидазо[2,1-b][1,3]оксазин (соединение 21 таблицы 1 и фигуры 28);
V. (6S)-6-({5-[3-фтор-4-(трифторметокси)фенил]-2-пиридинил}метокси)-2-нитро-6,7-дигидро-5H-имидазо[2,1-b][1,3]оксазин (соединение 22 таблицы 1 и фигуры 28);
W. (6S)-6-({2-фтор-4-[6-(трифторметил)-3-пиридинил]бензил}окси)-2-нитро-6,7-дигидро-5Н-имидазо[2,1-b][1,3]оксазин (соединение 23 таблицы 1 и фигуры 28);
X. (6S)-2-нитро-6-({6-[4-(трифторметокси)фенил]-3-пиридазинил}метокси)-6,7-дигидро-5Н-имидазо[2,1-b][1,3]оксазин (соединение 24 таблицы 1 и фигуры 28);
Y. (6S)-2-нитро-6-[(5-{[6-(трифторметил)-3-пиридинил]этинил}-2-пиридинил)метокси]-6,7-дигидро-5Н-имидазо[2,1-b][1,3]оксазин (соединение 25 таблицы 1 и фигуры 28);
Z. (6S)-6-{[4-(5-фтор-2-пиридинил)бензил]окси}-2-нитро-6,7-дигидро-5Н-имидазо[2,1-b][1,3]оксазин (соединение 26 таблицы 1 и фигуры 28);
AA. (6S)-2-нитро-6-({1-[4-(трифторметокси)фенил]-1H-пиразол-4-ил}метокси)-6,7-дигидро-5H-имидазо[2,1-b][1,3]оксазин (соединение 27 таблицы 1 и фигуры 28);
BB. (6S)-6-({6-[3-хлор-4-(трифторметокси)фенил]-3-пиридинил}метокси)-2-нитро-6,7-дигидро-5H-имидазо[2,1-b][1,3]оксазин (соединение 28 таблицы 1 и фигуры 28);
CC. (6S)-2-нитро-6-({5-[4-(трифторметокси)фенил]-2-пиримидинил}метокси)-6,7-дигидро-5Н-имидазо[2,1-b][1,3]оксазин (соединение 29 таблицы 1 и фигуры 28);
DD. (6S)-2-нитро-6-({3-[4'-(трифторметокси)[1,1'-бифенил]-4-ил]-2-пропинил}окси)-6,7-дигидро-5H-имидазо[2,1-b][1,3]оксазин (соединение 30 таблицы 1 и фигуры 28);
EE. (6S)-2-нитро-6-[(4-{(E)-2-[4-(трифторметокси)фенил]этенил}бензил)окси]-6,7-дигидро-5Н-имидазо[2,1-b][1,3]оксазин (соединение 31 таблицы 1 и фигуры 28);
FF. (6S)-2-нитро-6-[(4-{[4-(трифторметокси)фенил]этинил}бензил)окси]-6,7-дигидро-5H-имидазо[2,1-b][1,3]оксазин (соединение 32 таблицы 1 и фигуры 28) и
GG. (6S)-2-нитро-6-[(6-{[4-(трифторметокси)фенил]этинил}-3-пиридинил)метокси]-6,7-дигидро-5Н-имидазо[2,1-b][1,3]оксазин (соединение 33 таблицы 1 и фигуры 28).
Соединения формулы I могут существовать в различных геометрических и энантиомерных формах, и как чистые формы, так и смеси этих отдельных изомеров включены в объем данного изобретения, а также включены их любые физиологически функциональные или фармацевтически приемлемые производные в виде солей или пролекарства. Получение этих альтернативных форм хорошо известно специалистам в данной области.
Настоящее изобретение относится также к способам предотвращения или терапии заболеваний, вызванных микробными инфекциями, такими как Mycobacterium tuberculosis, включающим стадию введения соединения формулы I.
В другом аспекте настоящего изобретения предложена фармацевтическая композиция, содержащая терапевтически эффективное количество соединения формулы (I), определенной выше, и фармацевтически приемлемый эксципиент, адъювант, носитель, буфер или стабилизатор. “Терапевтически эффективное количество” следует понимать как количество соединения формулы I, которое достаточно для проявления противобактериальных или противомикробных эффектов. Действительное количество, частота и курс по времени введения будет зависеть от природы и тяжести подвергаемого лечению заболевания. Указание по лечению находится в пределах обязанности обычных практикующих врачей и других врачей в области медицины. Фармацевтически приемлемый эксципиент, адъювант, носитель, буфер и стабилизатор должны быть нетоксичными и не должны препятствовать эффективности активного ингредиента. Точная природа носителя или другого вещества будет зависеть от пути введения, который может быть пероральным, или пути введения посредством инъекции, таким как кожная, подкожная или внутривенная инъекция, или пути введения посредством ингалятора с сухим порошком.
Фармацевтические композиции для перорального введения могут быть в форме таблетки, капсулы, порошка или жидкости. Таблетка может содержать твердый носитель или адъювант. Жидкие фармацевтические композиции обычно содержат жидкий носитель, такой как вода, нефтепродукт, животные или растительные масла, минеральное масло или синтетическое масло. Может быть включен физиологический солевой раствор, раствор декстрозы или другого сахарида или гликоли, такие как этиленгликоль, пропиленгликоль или полиэтиленгликоль. Капсула может содержать твердый носитель, такой как желатин. Для внутривенной, кожной или подкожной инъекции активный ингредиент может быть в форме парентерально приемлемого водного раствора, который свободен от пирогенов и имеет подходящий рН, изотоничность и стабильность. Соответствующие специалисты в данной области вполне способны приготовить подходящие растворы с применением, например, изотонических носителей, таких как раствор для инъекции хлорида натрия, раствор для инъекции Рингера, содержащий лактат раствор для инъекции Рингера. При необходимости можно включать консерванты, стабилизаторы, буферы, антиоксиданты и/или другие добавки.
Фармацевтическая композиция может дополнительно содержать одно или несколько дополнительных противоинфекционных лекарственных средств. Этими противоинфекционными лекарственными средствами могут быть любые подходящие лекарственные средства, доступные из коммерческих источников или из других источников, которые, как известно, эффективно предотвращают или лечат заболевания, вызванные микробными инфекциями, такими как заболевания, вызванные Mycobacterium tuberculosis.
В другом аспекте при изготовлении лекарственного средства предложено применение терапевтически эффективного количества соединения формулы I, определенной выше, для введения субъекту. Предложен также способ получения соединения формулы I.
Термин “фармакологически приемлемая соль”, применяемый на всем протяжении описания, следует принимать как значение любой являющейся производным кислоты или основания соли, образованной из хлористоводородной, серной, фосфорной, уксусной, лимонной, щавелевой, малоновой, салициловой, молочной, фумаровой, янтарной, аскорбиновой, малеиновой, метансульфоновой, изоэтоновой кислот и тому подобных и карбоната калия, гидроксида натрия или калия, аммиака, триэтиламина, триэтаноламина и тому подобных.
Термин “пролекарство” означает фармакологическое вещество, которое вводят в неактивной или значительно менее активной форме. После введения пролекарство в результате метаболизма in vivo преобразуется в активный метаболит.
Термин “терапевтически эффективное количество” означает нетоксичное, но достаточное количество лекарственного средства для обеспечения требуемого терапевтического действия. Количество, которое является “эффективным”, изменяется от субъекта к субъекту в зависимости от возраста и общего состояния индивидуума, конкретной концентрации, вводимой композиции и тому подобного. Поэтому не всегда можно указать точное эффективное количество. Однако подходящее эффективное количество в любом отдельном случае может определить средний специалист в данной области с применением обычного экспериментирования. Кроме того, эффективным количеством является концентрация, которая находится в диапазоне, достаточном для того, чтобы позволить легко применять препарат, так чтобы доставить количество лекарственного средства, которое находится в пределах терапевтически эффективного диапазона.
Термин “аза” означает группу -СН=, замененную в соединении группой -N=. Термин “диаза” означает в соединении группу -СН=СН, замененную на -N=N-, группу -СН=СН-СН=, замененную на -N=CH-N=, или -СН=СН-СН=СН-, замененную на -N=CH-CH=N-.
Дополнительные аспекты настоящего изобретения станут очевидными из нижеследующего описания, представленного посредством только примера и со ссылкой на сопутствующие синтетические схемы.
Пример 1. Общие синтетические схемы
Соединения можно получить общими способами, указанными на схемах 1-24, показанных на фигурах 3-26, или любым другим подходящим способом. В описании схем 1-24 ниже дана ссылка на репрезентативные соединения, показанные в таблице 1 ниже и на фигурах 2 и 27-28.
На схеме 1, показанной на фигуре 3, реагенты и условия были следующими: (i) 2 М Na2CO3, толуол, EtOH, Pd(dppf)Cl2 в атмосфере N2, 88°С, 1-2,5 час; (ii) 30% HBr/AcOH, 20°С, 6-11 час; (iii) NaH, ДМФА, 0-20°С, 3 час. Сочетания Сузуки 4-(гидроксиметил)фенилбороновой кислоты (34) с галогенидами 35 и 36 в присутствии Pd(dppf)Cl2 давали бифениловые спирты 37 и 38, которые превращали в соответствующие бромметилсоединения 39 и 40. Сочетание их с известным спиртом 41 (описано получение его в патенте США № 5668127 посредством 4 стадий, исходя из 2,4-динитроимидазола и трет-бутилдиметилсилил-(S)-глицидилового простого эфира) давало требуемые соединения 1 и 2 таблицы 1.
На схеме 2, показанной на фигуре 4, реагенты и условия были следующими: (i) NaH, ДМФА, 5-20°С, 2 час, (ii) 2 М K2CO3, толуол, EtOH, Pd(dppf)Cl2 в атмосфере N2, кипячение с обратным холодильником, 30 мин. Аналогичное сочетание с помощью NaH спирта 41 с 4-иодбензилбромидом (42) давало известный 4-иодбензиловый простой эфир 43 (описано получение в патенте США № 6087358 посредством такой же процедуры), который подвергали сочетанию Сузуки, как на схеме 1, с 4-(трифторметокси)фенилбороновой кислотой (44) с образованием соединения 3 таблицы 1.
На схеме 3, показанной на фигуре 5, реагенты и условия были следующими: (i) MsCl, Et3N, ТГФ, 0°С, 30 мин, затем NaI, ацетон, кипячение с обратным холодильником, 1 час; (ii) NaH, ДМФА, от -78 до 0°С, 1 час; (iii) 2 M K2CO3, толуол, EtOH, Pd(dppf)Cl2 в атмосфере N2, кипячение с обратным холодильником, 30 мин. Сочетание с помощью NaH спирта 41 с 2-хлор-5-(иодметил)пиразином (46) (получен из известного (5-хлор-2-пиразинил)метанола (45) (получен хлорированием и восстановлением 5-гидроксипиразин-2-карбоновой кислоты, как описано Kiener et al., 1994) реакцией с MsCl с последующей реакцией с NaI) давало хлорид 47. Это соединение подвергали сочетанию Сузуки с 4-(трифторметокси)фенилбороновой кислотой (44), получая при этом соединение 4 таблицы 1.
На схеме 4, показанной на фигуре 6, реагенты и условия были следующими: (i) NaH, ДМФА, 5-20°С, 16 час; (ii) 44, 2 М K2CO3, ДМФА, Pd(dppf)Cl2 в атмосфере N2, 90°С, 2 дня; (iii) NBS, PPh3, CH2Cl2, 20°С, 3,5 час; (iv) 41, NaH, ДМФА, 0-20°С, 2,5 час; (v) 55-57, 2 М Na2CO3, толуол, EtOH, Pd(dppf)Cl2 в атмосфере N2, 90°С, 20-120 мин; (vi) водн. NaNO2, 25% H2SO4, 0°С, 12 мин, затем водн. KI, 20°С, 10 мин, затем 52°С, 2 час; (vii) n-BuLi, B(OiPr)3, толуол, ТГФ, от -78 до -20°С, 5 час, затем 2 н. HCl. Сочетание с помощью NaH 2-хлор-5-(хлорметил)пиридина 48 со спиртом 41 давало хлорид 49, который подвергали сочетанию Сузуки с 4-(трифторметокси)фенилбороновой кислотой (44), получая при этом соединение 6 таблицы 1. Бромирование коммерчески доступного (6-бром-3-пиридинил)метанола (50) с NBS/PPh3 давало бромметилпиридин 51, который аналогично сочетали с применением NaH со спиртом 41, получая при этом бромид 52. Это соединение подвергали сочетанию Сузуки с бороновыми кислотами 55 (полученными из анилина 53 посредством нового иодида 54), 56 или 57, получая при этом соответствующие соединения 28, 21 и 5 таблицы 1.
На схеме 5, показанной на фигуре 7, реагенты и условия были следующими: (i) NaH, ДМФА, 5-20°С, 2 час; (ii) 44, 2 М K2CO3, толуол, EtOH, Pd(dppf)Cl2 в атмосфере N2, 90°С, 30 мин. Сочетание с помощью NaH 5-бром-2-(хлорметил)пиридина (58) (получен хлорированием (5-бром-2-пиридинил)метанола, как описано van den Heuvel et al., 2004) со спиртом 41 давало бромид 59, который подвергали сочетанию Сузуки с 4-(трифторметокси)фенилбороновой кислотой (44), получая при этом соединение 7 таблицы 1.
На схеме 6, показанной на фигуре 8, реагенты и условия были следующими: (i) NaH, ДМФА, 20°С, 1 час; (ii) бис(пинаколято)диборон, Pd(dppf)Cl2 в атмосфере N2, KOAc, ДМСО, 90°С, 1 час; (iii) 2-хлор-5-(трифторметил)пиридин или 5-бром-2-(трифторметил)пиридин, 2 М К2СО3, толуол, EtOH, Pd(dppf)Cl2 в атмосфере N2, кипячение с обратным холодильником, 30 мин. Бромид 61 получали сочетанием с помощью NaH спирта 41 с 4-бромбензилбромидом (60). Реакция 61 с бис(пинаколято)дибороном давала 4-боронатный эфир 62, который подвергали сочетанию Сузуки с 2-хлор-5-(трифторметил)пиридином или 5-бром-2-(трифторметил)пиридином, получая при этом соответственно соединения 8 и 9 таблицы 1.
На схеме 7, показанной на фигуре 9, реагенты и условия были следующими: (i) водный пиридин, -5°С, 30 мин; (ii) бицикло[2.2.1]гепта-2,5-диен, Et3N, толуол, 70°С, 1 час, затем ксилол, кипячение с обратным холодильником, 2 час; (iii) LiAlH4, Et2O, 0-20°С, 1 час, (iv) PBr3, Et2O, 20°С, 17 час; (v) 41, NaH, ДМФА, 0°С, 2 час. Этил-(2Z)-хлор-{[4-(трифторметокси)фенил]гидразоно}этаноат (65) [получен из тетрафторбората 4-(трифторметокси)бензолдиазония (63) и этил-2-хлорацетоацетата (64)] подвергали реакции с бицикло[2.2.1]гепта-2,5-диеном, получая при этом карбоксилат 66. Его восстанавливали (LiAlH4) в спирт 67, который затем бромировали PBr3, получая при этом бромид 68. Сочетание с помощью NaH со спиртом 41 затем давало соединение 10 таблицы 1.
На схеме 8, показанной на фигуре 10, реагенты и условия были следующими: (i) CuI, PdCl2(PPh3), сульфат метилгидразина, водный NaHCO3, ТГФ, 20°С, 2 дня в атмосфере СО; (ii) 4 н. HCl, ТГФ, 80°С, 16 час; (iii) PBr3, Et2O, 0-20°С, 16 час; (iv) 41, NaH, ДМФА, 0°С, 2 час. Пиразол 71 получали реакцией 2-(2-пропинилокси)тетрагидро-2H-пирана (69), 1-иод-4-(трифторметокси)бензола (70) и метилгидразина в присутствии CuI и PdCl2(PPh3)2 и в атмосфере СО. Гидролизом простого эфира ТНР 71 в спирт 72 с последующим бромированием при помощи PBr3 получали бромид 73, который подвергали сочетанию при помощи NaH со спиртом 41, получая при этом соединение 11 таблицы 1.
На схеме 9, показанной на фигуре 11, реагенты и условия были следующими: (i) NaH, ДМФА, 0-20°С, 3 час; (ii) ArB(OH)2, 2 М Na2CO3, толуол, EtOH, Pd(dppf)Cl2 в атмосфере N2, 85-90°С, 1-3 час; (iii) бис(пинаколято)диборон, Pd(dppf)Cl2 в атмосфере N2; KOAc, ДМСО, 89°С, 5 час; (iv) 2-хлор-5-(трифторметил)пиридин, 2 М Na2CO3, толуол, EtOH, Pd(dppf)Cl2 в атмосфере N2, 90°С, 120 мин. Сочетание при помощи NaH 4-бром-2-фторбензилбромида (74) со спиртом 41 давало бромид 75, который подвергали сочетанию Сузуки с подходящими арилбороновыми кислотами, получая при этом соединения 12 и 23 таблицы 1. Реакция бромида 75 с бис(пинаколято)дибороном давала боронатный эфир 76, сочетанием Сузуки которого с 2-хлор-5-(трифторметил)пиридином получали соединение 14 таблицы 1.
На схеме 10, показанной на фигуре 12, реагенты и условия были следующими: (i) кат. CsF, PhCH2OH, 120°С, 16 час; (ii) TIPSCl, имидазол, ДМФА, 20°С, 16 час; (iii) 4'-(трифторметокси)[1,1'-бифенил]-4-ол, DIAD, PPh3, бензол, 5-20°С, 18 час; (iv) Н2, 5% Pd-C, EtOAc, EtOH, 413685,6 Па (60 фунт/кв. дюйм), 4 час; (v) I2, PPh3, имидазол, бензол, 20°С, 1 час; (vi) 2-бром-4(5)-нитроимидазол, К2СО3, ДМФА, 87°С, 20 час; (vii) TBAF, ТГФ, 20°С, 1 час; (viii) NaH, ДМФА, 5-20°С, 30 мин. Реакция (S)-глицидного спирта (77) и бензилового спирта в присутствии CsF давала диол 78, который монозащищали TIPS-хлоридом, и образовавшийся спирт 79 подвергали сочетанию Мицунобу с 4'-(трифторметокси)[1,1'-бифенил]-4-олом (Edsall et al., 2003, описано получение его посредством сочетания Сузуки 4-бромфенола и бороновой кислоты 44), получая при этом простой эфир 80. Его дебензилировали гидрогенолизом и образовавшийся спирт 81 иодировали I2/PPh3, получая при этом 82. Это соединение сочетали с 2-бром-4(5)-нитроимидазолом и образовавшееся соединение 83 дебензилировали TBAF и кольцо замыкали при помощи NaH, получая при этом соединение 13 таблицы 1.
На схеме 11, показанной на фигуре 13, реагенты и условия были следующими: (i) NaBH4, I2, ТГФ, 0-20°С, 14 час; (ii) 30% HBr/AcOH, 20°С, 20 час; (iii) NaH, ДМФА, 0-20°С, 3,5 час; (iv) 2 M Na2CO3, толуол, EtOH, Pd(dppf)Cl2 в атмосфере N2, 90°С, 6 час. Сочетание при помощи NaH 4-бром-3-фторбензилбромида (86) (получен из кислоты 84 с помощью известного спирта 85 (описан deSolms et al., 2003, получен посредством восстановления бораном 84)) со спиртовым производным оксазина 41 давало бромид 87, который подвергали сочетанию Сузуки с 4-(трифторметокси)фенилбороновой кислотой (44), получая при этом соединение 15 таблицы 1.
На схеме 12, показанной на фигуре 14, реагенты и условия были следующими: (i) 44, водный Na2CO3, толуол, EtOH, Pd(PPh3)4 в атмосфере N2, кипячение с обратным холодильником, 18 час; (ii) n-BuLi, ТГФ, -95°С, 0,5 мин, затем ДМФА, -90°С, 20 мин; (iii) NaBH4, MeOH, 0°С, 1 час; (iv) MsCl, Et3N, ТГФ, 0°С, 1 час, затем LiBr, Me2CO, кипячение с обратным холодильником, 1 час; (v) 41, NaH, ДМФА, от -78 до 0°С, 1 час. Сочетание Сузуки бороновой кислоты 44 и 2-иод-5-бромпиримидина (88) давало бромид 89, который обрабатывали n-BuLi и ДМФА, получая при этом альдегид 90. Его восстанавливали NaBH4 в спирт 91, который подвергали реакции с MsCl с последующей реакцией с LiBr, получая при этом бромид 92. Сочетание 92 со спиртом 41 давало соединение 16 таблицы 1.
На схеме 13, показанной на фигуре 15, реагенты и условия были следующими: (i) 44, 2 М K2CO3, DME, Pd(PPh3)4 в атмосфере N2, 105°С, 24 час; (ii) LiAlH4, Et2O, 20°С, 3 час; (iii) PBr3, CH2Cl2, 20°С, 2 час; (iv) 41, NaH, ДМФА, 20°С, 3 час. Сочетание Сузуки метил-4-(бромметил)бензоата (93) и 4-(трифторметокси)фенилбороновой кислоты (44) давало метилбензоат 94. Его восстанавливали LiAlH4 в спирт 95, который давал бромид 96 при обработке PBr3. Сочетание данного бромида со спиртом 41 затем давало соединение 17 таблицы 1.
На схеме 14, показанной на фигуре 16, реагенты и условия были следующими: (i) НС≡CTMS, Et3N, ДМФА, CuI, PdCl2(PPh3)2 в атмосфере N2, 50°С, 18 час, затем TBAF, ТГФ, 0-20°С, 2 час; (ii) 70 или 98, Et3N, ДМФА, CuI, PdCl2(PPh3)2 в атмосфере N2, от 20 до 50°С, 0,5 час. Сочетание Соногашира бромида 59 (см. схему 5) с этинил-TMS в присутствии Et3N, CuI и PdCl2(PPh3)2 с последующим десилилированием при помощи TBAF давало ацетилен 97, который аналогично сочетали с 1-иод-4-(трифторметокси)бензолом (70) или 5-бромо-2-(трифторметил)пиридином (98), получая при этом соответственно соединения 18 и 25 таблицы 1.
На схеме 15, показанной на фигуре 17, реагенты и условия были следующими: (i) 44, диоксан, 2 М К2СО3, Pd(dppf)Cl2 в атмосфере N2, кипячение с обратным холодильником, 1 час; (ii) DIBAL-H, толуол, от -78 до 20°С, 1 час; (iii) PBr3, Et2O, 0-20°С, 1 час; (iv) NaH, ДМФА, от -78 до 0°С, 1 час. Бромид 99 подвергали сочетанию Сузуки с бороновой кислотой 44 (см. схему 3), получая при этом сложный эфир 100, который восстанавливали с помощью DIBAL-H в толуоле с получением спирта 101. Бромирование 101 с помощью PBr3 давало соединение 102, которое подвергали с помощью NaH сочетанию со спиртом 41, получая при этом соединение 19 таблицы 1.
На схеме 16, показанной на фигуре 18, реагенты и условия были следующими: (i) трифосген, Et3N, 0-20°С, 105 мин; (ii) ТГФ, 20°С, 2 час. Спирт 41 обрабатывали трифосгеном и сырой карбонилхлорид 103 подвергали непосредственно реакции с 1-[4-(трифторметокси)фенил]пиперазином (104), получая при этом соединение 20 таблицы 1.
На схеме 17, показанной на фигуре 19, реагенты и условия были следующими: (i) 56, 2 М Na2CO3, толуол, EtOH, Pd(dppf)Cl2 в атмосфере N2, 89°С, 2 час; (ii) NBS, PPh3, CH2Cl2, 20°С, 3 час; (iii) NaH, ДМФА, 0-20°С, 2,5 час. Сочетание Сузуки бромида 105 с бороновой кислотой 56 (см. схему 4) давало спирт 106, который бромировали NBS/PPh3, получая при этом соединение 107. Его сочетали с помощью NaH со спиртом 41 с получением соединения 22 таблицы 1.
На схеме 18, показанной на фигуре 20, реагенты и условия были следующими: (i) NaH, ДМФА, -42°С, 1 час; (ii) 44, 2 М К2СО3, толуол, EtOH, Pd(dppf)Cl2 в атмосфере N2, кипячение с обратным холодильником, 0,5 час. Реакция при низкой температуре спиртового оксазина 41 и 3-(бромметил)-6-хлорпиридазина (108) (получен посредством радикальной реакции бромирования 3-хлор-6-метилпиридазина, как описано Ohshita J., EP 1555259, 2005) давала хлорид 109, сочетанием Сузуки которого с бороновой кислотой 44 (см. схему 3) получали соединение 24 таблицы 1.
На схеме 19, показанной на фигуре 21, реагенты и условия были следующими: (i) 2 М Na2CO3, толуол, EtOH, Pd(dppf)Cl2 в атмосфере N2, 89°С, 200 мин; (ii) NBS, PPh3, CH2Cl2, 20°С, 3 час; (iii) 41, NaH, ДМФА, 0-20°С, 135 мин. Сочетание Сузуки бромида 110 с бороновой кислотой 34 давало спирт 111, который бромировали с получением соединения 112, которое затем сочетали со спиртом 41, получая при этом соединение 26 таблицы 1.
На схеме 20, показанной на фигуре 22, реагенты и условия были следующими: (i) водный NaOAc, AcOH, 100°С, 15 час; (ii) (СН3)2СН(СН2)2ONO, ТГФ, кипячение с обратным холодильником, 20 час; (iii) LiAlH4, Et2O, кипячение с обратным холодильником, 2 час; (iv) PBr3, Et2O, 0°С, 2 час; (v) 41, NaH, ДМФА, 0°С, 2 час. Реакция этил-(2Е)-2-циано-3-этокси-2-пропеноата 113 и гидразина 114 давала пиразолкарбоксилат 115, который деаминировали изоамилнитритом. Образовавшийся карбоксилат 116 восстанавливали в спирт 117, который затем бромировали PBr3, получая при этом соединение 118. Это соединение с помощью NaH подвергали сочетанию со спиртом 41, получая при этом соединение 27 таблицы 1.
На схеме 21, показанной на фигуре 23, реагенты и условия были следующими: (i) NBS, AIBN, CCl4, 60°С, 3 час; (ii) NaH, ДМФА, от -78 до 0°С, 0,5 час; (iii) 44, 2 М К2СО3, толуол, EtOH, Pd(dppf)Cl2 в атмосфере N2, кипячение с обратным холодильником, 0,5 час. Бромирование 5-бром-2-метилпиримидина (119) давало соединение 120, которое с помощью NaH сочетали со спиртом 41, получая при этом бромид 121. Сочетание Сузуки 121 с бороновой кислотой 44 (см. схему 3) давало соединение 29 таблицы 1.
На схеме 22, показанной на фигуре 24, реагенты и условия были следующими: (i) NaH, ДМФА, 0°С, 1 час; (ii) 44, 2 М К2СО3, толуол, EtOH, Pd(dppf)Cl2 в атмосфере N2, кипячение с обратным холодильником, 0,5 час. Сочетание с помощью NaH спирта 41 и 1-бром-4-(3-бром-1-пропинил)бензола (122) (получен в две стадии из 1-бром-4-иодбензола и пропаргилового спирта, как описано в WO 9524400) давало бромид 123, который сочетали реакцией Сузуки с бороновой кислотой 44, получая при этом соединение 30 таблицы 1.
На схеме 23, показанной на фигуре 25, реагенты и условия были следующими: (i) К2СО3, 18-краун-6, ТГФ, CH2Cl2, кипячение с обратным холодильником, 18 час; (ii) LiAlH4, Et2O, 0-20°С, 0,5 час; (iii) PBr3, CH2Cl2, 0-20°С, 1 час; (iv) 41, NaH, ДМФА, от -78 до 0°С, 1 час. Реакция Виттига альдегида 125 и фосфониевой соли 124 давала сложный эфир 126, который восстанавливали LiAlH4, получая при этом спирт 127. Бромирование 127 PBr3 давало соединение 128, сочетание которого при помощи NaH со спиртом 41 давало соединение 31 таблицы 1.
На схеме 24, показанной на фигуре 26, реагенты и условия были следующими: (i) НС≡CTMS, Et3N, ДМФА, CuI, PdCl2(PPh3)2 в атмосфере N2, 20°С, 0,5-18 час, затем TBAF, ТГФ, 0-20°С, 2 час; (ii) 70, Et3N, ДМФА, CuI, PdCl2(PPh3)2 в атмосфере N2, 20°С, 0,5 час. Сочетания Соногашира иодида 43 (см. схему 2) или бромида 52 (см. схему 4) с этинил-TMS в присутствии Et3N, CuI и PdCl2(PPh3)2 с последу