Каннабиноиды в комбинации с неканнабиноидными химиотерапевтическими агентами (например, смрэ или алкилирующими агентами)
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к онкологии, и может быть использовано для лечения глиомы головного мозга. Для этого предложена комбинация каннабиноидов - тетрагидроканнабинола (ТГК) и каннабидиола (КБД) и неканнабиноидного химиотерапевтического агента. Причем соотношение ТГК и КБД составляет от 5:1 до 1:5. Данная комбинация противоопухолевых средств обеспечивает эффективное уменьшение объема опухоли мозга за счет селективной гибели трансформированных клеток. 13 з.п. ф-лы, 2 табл., 8 ил.
Реферат
Настоящее изобретение относится к применению одного или более каннабиноидов в комбинации с неканнабиноидным химиотерапевтическим агентом для изготовления лекарственного средства для применения при лечении рака. В частности, для лечения рака, представляющего собой опухоль мозга, более конкретно, глиому, и еще более конкретно мультиформную глиобластому (GBM), а предпочтительными каннабиноидами являются тетрагидроканнабинол (ТГК), каннабидиол (КБД) или их комбинация.
Уровень техники
Рак представляет собой заболевание, при котором группа клеток характеризуется неконтролируемым ростом. Это означает, что рост и деление клеток превышают нормальные показатели. Клетки также способны поражать и разрушать окружающие ткани. Кроме того, раковые клетки также иногда метастазируют, что означает, что они попадают в другие части тела через кровь или лимфу.
Большинство видов рака вызвано нарушениями в генетическом материале клеток. Такие нарушения могут происходить под воздействием канцерогенных веществ. Другие генетические нарушения, вызывающие рак, могут быть приобретены случайно из-за ошибок при репликации ДНК или могут быть унаследованы и, таким образом, присутствуют во всех клетках с рождения.
Генетические нарушения, обнаруженные при раке, как правило, затрагивают два основных класса генов. Онкогены, вызывающие рак, часто активируются в раковых клетках, и эти клетки приобретают новые свойства, такие как гиперактивный рост и деление, защита против программируемой гибели клеток, несоблюдение нормальных границ тканей и способности оставаться постоянными при разнообразии окружающих тканей.
Гены-супрессоры опухолей часто инактивированы в раковых клетках, что приводит к подавлению нормальных функций этих клеток, таких как точная репликация ДНК, контроль цикла клетки, ориентация и адгезия в тканях и взаимодействие с защитными клетками иммунной системы.
Существует много различных видов рака и рак обычно классифицируют по типу ткани, из которых он возникает.
Лечение рака обычно проводят одним или более из следующего: хирургия, химиотерапия, лучевая терапия, иммунотерапия и терапия моноклональными антителами. Вид терапии зависит от места и вида опухоли и стадии заболевания.
Полное удаление рака без повреждения остальных частей тела является целью лечения. Иногда это может быть достигнуто хирургией, но часто ее эффективность ограничивается способностью рака поражать смежные ткани или распространяться в отдаленные участки микроскопическими метастазами. Эффективность химиотерапии часто ограничивается токсичностью в отношении других тканей тела. Излучение также может причинить вред нормальным тканям.
Рак, как известно, поражает различные органы тела и наиболее распространенные виды рака включают: рак желчного протока, рак мочевого пузыря, рак кости, рак кишечника (включая рак ободочной кишки и рак прямой кишки), рак мозга, рак груди, рак нейроэндокринной системы (обычно известный как карциноид), рак шейки матки, рак глаза, рак пищевода, рак головы и шеи (эта группа включает карциномы, которые начинаются в клетках, которые формируют покров рта, носа, горла, уха или поверхностного слоя, покрывающего язык), саркома Капоши, рак почки, рак гортани, лейкемию, рак печени, рак легкого, рак лимфатических узлов, лимфому Ходжкина, неходжкинскую лимфому, меланому, мезотелиому, миелому, рак яичника, рак поджелудочной железы, рак пениса, рак простаты, рак кожи, саркома мягкой ткани, рак спинного мозга, рак желудка, рак яичка, рак щитовидной железы, рак влагалища, рак вульвы и рак матки.
Опухоль, которая развивается в мозге, может разрушить или повредить клетки мозга, приводя к воспалению, сжимая другие части мозга, вызывая церебральный отек (набухание головного мозга), и может вызвать увеличение внутричерепного давления (давление в черепе).
Каждый год, приблизительно 4300 человек, в Великобритании ставят диагноз - опухоль мозга. Первичная опухоль мозга представляет собой образование, образованное ростом или бесконтрольной пролиферацией клеток в мозге. Злокачественные первичные опухоли мозга, наиболее вероятно, вызовут проблемы при распространении в окружающие нормальные ткани мозга, и будут оказывать давление и вызовут повреждение окружающих областей мозга. Эти опухоли редко распространяются за пределы мозга в другие части тела. Однако возникновение вторичных опухолей мозга происходит при попадании раковых клеток из других частей тела, таких как легкое или грудь, в мозг.
Хирургия является лечением выбора для многих опухолей мозга. Некоторые могут быть удалены оперативно полностью, но глубокие или представляющие собой инфильтрат тканей мозга могут быть только уменьшены в объеме, но не удалены.
Лучевая терапия и химиотерапия могут быть рекомендованы в зависимости от типа имеющейся опухоли.
Глиомные опухоли часто могут быть смертельными. Свойство распространения инфильтративного роста глиомной опухоли часто делает удаление хирургическими методами невозможным, что сильно усложняет клиническое воздействие на этих пациентов.
Мультиформная глиобластома (GBM) является самым распространенным и самым агрессивным видом первичной опухоли мозга и составляет 52% от всех случаев первичных опухолей мозга и 20% от всех внутричерепных опухолей.
Исследуются различные подходы для снижения смертности пациентов с диагнозом глиома. Эти подходы включают методы терапии, направленные на клетки глиомы, при этом не повреждающие нормальные клетки, методы, ограничивающие распространение раковых клеток, и методы воздействия, которые блокируют молекулы, необходимые для поддержания опухоли.
Одно из исследований в этой области включает применение каннабиноидов в качестве противоопухолевых агентов.
Каннабиноиды представляют собой активные компоненты растений конопли, и было обнаружено, что они проявляют широкий ряд фармакологических свойств.
Например, в EP1177790 (Guzman et al.) описано лечение опухолей головного мозга путем введения природного или синтетического каннабиноида, более конкретно, ТГК. Заявлено, что активация специфичных рецепторов приводит к селективной смерти трансформированных клеток.
Недавно было показано, что каннабиноид КБД проявляет противоопухолевые свойства (Massi et al. 2004). Работа, представленная в этом документе, описывает антипролиферативное действие как in vitro на линиях клеток глиомы человека U87 и U373, так и in vivo на клетках глиомы человека U87, подкожно введенных безтимусным мышам.
В Biochemical Pharmacology 2000, vol 6, p. 1807-1813, сравнивались эффекты каннабиноидов, включающих ТГК и КБД, с модулятором эстрогенового рецептора тамоксифеном, и в результате было показано, что эффект, оказываемый каннабиноидами, слабый и что отсутствовало какое-либо значительное взаимодействие между ними и тамоксифеном.
Злокачественные глиомы представляют собой весьма инфильтративные и пролиферативные опухоли с характерной структурой роста. Глиомные клетки попадают в смежные нормальные структуры мозга и окружают большие кровеносные сосуды.
Кроме того, более ранний патент заявителей EP1802274 описывает применение каннабиноида КБД для замедления прогресса раковых клеток, мигрирующих из первичного места опухоли к вторичному участку.
Находящаяся одновременно на рассмотрении заявка GB 0810195.8, поданная 4 июня 2008, описывает применение комбинации каннабиноидов для лечения рака.
Раскрытие изобретения
В соответствии с настоящим изобретением, предлагается применение одного или более каннабиноидов в комбинации с неканнабиноидным химиотерапевтическим агентом для изготовления лекарственного средства для применения при лечении рака.
Предпочтительно один или более каннабиноидов выбираются из группы, состоящей из: тетрагидроканнабинола (ТГК); и каннабидиола (КБД).
В одном варианте осуществления, используется единственный или в основном единственный каннабиноид. Единственный каннабиноид является или ТГК или КБД.
Альтернативно и предпочтительно, может использоваться комбинация каннабиноидов.
Комбинация каннабиноидов предпочтительно представляет ТГК и КБД.
Предпочтительно, соотношение ТГК и КБД составляет от 20:1 до 1:20.
Более предпочтительно, соотношение ТГК и КБД составляет от 5:1 до 1:5.
Еще более предпочтительно, соотношение ТГК и КБД составляет от 2:1 до 1:2, более приблизительно 1:1.
Каждый каннабиноид присутствует в количестве, обеспечивающем терапевтическое действие. Диапазоны доз ТГК и КБД могут быть определены по содержанию каннабиноидов, которое находится предпочтительно в диапазоне от 5 до 100 мг общего количества каннабиноидов. Если используется несколько каннабиноидов, то каждый может быть использован в количестве, составляющем менее оптимального, как если он использовался отдельно.
В одном варианте осуществления, неканнабиноидный химиотерапевтический агент представляет собой селективный модулятор эстрогенового рецептора.
Селективные модуляторы эстрогенового рецептора представляют собой класс лекарственных средств, которые действуют на эстрогеновый рецептор. Их действие различно в различных тканях, таким образом, представляется возможность выборочно ингибировать или стимулировать эстроген-подобное действие на различные ткани.
Селективные модуляторы эстрогенового рецептора включают: афимоксифен (4-гидрокситамоксифен); арзоксифен; базедоксифен; кломифен; лазофоксифен; ормелоксифен; ормелоксифен; ралоксифен; тамоксифен или торемифен, и они применяются при различных медицинских показаниях.
Некоторые селективные модуляторы эстрогенового рецептора, применяемые в качестве противоопухолевых агентов, включают ралоксифен, тамоксифен или торемифен. Они предпочтительны для использования в настоящем изобретении.
В альтернативном варианте осуществления, неканнабиноидный химиотерапевтический агент может являться алкилирующим агентом.
Алкилирующий агент представляет собой противоопухолевый агент, который оказывает свое действие при взаимодействии с ДНК несколькими путями.
Дополнительные молекулы, называемые алкильными группами, присоединяются к ДНК, что приводит к их разрушению, поскольку клетка пытается заменить их. Алкилирующие агенты также взаимодействуют со связями между нитями ДНК, препятствуя их разделению, необходимой стадией для репликации ДНК. Заменяя основания (важные компоненты ДНК), алкилирующие агенты также создают ошибки спаривания, что представляет собой другой способ остановить ДНК, воспроизводимую должным образом.
Все эти изменения происходят, когда клетка готовится к делению, и созданное перманентное повреждение приводит к прекращению деления и гибели клетки.
Предпочтительный алкилирующий агент выбирается из группы, состоящей из: алкилированных сульфонатов; бифульфана; этилениминов и метилениминов; гексаметилмеламина; алтретамина; тиотепы; азотистых ипритов; циклофосфамида; мехлоретамина; мустина; урамустина; урацилового производного иприта; мелфалана; хлорамбуцила; ифосфамида; нитромочевин; кармустина; цисплатина; стрептозоцина; триазенов; декарбазина; имидазотетразинов; и темозоломида.
Алкилирующие агенты, применяемые в качестве противоопухолевых агентов, включают: цисплатин, темозоломид и кармустин, и они предпочтительны в настоящем изобретении.
Рак, который требует лечения, может представлять собой опухоль мозга.
Опухоли мозга обычно классифицируют в соответствии с местоположением опухоли и типом клеток, из которой происходит рак.
Например, различные виды опухолей мозга включают: акустическую неврому, астроцитому, лимфому ЦНС, эпендимому, гемангиобластому, медуллобластому, менингиому, глиому, смешанную глиому, олигодендроглиому, опухоли шишковидных областей и опухоли гипофиза.
Глиомы представляют собой опухоли глиальных клеток; эти клетки поддерживают и защищают нервные клетки мозга. Глиомы составляют почти половину всех первичных опухолей мозга и одну пятую ото всех первичных опухолей спинного мозга.
Комбинированная терапия по изобретению особенно полезна, в случае если опухоль мозга представляет собой глиомную опухоль, более конкретно, мультиформную глиобластому (GBM).
Один или более каннабиноидов могут присутствовать в форме растительных экстрактов, чистых соединений или как комбинация из указанных форм.
Растительный экстракт представляет собой экстракт из растительного материала, как указано в Guidance for Industry Botanical Drug Products Draft Guidance, August 2000, US Department of Health and Human Services, Food and Drug Administration Centre for Drug Evaluation and Research.
Растительный материал представляет собой растение или часть растения (например, кора, древесина, листья, стебли, корни, цветы, плоды, семена, ягоды или их части), а также экссудаты.
Более предпочтительно, растительный экстракт представлен в форме растительного лекарственного средства.
Растительное лекарственное средство определено следующим образом. Растительные лекарственные средства, которые получены из растений конопли, включают первичные экстракты, полученные такими методами, как, например, мацирация, перколяция, экстракция растворителями, такими как C1-C5 спирт (например, этанол), норфлуран (HFA134a), HFA227, экстракция сжиженным углекислым газом под давлением и с использованием горячего газа. Первичный экстракт может быть дополнительно очищен суперкритической или докритической экстракцией, выпариванием и хроматографией. Если используются указанные растворители, то полученный экстракт может содержать неспецифичные жирорастворимые вещества. Они могут быть удалены разными методами, включая воздействие холодом (winterisation), которое включает охлаждение до -20°C с последующей фильтрацией для удаления восковых балластных веществ, экстракцию сжиженным углекислым газом и перегонку.
Из растительных лекарственных средств получают растительные лекарственные продукты, определение которых приведено в Guidance for Industry Botanical Drug Products Draft Guidance, August 2000, US Department of Health and Human Services, Food and Drug Administration Centre for Drug Evaluation and Research, и является следующим: "растительный продукт, который предназначен для применения в качестве лекарственного средства; лекарственный продукт, который приготовлен из растительного лекарственного средства".
Один или более каннабиноидов могут быть введены раздельно, последовательно или одновременно с неканнабиноидным противоопухолевым агентом.
Один или более каннабиноидов могут присутствовать вместе с неканнабиноидным химиотерапевтическим агентом в форме набора вместе с инструкцией к применению или без нее.
Далее описаны конкретные варианты настоящего изобретения посредством примеров с привлечением соответствующих фигур, где:
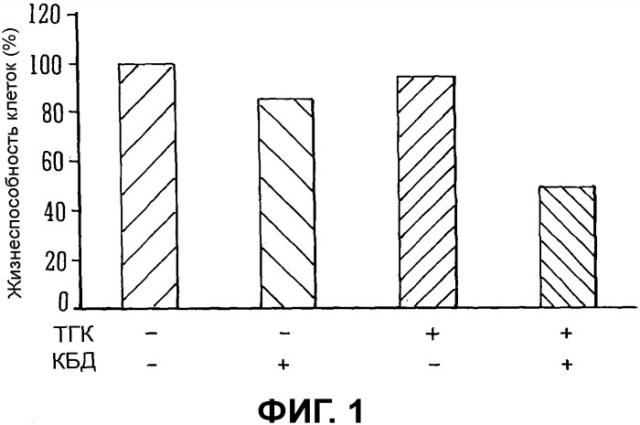
Фиг.1 представляет собой гистограмму, на которой показана жизнеспособность клеток астроцитомы человека MG U87 после обработки ТГК, КБД или комбинацией ТГК и КБД по сравнению с контролем;
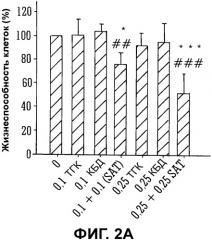
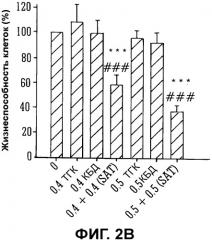
Фиг.2A и 2B представляют собой гистограммы, на которых показаны данные жизнеспособности клеток in vivo при различных концентрациях на двух линиях клеток, U87MG (Фиг.2A) и T98G (Фиг.2B);
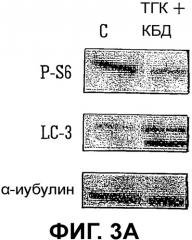
На Фиг.3A, 3B и 3C показаны данные о предполагаемом механизме действия комбинации на клетки U87MG;
Фиг.4 представляет собой гистограмму, на которой показана жизнеспособность клеток астроцитомы человека U87 MG после обработки обычным каннабиноидом, ТГК или комбинацией обычного каннабиноида ТГК и обычного неканнабиноидного противоопухолевого агента, тамоксифена, по сравнению с контролем; и
Фиг.5 представляет собой гистограмму, на которой показана жизнеспособность клеток астроцитомы человека U87 MG после обработки обычным каннабиноидом ТГК или комбинацией обычного каннабиноида ТГК и обычного неканнабиноидного противоопухолевого агента, цисплатина, по сравнению с контролем.
Осуществление изобретения
В нижеследующих примерах 1-5 показана эффективность одного или более каннабиноидов при лечении раковых клеток как in vitro, так и in vivo.
В примере 6, где в иллюстративных целях использовали один каннабиноид, показано, что комбинация одного или более каннабиноидов с неканнабиноидным противоопухолевым агентом может быть лучше, чем применение только неканнабиноидного противоопухолевого агента.
Пример 1: Эффект ТГК и КБД при ингибировании роста раковой клетки in vitro.
Тетрагидроканнабинол (ТГК) и каннабидиол (КБД) в форме растительных экстрактов конопли растворяли в этаноле до концентрации 100 мМ, хранили при -20°C до момента использования.
Перед использованием растительные экстракты конопли дополнительно разбавляли до требуемой концентрации, при этом обеспечивали концентрацию этанола ниже 0,001%.
В этом эксперименте использовали клетки глиомы человека U87. Клетки хранили при 37°C в увлажненной среде 5% CO2 и 95% воздуха.
Клетки культивировали в колбе для культур на 75 см2 в модифицированной по способу Дульбекко среде Игла (DMEM), в которую добавляли 4 мМ L-глютамина, 100 единиц/мл пенициллина, 100 мг/мл стептомицина, 1% пирувата натрия, 1% заменимых аминокислот и 10% термоинактивированной эмбриональной коровьей сыворотки.
Жизнеспособность клеток астроцитомы человека U87 MG исследовали при различных концентрациях каннабиноида. Экстракты ТГК и КБД сравнивали с чистыми ТГК и КБД.
Результаты:
| Таблица 1Жизнеспособность клеток астроцитомы человека U87 MG в культуре | |||
| IC50 мкМ(чистые каннабиноиды) | IC50 мкМ(растительный экстракт конопли) | IC50 (эквивалентное количество чистого в растительном экстракте конопли) | |
| ТГК | 0,37 | 0,64 | 0,43 |
| КБД | 0,47 | 0,72 | 0,47 |
Как видно из Таблицы 1, приведенной выше, экстракты ТГК и КБД более благоприятны при сравнении активностей с соответствующим чистыми соединениями, если количество каннабиноида в экстракте доведено до эквивалентного количества чистого соединения.
Это показывает, что ТГК и КБД и их экстракты эффективны при ингибировании роста клеток глиомы.
Пример 2: Эффект комбинации экстрактов ТГК и КБД при ингибировании роста раковых клеток in vitro.
В этом эксперименте исследовали, будут ли комбинации экстрактов ТГК и КБД, такими же эффективными при ингибировании роста клетки, как экстракты по отдельности.
Методы исследования аналогичны, описанным в примере 1 выше.
Результаты:
На Фиг.1 изображена гистограмма, показывающая жизнеспособность клеток астроцитомы человека U87 MG в отношении экстрактов ТГК и КБД по отдельности и в комбинации друг с другом.
Как видно, при применении ТГК и КБД в комбинации жизнеспособность клеток значительно снижалась по сравнению с жизнеспособностью клеток после обработки ТГК и КБД по отдельности.
На основании этих данных можно предположить, что каннабиноиды ТГК и КБД были бы более эффективны при лечении опухолей в случае применения в комбинации.
Пример 3: Эффект комбинации ТГК и КБД при ингибировании роста раковой клетки in vivo.
В этом эксперименте исследовали, будет ли комбинация экстрактов ТГК и КБД также эффективна in vivo.
Клетки астроцитомы человека U87 MG ксенотрасплантировали безтимусным мышам и вводили исследуемые соединения в опухоль в концентрации 15 мг/кг в день.
Результаты:
| Таблица 2Объем опухоли через 15 дней после обработки по отношению к начальному моменту времени | |
| Объем опухоли | |
| Носитель | 9,2±0,6 |
| Чистый ТГК | 5,1±0,4 |
| Экстракт ТГК | 6,6±0,3 |
| Экстракт ТГК:КБД (1:1) | 4,8±0,3 |
Как видно из Таблицы 2, объем опухоли после обработки комбинацией экстрактов 1:1 ТГК и КБД значительно снизился по сравнению с обработанными чистым ТГК или только экстрактом ТГК.
На основании этих данных можно предположить, что каннабиноиды ТГК и КБД будут более эффективны при лечении опухолей при применении в комбинации.
Пример 4: Влияние концентрации каннабиноида на жизнеспособность клеток на двух разных линиях клеток.
Действие ТГК, КБД и смеси ТГК и КБД в соотношении 1:1 исследовали при изменении концентраций на двух линиях клеток: U87MG и T98G. Данные жизнеспособности клеток показаны на Фиг.2A и 2B.
По данным Фиг.2A видно, что неэффективная/субоптимальная дозы ТГК и КБД, составляющие 0,1 мкг/мл и 0,25 мкг/мл (более чем 90% жизнеспособности клеток), уступали статистически значимому уменьшению жизнеспособности клетки в случае комбинации (SAT), где данные показывают дозозависимые свойства с увеличением концентрации (большая цитотоксичность при 0,25 мкг/мл).
Подобные результаты были получены на клеточной линии T98G, (альтернативная линия клеток глиомы человека), как показано на Фиг.2B.
Пример 5: Изучение механизма действия.
ТГК, как известно, вызывает гибель клетки посредством сигнального пути, включающего ген ATG1 и панкаспазу. Результаты исследования, показывающие фосфориляцию S6, липидизацию LC3 и действие ATG1 и ингибитора панкаспаз, показаны на Фиг.3A, 3B и 3C соответственно.
Из Фиг.3A видно, что комбинация ТГК:КБД (при сравнении с контролем C):
- ингибирует mTORC1 активность (как определено по уровню фосфориляции S6); и
- вызывает накопление липидизированной формы LC3 (проба аутофагии).
На Фиг.3B показано, что подавление экспрессии (сайленсинг) аутофагии, присущей гену ATG1, селективным (siATG10) siRNA ингибитором уменьшает индуцированную гибель клеток по сравнению с клетками, трансфецированными контролем siC.
Наконец, на Фиг.3c показано, что клетки, обработанные ингибитором панкаспаз, Z-VAD, также предотвращают индуцированную гибель - смерть клетки.
Пример 6: Эффект экстракта обычного каннабиноида в комбинации с обычными неканнабиноидными противоопухолевыми агентами на ингибирование роста раковой клетки in vitro.
В этом эксперименте исследовали действие лекарственного средства, содержащего каннабиноид, в комбинации с неканнабиноидными противоопухолевыми агентами.
Исследование жизнеспособности клеток выполняли как описано в примере 1 выше.
Результаты:
На Фиг.4 и 5 представлены гистограммы, на которых показана жизнеспособность клеток астроцитомы человека U87 MG, обработанные ТГК, противоопухолевым агентом или комбинацией этих двух по сравнению с контролем.
Как видно из этих фигур, оба исследуемых обычных антипротивоопухолевых агента, тамоксифен и цисплатин, были более эффективными в снижении жизнеспособности клеток при применении в комбинации с обычным каннабиноидом, ТГК. Данные примеров 1-5 подтверждают, что подобные эффекты должны были ожидаться с КБД и комбинацией ТГК и КБД.
Примеры 1-6 демонстрируют, что комбинация одного или более каннабиноидов с неканнабиноидным противоопухолевым лекарственным средством более эффективна, чем применение только неканнабиноидного противоопухолевого лекарственного средства.
1. Комбинация каннабиноидов тетрагидроканнабинола (ТГК) и каннабидиола (КБД) в соотношении от 5:1 до 1:5 и неканнабиноидного химиотерапевтического агента для лечения глиомы.
2. Комбинация каннабиноидов тетрагидроканнабинола (ТГК) и каннабидиола (КБД) по п.1, где лечение опухоли мозга заключается в снижении жизнеспособности клеток, ингибировании роста клеток или уменьшении объема опухоли.
3. Комбинация каннабиноидов тетрагидроканнабинола (ТГК) и каннабидиола (КБД) по любому из предшествующих пунктов, где соотношение ТГК и КБД составляет от 2:1 до 1:2.
4. Комбинация каннабиноидов тетрагидроканнабинола (ТГК) и каннабидиола (КБД) по любому из предшествующих пунктов, где соотношение ТГК и КБД составляет приблизительно 1:1.
5. Комбинация каннабиноидов тетрагидроканнабинола (ТГК) и каннабидиола (КБД) по любому из предшествующих пунктов, где общее количество каннабиноидов находится в диапазоне между 5 и 100 мг.
6. Комбинация каннабиноидов тетрагидроканнабинола (ТГК) и каннабидиола (КБД) по любому из предшествующих пунктов, где неканнабиноидный химиотерапевтический агент представляет собой селективный модулятор эстрогенового рецептора.
7. Комбинация каннабиноидов тетрагидроканнабинола (ТГК) и каннабидиола (КБД) по п.6, где селективный модулятор эстрогенового рецептора выбирается из группы, состоящей из: афимоксифена (4-гидрокситамоксифена); арзоксифена; базедоксифена; кломифена; лазофоксифена; ормелоксифена; ралоксифена; тамоксифена и торемифена.
8. Комбинация каннабиноидов тетрагидроканнабинола (ТГК) и каннабидиола (КБД) по п.7, где селективный модулятор эстрогенового рецептора является одним из: ралоксифена; тамоксифена и торемифена.
9. Комбинация каннабиноидов тетрагидроканнабинола (ТГК) и каннабидиола (КБД) по любому из пп.1-5, где неканнабиноидный химиотерапевтический агент представляет собой алкилирующий агент.
10. Комбинация каннабиноидов тетрагидроканнабинола (ТГК) и каннабидиола (КБД) по п.9, где алкилирующий агент выбирается из группы, состоящей из: алкилированных сульфонатов; бусульфана; этилениминов; метилмеламинов; гексаметилмеламина; алтретамина; тиотепы; азотистых ипритов; циклофосфамида; мехлоретамина; мустина; урамустина; урацилового производного иприта; мелфалана; хлорамбуцила; ифосфамида; нитромочевины; кармустина; цисплатина; стрептозоцина; триазенов; декарбазина; имидазотетразинов и темозоломида.
11. Комбинация каннабиноидов тетрагидроканнабинола (ТГК) и каннабидиола (КБД) по п.10, где алкилирующий агент является одним из: цисплатина; темозоломида и кармустина.
12. Комбинация каннабиноидов тетрагидроканнабинола (ТГК) и каннабидиола (КБД) по п.1, где ТГК и КБД присутствуют как растительные экстракты, как чистые соединения или их комбинация.
13. Комбинация каннабиноидов тетрагидроканнабинола (ТГК) и каннабидиола (КБД) по п.12, где растительный экстракт находится в форме растительного лекарственного средства.
14. Комбинация каннабиноидов тетрагидроканнабинола (ТГК) и каннабидиола (КБД) по любому из предшествующих пунктов, где ТГК и КБД вводятся раздельно, последовательно или одновременно с неканнабиноидным противоопухолевым агентом.