Набор олигодезоксирибонуклеотидных праймеров и флуоресцентно-меченых зондов для идентификации рнк метапневмовируса человека
Иллюстрации
Показать всеИзобретение относится к области биохимии, в частности к набору олигодезоксирибонуклеотидных праймеров и флуоресцентно-меченых зондов для идентификации РНК метапневмовируса человека методом ПЦР в реальном времени, содержащему четыре прямых олигодезоксирибонуклеотидных праймера и два обратных олигодезоксирибонуклеотидных праймера, а также два флуоресцентно-меченых ДНК-зонда. Изобретение позволяет наравне с известными аналогами провести надежную и достоверную детекцию метапневмовируса человека в клинических образцах и других биологических материалах. 1 ил., 3 табл.
Реферат
Изобретение относится к наборам праймеров и флуоресцентно-меченого зонда для выявления генетического материала (РНК) метапневмовируса человека в клинических образцах, секционных пробах, образцах окружающей среды, культуральных вируссодержащих жидкостях и прочих биопрепаратах с целью постановки диагноза, коррекции лечения, эпидемиологического расследования, а также для решения научно-исследовательских задач по мониторингу и изучению свойств метапневмовируса, созданию диагностических, профилактических и лечебных препаратов и может быть использовано в медицине, биотехнологии и эпидемиологии.
При помощи разработанных диагностических праймеров и флуоресцентно-меченых зондов возможно выявление генетического материала (РНК) метапневмовируса человека.
Метод полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР) является наиболее распространенным методом, используемым в лабораторной практике для дифференциальной диагностики инфекционных заболеваний. В основе метода лежат две реакции - обратная транскрипция и полимеразная цепная реакция. В реакции обратной транскрипции на матрице вирусной РНК строится комплиментарная ДНК (кДНК). В следующей за реакцией обратной транскрипции ПЦР происходит многократное избирательное удвоение целевого участка кДНК (амплификация). Амплифицируемый участок кДНК является маркерным, так как строго ограничен последовательностями ДНК-затравок (праймеров), без которых невозможно протекание ПЦР. Для детекции накопления продуктов амплификации в режиме реального времени помимо пары праймеров необходим также флуорисцентно-меченый ДНК-зонд. Сложность выбора праймеров и зонда обусловлена требованием их строгой видоспецифичности. В случае если выбранные олигонуклеотиды не обладают видовой специфичностью к целевому объекту, либо не обладают достаточной гомологией к целевой нуклеотидной последовательности, возможны ложноотрицательные результаты исследования. В случае если выбранные праймеры и зонды демонстрируют сродство к нецелевым последовательностям ДНК, то возможны ложноположительные результаты исследования. Правильный выбор сочетания пары праймеров и флуоресцентно-меченого ДНК-зонда позволяет осуществить строго специфическую амплификацию целевого фрагмента кДНК и провести детекцию накопления продуктов ПЦР в режиме реального времени.
Известны зарубежные аналоги, представляющие собой набор праймеров, обеспечивающих специфичный синтез фрагментов кДНК на матрице геномной РНК метапневмовируса человека. В заявке США №20060014140, опубл. 2006 г. представлен набору праймеров для детекции метапневмовируса человека. В патентах Китая №CN102031314, опубл. 2011 г., №CN101550454, опубл. 2009 г., №CN101538618, опубл. 2009 г. представлены наборы праймеров и ДНК-зондов для детекции генетического материала метапневмовируса человека методом ПЦР в реальном времени.
Наиболее близким аналогом (прототипом) является набор праймеров для детекции кДНК метапневмовируса человека методом ПЦР "АмплиСенс®ОРВИ-скрин-FL" (http://www.pacxodka39.ru/product_3056.html ЦНИИ Эпидемиологии, г. Москва). Набор реагентов предназначен для выявления возбудителей острых респираторных вирусных инфекций человека (ОРВИ): РНК респираторно-синцитиального вируса, РНК метапневмовируса, вирусов парагриппа 1-4 типов, коронавирусов, риновирусов, ДНК аденовирусов групп B, C и E и бокавируса в клиническом материале методом полимеразной цепной реакции (ПЦР) с гибридизационно-флуоресцентной детекцией.
Однако в известных аналогах и прототипе праймеры имеют недостаточный уровень гомологии ко всем циркулирующим в настоящее время метапневмовирусам человека в природе, а также имеющимся в базе данных геномам метапневмовируса человека, что снижает надежность и достоверность диагностики указанного вируса с использованием заявляемых праймеров.
Техническим результатом заявляемого изобретения является расширение спектра импортозамещающих олигодезоксирибонуклеотидных праймеров и флуоресцентно-меченых зондов, позволяющих надежно и достоверно идентифицировать РНК метапневмовируса человека методом ПЦР в реальном времени. Указанный результат достигается разработкой набора олигодезоксирибонуклеотидных праймеров для детекции РНК метапневмовируса человека, содержащего четыре олигонуклеотидных полимера, обладающих активностью прямого и обратного праймеров в полимеразной цепной реакции, а также два флуоресцентно-меченых ДНК-зонда. Указанные олигонуклеотиды имеют следующую структуру:
В рамках заявляемого технического решения разработанные праймеры и ДНК-зонды обладают высокой степенью гомологии ко всем известным нуклеотидным последовательностям геномов изолятов метапневмовируса человека, доступным в международной базе данных биотехнологической информации GenBank.
По сравнению с известными наборами олигонуклеотидов-аналогов, предлагаемые к патентованию олигонуклеотиды для детекции метапневмовируса человека методом ПЦР в реальном времени имеют ряд значительных преимуществ. Во-первых, в заявляемом наборе присутствуют четыре прямых праймера, два обратных праймера и три меченых ДНК-зонда. Такая комбинация, в дополнении к примененной вырожденности олигонуклеотидов, обеспечивает максимальную гомологию патентуемых праймеров и зондов ко всем имеющимся в международной базе данных GenBank последовательностям геномов метапневмовируса человека. Во-вторых, патентуемый набор олигонуклеотидов был оптимизирован для применения с отечественными реагентами и ферментами (производства ООО «Лаборатория МЕДИГЕН»), а также самых распространенных в лабораторной практике приборов для ПЦР в реальном времени - “Rotor Gene 6000” (Corbet Research, Австралия) и iQ5 (BioRad, США).
Апробация олигонуклеотидов была осуществлена с использованием назофарингеальных смывов от пациентов с симптомами ОРВИ (порядок проведения исследования одобрен этическим комитетом ФБУН ГНЦ ВБ «Вектор» (IRB 00001360)). Экспериментально было показано, что выбранные праймеры и ДНК-зонд обеспечивают надежный синтез целевых ДНК-фрагментов. Специфичность амплификации дополнительно подтверждали секвенированием.
Характеристика набора праймеров и участка амплифицируемой геномной РНК. Предлагаемые к патентованию праймеры, фланкируют участок гена кодирующего вирусный белок нуклеопротеина (NP-ген). В ПЦР амплифицируется фрагмент генома с 3620 по 3742 нуклеотид (122 п.н.) и с 3204 по 3379 нуклеотид (175 п.н.). Использование в комплекте с диагностическими праймерами флуоресцентно-меченого ДНК-зонда позволяет производить детекцию накопления продуктов амплификации в режиме реального времени.
Важно отметить, что оптимизация условий проведения ПЦР осуществлялась с использованием наборов коммерчески доступных реагентов, приборов и ферментов, предназначенных для массового использования в лабораторной практике, что позволяет быстрое и надежное применение данного изобретения в медицинских и научно-исследовательских лабораториях.
Перечень графических материалов
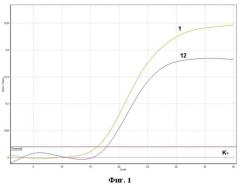
На фиг. 1 представлены результаты анализа образцов методом ПЦР в реальном времени. В эксперименте методом ПЦР в реальном времени были проанализированы тридцать клинических образцов на наличие маркеров респираторных вирусов, в одном образце (кривая № 12) была обнаружена РНК метапневмовируса человека.
Методика конструирования набора диагностических праймеров и флуоресцентно-меченых зондов
На основе теоретического изучения структуры генома метапневмовируса человека, на консервативную область гена вирусного нуклеопротеина (NP-ген) были рассчитаны и синтезированы праймеры и флуоресцентно-меченые ДНК-зонды для проведения полимеразной цепной реакции (таблица 1). В ходе работы было проанализировано 1342 имеющихся в базе данных нуклеотидных последовательностей генома метапневмовируса человека.
Таблица 1.
Праймеры и зонды для детекции метапневмовируса человека
| Вирус | Последовательность в GenBank | Локализация | Нуклеотидная последовательность5' →3' | Tm, °C | ПЦР-продукт, п.н. |
| MpV | DQ843659.1 | 3620-3639 | AARATGGCYGTYAGYTTCAGAAGAATGGTCGCTAGCTTCAG | 49.250.8 | 122 |
| 3742-3723 | GGCYARYTCAGCATCNGTCAT | 51.0 | |||
| 3678-3702 | ROX-TTTCAGACAAYGCAGGGATAACACC-BHQ2ROX-TTTCAGACAAYGCTGGAATAACACC-BHQ2 | 58.157.2 | |||
| AY525843.1 | 3204-32263207-3226 | TYTTYACATTAGARGTTGGTGATGTTTTACACTGGAGGTAGGTGATGT | 51.349.8 | 175 | |
| 3379-3356 | ACAAAYCTWGATTGYCTGGG | 50.2 | |||
| 3250-3269 | ROX-TGGRCCYAGCYTAAWCAAAACAGA-BHQ2 | 57.4 |
Методика получения положительных контрольных образцов
Положительные контрольные образцы были получены методом ТОРО-Т/А клонирования. После чего компетентные клетки E. Coli линии TOP 10 (Invitrogen, США) были трансформированы полученными плазмидами pCR2.1 (Invitrogen, США), несущими вирусспецифическую вставку синтезированных фрагментов ДНК. В ходе проделанной работы была сконструирована рекомбинантная плазмида: pMpV. Наличие специфической к вирусному геному ДНК-вставки подтверждали секвенированием.
Анализ эффективности проведенной трансформации осуществляли проведением ПЦР в режиме реального времени в соответствии с протоколом, описанным ниже, где в реакционную смесь в качестве положительного образца добавляли 1×ТЕ-буфер, содержащий рекомбинантную плазмиду pMpV, со встройкой вирусспецифического синтезированного ДНК-дуплекса. В качестве отрицательного контрольного образца в реакционную смесь добавляли 1×ТЕ-буфер.
Экстракция вирусной РНК
Вирусную РНК выделяли из 100 мкл назофарингеального смыва с использованием набора «РИБО-преп» (ФБУН ЦНИИЭ, г. Москва) согласно инструкции производителя.
Реакция обратной транскрипции
Синтез комплементарной ДНК (кДНК) проводили на матрице суммарной РНК с использованием набора реагентов «Реверта-L» (ФБУН ЦНИИЭ, г. Москва) согласно инструкции производителя.
Проведение полимеразной цепной реакции
Условия проведения амплификации оптимизировали по концентрации ионов магния, концентрации праймеров и зондов в реакционной смеси, температуре отжига праймеров.
Таблица 2.
ПЦР-смесь (из расчета на одну пробирку)
| Компонент | Объем, мкл |
| ПЦР-буфер×10 | 3 |
| дНТФ (5 мМ) | 1 |
| MgCl2 (50 мМ) | 1.5 |
| Hot Start Taq ДНК-полимераза | 0.3 |
| Смесь прямых праймеров - F (каждого 10 нМ) | 2 |
| Смесь обратных праймеров - R (каждого10 нМ) | 2 |
| Смесь ДНК-зондов - Z (каждого 15 нМ) | 0.5 |
| Образец | 3 |
| diH2O | 16.7 |
Реакцию амплификации проводили в 30 мкл смеси для ПЦР (таблица 2), содержащей 1×Taq буфер для амплификации, 2.5 мМ MgCl2, 0.17 мМ каждого из нуклеозидтрифосфатов, 1.5 активных единиц Smart Taq ДНК-полимеразы (все компоненты ООО «Лаборатория МЕДИГЕН»), 20 пМ прямого и обратного праймеров, 8 пМ флуоресцентного ДНК-зонда.
ПЦР в режиме реального времени проводили согласно программе амплификации, приведенной в таблице 3. Детекцию интенсивности флуоресценции проводили по каналу - Orange 585/610 нм (краситель ROX). Измерение флуоресценции проводили на приборах “Rotor Gene 6000” (Corbet Research, Австралия) и iQ5 (BioRad, США). Результаты оценивали по наличию флуоресценции до 30 цикла. Результаты анализа образцов методом ПЦР в реальном времени с использованием патентуемых олигонуклеотидов по каналу ROX (585/610 нм) представлены на фиг. 1, на графиках которой приведены:
1 - положительный контрольный образец (плазмидная конструкция pMpV);
12 - клинический образец, в котором обнаружена РНК метапневмовируса;
К - отрицательный контрольный образец (однократный ТЕ-буфер).
Таблица 3.
Программа амплификатора для ПЦР-РВ
| № | Операция | T, °C | T, мин:с |
| 1 | Hold/Активация Smart Taq-ДНК-полимеразы | 95 | 05:00 |
| 2 | Cycling 1/Циклирование 1 (10 циклов) | 95 | 00:15 |
| 51 | 00:20 | ||
| 72 | 00:15 | ||
| 3 | Cycling 2/Циклирование 2 (30 циклов) | 95 | 00:15 |
| 51 | 00:20 детекция | ||
| 72 | 00:15 |
Апробация патентуемых олигонуклеотидов
Предлагаемые к патентованию олигонуклеотиды были нами апробированы в эпидемиологическом исследовании по изучению видового разнообразия агентов, вызывавших ОРВИ у жителей г. Новосибирска и Новосибирской области в октябре-апреле 2011-2012 г.г.
Нами было исследовано 164 образца назофарингеальных смывов от пациентов с симптомами острой респираторной вирусной инфекции. Этиологический агент заболевания был нами установлен в 43% случаев (69 образцов). Метапневмовирус в исследуемых образцах был выявлен в 1% случаев (2 образца). Специфичность ПЦР-исследования дополнительно подтверждали секвенированием.
Таким образом, заявляемый набор олигонуклеотидных праймеров и флуоресцентно-меченых зондов обеспечивает наравне с известными аналогами надежную и достоверную детекцию метапневмовируса человека в клинических образцах и других биологических материалах.
Приложение
<110> Федеральное бюджетное учреждение науки «Государственный
научный центр вирусологии и биотехнологии "Вектор"» (ФБУН
ГНЦ ВБ "Вектор")
<120> Набор олигодезоксирибонуклеотидных праймеров и флуоресцентно-меченых ДНК-зондов для идентификации РНК метапневмовируса человека.
<210> 3
<223> Последовательности олигонуклеотидов, видоспецифических к метапневмовирусу человека.
<400> 1 прямые праймеры (forward primers) 5`→3`
F: 5`-AARATGGCYGTYAGYTTCAG-3` (20 н.)
F: 5`-AAGAATGGTCGCTAGCTTCAG-3` (21 н.)
F: 5`-TYTTYACATTAGARGTTGGTGATGT-3` (25 н.)
F: 5`-TTTACACTGGAGGTAGGTGATGT-3` (23 н.)
<400> 2 обратные праймеры (reverse primers) 5`→3`
R: 5`-GGCYARYTCAGCATCNGTCAT-3` (21 н.)
R: 5`-ACAAAYCTWGATTGYCTGGG-3` (20 н.)
<400> 3 флуоресцентно-меченые ДНК-зонды (probes) 5`→3`
Z: 5`-ROX-TTTCAGACAAYGCAGGGATAACACC-BHQ2-3` (25 н.)
Z: 5`-ROX-TTTCAGACAAYGCTGGAATAACACC-BHQ2-3` (25 н.)
Набор олигодезоксирибонуклеотидных праймеров и флуоресцентно-меченых зондов для идентификации РНК метапневмовируса человека методом ПЦР в реальном времени, содержащий четыре прямых олигодезоксирибонуклеотидных праймера и два обратных олигодезоксирибонуклеотидных праймера, а также два флуоресцентно-меченых ДНК-зонда, имеющих следующую структуру:• прямые праймеры (forward primers) 5`→3`F: 5`-AARATGGCYGTYAGYTTCAG-3` (20 н.)F: 5`-AAGAATGGTCGCTAGCTTCAG-3` (21 н.)F: 5`-TYTTYACATTAGARGTTGGTGATGT-3` (25 н.)F: 5`-TTTACACTGGAGGTAGGTGATGT-3` (23 н.)• обратные праймеры (reverse primers) 5`→3`R: 5`-GGCYARYTCAGCATCNGTCAT-3` (21 н.)R: 5`-ACAAAYCTWGATTGYCTGGG-3` (20 н.)• флуоресцентно-меченые ДНК-зонды (probes) 5`→3`Z: 5`-ROX-TTTCAGACAAYGCAGGGATAACACC-BHQ2-3` (25 н.)Z: 5`-ROX-TTTCAGACAAYGCTGGAATAACACC-BHQ2-3` (25 н.)