Набор олигодезоксирибонуклеотидных праймеров и флуоресцентно-меченых зондов для идентификации рнк риновирусов человека
Иллюстрации
Показать всеИзобретение относится к области биохимии, в частности к набору олигодезоксирибонуклеотидных праймеров и флуоресцентно-меченых зондов для идентификации риновирусов человека видов А, В и С, методом ПЦР в реальном времени, содержащему два прямых и два обратных олигодезоксирибонуклеотидных праймера и два флуоресцентно-меченых ДНК-зонда. Изобретение позволяет наравне с известными аналогами провести надежную и достоверную детекцию риновируса человека в клинических образцах и других биологических материалах. 2 ил., 3 табл.
Реферат
Изобретение относится к наборам праймеров и флуоресцентно-меченого зонда для выявления генетического материала (РНК) риновирусов человека в клинических образцах, секционных пробах, образцах окружающей среды, культуральных вируссодержащих жидкостях и прочих биопрепаратах с целью постановки диагноза, коррекции лечения, эпидемиологического расследования, а также для решения научно-исследовательских задач по мониторингу и изучению свойств риновирусов, созданию диагностических, профилактических и лечебных препаратов и может быть использовано в медицине, биотехнологии и эпидемиологии.
При помощи разработанных диагностических праймеров и флуоресцентно-меченых зондов возможно выявление генетического материала (РНК) риновирусов человека видов А, В и С.
Метод полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР) является наиболее распространенным методом, используемым в лабораторной практике для дифференциальной диагностики инфекционных заболеваний. В основе метода лежат две реакции - обратная транскрипция и полимеразная цепная реакция. В реакции обратной транскрипции на матрице вирусной РНК строится комплементарная ДНК (кДНК). В следующей за реакцией обратной транскрипции ПЦР происходит многократное избирательное удвоение целевого участка кДНК (амплификация). Амплифицируемый участок кДНК является маркерным, так как строго ограничен последовательностями ДНК-затравок (праймеров), без которых невозможно протекание ПЦР. Для детекции накопления продуктов амплификации в режиме реального времени помимо пары праймеров необходим также флуоресцентно-меченый ДНК-зонд. Сложность выбора праймеров и зонда обусловлена требованием их строгой видоспецифичности. В случае если выбранные олигонуклеотиды не обладают видовой специфичностью к целевому объекту, либо не обладают достаточной гомологией к целевой нуклеотидной последовательности, возможны ложноотрицательные результаты исследования. В случае если выбранные праймеры и зонды демонстрируют сродство к нецелевым последовательностям ДНК, то возможны ложноположительные результаты исследования. Правильный выбор сочетания пары праймеров и флуоресцентно-меченого ДНК-зонда позволяет осуществить строго специфическую амплификацию целевого фрагмента кДНК и провести детекцию накопления продуктов ПЦР в режиме реального времени.
Известны зарубежные аналоги, представляющие собой наборы праймеров и флуорогенных ДНК-зондов, обеспечивающих специфичный синтез фрагментов кДНК на матрице геномной РНК риновируса человека. В заявке на патент США № US 20110111391, опубл. 2011 г. представлены олигонуклеотиды, позволяющие идентифицировать в клиническом материале новую группу риновирусов группы С. В заявке на патент США № US 20100143881, опубл. 2010 г., а также в патентах Китая № CN 101985665, опубл. 2011 г. и Японии JP 2003093057, опубл. 2003 г. представлены олигонуклеотидные праймеры и зонды для детекции различных серогрупп и генотипов риновируса человека.
Наиболее близким аналогом (прототипом) является набор праймеров для детекции кДНК метапневмовируса человека методом ПЦР "АмплиСенс®ОРВИ-скрин-FL" (http://www.pacxodka39.ru/product_3056.html ЦНИИ Эпидемиологии, г.Москва). Набор реагентов предназначен для выявления возбудителей острых респираторных вирусных инфекций человека (ОРВИ): РНК респираторно-синцитиального вируса, РНК метапневмовируса, вирусов парагриппа 1-4 типов, коронавирусов, риновирусов, ДНК аденовирусов групп В, С и Е и бокавируса в клиническом материале методом полимеразной цепной реакции (ПЦР) с гибридизационно-флуоресцентной детекцией.
Однако в известных аналогах и прототипе праймеры имеют недостаточный уровень гомологии ко всем циркулирующим в настоящее время риновирусам человека в природе, а также имеющимся в базе данных геномам метапневмовируса человека, что снижает надежность и достоверность диагностики указанного вируса с использованием заявляемых праймеров.
Техническим результатом заявляемого изобретения является расширение спектра импортозамещающих олигодезоксирибонуклеотидных праймеров и флуоресцентно-меченых зондов, позволяющих надежно и достоверно идентифицировать риновирусы человека видов А, В и С методом ПЦР в реальном времени.
Указанный результат достигается разработкой набора олигодезоксирибонуклеотидных праймеров для детекции РНК риновирусов человека, содержащего четыре олигонуклеотидных полимера, обладающих активностью прямого и обратного праймеров в полимеразной цепной реакции, а также два флуоресцентно-меченых ДНК-зонда. Указанные олигонуклеотиды имеют следующую структуру:
В рамках заявляемого технического решения разработанные праймеры и ДНК-зонды обладают высокой степенью гомологии ко всем известным нуклеотидным последовательностям геномов изолятов риновирусов человека, доступным в международной базе данных биотехнологической информации GenBank.
В связи с тем, что риновирус человека обладает значительной вариабельностью генома, с каждым годом в международной базе данных GenBank растет количество как полных, так и фрагментарных нуклеотидных последовательностей генома риновируса человека. Несмотря на все указанные достоинства упомянутых выше наборов реагентов-аналогов, позволяющих детектировать генетический материал риновируса человека в клиническом материале, представляемый к патентованию набор олигонуклеотидов обладает рядом значительных преимуществ.
Заявляемые праймеры и флуоресцентно-меченые ДНК-зонды, в отличие от указанных выше наборов олигонуклеотидов-аналогов за счет внесения «вырожденных» нуклеотидов в их последовательность, обладают значительным уровнем гомологии ко всем имеющимся в базе данных геномам риновируса человека. Так как набор представляет собой комплект из четырех праймеров и двух флуорогенных ДНК-зондов, он обеспечивает более надежную детекцию всех известных на сегодняшний день серотипов и генотипов риновируса человека. К тому же разработанные нами праймеры и зонды были использованы в ПЦР смесях, состоящих из компонентов отечественного производства, что делает разработку легко- и широкодоступной для применения в лабораториях Российской Федерации, это обеспечивает быстрое и надежное внедрение разработки в практику. Используемая в качестве положительного контрольного образца плазмидная конструкция, несущая фрагмент генома риновируса человека, может быть использована в количественной ПЦР. Это дает возможность оценить вирусную нагрузку в исследуемом образце.
Апробация олигонуклеотидов была осуществлена с использованием назофарингеальных смывов от пациентов с симптомами ОРВИ (порядок проведения исследования одобрен этическим комитетом ФБУН ГНЦ ВБ «Вектор» (IRB 00001360)). Экспериментально было показано, что выбранные праймеры и ДНК-зонд обеспечивают надежный синтез целевых ДНК-фрагментов. Специфичность амплификации дополнительно подтверждали секвенированием.
Характеристика набора праймеров и участка амплифицируемой геномной РНК
Предлагаемые к патентованию праймеры фланкируют участок гена, кодирующего вирусный гликопротеин 1 (VP1-ген). В ПЦР амплифицируется фрагмент генома с 53 по 304 (251 п.н.) и с 84 по 412 (328 п.н.). Использование в комплекте с диагностическими праймерами флуоресцентно-меченых ДНК-зондов позволяет производить детекцию накопления продуктов амплификации в режиме реального времени.
Важно отметить, что оптимизация условий проведения ПЦР осуществлялась с использованием наборов коммерчески доступных реагентов, приборов и ферментов, предназначенных для массового использования в лабораторной практике, что позволяет быстро и надежно применять данное изобретение в медицинских и научно-исследовательских лабораториях.
Перечень графических материалов
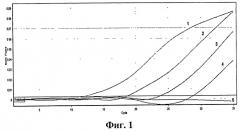
На фиг.1 представлены результаты анализа образцов методом ПЦР в реальном времени. В эксперименте методом ПЦР в реальном времени были проанализированы четыре последовательных десятикратных разведения ПКО (плазмидная конструкция pRhV).
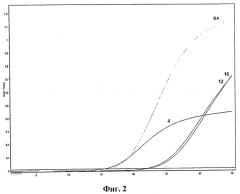
На фиг.2. представлены результаты анализа клинических образцов методом ПЦР в реальном времени с использованием патентуемых олигонуклеотидов.
Методика конструирования набора диагностических праймеров и флуоресцентно-меченых зондов
На основе теоретического изучения структуры генома риновирусов человека, на консервативную область гена вирусного гликопротеина 1 (VP1-ген) были рассчитаны и синтезированы праймеры и флуоресцентно-меченые ДНК-зонды для проведения полимеразной цепной реакции (табл.1). В ходе работы было проанализировано 4398 имеющихся в базе данных нуклеотидных последовательностей генома риновируса человека.
| Таблица 1 | |||||
| Праймеры и зонды для детекции риновирусов человека | |||||
| Вирус | Последовательность в GenBank | Локализация | Нуклеотидная последовательность 5'→3' | Tm, °C | ПЦР-продукт, п.н. |
| RhV | JQ837720.1 | 53-71 | TARACCTKGCAGATGRGGC | 51.2 | 251 |
| 304-284 | AAACACGGACAYCCAAAGTAG | 49.7 | |||
| 103-119 | FAM-CCYGCGTGGCKGCCTGC-BHQ1 | 59.2 | |||
| JN815239.1 | 84-100 | TTAACCGTYAHCCGCCA | 49.4 | 328 | |
| 412-394 | ACCCAAAGTAGTCGGTCCC | 50.3 | |||
| 218-233 | FAM-BBAGCCYGCGTGGCKG-BHQ1 | 56.8 |
Методика получения положительных контрольных образцов
Положительные контрольные образцы были получены методом TOPO-T/A клонирования. После чего компетентные клетки Е. coli линии ТОР 10 (Invitrogen, США) были трансформированы полученными плазмидами pCR2.1 (Invitrogen, США), несущими вирусспецифическую вставку синтезированных фрагментов ДНК. В ходе проделанной работы была сконструирована рекомбинантная плазмида: pRhV. Наличие специфической к вирусному геному ДНК-вставки подтверждали секвенированием.
Анализ эффективности проведенной трансформации осуществляли проведением ПЦР в режиме реального времени в соответствии с протоколом, описанным ниже, где в реакционную смесь в качестве положительного образца добавляли 1×TE-буфер, содержащий рекомбинантную плазмиду pRhV, со встройкой вирусспецифического синтезированного ДНК-дуплекса. В качестве отрицательного контрольного образца в реакционную смесь добавляли 1×TE-буфер.
Экстракция вирусной РНК. Вирусную РНК выделяли из 100 мкл назофарингеального смыва с использованием набора «РИБО-преп» (ЦНИИЭ, г.Москва) согласно инструкции производителя.
Реакция обратной транскрипции. Синтез комплементарной ДНК (кДНК) проводили на матрице суммарной РНК с использованием набора реагентов «Реверта-L» (ЦНИИЭ, г.Москва) согласно инструкции производителя.
Проведение полимеразной цепной реакции. Условия проведения амплификации оптимизировали по концентрации ионов магния, концентрации праймеров и зондов в реакционной смеси, температуре отжига праймеров.
Реакцию амплификации проводили в 30 мкл смеси для ПЦР (табл. 2), содержащей 1×Taq буфер для амплификации, 2.5 мМ MgCl2, 0.17 мМ каждого из нуклеозидтрифосфатов, 1.5 активных единиц Smart Taq ДНК-полимеразы (все компоненты ООО «Лаборатория МЕДИГЕН»), 20 пМ прямого и обратного праймеров, 8 пМ флуоресцентного ДНК-зонда.
| Таблица 2 | |
| ПЦР-смесь (из расчета на одну пробирку) | |
| Компонент | Объем, мкл |
| ПЦР-буфер × 10 | 3 |
| дНТФ (5 мМ) | 1 |
| MgCl2 (50 мМ) | 1.5 |
| Hot Start Taq ДНК-полимераза (5 е.а./мкл) | 0.3 |
| Смесь прямых праймеров - F (каждого 10 нМ) | 2 |
| Смесь обратных праймеров - R (каждого 10 нМ) | 2 |
| Смесь ДНК-зондов - Z (каждого 15 нМ) | 0.5 |
| Образец | 3 |
| diH2O | 16.7 |
ПЦР в режиме реального времени проводили согласно программе амплификации табл.3. Детекцию интенсивности флуоресценции проводили по каналу - Green 470/510 нм (краситель РАМ). Измерение флуоресценции проводили на приборах "Rotor Gene 6000" (Corbet Research, Австралия) и iQ5 (BioRad, США). Результаты оценивали по наличию флюоресценции до 30 цикла (фиг.1 и 2).
| Таблица 3 | |||
| Программа амплификатора для ПЦР-РВ | |||
| № | Операция | Т, °C | Т, мин:с |
| 1 | Hold/Активация Smart Taq-ДНК-полимеразы | 95 | 05:00 |
| 2 | Cycling 1/Циклирование 1 (10 циклов) | 95 | 00:10 |
| 50 | 00:30 | ||
| 72 | 00:20 | ||
| 3 | Cycling 2/Циклирование 2 (30 циклов) | 95 | 00:10 |
| 50 | 00:30 детекция | ||
| 72 | 00:20 |
На фиг.1 приведены результаты анализа образцов методом ПЦР в реальном времени с использованием патентуемых олигонуклеотидов, на графиках которой представлены:
1 - положительный контрольный образец (плазмидная конструкция hRhV) разведение №1 (10-1);
2 - положительный контрольный образец (плазмидная конструкция hRhV) разведение №1 (10-2);
3 - положительный контрольный образец (плазмидная конструкция hRhV) разведение №1 (10-3);
3 - положительный контрольный образец (плазмидная конструкция hRhV) разведение №1 (10-4);
4 - отрицательный контрольный образец (однократный TE-буфер).
На фиг.2 приведены результаты анализа клинических образцов методом ПЦР в реальном времени с использованием патентуемых олигонуклеотидов, на графиках которой видно, что в образцах №4, 12, 16 обнаружена РНК риновируса человека; К+ - положительный контрольный образец (pRhV).
Апробация патентуемых олигонуклеотидов. Предлагаемые к патентованию олигонуклеотиды были нами апробированы в эпидемиологическом исследовании по изучению видового разнообразия агентов, вызывавших ОРВИ у жителей г. Новосибирска и Новосибирской области в октябре-апреле 2011-2012 г.г. Нами было исследовано 164 образца назофарингеальных смывов от пациентов с симптомами острой респираторной вирусной инфекции. Этиологический агент заболевания был нами установлен в 43% случаев (69 образцов) (фиг. 2). Риновирусы в исследуемых образцах был выявлен в 8% случаев (13 образцов). В структуре сочетанных инфекций риновирус был выявлен нами в 21,7% случаев (5 образцов из 11). Специфичность ПЦР-исследования дополнительно подтверждали секвенированием.
Таким образом, заявляемый набор олигонуклеотидных праймеров и флуоресцентно-меченых зондов обеспечивает наравне с известными аналогами надежную и достоверную детекцию риновируса человека в клинических образцах и других биологических материалах.
Набор олигодезоксирибонуклеотидных праймеров и флуоресцентно-меченых зондов для идентификации риновирусов человека видов А, В и С, методом ПЦР в реальном времени, содержащий два прямых и два обратных олигодезоксирибонуклеотидных праймера и два флуоресцентно-меченых ДНК-зонда, имеющих следующую структуру:- прямые праймеры (forward primers) 5'→3'
| F: 5'-TARACCTKGCAGATGRGGC-3' | (19 н.) |
| F: 5'-TTAACCGTYAMCCGCCA-3' | (17 н.) |
| R: 5'-GAAACACGGACACCCAAAGTAG-3' | (22 н.) |
| R: 5'-ACCCAAAGTAGTCGGTCCC-3' | (19 н.) |
| Z: 5'-FAM-CCYGCGTGGCKGCCTGC-BHQ1-3' | (17 н.) |
| Z: 5'-FAM-YYAGCCTGCGTGGCGG-BHQ1-3' | (16 н.). |