Гликозилированный пептид glp-1
Иллюстрации
Показать всеИзобретение относится к области генной инженерии, конкретно к получению пептида GLP-1, модифицированного олигосахаридной цепью, и может быть использовано в медицине для лечения или профилактики заболеваний, ассоциированных с GLP-1. В пептиде GLP-1 с SEQ ID NO: 2 или SEQ ID NO: 3 две аминокислоты пептида замещены аминокислотой, модифицированной биантеннальной олигосахаридной цепью комплексного типа, и где каждый из центров замещения выбирается из группы, состоящей из положений 18, 22, 26, 30, 34 и 36 в пептиде GLP-1 с SEQ ID NO: 2 или SEQ ID NO: 3. Указанный модифицированный пептид GLP-1 может включать делецию, замещение или присоединение 1-5 аминокислот, за исключением аминокислот, модифицированных олигосахаридной цепью. Изобретение позволяет получить пептид GLP-1, модифицированный олигосахаридной цепью, который демонстрирует более сильную активность подавления глюкозы в крови и увеличенный, по меньшей мере, в 2 раза период полужизни, по сравнению с GLP-1 с SEQ ID NO: 3. 5 н. и 19 з.п. ф-лы, 5 ил., 6 табл., 16 пр.
Реферат
Область техники, к которой относится данное изобретение
Настоящее изобретение относится к пептиду GLP-1, модифицированному олигосахаридной цепью.
Уровень техники
GLP-1 (глюкагоноподобный пептид-1) представляет собой пептид кишечного происхождения, который играет важную роль в регуляции гомеостаза глюкозы. GLP-1 синтезируется в L-клетках желудочно-кишечного тракта в результате тканеспецифичной посттрансляционной переработки препроглюкагона, являющегося предшественником глюкагона и выделяющегося в кровоток при приеме пищи. Этот пептид выполняет роль основного медиатора энтероинсулярной оси и функционирует путем связывания с соответствующими рецепторами.
Известно, что GLP-1 действует главным образом на поджелудочную железу и способствует высвобождению инсулина из β-клеток, скорость которого зависит от концентрации глюкозы. Кроме того, считают, что GLP-1 по-видимому подавляет секрецию глюкагона, задерживает опорожнение желудка и усиливает удаление периферической глюкозы.
Введение GLP-1 пациентам с инсулиннезависимым сахарным диабетом может нормализовать уровень глюкозы после приема пищи, что указывает на то, что GLP-1 может быть использован в качестве терапевтического лекарственного средства. GLP-1 также влияет на улучшение гликемического контроля у пациентов с инсулинозависимым сахарным диабетом. Поскольку эффект промотирования выделения инсулина, вызываемый GLP-1, зависит от концентрации глюкозы в плазме, GLP-1 выступает в качестве посредника в уменьшении выделения инсулина при низкой концентрации глюкозы в плазме и, следовательно, преимущественно не вызывает значительной гипогликемии. Таким образом, высокобезопасное лечение диабета при необходимости может быть достигнуто благодаря контролю за количеством GLP-1 в крови. Однако полупериод GLP-1 в крови является настолько низким и равным от 2 до 6 минут, что создает проблему его ограниченного применения в качестве терапевтического лекарственного средства.
Для решения этой проблемы сделана попытка провести модификацию GLP-1. Например, патентный документ 1 раскрывает производное пэгилированного GLP-1, содержащего соединение GLP-1, конъюгированное по меньшей мере с 1 молекулой полиэтиленгликоля (ПЭГ). В соединении пэгилированного производного GLP-1 каждая молекула ПЭГ присоединена к соединению GLP-1 по Cys или Lys- аминокислотам или по концевой карбоксильной группе аминокислоты. Соединение пэгилированного производного GLP-1 характеризуется увеличением полупериода, по меньшей мере на 1 час.
В соответствии с патентным документом 1 полученный биологически активный пептид характеризуется более продолжительным полупериодом и значительно более медленным выведением по сравнению с соответствующими параметрами для непэгилированных пептидов. Было также показано, что пэгилированное производное GLP-1 и композицию используют для лечения таких хронических состояний, как диабет, ожирение и синдром раздраженного кишечника, а также для снижения уровня сахара в крови, подавления желудочной и/или кишечной подвижности, желудочного и/или кишечного опорожнения и контроля за приемом пищи (например, непатентный документ 1).
Однако ПЭГ представляет собой соединение, которое не метаболизируется in vivo. Следовательно, при непрерывном введении соединения пэгилированного производного GLP-1 ПЭГ аккумулируется in vivo и может вызывать неблагоприятные реакции в живых организмах (непатентный документ 1).
Более того, чтобы увеличить полупериод, был также предложен способ присоединения олигосахаридной цепи к GLP-1 или модифицированному GLP-1 (например, патентные документы 3 и 4). Патентный документ 3 раскрывает способ, представляющий собой введение аминокислоты, модифицированной олигосахаридной цепью в положениях 26, 34 и/или 37 GLP-1 и т.д. Однако тип олигосахаридной цепи и центры, по которым присоединены олигосахаридные цепи, являются менее чем оптимальными. С другой стороны, патентный документ 4 раскрывает способ, представляющий собой связывание модифицированной гиалуроновой кислоты, имеющей молекулярную массу приблизительно 200 кДа, с аналогом GLP-1. Однако, когда такие большие молекулы гиалуроновой кислоты производят в больших количествах, трудно сделать их одинаковыми по длине или по структуре. Поэтому реальные гиалуроновые кислоты могут значительно отличаться по структуре и по длине. Для фармацевтического применения требуются пептиды, модифицированные олигосахаридной цепью, имеющей одинаковую длину или структуру.
Эксендин-4, выделенный из слюны ящерицы (Heloderma), представляет собой соединение, структурно подобное GLP-1, и обладает подобной активностью и высокой стабильностью в крови (непатентный документ 2), который был выпущен на рынок в США. Однако эксендин-4 имеет последовательность аминокислот, отличающуюся от человеческой, и может индуцировать выработку нейтрализующих антител, что обуславливает необходимость долгосрочного введения, приводящего к снижению эффективности (непатентные документы 3-5).
С другой стороны, стало очевидным, что олигосахаридные цепи выполняют различные функции in vivo. Они являются менее подробно изученными из-за их сложности и разнообразия структур, хотя важность их изучения не вызывает сомнения. Сделана попытка разработать способ получения гликопептида, имеющего постоянный состав (патентный документ 2). Однако этот способ получения еще является менее совершенным с точки зрения преимуществ или крупномасштабной продукции и не является конструктивным способом, особенно для получения длинноцепочечных олигосахаридных цепей, существующих in vivo.
[Патентный документ 1] National Publication of International Patent Application №2006-520818
[Патентный документ 2] WO 2005-095331
[Патентный документ 3] National Republication of International Patent Application №2006-095775
[Патентный документ 4] WO 2007/063907
[Непатентный документ 1] Toxicological Science, 42, 152-157 (1998)
[Непатентный документ 2] J Biol Chem. 267, 7402-5 (1992)
[Непатентный документ 3] Vascular Health and Risk Management 2, 69-77 (2006)
[Непатентный документ 4] JAMA. 298, 194-206 (2007)
[Непатентный документ 5] Endocrine Reviews 28, 187-218 (2007)
Сущность изобретения
Проблемы, решаемые изобретением
Целью настоящего изобретения является обеспечение пептида GLP-1, модифицированного олигосахаридной цепью, имеющего более высокую стабильность в крови, чем у GLP-1 и, более предпочтительно, являющегося более сильным регулятором уровня сахара в крови, по сравнению с GLP-1.
Средства решения проблем
Настоящее изобретение может иметь следующие характерные признаки для решения этой проблемы.
А именно настоящее изобретение обеспечивает пептид GLP-1, модифицированный олигосахаридной цепью, имеющий активность GLP-1, где по меньшей мере две аминокислоты замещены аминокислотой, модифицированной олигосахаридной цепью, в
(а) GLP-1;
(b) пептиде, имеющем аминокислотную последовательность GLP-1 с делецией, замещением или присоединением одной или нескольких аминокислот, или в
(c) аналоге GLP-1.
Настоящее изобретение также обеспечивает пептид GLP-1, модифицированный олигосахаридной цепью, имеющий активность GLP-1, где по меньшей мере две аминокислоты замещены аминокислотой, модифицированной олигосахаридной цепью, в
(a) GLP-1 или
(b) пептиде, имеющем аминокислотную последовательность GLP-1 с делецией, замещением или присоединением одной или нескольких аминокислот, и имеющем активность GLP-1.
Настоящее изобретение также обеспечивает пептид GLP-1, модифицированный олигосахаридной цепью, имеющий активность GLP-1, где пептид GLP-1, модифицированный олигосахаридной цепью 1, представляет собой
(a) пептид GLP-1, модифицированный олигосахаридной цепью, где по меньшей мере каждая из двух аминокислот GLP-1 замещена аминокислотой, модифицированной олигосахаридной цепью и по меньшей мере один из центров замещения находится в положении 18, 20, 22, 26, 30, 34 или 36 в GLP-1; или
(b) пептид GLP-1, модифицированный олигосахаридной цепью, имеющий аминокислотную последовательность пептида GLP-1, присоединенного к олигосахаридной цепи, характеризующегося (а) делецией, замещением или присоединением одной или нескольких аминокислот, за исключением конъюгатов олигосахаридных цепей с аминокислотами.
Настоящее изобретение также обеспечивает пептид GLP-1, модифицированный олигосахаридной цепью, имеющий активность GLP-1, где пептид GLP-1, модифицированный олигосахаридной цепью, представляет собой
(a) пептид GLP-1, модифицированный олигосахаридной цепью, где по меньшей мере каждая из двух аминокислот GLP-1 замещена аминокислотой, модифицированной олигосахаридной цепью, и каждый из замещенных центров находится в положении 18, 20, 22, 26, 30, 34 или 36 в GLP-1; или
(b) пептид GLP-1, модифицированный олигосахаридной цепью, имеющий аминокислотную последовательность пептида GLP-1 в конъюгате с олигосахаридной цепью, характеризующуюся (а) делецией, замещением или присоединением одной или нескольких аминокислот, за исключением конъюгатов олигосахаридных цепей с аминокислотами.
В настоящем изобретении пептид GLP-1, модифицированный олигосахаридной цепью, может представлять собой предпочтительно, но не ограничиваться конъюгатом олигосахаридной цепи с Asn или конъюгатом олигосахаридной цепи с Cys в зависимости от варианта осуществления.
В настоящем изобретении аминокислоты, модифицированные олигосахаридной цепью, присоединенные к пептиду GLP-1, могут быть одними и теми же или отличными по типу олигосахаридных цепей или аминокислот.
В настоящем изобретении в аминокислоте, модифицированной олигосахаридной цепью, олигосахаридная цепь может быть связана с аминокислотой через линкер или без линкера. Предпочтительно, когда олигосахаридная цепь связана с аминокислотой без линкера (т.е. напрямую), в зависимости от варианта осуществления.
В настоящем изобретении олигосахаридная цепь обычно предпочтительно представляет собой олигосахаридную цепь, состоящую из четырех или более остатков сахаров. Однако олигосахаридная цепь, состоящая из пяти-одиннадцати остатков сахаров, является более предпочтительной, в зависимости от варианта осуществления.
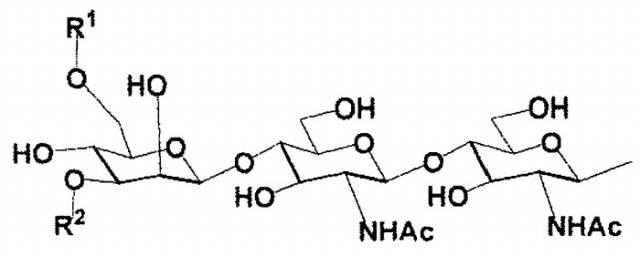
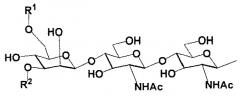
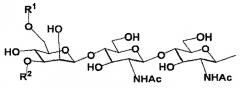
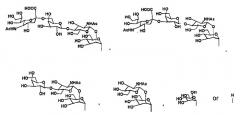
В настоящем изобретении олигосахаридная цепь может представлять собой предпочтительно, но не ограничиваться биантеннальной олигосахаридной цепью комплексного типа, в зависимости от варианта осуществления. Олигосахаридная цепь может представлять собой предпочтительно, но не ограничиваться олигосахаридной цепью, выбранной из группы, состоящей из дисиало, моносиало, асиало, диGlcNAc и диманнозоолигосахаридных цепей, в зависимости от варианта осуществления.
В настоящем изобретении олигосахаридная цепь может представлять собой предпочтительно, но не ограничиваться олигосахаридной цепью, представленной следующей формулой, в зависимости от варианта осуществления.
Формула 1
где
R1 и R2 являются одинаковыми или различными и каждая группа представлена
Формула 2
и
Ас является ацетильной группой.
Настоящее изобретение также обеспечивает пептид GLP-1, модифицированный олигосахаридной цепью, в котором по меньшей мере одна аминокислота исходного пептида замещена аминокислотой, модифицированной олигосахаридной цепью и олигосахаридная цепь представляет собой олигогиалуроновую кислоту. Примеры олигогиалуроновой кислоты могут включать в себя олигосахаридную цепь, содержащую два (тетрасахарид) или более и восемь или менее звеньев, состоящих из N-ацетилглюкозамина и глюкуроновой кислоты. Олигогиалуроновая кислота может иметь 2 тетрасахаридных или 4 октасахаридных звена.
Настоящее изобретение также обеспечивает пептид GLP-1, модифицированный олигосахаридной цепью, где олигосахаридная цепь связана по меньшей мере с одной аминокислотой линкером. Примеры аминокислоты пептида GLP-1, связанного линкером, могут включать в себя Lys. В этом случае линкер может содержать концевую аминокислоту, связанную с олигосахаридной цепью. Пример аминокислоты, находящейся на конце линкера, связанного с олигосахаридной цепью, может включать в себя Asn.
В настоящем изобретении олигосахаридная цепь является предпочтительно гомогенной и предпочтительно имеет, например, по меньшей мере 90% или по меньшей мере 99% гомогенности.
Пептид GLP-1, модифицированный олигосахаридной цепью, настоящего изобретения предпочтительно имеет более высокую стабильность в кровотоке, чем стабильность GLP-1.
Пептид GLP-1, модифицированный олигосахаридной цепью, настоящего изобретения может являться более сильным регулятором уровня сахара в крови, предпочтительно по меньшей мере в 5 раз, более предпочтительно по меньшей мере в 10 раз, еще более предпочтительно по меньшей мере в 20 раз, чем GLP-1 в OGTT (пероральная проба на переносимость глюкозы).
Пептид GLP-1, модифицированный олигосахаридной цепью, настоящего изобретения может иметь большую устойчивость к дипептидил пептидазе-4 (DPP-IV) предпочтительно по меньшей мере в 20 раз, более предпочтительно по меньшей мере в 30 раз, еще более предпочтительно по меньшей мере в 50 раз, чем GLP-1.
Пептид GLP-1, модифицированный олигосахаридной цепью, настоящего изобретения может быть использован в качестве нового активного ингредиента при медицинском применении. Такое медицинское применение включает лечение или предотвращение заболеваний, связанных с GLP-1. Типичным примером таких заболеваний является, например, диабет.
Конечно, одна или любая комбинация свойств настоящего изобретения, описанного выше, также характерна для пептида GLP-1, модифицированного олигосахаридной цепью настоящего изобретения.
Содержание настоящего изобретения
Пептид GLP-1, модифицированный олигосахаридной цепью, настоящего изобретения имеет более высокую стабильность в кровотоке, чем GLP-1. В одном из аспектов настоящего изобретения пептид GLP-1, модифицированный олигосахаридной цепью, настоящего изобретения является более сильным регулятором уровня сахара в крови, чем GLP-1. Соответственно, пептид GLP-1, модифицированный олигосахаридной цепью, настоящего изобретения может быть введен в более низкой дозе и при меньшем количестве доз, чем GLP-1.
Олигосахаридные цепи, которые присоединяют к пептиду GLP-1, модифицированному олигосахаридной цепью, настоящего изобретения легко расщепляются in vivo и поэтому не вызывают неблагоприятных реакций, приводящих к их накоплению в живых организмах.
Некоторые или все олигосахаридные цепи, которые присоединяют к пептиду GLP-1, модифицированному олигосахаридной цепью, настоящего изобретения представляют собой олигосахаридные цепи, in vivo входящие в состав млекопитающих, в том числе человека, птиц и т.д., или их модифицированные олигосахаридные цепи. Едва ли они могут вызывать побочные реакции или антигенность при введении в живой организм. Поэтому они не представляют проблем с точки зрения аллергических реакций, выработки антител или связанной с этим потери активности.
В большинстве случаев олигосахаридные цепи, используемые в настоящем изобретении, являются относительно короткими. Поэтому те из них, которые имеют гомогенную структуру, могут быть получены без использования стадий, вызывающих осложнения. Таким образом, высококачественный пептид GLP-1, модифицированный олигосахаридной цепью, фармацевтического уровня может быть легко получен в больших количествах.
Краткое описание чертежей
На фиг.1 представлены результаты измерения при помощи пероральной пробы на переносимость глюкозы (OGTT) эффекта подавления увеличения уровня сахара в крови при введении пептида GLP-1, модифицированного олигосахаридной цепью (конъюгат GLP-1 с 26 и 34Cys-дисиалоолигосахаридной цепью или конъюгат GLP-1 с 18 и 36Cys-дисиалоолигосахаридной цепью) или GLP-1. Конъюгат GLP-1 с 26 и 34Cys-дисиалоолигосахаридной цепью или конъюгат GLP-1 с 18 и 36Cys-дисиалоолигосахаридной цепью вводят в дозе, равной 0,9 нмоль/кг, в то время как GLP-1 вводят в дозе, равной 9 нмоль/кг;
на фиг.2 представлены результаты измерения при помощи пероральной пробы на переносимость глюкозы (OGTT) эффекта подавления увеличения уровня сахара в крови при введении пептида GLP-1, модифицированного олигосахаридной цепью (конъюгат GLP-1 с 22 и 30Cys-дисиалоолигосахаридной цепью, конъюгат GLP-1 с 22 и 36Cys-дисиалоолигосахаридной цепью или конъюгат GLP-1 с 30 и 36Cys-дисиалоолигосахаридной цепью) или GLP-1. Конъюгат GLP-1 с 22 и 30Cys-дисиалоолигосахаридной цепью и конъюгат GLP-1 с 22 и 36Cys- дисиалоолигосахаридной цепью или конъюгат GLP-1 с 30 и 36Cys-дисиалоолигосахаридной цепью вводят в дозе, равной 0,9 нмоль/кг, в то время как GLP-1 вводят в дозе, равной 9 нмоль/кг;
на фиг.3 представлены результаты измерения при помощи пероральной пробы на переносимость глюкозы (OGTT) эффекта подавления увеличения уровня сахара в крови при введении пептида GLP-1, модифицированного олигосахаридной цепью (конъюгат GLP-1 с 36Cys-тетрасахаридом гиалуроновой кислоты или конъюгат GLP-1 с 36Cys-октасахаридом гиалуроновой кислоты) или GLP-1. Конъюгат GLP-1 с 36Cys-тетрасахаридом гиалуроновой кислоты или конъюгат GLP-1 с 36Cys-октасахаридом гиалуроновой кислоты, соответственно, вводят в дозе, равной 9 нмоль/кг;
на фиг.4 представлены результаты измерения при помощи пероральной пробы на переносимость глюкозы (OGTT) эффекта подавления увеличения уровня сахара в крови при введении пептида GLP-1, модифицированного олигосахаридной цепью (конъюгат Asn-линкермодифицированного GLP-1 с 26Lys-асиалоолигосахаридной цепью) или GLP-1. Конъюгат Asn-линкермодифицированного GLP-1 с 26Cys-асиалоолигосахаридной цепью и GLP-1 соответственно вводят в дозе, равной 9 нмоль/кг; и
на фиг.5 представлены результаты измерения при помощи пероральной пробы на переносимость глюкозы (OGTT), проведенные для изучения влияния дозы пептида GLP-1, модифицированного олигосахаридной цепью на эффект подавления увеличения уровня сахара в крови. Конъюгат GLP-1 с 8 и 36Cys-дисиалоолигосахаридной цепью вводят в дозе, равной 0,9 нмоль/кг, в то время как GLP-1 вводят в дозе, равной 9 нмоль/кг.
Подробное изучение предпочтительных вариантов осуществления
Термин "GLP-1", используемый здесь, обозначает глюкагоноподобный пептид-1 и называется GLP-1 (7-37).
GLP-1 (7-37) имеет аминокислотную последовательность
His-Ala-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Val-Ser-Ser-Tyr-Leu-Glu-Gly-Gln-Ala-Ala-Lys-Glu-Phe-Ile-Ala-Trp-Leu-Val-Lys-Gly-Arg-Gly (SEQ ID №:2).
В настоящем изобретении "аналог GLP-1" представляет собой пептид, структурно подобный GLP-1, и/или пептид, структурно перекрывающийся с GLP-1. Примеры таких пептидов включают в себя: пептид, имеющий аминокислотную последовательность GLP-1 с делецией, замещением или присоединением одной или нескольких аминокислот; пептид, имеющий аминокислотную последовательность GLP-1 с консервативным замещением одной или нескольких аминокислот; модифицированный GLP-1; фрагмент GLP-1, имеющий активность GLP-1; удлиненный GLP-1, имеющий активность GLP-1; и эксендин-4 ("Ех-4" означает эксендин-4 в данном описании патента) и его аналог (Curr. Opin. Investig. Drugs 8, 842-8 (2007), J. Pharmacol. Exp. Ther. 307, 490-496 (2003), Diabetes 50, 2530-9 (2001), etc.).
Термин "аминокислота", используемый здесь, используют в самом широком смысле и включает в себя не только природные аминокислоты, но также и неприродные аминокислоты, например разновидности аминокислот и их производные. Принимая во внимание это широкое определение, специалисты в данной области могут понять, что примеры аминокислот, используемых здесь, включают в себя природные протеиногенные L-аминокислоты; D-аминокислоты; химически модифицированные аминокислоты, например разновидности аминокислот и их производные, природные непротеиногенные аминокислоты, например норлейцин, β-аланин и орнитин; и химически синтезированные соединения, имеющие свойства, характерные для аминокислот, известных в данной области. Примеры таких неприродных аминокислот включают в себя α-метиламинокислоты (α-метилаланин и т.п.), D-аминокислоты, гистидиноподобные аминокислоты (2-аминогистидин, β-гидроксигистидин, гомогистидин, α-фторметилгистидин и α-метилгистидин и т.п.), аминокислоты, имеющие дополнительные метиленовые группы в боковой цепи ("гомо"аминокислоты) и аминокислоты, в которых карбоксильная функциональная группа в боковой цепи замещена группой сульфокислоты (цистеиновая кислота и т.п.). Известно, что некоторые аналоги GLP-1, имеющие активность GLP-1, содержат неприродные аминокислоты. В предпочтительном аспекте аминокислоты, входящие в состав соединения настоящего изобретения, состоят только из природных аминокислот.
В предложении "деления, замещение или присоединением одной или нескольких аминокислот", используемом здесь, число замещенных аминокислот и т.д. необязательно ограничено, если активность GLP-1 сохраняется. Число замещенных аминокислот и т.д. находится в диапазоне от 1 приблизительно до 9, предпочтительно от 1 приблизительно до 5, более предпочтительно от 1 приблизительно до 3 или находится в пределах 20%, составляя предпочтительно в пределах 10% от общей длины. Замещенные или присоединенные аминокислоты могут представлять собой природные аминокислоты, неприродные аминокислоты или аналоги аминокислот и предпочтительно являются природными аминокислотами. Примеры пептида GLP-1, содержащего "делецию, замещение или присоединение одной или нескольких аминокислот" включают в себя BIM51077, где каждый из 8Ala и 35Gly в GLP-1 замещены неприродной аминокислотой α-метилаланином (также обозначаемой как аминоизомасляная кислота или Aib); его 37Gly вычеркнут из цепочки; и его 36Arg превращен в амид (Curr. Opin. Investig. Drugs 8, 842-8 (2007)).
Термин "консервативное замещение одной или нескольких аминокислот" используемый здесь, относится к аминокислотному замещению, при котором исходная аминокислота замещается на аминокислоту, имеющую индексы гидрофильности и/или гидрофобности, подобные принадлежащим исходной аминокислоте, и не приводит к заметному уменьшению или потере активности GLP-1 после замещения.
"Модифицированный GLP-1", использованный здесь, представляет собой соединение, в котором GLP-1 подвержен природной или искусственной модификации. Примеры такой модификации включают в себя алкилирование, ацилирование (например, ацетилирование), амидирование, карбоксилирование, этерификацию, образование дисульфидных связей, гликозилирование, липидирование, фосфорилирование, гидроксилирование и мечение одного или нескольких аминокислотных остатков GLP-1.
"Фрагмент GLP-1, имеющий активность GLP-1", использованный здесь, представляет собой пептид, в котором пропущена одна или несколько аминокислот с N-конца и/или С-конца GLP-1 и который сохраняет активность GLP-1.
"Удлиненный GLP-1, имеющий активность GLP-1", используемый здесь, представляет собой пептид, в котором добавлена одна или несколько аминокислот с N-конца и/или С-конца GLP-1 и который сохраняет активность GLP-1 (см., например, Endocrinology, 125, 3109-14 (1989)).
В предложении "пептид, содержащий одну или несколько аминокислот, дополнительно присоединенных к С-концу (положение 37) GLP-1", использованном здесь, аминокислоты, присоединенные к С-концу GLP-1, последовательно относятся к аминокислоте в положении 38, аминокислоте в положении 39 и т.д. В предложении "пептид, содержащий одну или несколько аминокислот, дополнительно присоединенных к N-концу (положение 7) GLP-1", аминокислоты, присоединенные к N-концу GLP-1 соответственно, относятся к аминокислоте в положении 6, аминокислоте в положении 5 и т.д. Примеры "пептида, содержащего одну аминокислоту, дополнительно присоединенную к С-концу (положение 37) GLP-1" включают в себя пептид, содержащий Asn или Cys, присоединенные к 37Gly в GLP-1.
"Пептид GLP-1, модифицированный олигосахаридной цепью (гликозилированный пептид GLP-1, конъюгат пептида GLP-1 с углеводной цепью)" настоящего изобретения отличается тем, что по меньшей мере одна аминокислота замещена олигосахаридной цепью, присоединенной к аминокислоте.
"Пептид GLP-1, модифицированный олигосахаридной цепью", используемый здесь, включает в себя пептид, в котором по меньшей мере одна аминокислота GLP-1 замещена аминокислотой, модифицированной олигосахаридной цепью и пептидом, в котором по меньшей мере одна аминокислота аналога GLP-1 замещена аминокислотой, модифицированной олигосахаридной цепью. Такие пептиды внедряются в пептид GLP-1, модифицированный олигосахаридной цепью, даже когда они дополнительно содержат делецию, замещение или присоединение одной или нескольких аминокислот за исключением аминокислот, связанных с олигосахаридной цепью. Пептид, в котором С-конец любого из этих пептидов подвергнут амидированию (например, GLP-1(7-36)NH2, имеющий аминокислотную последовательность His-Ala-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Val-Ser-Ser-Tyr-Leu-Glu-Gly-Gln-Ala-Ala-Lys-Glu-Phe-Ile-Ala-Trp-Leu-Val-Lys-Gly-Arg-NH2 (SEQ ID №:3), где по меньшей мере одна аминокислота замещена аминокислотой, модифицированной олигосахаридной цепью, также внедряется в пептид GLP-1, модифицированный олигосахаридной цепью. Соли этих пептидов также внедряются в пептид GLP-1, модифицированный олигосахаридной цепью.
Соли, использованные здесь, могут представлять собой аддитивные соли кислоты и аддитивные соли основания. Кислотами, используемыми для получения аддитивных солей кислоты, являются неорганические кислоты, например хлористоводородная кислота, бромистоводородная кислота, йодистоводородная кислота, серная кислота и фосфорная кислота, и органические кислоты, например п-толуолсульфокислота, метансульфокислота, щавелевая кислота, п-бромфенилсульфокислота, карбоновая кислота, янтарная кислота, лимонная кислота и уксусная кислота. Примеры аддитивных солей основания включают в себя соли, полученные на основе гидроксида аммония или гидроксидов щелочных или щелочно-земельных металлов, и соли, полученные на основе неорганических оснований, например карбоната и бикарбоната. Особенно предпочтительными являются фармацевтически приемлемые соли.
Термин "аминокислота, модифицированная олигосахаридной цепью", использованный здесь, представляет собой аминокислоту, связанную с олигосахаридной цепью. В контексте данной работы олигосахаридная цепь может быть присоединена к аминокислоте при помощи линкера. Место на олигосахаридной цепи, к которому присоединяется аминокислота, не является строго лимитированным. Предпочтительно, аминокислота связана с восстанавливающей концевой группой олигосахаридной цепи.
Тип аминокислоты, связанной с олигосахаридной цепью, не является строго лимитированным и могут быть использованы как природные, так и неприродные аминокислоты. Исходя из того, что аминокислота, связанная с олигосахаридные цепью, структурно является такой же или подобной той, которая находится в форме гликопептида (гликопротеина) in vivo, аминокислота, модифицированная олигосахаридной цепью, предпочтительно представляет собой Asn, связанный с олигосахаридной цепью, например с N-связанной олигосахаридной цепью, или Ser, связанный с или Thr, связанный с олигосахаридной цепью, например с O-связанной олигосахаридной цепью, особенно предпочтительным является Asn, связанный с олигосахаридной цепью.
Когда олигосахаридная цепь присоединена к аминокислоте через линкер, аминокислота в составе конъюгата с олигосахаридной цепью является: аминокислотой, содержащей две или несколько карбоксильных групп в молекуле, например аспарагиновая кислота или глутаминовая кислота; аминокислотой, содержащей две или несколько аминогрупп в молекуле, например лизин, аргинин, гистидин или триптофан; аминокислотой, содержащей гидроксильную группу в молекуле, например серин, треонин или тирозин, аминокислотой, содержащей тиольную группу в молекуле, например цистеин; или аминокислотой, содержащей амидную группу в молекуле, например аспарагин или глутамин, с точки зрения более легкого связывания с линкером. Особенно, с точки зрения реакционной способности, предпочтительными являются аспарагиновая кислота, глутаминовая кислота, лизин, аргинин, серин, треонин, цистеин, аспарагин или глутамин.
Конъюгаты олигосахаридных цепей с пептидами GLP-1 настоящего изобретения существенно не отличаются как регуляторы увеличения уровня сахара в крови от конъюгата Asn с олигосахаридной цепью (без линкера) и конъюгата Cys с олигосахаридной цепью (через линкер) в качестве аминокислоты, модифицированной олигосахаридной цепью, когда они содержат олигосахаридные цепи одинаковой структуры, те же самые структуры за исключением структуры олигосахаридных цепей, одинаковые центры присоединения олигосахаридных цепей и одинаковое число присоединенных олигосахаридных цепей.
Когда олигосахаридную цепь присоединяют к аминокислоте с помощью линкера, могут быть использованы любые линкеры, широко используемые в данной области. Примеры таких линкеров могут включать в себя: -NH-(CO)-(CH2)a-CH2-, где "а" является целым числом, предпочтительно целым числом от 0 до 4, но не ограничиваются этими числами за исключением случаев, когда подавляются интересующие нас линкерные функции; C1-10 полиметилен и -CH2-R-, где R является группой, образующейся при отщеплении одного атома водорода от группы, выбранной из группы, состоящей из алкила, замещенного алкила, алкенила, замещенного алкенила, алкинила, замещенного алкинила, арила, замещенного арила, карбоциклической группы, замещенной карбоциклической группы, гетероциклической группы и замещенной гетероциклической группы; и -(СО)-(СН2)а-(СО)-, где "а" является целым числом, предпочтительно целым числом от 0 до 4, но не ограничиваются этими числами за исключением случаев, когда подавляются интересующие нас линкерные функции.
В аминокислоте, модифицированной олигосахаридной цепью, когда олигосахаридная цепь присоединена к аминокислоте, входящей в состав GLP-1 при помощи линкера, линкер также предпочтительно содержит аминокислоту на конце, связанном с олигосахаридной цепью. Предпочтительные примеры типов аминокислоты могут включать в себя, но не ограничиваться Asn.
Пептид GLP-1, модифицированный олигосахаридной цепью, содержащий аминокислоту, модифицированную олигосахаридной цепью, в котором олигосахаридная цепь связана с аминокислотой без линкера, может обладать более низкой антигенностью, чем пептид GLP-1, модифицированный олигосахаридной цепью, в котором олигосахаридная цепь связана с аминокислотой через линкер. Пептид GLP-1, модифицированный олигосахаридной цепью, содержащий аминокислоту, модифицированную олигосахаридной цепью, в котором олигосахаридная цепь связана с аминокислотой через линкер, может обладать более высокой стабильностью в кровотоке, чем пептид GLP-1, модифицированный олигосахаридной цепью, в котором олигосахаридная цепь связана с аминокислотой без линкера.
Способ получения пептида GLP-1, модифицированного олигосахаридной цепью, настоящего изобретения не ограничивается каким-либо способом описания (например, описанием, утверждающим: "пептид GLP-1, модифицированный олигосахаридной цепью, где аминокислота замещена аминокислотой, модифицированной олигосахаридной цепью"). Пептид GLP-1, модифицированный олигосахаридной цепью, полученный любым из следующих процессов А - С, включен в "пептид GLP-1, модифицированный олигосахаридной цепью, в котором аминокислота замещена аминокислотой, модифицированной олигосахаридной цепью". Более того, например: пептид GLP-1, модифицированный олигосахаридной цепью, где олигосахаридная цепь, не связанная с аминокислотой, соединяется напрямую или через линкер с аминокислотой в пептиде; пептид GLP-1, модифицированный олигосахаридной цепью, где уже присоединенная олигосахаридная цепь дополнительно удлиняется присоединением к ней сахара или олигосахаридной цепи; пептид GLP-1, модифицированный олигосахаридной цепью, в котором одна или несколько аминокислот, связанные с амино и/или карбоксильными группами аминокислоты, модифицированной олигосахаридной цепью, дополнительно присоединяются к одному или нескольким фрагментам GLP-1; и пептид GLP-1, модифицированный олигосахаридной цепью, в котором связанная с олигосахаридной цепью аминокислота присоединена через линкер с аминокислотой в пептиде, также внедряется в пептид GLP-1, модифицированный олигосахаридной цепью настоящего изобретения при условии, что конечные структуры согласуются с этим.
Число замещений, соответствующих замещению аминокислоты GLP-1 аминокислотой, модифицированной олигосахаридной цепью, может быть согласовано соответствующим образом со стабильностью в кровотоке, биологической активностью (например, способностью регулирования уровня сахара в крови), числом аминокислот, находящихся в конечном пептиде GLP-1, модифицированном олигосахаридной цепью, молекулярной массой пептида GLP-1, модифицированного олигосахаридной цепью до и после присоединения олигосахаридной цепи, и т.д. Например, предпочтительными являются от 1 до 5 замещений, и более предпочтительны от 1 до 3 замещений. В одном из аспектов настоящего изобретения, предпочтительными являются по меньшей мере 2 замещения, например предпочтительным является от 2 до 5 замещений, и более предпочтительным является от 2 до 3 замещений. Предпочтительно, с точки зрения удобства может быть выбрано одно замещение, если это одно замещение приводит к желаемой активности. Обычно пептид GLP-1, модифицированный олигосахаридной цепью, в котором одна аминокислота пептида GLP-1 замещена аминокислотой, модифицированной олигосахаридной цепью, проявляет повышенную стабильности в кровотоке и пониженную способность регулирования уровня сахара в крови, если одна или несколько аминокислот за исключением аминокислот, модифицированных олигосахаридной цепью, дополнительно замещены аминокислотой, модифицированной олигосахаридной цепью (однако пониженная способность регулирования уровня сахара в крови может быть компенсирована повышенной стабильностью в кровотоке).
В пептиде GLP-1, модифицированном олигосахаридной цепью, настоящего изобретения центр замещения аминокислоты аминокислотой, модифицированной олигосахаридной цепью, может быть соответствующим образом адаптирован к стабильности в кровотоке или способности регулирования уровня сахара в крови.
В одном из аспектов настоящего изобретения центр замещения аминокислоты GLP-1 аминокислотой, модифицированной олигосахаридной цепью, может быть выбран из любых центров GLP-1 в соответствии с желаемой активностью и является, например, по меньшей мере, одним из центров, выбранных из положений 8, 9, 12, 18, 19, 20, 22, 26, 30, 34, 36 и 38 (= присоединению аминокислоты, модифицированной олигосахаридной цепью к аминокислоте в положении 37) в GLP1, предпочтительно по меньшей мере, одним из центров, выбранных из положений 18, 20, 22, 26, 30, 34, 36 и 38, e.g., например одним из центров, выбранных из положений 18, 26, 30, 34 и 36, и особенно одним из центров, выбранных из положений 30 и 36.
В одном из аспектов настоящего изобретения с точки зрения стабильности пептида GLP-1, модифицированного олигосахаридной цепью, в крови центр замещения аминокислоты аминокислотой, модифицированной олигосахаридной цепью, может быть выбран из любых центров GLP-1 и является, например, по меньшей мере, одним из центров, выбранных из положений 9, 10, 11, 12, 14, 16, 18, 19, 20, 22, 24, 25, 26, 27, 28, 30, 32, 34, 36 и 38 (= присоединению аминокислоты, модифицированной олигосахаридной цепью к аминокислоте в положении 37) в GLP1, предпочтительно по меньшей мере одним из центров, выбранных из положений 9, 10, 11, 12, 14 и 28, и особенно одним из центров, выбранных из положений 9, 10, 11 и 12. В частности, замещение аминокислоты в центре, близком к N-концу, GLP-1 также является предпочтительным. В частности, примеры центров замещения по меньшей мере двух аминокислот GLP-1 аминокислотами, модифицированными олигосахаридной цепью, могут включать в себя замещение в положении 18 и 36, замещение в положении 26 и 34, замещение в положении 22 и 30, замещение в положении 22 и 36 и замещение в положении 30 и 36 в GLP-1.
В одном из аспектов настоящего изобретения с точки зрения эффекта контроля за уровнем сахара в крови пептидом GLP-1, модифицированным олигосахаридной цепью, центр замещения аминокислоты аминокислотой, модифицированной олигосахаридной цепью, является, например, одним из центров, выбранных из положений 18, 19, 20, 22, 26, 30, 34, 36 и 38 (= присоединению аминокислоты, модифицированной олигосахаридной цепью к аминокислоте в положении 37) в GLP1, предпочтительно по меньшей мере, одним из центров, выбранных из положений 18, 26, 30, 34 и 36, и особенно одним из центров, выбранных из положений 30 и 36. В частности, примеры центров замещения по меньшей мере двух аминокислот GLP-1 аминокислотами, модифицированными олигосахаридной цепью, могут включать в