Способ лечения путем применения комбинированной терапии
Иллюстрации
Показать всеИзобретение относится к способу лечения пролиферативного заболевания у субъекта, включающему введение субъекту (а) терапевтически эффективного количества AC220 или его соли в дозе от примерно 27 до 1000 мг/день, и (b) второго агента, выбранного из азацитидина, цитарабина, этопозида, даунорубицина, кладрибина, где азацитидин вводят в дозе 50-100 мг/м2/день, цитарабин вводят в дозе от 5 мг/м2/день до 3 г/м2/день, этопозид вводят в дозе 10-150 мг/м2/день и даунорубицин вводят в дозе 10-60 мг/м2/день. Изобретение позволяет расширить арсенал лекарственных средств для лечения пролиферативных заболеваний, включающих рак. 38 з.п. ф-лы, 10 ил., 26 табл., 9 пр.
Реферат
СПОСОБ ЛЕЧЕНИЯ ПУТЕМ ПРИМЕНЕНИЯ КОМБИНИРОВАННОЙ ТЕРАПИИ
Родственные заявки
Настоящая заявка заявляет приоритет предварительных заявок США: заявки № 61/202647, поданной 23 марта 2009 года; № 61/173803, поданной 29 апреля 2009 года; и № 61/266989, поданной 4 декабря 2009 года. Раскрытия вышеупомянутых заявок включены в настоящее изобретение посредством ссылки во всей их полноте.
Область изобретения
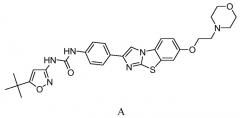
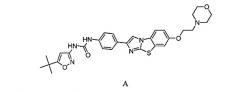
Настоящее изобретение относится к комбинированной терапии для лечения пролиферативного заболевания. Дополнительно в изобретении рассмотрены способы введения N-(5-трет-бутил-изоксазол-3-ил)-N'-{4-[7-(2-морфолин-4-ил-этокси)имидазо[2,1-b][1,3]бензотиазол-2-ил]фенил}мочевины или ее фармацевтически приемлемой соли, гидрата, сольвата или пролекарства, в комбинации с химиотерапевтическим агентом, таким как нуклеозидный аналог, антрациклин, ингибитор топоизомеразы или с их комбинацией. В конкретных вариантах осуществления способы предназначены для лечения рака.
Уровень изобретения
В последнее время во всем мире рак является одной из десяти ведущих причин смерти. Например, в 2007 году смертность от рака составила 7,9 миллионов случаев (примерно 13% всех случаев смерти). Согласно отчету за 2008 год Международного агентства исследования рака (IARC), являющегося подразделением Всемирной организации здравоохранения (ВОЗ), уровень заболеваемости раком в мире в период от 1975 года до 2000 года удвоился, и предполагается, что рак станет ведущей причиной смерти в мире к 2010 году.
Гематологические злокачественные заболевания, такие как лейкоз, лимфома, множественная миелома и другие раковые заболевания, связанные с кровью и органами кроветворения, занимают пятое место среди наиболее частых случаев рака и являются второй основной причиной смерти среди смертности от рака. Несмотря на последние разработки новых противораковых агентов, в существующих способах терапии гематологических злокачественных заболеваний по прежнему доминирует применение лекарств для лечения солидных опухолей.
Известно противораковое действие N-(5-трет-бутил-изоксазол-3-ил)-N'-{4-[7-(2-морфолин-4-ил-этокси)имидазо[2,1-b][1,3]бензотиазол-2-ил]фенил}мочевины или AC220. Опубликованы предложения по лечению ряда раковых заболеваний с помощью AC220. Описаны разные схемы введения, например, в опубликованных патентных заявках США № US 2007/0232604, US 2009/0123418, US 2009/0131426, которые включены в изобретение посредством ссылки во всей их полноте.
В настоящее время существует потребность в разработке лечения пролиферативных заболеваний, включающих рак.
Сущность раскрытия
В одном варианте осуществления в изобретении рассматривается способ лечения пролиферативного заболевания, содержащий совместное введение нуждающемуся в этом пациенту терапевтически эффективного количества (a) нуклеозидного аналога, антрациклина, ингибитора топоизомеразы или их комбинации; и (b) соединения, имеющего структурную формулу (I) или его соль, сольват, гидрат, сложный эфир и/или пролекарство. В одном варианте осуществления нуклеозидный аналог представляет собой антиметаболит неопластической клетки. В одном варианте осуществления изобретение относится к способу лечения гематологического неопластического заболевания, при этом указанный способ содержит совместное введение нуждающемуся в этом пациенту терапевтически эффективного количества (a) нуклеозидного аналога, и указанный нуклеозидный аналог представляет собой антиметаболит неопластической клетки; антрациклин; ингибитор топоизомеразы; или их комбинацию; и (b) соединения, имеющего структурную формулу (I) или его соли, сольвати, гидрати, сложного эфира и/или пролекарства.
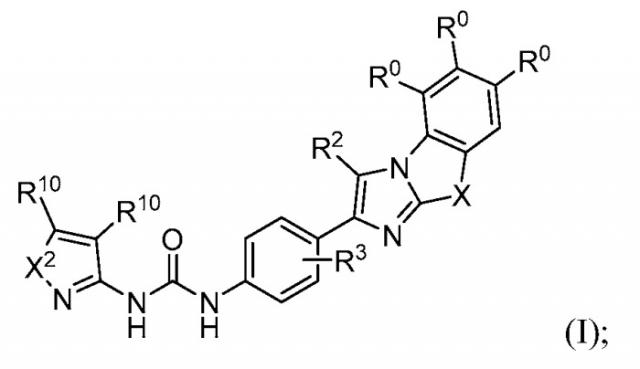
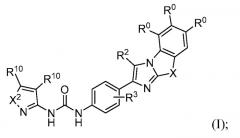
Соединение формулы (I) представляет собой:
в которой
X2 представляет собой -О- или -S-;
X представляет собой -S-, -N(R5)- или -O-;
два из трех R0 представляют собой водород; и другой R0 представляет собой галоген, гидрокси, необязательно замещенный алкил, необязательно замещенный алкокси, или
Y представляет собой -О-, -S-, -N(R14)- или -C(H)R15-;
K представляет собой -O(CH2)q-, -C(O), -C(O)NH(CH2)q-, -(CH2)qO-, или -(CH2)qO(CH2)q-;
p является целым числом от 0 до 2;
каждый q независимо является целым числом от 1 до 4;
R2 представляет собой водород, галоген, нитро, циано, необязательно замещенный алкил, -OR12, -SR12, -N(R12)2, -S(O)tR13, -C(O)R12, -C(O)OR12, -C(O)N(R12)2, -C(O)SR12 или -N(R12)S(O)tR13;
R3 представляет собой водород, галоген, нитро, циано, необязательно замещенный алкил, -OR12, -SR12, -N(R12)2, -S(O)tR13, -C(O)R12, -C(O)OR12, -C(O)N(R12)2, -C(O)SR12 или -N(R12)S(O)tR13;
R5 представляет собой водород или необязательно замещенный алкил;
каждый R10 независимо выбирают из водорода, галогена, необязательно замещенного алкила, необязательно замещенного циклоалкила или необязательно замещенного арила;
каждый R12 независимо выбирают из группы, состоящей из водорода, необязательно замещенного алкила, необязательно замещенного алкенила, необязательно замещенного алкинила, необязательно замещенного циклоалкила, необязательно замещенного циклоалкилалкила, необязательно замещенного арила, необязательно замещенного аралкила, необязательно замещенного гетероциклила, необязательно замещенного гетероциклилалкила, необязательно замещенного гетероарила и необязательно замещенного гетероаралкила;
R13 представляет собой необязательно замещенный алкил;
R14 представляет собой водород, необязательно замещенный алкил, -C(O)OR12, -C(O)SR12, -C(O)NR12 или -S(O)tR13;
R15 представляет собой водород или необязательно замещенный алкил; и
t равен 1 или 2.
В другом варианте осуществления изобретение относится к упаковке комбинации, содержащей:
(a) по меньшей мере одну отдельную дозу нуклеозидного аналога, антрациклина, ингибитора топоизомеразы или их комбинации; и (b) по меньшей мере одну отдельную дозу соединения со структурной формулой (I), описанного выше, или его соли, сольвата, сложного эфира и/или пролекарства.
В другом варианте осуществления изобретение относится к упаковке комбинации, содержащей:
(a) по меньшей мере одну отдельную дозу нуклеозидного аналога, при этом нуклеозидный аналог представляет собой антиметаболит неопластической клетки, и (b) по меньшей мере одну отдельную дозу соединения со структурной формулой (I), описанного выше, или его соли, сольвата, сложного эфира и/или пролекарства.
В другом варианте осуществления изобретение относится к упаковке комбинации, содержащей:
(a) по меньшей мере одну отдельную дозу антрациклина, ингибитора топоизомеразы или их комбинации; и (b) по меньшей мере одну отдельную дозу соединения со структурной формулой (I), описанного выше, или его соли, сольвата, сложного эфира и/или пролекарства.
В другом варианте осуществления изобретение относится к фармацевтической композиции, содержащей терапевтически эффективное количество (a) нуклеозидного аналога, антрациклина, ингибитора топоизомеразы или их комбинации; и (b) соединения со структурной формулой (I), описанного выше, или его соли, сольвата, сложного эфира и/или пролекарства.
В другом варианте осуществления изобретение относится к фармацевтической композиции, содержащей терапевтически эффективное количество (a) нуклеозидного аналога, при этом нуклеозидный аналог представляет собой антиметаболит неопластической клетки; и (b) соединения со структурной формулой (I), как описано выше, или его соли, сольвата, сложного эфира и/или пролекарства.
В другом варианте осуществления изобретение относится к фармацевтической композиции, содержащей терапевтически эффективное количество (a) антрациклина, ингибитора топоизомеразы, или их комбинации; и (b) соединения со структурной формулой (I), как описано выше, или его соли, сольвата, сложного эфира и/или пролекарства.
В конкретных вариантах осуществления изобретение рассматривает способы лечения, предупреждения или контроля пролиферативного заболевания. В конкретных вариантах осуществления способы содержат введение субъекту терапевтически или профилактически эффективного количества AC220 или его фармацевтически приемлемого пролекарства, соли, сольвата или гидрата в комбинации со вторым противораковым агентом. В одном варианте осуществления вторым агентом является нуклеозидный аналог, антрациклин, ингибитор топоизомеразы или их комбинации. В одном варианте осуществления вторым агентом является нуклеозидный аналог, при этом нуклеозидный аналог представляет собой антиметаболит неопластической клетки. В одном варианте осуществления вторым агентом является антрациклин, ингибитор топоизомеразы или их комбинация. В одном варианте осуществления ингибитор топоизомеразы выбирают из амсакрина, этопозида, этопозида фосфата и тенипозида. В одном варианте осуществления ингибитором топоизомеразы является этопозид. В одном варианте осуществления антрациклин выбирают из даунорубицина, доксорубицина, эпирубицина, идарубицина, митоксантрона, амрубицина и валрубицина. В одном варианте осуществления антрациклином является даунорубицин. В одном варианте осуществления второй агент представляет собой цитарабин, даунорубицин, этопозид или их комбинацию.
В одном варианте осуществления рассматриваемые способы включают введение AC220 или его фармацевтически приемлемой соли, пролекарства, сольвата или гидрата в комбинации с цитарабином, который вводят интратекально в дозе от около 5 мг/м2 до около 75 мг/м2 один раз в день или один раз каждые четыре дня, или около 30 мг/м2 каждые четыре дня, в другом варианте осуществления цитарабин вводят внутривенно от около 5 мг/м2/день до около 3 г/м2/день или от около 100 мг/м2/день до около 200 мг/м2/день. В одном варианте осуществления AC220 вводят один раз в день в течение одной недели, двух недель, трех недель, четырех недель или пяти недель. Введение цитарабина можно осуществлять путем внутривенного вливания, внутривенного прерывистого вливания, с помощью болюсного вливания или подкожной инъекции. В одном варианте осуществления введение цитарабина проводят в течение 5 дней. В одном варианте осуществления введение цитарабина проводят в течение 7 дней. В одном варианте осуществления введение цитарабина проводят в дни от 1 до 5. В одном варианте осуществления введение цитарабина проводят в дни от 1 до 7.
В одном варианте осуществления представленные способы включают введение AC220 или его фармацевтически приемлемой соли, пролекарства, сольвата или гидрата в комбинации с этопозидом в количестве от около 10 мг/м2 до около 150 мг/м2. Например, один вариант осуществления включает введение этопозида в дозе от около 30 до около 120 мг/м2. Один вариант осуществления включает введение этопозида в дозе около 35, 50 или 100 мг/м2. Введение этопозида можно осуществлять путем внутривенного вливания, внутривенного прерывистого вливания, болюсного вливания или подкожной инъекции. В одном варианте осуществления введение этопозида выполняют один раз в день в течение 5 дней, при этом AC220 вводят один раз в день в течение одной недели, двух недель, трех недель, четырех недель или пяти недель. В одном варианте осуществления введение этопозида выполняют один раз в день в дни 1, 3 и 5, при этом введение AC220 выполняют один раз в день в течение одной недели, двух недель, трех недель, четырех недель или пяти недель.
В одном варианте осуществления представленные способы включают введение AC220 или его фармацевтически приемлемой соли, пролекарства, сольвата или гидрата в комбинации с даунорубицином в количестве от около 10 мг/м2 до около 50 мг/м2. Например, один вариант осуществления включает введение даунорубицина в дозе от около 20 до около 50 мг/м2. Один вариант осуществления включает введение даунорубицина в дозе около 25, 30 или 45 мг/м2. Введение даунорубицина можно осуществлять путем внутривенного вливания, внутривенного прерывистого вливания, болюсного вливания или подкожной инъекции. В одном варианте осуществления введение даунорубицина выполняют один раз в день в 1, 2 и 3 дни, при этом AC220 вводят один раз в день в течение одной недели, двух недель, трех недель, четырех недель или пяти недель. В одном варианте осуществления введение даунорубицина выполняют один раз в день на 1 и 2 день, при этом AC220 вводят один раз в день в течение одной недели, двух недель, трех недель, четырех недель или пяти недель. В одном варианте осуществления введение даунорубицина выполняют один раз в день в 1 день, при этом AC220 вводят один раз в день в течение одной недели, двух недель, трех недель, четырех недель или пяти недель.
В одном варианте осуществления представленные способы включают введение AC220 или его фармацевтически приемлемой соли, пролекарства, сольвата или гидрата в комбинации с цитарабином и даунорубицином.
В конкретных вариантах осуществления недельным циклом считается введение через неделю AC220 и вторых агентов, выбираемых из нуклеозидного аналога, антрациклина, ингибитора топоизомеразы и их комбинации, как указано выше. Предполагается, что способы осуществляют в виде одного недельного цикла, необязательно с периодом выжидания от одного дня до нескольких дней или от одной недели до нескольких недель, во время которых не вводят ни второй агент, ни AC220, и затем повторяют недельный цикл. Указанные способы также предполагают постоянное повторение недельных циклов, например, в течение 2-5 недель. Дополнительно, эти способы предполагают повторение цикла в виде нескольких циклов, с периодом выжидания от одного дня до нескольких дней или от одной недели до нескольких недель, во время которых не вводят ни AC220, ни второй агент, и затем повторяют один или больше циклов. Наконец, способы по изобретению рассматривают введение AC220/второго агента в виде недельного цикла, с последующим циклом введения второго агента или AC220 единственных.
Также изобретение рассматривает способ ингибирования клеточного роста, который содержит контакт клетки с эффективным количеством AC220 или его фармацевтически приемлемым пролекарством, солью, сольватом или гидратом в комбинации со вторым противораковым агентом, выбранным из антрациклина, ингибитора топоизомеразы и их комбинаций.
Краткое описание фигур
Фигура 1 представляет собой график эффективности контроля опухолевого роста с помощью введения AC220 плюс цитарабин (с совпадающим по времени введением) при сравнении с введением контроля, AC220 единственного и цитарабина единственного.
Фигура 2 представляет собой график эффективности контроля опухолевого роста с помощью введения AC220 плюс цитарабин (при последовательном введении) при сравнении с введением контроля, AC220 единственного и цитарабина единственного.
Фигура 3 представляет собой график эффективности контроля опухолевого роста с помощью введения AC220 плюс азацитидин (с совпадающим по времени введением) при сравнении с введением контроля, AC220 единственного и азацитидина единственного.
Фигура 4 представляет собой график эффективности контроля опухолевого роста с помощью введения AC220 плюс азацитидин (при последовательном введении) при сравнении с введением контроля, AC220 единственного и азацитидина единственного.
Фигура 5А показывает эффект введения AC220 в комбинации с этопозидом, который определяют по 10%, 25%, 50%, 75%, 90% и 95%-ому ингибированию роста клеток MV4-11 при сопутствующем введении.
Фигура 5B показывает эффект введения AC220 в комбинации с этопозидом, который определяют по 10%, 25%, 50%, 75%, 90% и 95%-ному ингибированию роста клеток MV4-11 при введении этопозида за 1 день до введения AC220.
Фигура 6A показывает эффект AC220 в комбинации с даунорубицином, который определяют по 10%, 25%, 50%, 75%, 90% и 95%-ому ингибированию роста клеток MV4-11 при сопутствующем введении.
Фигура 6B показывает эффект введения AC220 в комбинации с даунорубицином, который определяют по 10%, 25%, 50%, 75%, 90% и 95%-ому ингибированию роста клеток MV4-11 при введении даунорубицина за 1 день до введения AC220.
Фигура 6C показывает эффект введения AC220 в комбинации с даунорубицином, который определяют по 10%, 25%, 50%, 75%, 90% и 95%-ому ингибированию роста клеток MV4-11 при введении даунорубицина через 1 день после введения AC220.
Фигура 7 представляет собой график эффективности контроля опухолевого роста с помощью введения AC220 плюс даунорубицин на модели солидной опухоли MV4-11 при сравнении с введением контроля, AC220 единственного и даунорубицина единственного.
Подробное описание
В конкретных вариантах осуществления изобретение рассматривает способы лечения, контроля или предупреждения пролиферативных заболеваний, и указанные способы включают введение субъекту, такому как млекопитающее, нуждающемуся в таком лечении, менеджменте или предупреждении, терапевтически или профилактически эффективного количества соединения со структурной формулой (I), описанного выше, или его соли, сольвата, сложного эфира и/или пролекарства, в комбинации со вторым агентом, выбранным из нуклеозидного аналога, антрациклина, ингибитора топоизомеразы или их комбинации.
В конкретных вариантах осуществления изобретение рассматривает способы лечения, контроля или предупреждения пролиферативных заболеваний, которые содержат введение субъекту, такому как млекопитающее, нуждающемуся в таком лечении, контроле или предупреждении, терапевтически или профилактически эффективного количества AC220 или его фармацевтически приемлемой соли, пролекарства, сольвата или гидрата, в комбинации со вторым агентом, выбранным из нуклеозидного аналога, антрациклина, ингибитора топоизомеразы или их комбинации.
В конкретных вариантах осуществления изобретение рассматривает способы лечения, контроля или предупреждения пролиферативных заболеваний, которые включают введение субъекту, такому как млекопитающее, нуждающемуся в таком лечении, контроле или предупреждении, терапевтически или профилактически эффективного количества AC220 или его фармацевтически приемлемой соли, пролекарства, сольвата или гидрата, в комбинации со вторым агентом, выбранным из антрациклина и ингибитора топоизомеразы.
В конкретных вариантах осуществления изобретение относится к способам и композициям для лечения гематологического неопластического заболевания путем комбинированного применения нуклеозидного аналога, антрациклина, ингибитора топоизомеразы или их комбинации, и соединения со структурной формулой (I), описанного выше, или его соли, сольвата, сложного эфира и/или пролекарства.
В конкретных вариантах осуществления изобретение относится к способам и композициям для лечения гематологического неопластического заболевания путем комбинированного применения нуклеозидного аналога и соединения со структурной формулой (I), описанного выше, или его соли, сольвата, сложного эфира и/или пролекарства.
В одном варианте осуществления способы охватывают лечение, предупреждение или контроль ряда раковых заболеваний, выбираемых из рака мочевого пузыря, рака молочной железы, рака шейки матки, рака ЦНС, рака толстой кишки, рака пищевода, рака головы и шеи, рака печени, рака легкого, рака носоглотки, нейроэндокринного рака, рака яичника, рака поджелудочной железы, рака предстательной железы, рака почки, рака слюнной железы, мелкоклеточного рака легкого, рака кожи, рака желудка, рака яичка, рака щитовидной железы, рака матки или гематологического злокачественного заболевания. Рак может быть рецидивирующим, рефрактерным или резистентным к общепринятой терапии.
В конкретных вариантах осуществления рассматриваемые в изобретении способы предусматривают введение AC220 или его фармацевтически приемлемой соли, пролекарства, сольвата или гидрата в комбинации со вторым активным агентом, выбранным из клофарабина, цитарабина, даунорубицина и этопозида, или их комбинацией. В конкретных вариантах осуществления в рассматриваемых в изобретении способах вводят AC220 или его фармацевтически приемлемую соль, пролекарство, сольват или гидрат в комбинации со вторым активным агентом, выбранным из даунорубицина и этопозида. Ниже представлены конкретные дозы и схемы введения указанных комбинаций.
A. Определения
Для облегчения понимания раскрытия настоящего изобретения ниже приведены определения ряда терминов.
Используемая в изобретении номенклатура и лабораторные методики органической химии, лекарственной химии, биохимии, биологии, фармакологии и другие методики, описанные в изобретении, в целом являются общеизвестными и широко применяемыми в данной области техники. Если не указано иначе, все используемые в изобретении технические и научные термины обычно имеют то же значение, как общепринято рядовыми специалистами в области техники, к которому относится настоящее раскрытие.
Термины "опухоль", "новообразование" и "неопластическая патология или заболевание" используются в изобретении взаимозаменяемо и предназначены для обозначения нежелательной клеточной пролиферации одной или больше субпопуляций клеток в многоклеточном организме, которая приводит к повреждению (то есть, к нарушению самочувствия или уменьшению продолжительности жизни) у многоклеточных организмов. В конкретных вариантах осуществления опухоль может быть доброкачественной (неинвазивной) или злокачественной (инвазивной).
Термин "рак" относится к злокачественному новообразованию, характеризующемуся нерегулируемой клеточной пролиферацией, при которой клетки теряют нормальные механизмы регуляторного контроля, которые в других случаях регулируют скорость клеточного роста. Такие нерегулируемые делящиеся клетки в процессе, называемом "метастазированием", могут распространяться во всем организме и инвазировать нормальные ткани.
Понятие "натуральный" или "нативный", используемое по отношению к биологическим материалам, таким как молекулы нуклеиновой кислоты, полипептиды, клетки-хозяева и т.п., относится к материалам, которые встречаются в природе и не обработаны человеком. Аналогично, понятия "неприродное происхождение" или "ненативный" относятся к материалу, который не встречается в природе, или подвергался структурной модификации, или синтезирован человеком.
Термины "FLT3", который обозначает FMS-связанную тирозинкиназу 3, "FLK-2", который обозначает киназу эмбриональной печени 2, "STK1", который обозначает киназу стволовой клетки 1 и кластер дифференцировки 135 (CD-135), используются в изобретении взаимозаменяемо и относятся к белку рецептора FLT3 или его варианту, описанному, например, авторами Small et al. (1994) Proc. Natl. Acad. Sci. USA 91:459-463. Варианты FLT3 включают белки, по существу гомологичные нативному FLT3, то есть, белки, имеющие одну или больше аминокислотных делеций, вставок или замен природного или неприродного происхождения (например, производные, гомологи и фрагменты FLT3), по сравнению с аминокислотной последовательностью нативного FLT3. Аминокислотная последовательность варианта FLT3 по меньшей мере примерно на 80% идентична, по меньшей мере примерно на 90% идентична, или по меньшей мере на около 95% идентична нативному FLT3. Примеры мутантных форм нативного FLT3 природного происхождения включают мутацию FLT3 ITD (внутреннюю тандемную дупликацию), то есть мутацию вставки внутренней тандемной дупликации, также описанную авторами Nakao et al. (1996) Leukemia 10:1911-1918, и мутацию домена тирозинкиназы FLT3, то есть бессмысленную мутацию, такую как FLT3 D835, которая также описана авторами Yamamoto et al. (2001) Blood 97 (8):2434-2439.
Термины "пролиферативная патология или заболевание" относится к нежелательной клеточной пролиферации одной или больше субпопуляций клеток в многоклеточном организме, которая приводит к повреждению (то есть, к нарушению самочувствия или уменьшению продолжительности жизни) у многоклеточных организмов. Пролиферативная патология или заболевание может возникать у разных типов животных и людей. Например, используемые в изобретении термины "пролиферативная патология или заболевание" включают неопластические патологии и другие пролиферативные патологии.
Термин "неопластическая патология или заболевание" или "рак" относится к опухоли, обусловленной патологическим или нерегулируемым клеточным ростом. Примеры неопластических патологий включают без ограничения гематопоэтические болезни, такие как миелопролиферативные болезни, тромбоцитемию, эссенциальный тромбоцитоз (ЭТ), ангиогенную миелоидную метаплазию, миелофиброз (МФ), миелофиброз с миелоидной метаплазией (МММ), хронический идиопатический миелофиброз (ХИМ), истинную полицитемию (ИП), цитопении и предзлокачественные миелодиспластические синдромы; раковые заболевания, такие как злокачественные глиомы, раковые болезни легкого, рак молочной железы, раковые болезни толстой и прямой кишки, раковые болезни предстательной железы, раковые болезни желудка, раковые болезни пищевода, раковые болезни толстой кишки, раковые болезни поджелудочной железы, раковые болезни яичника и гематологические злокачественные заболевания.
Понятие "гематологическое злокачественное заболевание" относится к раку кровеобразующей и иммунной системы организма, а именно, костного мозга и лимфатической ткани.
Примеры гематологических злокачественных заболеваний включают, например, миелодисплазию, лимфомы, лейкозы, лимфомы (неходжкинкую лимфому), болезнь Ходжкина (также называемую ходжкинской лимфомой) и миеломы, такие как острый лимфоцитарный лейкоз (ОЛЛ), острый миелоцитарный лейкоз (ОМЛ), острый промиелоцитарный лейкоз (ОПЛ), хронический лимфоцитарный лейкоз (ХЛЛ), хронический миелоцитарный лейкоз (ХМЛ), хронический нейтрофильный лейкоз (ХНЛ), острый недифференцированный лейкоз (ОНДЛ), анапластическую крупноклеточную лимфому (АККЛ), пролимфоцитарный лейкоз (ПЛЛ), ювенилный миеломоноцитарный лейкоз (ЮММЛ), T-клеточный ОЛЛ взрослых, ОМЛ с трехлинейной миелодисплазией (ОМЛ/TMDS), недифференцированный лейкоз (НЛ), миелодиспластические синдромы (МДС), миелопролиферативные болезни (МПБ) и множественную миелому (ММ).
Термин "лейкоз" относится к злокачественным новообразованиям кровеобразующих тканей и включает без ограничения хронический лимфоцитарный лейкоз, хронический миелоцитарный лейкоз, острый лимфобластный лейкоз, острый миелогенный лейкоз и острый миелобластный лейкоз. Лейкоз может быть рецидивирующим, рефрактерным или резистентным к общепринятой терапии.
Термин "рецидивирующий" относится к ситуации, когда у субъекта или млекопитающего в состоянии ремиссии рака после лечения обнаруживают возвращение раковых клеток.
Термин "рефрактерный или резистентный" относится к ситуации, когда в организме субъекта или млекопитающего даже после интенсивного лечения имеются остаточные раковые клетки.
Термин "лекарственная резистентность" относится к состоянию, когда при болезни отсутствует реакция на лечение лекарством или лекарствами. Лекарственная резистентность может быть как врожденной, что означает, что при болезни никогда не было реакции на лекарство или лекарства, или она может быть приобретенной, что означает, что болезнь прекратила реагировать на лекарство или лекарства, на которые ранее была реакция при болезни. В конкретных вариантах осуществления лекарственная резистентность является врожденной. В конкретных вариантах осуществления лекарственная резистентность является приобретенной. Предполагается, что используемый в изобретении термин "лекарственная резистентность" включает резистентность к иматинибу, резистентность к дасатинибу и/или резистентность к нилотинибу.
Термин "сверхэкспрессирует" или "сверхэкспрессия" означает, что клетка, связанная с заболеванием, нарушением или состоянием, содержит определяемый более высокий уровень белка, такого как FLT3 или FLT3, чем идентичная клетка в другой ситуации, которая не связана с заболеванием, нарушением или состоянием.
Термин "субъект" относится к животному, включающему без ограничения примата (например, человека), корову, свинью, овцу, козу, лошадь, собаку, кошку, кролика, крысу или мышь. Термины "субъект" и "пациент" использованы в изобретении взаимозаменяемо по отношению, например, к млекопитающему субъекту, такому как человек, в одном варианте осуществления, по отношению к человеку.
Понятия "лечить", "осуществлять лечение" и "лечение" включают облегчение или прекращение нарушения, заболевания или состояния, или одного или больше симптомов, связанных с нарушением, заболеванием или состоянием; или облегчение или уничтожение непосредственно причины (причин) нарушения, заболевания или состояния.
Понятия "предупреждать", "предупреждение" включают подавление симптома конкретного заболевания или нарушения. В некоторых вариантах осуществления пациенты с семейным анамнезом рака или лейкоза являются кандидатами для профилактических схем. В общем, термин "предупреждение" относится к введению препарата до начала симптомов, в частности, пациента с риском ракового заболевания.
Как используется в изобретении и если не указано иначе, понятия "контролировать", "контролирующий" и "контроль" охватывают предупреждение рецидива конкретного заболевания или нарушения у пациента, страдавшего этим заболеванием, удлинение времени ремиссии у пациента, который страдает этим заболеванием или нарушением, уменьшение смертности больных, и/или поддержание уменьшения тяжести или отсутствия симптома, связанного с контролируемым заболеванием или состоянием.
Термин "контактировать" или "контакт" относятся к совместному сближению терапевтического агента и клетки или ткани таким образом, что в результате такого контакта возникает физиологический и/или химический эффект. Контакт может иметь место in vitro, ex vivo или in vivo. В одном варианте осуществления терапевтический агент контактирует с клеткой в клеточной культуре (in vitro) для определения эффекта терапевтического агента в клетке. В другом варианте осуществления контакт терапевтического агента с клеткой или тканью включает введение терапевтического агента субъекту, имеющему клетку или ткань для контакта.
Термин "терапевтически эффективное количество" включает количество соединения, которое при введении является достаточным для предупреждения развития или для некоторого облегчения одного или больше симптомов нарушения, заболевания или состояния, которое лечат. Термин "терапевтически эффективное количество" также относится к количеству соединения, которое является достаточным для проявления биологического или клинического ответа биологической молекулы (например, белка, фермента, РНК или ДНК), клетки, ткани, системы, животного или человека, к которому стремится исследователь, ветеринар, врач или клиницист.
Понятия "совместное введение" и "в комбинации с" включают введение двух терапевтических агентов (например, AC220 и второго противоракового агента, такого как даунорубицин или этопозид) или одновременно, или в качестве сопутствующего агента, или последовательно без конкретных ограничений времени. В одном варианте осуществления оба агента присутствуют в клетке или в организме пациента в одно и то же время или проявляют свой биологический или терапевтический эффект в одно и то же время. В одном варианте осуществления два терапевтических агента находятся в одной композиции или в стандартной лекарственной форме. В другом варианте осуществления два терапевтических агента находятся в отдельных композициях или в стандартных лекарственных формах.
Используемый в изобретении термин "нуклеозидный аналог" обозначает органическое соединение, содержащее нуклеооснование, связанное с углеводным кольцом посредством атома азота нуклеооснования. В одном варианте осуществления нуклеооснование представляет собой азотистое основание. В другом варианте осуществления углеводным кольцом является сахарное кольцо. Нуклеозидный аналог необязательно содержит фосфатную группу. Примеры азотистых оснований включают без ограничения пурин и его производные, такие как аденин, гуанин и гипоксантин, и пиримидин и его производные, такие как цитозин, урацил, тимин и 4-амино-триазин-2-(1Н)-он (аза-производное цитозина). Нуклеозидный аналог, предназначенный для использования в изобретении, представляет собой антиметаболит неопластической клетки, то есть, соединение, которое нарушает биологические функции неопластических клеток. Например, нуклеозидный аналог может нарушать метилирование ДНК, синтез ДНК и другие функции, связанные с делением клетки.
Используемый в изобретении термин "антрациклин" относится к типу противоопухолевых антибиотиков, которые получают из конкретных типов бактерий Streptomyces или являются их производными.
Используемый в изобретении термин "ингибитор топоизомеразы" относится к веществу, которое блокирует ферменты топоизомеразы.
Используемое в изобретении понятие "не пропущенный день" предназначено для обозначения дня, когда вводят по меньшей мере одно из соединений формулы (I) или его соль, сольват, сложный эфир и/или пролекарство, или второй агент, такой как нуклеозидный аналог, антрациклин или ингибитор топоизомеразы.
"Одновременное введение" означает, что нуклеозидный аналог, антрациклин или ингибитор топоизомеразы и соединение со структурной формулой (I) или его соль, сольват, сложный эфир и/или пролекарство вводят в один день. Для одновременного введения нуклеозидный аналог, антрациклин или ингибитор топоизомеразы, и соединение со структурной формулой (I) или его соль, сольват, сложный эфир и/или пролекарство можно вводить в одно и то же время или по одному.
"Последовательное введение" означает, что в течение двух или больше дней постоянного совместного введения без какого-либо пропущенного дня, в любой данный день вводят только что-либо одно из нуклеозидного аналога, антрациклина или ингибитора топоизомеразы и соединения со структурной формулой (I) или его соли, сольвата, сложного эфира и/или пролекарства.
"Накладывающееся по времени введение" означает, что в течение двух или больше дней постоянного совместного введения без какого-либо пропущенного дня имеется по меньшей мере один день одновременного введения и по меньшей мере один день, когда вводят только одно из нуклеозидного аналога, антрациклина или ингибитора топоизомеразы и соединения со структурной формулой (I) или его соли, сольвата, сложного эфира и/или пролекарства.
"Введение с интервалами" означает период совместного введения по меньшей мере с одним пропущенным днем. "Непрерывное введение" означает период совместного введения без какого-либо пропущенного дня. Непрерывное введение может быть одновременным, последовательным или накладывающимся по времени, как описано выше.
Термин "фармацевтически приемлемый носитель", "фармацевтически приемлемый наполнитель", "физиологически приемлемый носитель" или "физиологически приемлемый наполнитель" относятся к фармацевтически приемлемому материалу, композиции или носителю, такому как жидкий или твердый наполнитель, разбавитель, растворитель или инкапсулирующий материал. В одном варианте осуществления каждый компонент является "фармацевтически приемлемым" в том смысле, что он совместим с другими компонентами фармацевтической рецептуры и подходит для использования в контакте с тканью или органом людей и животных без чрезмерной токсичности, раздражения, аллергической реакции, иммуногенности или других проблем или осложнений, соизмеримых с приемлемым соотношением пользы/риска. См. публикации: Remington: The Science and Practice of Pharmacy, 21st Edition, Lippincott Williams & Wilkins: Philadelphia, PA, 2005; Handbook of Pharmaceutical Excipients, 5th Edition, Rowe et al., Eds., The Pharmaceutical Press and the American Pharmaceutical Association: 2005; и Handbook of Pharmaceutical Additives, 3rd Edition, Ash and Ash Eds., Gower Publishing Company: 2007; Pharmaceutical Preformulation and Formulation, 2nd Edition, Gibson Ed., CRC Press LLC: Boca Raton, FL, 2009.
Понятие "примерно" или "около" означает приемлемую погрешность в конкретном значении, определяемую рядовым специалистом в данной области техники, которая частично зависит от методики измерения или определения значения. В конкретных вариантах осуще