Новые лекарственные средства для местного применения на основе сульфатированной гиалуроновой кислоты в качестве стимуляторов или ингибиторов цитокиновой активности
Иллюстрации
Показать всеИзобретение относится к фармацевтической промышленности и представляет собой применение сульфатированной гиалуроновой кислоты для приготовления лекарственного средства для местного применения для лечения воспалительных/вызывающих раздражение заболеваний кожи, выбранных из дерматита, атопического дерматита, фотодерматита, сыпи, витилиго, экземы, псориаза, всех раздражений кожи, связанных с активацией противовоспалительных цитокинов, таких как IL-1, IL-2, IL-7, IL-8, IL-9 и TNF, где гиалуроновая кислота имеет молекулярную массу в диапазонах от 10 000 Да до 50 000 Да, от 150 000 Да до 250 000 Да и от 500 000 Да до 750 000 Да и степень сульфатации, равную 1. Изобретение обеспечивает стимуляцию синтеза белков иммунной системы для вызова иммунного ответа. 7 н. и 1 з.п. ф-лы, 33 пр., 15 ил., 3 табл.
Реферат
Область техники, к которой относится изобретение
В течение многих лет в научной/патентной литературе публиковались данные исследования сульфатированной гиалуроновой кислоты, которая получена из гиалуроновой кислоты (HA), подходящим образом сульфатированной в соответствии со способом, описанным в уровне техники (см. патенты EP0940410B1 и EP0702699B1), которой приписывают антикоагулянтные эффекты. HAS (сульфатированная гиалуроновая кислота) может быть также получена деацетилированием и последующей сульфатацией глюкозамина HA (определяемого как HA-NS) (EP0971961B1) для получения хирургических изделий и фармацевтических композиций. Известны также патенты EP0754460B1 и EP1385492B1, в которых описано применение HAS при таких патологиях, как, например, ARDS (тяжелая респираторная недостаточность, респираторный дистресс-синдром взрослых), суставной ревматизм и ревматоидный артрит. Настоящее изобретение относится к новому и неожиданному кожному применению HAS в качестве агента, регулирующего цитокиновую активность, поскольку заявитель обнаружил исключительную способность HAS модулировать активность конкретных цитокинов (и про-, и противовоспалительных), был исследован ее механизм действия и выявлено существенное различие между двумя типами сульфатированного продукта (HAS и HA-NS), но сверх того, заявитель неожиданно обнаружил неожиданно высокую активность в отношении различных типов и штаммов вируса герпеса, цитомегаловируса и вируса везикулярного стоматита.
Наконец, еще один объект настоящего изобретения относится к применению HAS в качестве стимулятора всасывания в кожу лекарственных средств противовоспалительной и гормональной природы.
Начиная с 1970 г. ученые поняли, что выбранные популяции лимфоидных клеток могут вырабатывать и высвобождать в циркуляторное русло молекулы белковой природы, не отождествляемые с антителами, определяемые термином «цитокины». Они представляют новый тип «гормона», способного действовать на различные клетки-мишени в многочисленных областях организма.
Прогресс научных знаний, относящихся к синтезу и биологическим/биохимическим функциям указанных белков, изменил «старое» представление об иммунной системе (I.S.) в научных кругах и открыл новые горизонты в понимании ее многочисленных функций, таким образом, создавая новые перспективы для лечения различных патологий, местных и/или системных, также включая новые терапевтические возможности, связанные с иммунотерапией онкологических заболеваний.
Центральными клетками иммунной системы являются лимфоциты, которые составляют примерно 20% всех белых телец и, на основании их разнообразных функций, образуют 3 группы: B-лимфоциты, T-лимфоциты и лимфоциты-киллеры. Многие цитокины представляют собой растворимые белки, продуцируемые лимфоцитами и/или моноцитами, способные действовать на другие клетки/ткани, также расположенные очень далеко от участка их продукции. Они действительно имеют иммунологические функции, а также регуляционные функции в синтезе других цитокинов в отношении части других клеток иммунной системы или клеток-мишеней, участвующих в каскаде реакций, инициируемых иммунной системой.
До настоящего времени были исследованы многочисленные различные цитокины, также имеющие многочисленные различные акронимы, но те цитокины, которые, в частности, исследованы заявителем, представляют собой: интерлейкин 1 и 2, интерлейкин 6, 7 и 12, далее определенные в настоящем описании как IL-1, IL-2, IL-6, IL-7 и IL-12, которые с TNF (фактором опухолевого некроза) определяются как цитокины воспалительной природы, тогда как интерлейкин-10 (IL-10), напротив, представляет собой цитокин с сильными противовоспалительными свойствами.
Первый цитокин, подлежащий исследованию, представлял собой определенно IL-1: он присутствует в двух формах α и β, это мощный индуктор провоспалительных процессов (системных и/или кожных). Он главным образом продуцируется B-лимфоцитами, T-лимфоцитами и макрофагами после бактериального стимула или стимуляции со стороны других агентов, включая другие цитокины; он также секретируется из периферических нейтрофилов, эндотелиальных, эпителиальных и гладкомышечных клеток, фибробластов, клеток Лангерганса кожи, остеокластов, синовиоцитов и многих других типов клеток. Обе формы связываются с одним и тем же рецептором и имеют очень похожие, если не идентичные, виды биологической активности. Многие из их провоспалительных функций связаны со стимуляцией других цитокинов, таких как IL-6 и IL-8, и сам их синтез может быть вызван цитокинами, такими как TNF, Интерферон, бактериальные эндотоксины, вирусы и различные типы других антигенов. Он участвует в развитии септического шока, но следует отметить, что недавно проведенные исследования продемонстрировали, что IL-1 способен активировать экспрессию некоторых онкогенов и, следовательно, участвовать в патогенезе неоплазий. В комбинации с другими цитокинами IL-1, поэтому, представляет один из основных медиаторов воспалительных процессов: он стимулирует T-клетки, фактически, для продукции IL-2 и B-клетки для продукции иммуноглобулинов. Он также участвует в патогенезе ревматоидного артрита и артроза: большие количества IL-1 были в действительности обнаружены в синовиальной жидкости пациентов, пораженных ревматоидным артритом и/или остеоартрозом. Он также активен при многочисленных патологиях преимущественно кожной природы, таких как дерматит в целом, атопический дерматит и псориаз. Наконец, он участвует в образовании сосудистого повреждения, такого как венозный тромбоз, и присутствует во всех сосудах при патологиях артерио/артериосклеротического типа. Рецепторные антагонисты в настоящее время уже находят клиническое применение (и также исследуются экспериментально) для данного цитокина, поскольку оказывается, что блокада рецептора является эффективным путем лечения указанных патологий, при которых IL-1 относится к протагонистам.
TNF: Фактор некроза опухоли представляет собой часть группы цитокинов, которая содействует фазе острого системного воспаления. Поэтому TNF участвует в очень широком числе процессов, таких как клеточная пролиферация, дифференциация и апоптоз, канцерогенез и вирусная репликация.
Он главным образом продуцируется макрофагами и рядом других типов клеток, включая мастоциты, лимфоидные клетки, мышечные и эндотелиальные клетки, фибробласты и нервные клетки. Его синтез может стимулироваться бактериальными эндотоксинами, другими цитокинами, такими как IL-2, Интерферон и IL-1, и он может ингибироваться стероидами.
Путем действия на многочисленные органы и системы, в целом, вместе с другими цитокинами, он участвует в развитии и регуляции многих патогенетических процессов:
- он модулирует экспрессию многих белков и важных цитокинов, таких как IL-1 и IL-6, таким образом, приводя к участию в кожных патологиях, таких как витилиго, экзема, псориаз и дерматит в целом;
- он стимулирует синтез коллагеназ в синовиоцитах, и по этой причине большие количества TNF были обнаружены в синовиальных жидкостях пациентов, страдающих артрозом и ревматоидным артритом;
- он активирует остеокласты и поэтому вызывает реабсорбцию костной ткани (остеопороз);
- он сильно привлекает нейтрофилы и помогает им прикрепляться к эндотелиальным клеткам для экстравазации;
- он стимулирует продукцию макрофагами молекул с окисляющим действием;
- он участвует в развитии определенных патологических состояний сердечно-сосудистой системы, участвуя в образовании венозного тромбоза, в патогенезе артериосклероза и васкулита.
TNF способен связываться с двумя рецепторами, TNF-R1 (рецептором TNF типа 1) и TNF-R2 (рецептором TNF типа 2), которые экспрессируются во всех соматических клетках, исключая эритроциты. Вкратце, TNF стимулирует и системную, и кожную воспалительную реакцию, которая, в свою очередь, запускает многочисленные патологические процессы, также имеющие аутоиммунную природу, такие как ревматоидный артрит, болезнь Крона, псориаз и астма. До настоящего времени в научных исследованиях предпринимались попытки усовершенствовать «биологические» лекарственные средства (такие как, например, моноклональные антитела), которые ингибируют синтез TNF и/или блокируют его рецептор.
IL-2: это обладающий высокой провоспалительной активностью, атерогенный цитокин, главным образом продуцируемый T-лимфоцитами, синтез которого ингибируется стероидами и циклоспоринами. IL-2 играет центральную роль в регуляции иммунного ответа: он в действительности стимулирует синтез IFN в периферических лейкоцитах и вызывает продукцию IL-1 и TNF. IL-2 может также повредить гематоэнцефалический барьер и целостность эндотелия церебральных сосудов, вызывая нейропсихиатрические расстройства, такие как дезориентация и депрессия.
Следовательно, имеются многочисленные патологические состояния, которые были связаны с аберрантной продукцией IL-2, такие как лимфома Ходжкина, рассеянный склероз, ревматоидный артрит и красная волчанка.
IL-6: продуцируется многими типами клеток, кроме иммунной системы, он с TNF относится к наиболее важным членам группы химических медиаторов острой фазы воспалительного процесса и поэтому вовлечен в патологические процессы с сильным воспалительным компонентом, такие как астма (где он участвует в возникновении и поддержании воспалительного процесса), хроническое воспаление кишечника (болезнь Крона), ревматоидный артрит и артроз. Действительно, как ранее утверждалось, цитокины, такие как TNF, IL-1 и IL-6, как оказалось, в значительной степени вовлечены в дегенеративный процесс суставного остеоартроза, поскольку они играют главную роль в регуляции экспрессии металлопротеиназ (ответственных за разрушение хрящевой ткани), в продукции простагландинов и в остеокластической активации и, по этой причине, высокие уровни цитокинов были зарегистрированы в синовиальных жидкостях пациентов, страдающих артрозом и ревматоидным артритом (R.A.). Указанные данные стимулировали использование ингибиторов указанных выше интерлейкинов и/или антагонистов их рецепторов в качестве новой стратегии лечения артрозной патологии.
Наконец, недавно проведенные исследования связали онкологические заболевания с продолжительностью жизни и выявили, как на некоторые опухоли влияет вид/количественная ситуация цитокиновых белков пациента: вкратце, недавно полученные доказательства связали низкий профиль продукции IL-10 и высокий уровень секреции IL-6 со снижением клинического выживания пациентов, пораженных патологическими опухолевыми процессами, тогда как генотип, способный продуцировать и поддерживать высокие уровни IL-10, может содействовать выживанию (Caruso C. et al., Ann N. Y. Acad. SCI., 2004, 1028:1-13).
IL-7: цитокин, главным образом, продуцируемый стромальными клетками костного мозга, он также секретируется тимусом и кератиноцитами. IL-7 индуцирует синтез воспалительных цитокинов, таких как IL-1, IL-6 и TNF, таким образом, участвуя в патогенезе некоторых кожных заболеваний (таких как псориаз и кожная лимфома) и заболеваний костно-суставной системы; действительно, высокие уровни IL-7 были обнаружены у пациентов, страдающих R.A.
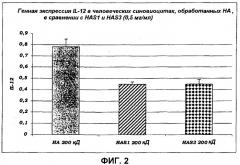
IL-12: этот белок также играет центральную роль в регуляции функций иммунной системы. Он в действительности действует на дифференциацию лимфоцитов, он индуцирует синтез Интерферона и TNF, и его продукция может ингибироваться IL-10. Избыточная продукция данного белка участвует в патогенезе заболеваний аутоиммунной природы, таких как колит, артрит, инсулинозависимый сахарный диабет, энцефаломиелит, псориаз и рассеянный склероз (Brahmachari S. et al., Minerva Med., 2008, 99(2):105-118).
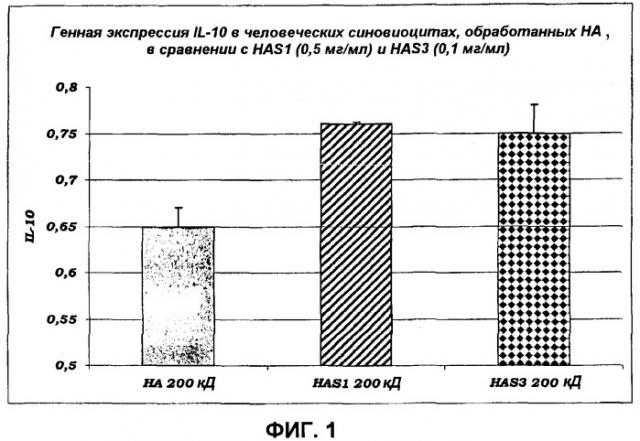
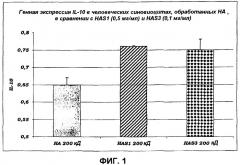
IL-10: главным образом продуцируется лимфоцитами, он представляет собой цитокин противовоспалительной природы, способный ингибировать синтез IL-2 и Интерферона, продуцируемого T-лимфоцитами. Противовоспалительное действие IL-10 также выявляется в способности ингибировать синтез IL-1, IL-6, IL-8, IL-12 и TNF в макрофагах, стимулированный бактериальными эндотоксинами. Дефициты IL-10 связаны с такими патологическими состояниями, как сахарный диабет и хронические кишечные воспаления, такие как болезнь Крона. Недавно полученные данные также привели к экспериментальному применению IL-10 в качестве нового терапевтического подхода к лечению системной красной волчанки. Низкие уровни IL-10 наблюдались в кожных тканях пациентов, страдающих такими патологическими состояниями, как витилиго, псориаз, экзема и дерматит. Следует отметить, что и кортикостероиды, и циклоспорин увеличивают продукцию и/или высвобождение данного интерлейкина из связанных с процессом компетентных клеток во время обычной иммуносупрессивной терапии для лечения воспалительных состояний и отторжения органов (Zhou X. et al., Current Drug Tar-gets-Immune, Endocrine & Metabolic Disorders, 2005, 5(465-475)). Экспериментальные данные также продемонстрировали эффективность в снижении высвобождения простагландинов и циклооксигеназы, индуцированной in vitro TNF, на человеческих синовиоцитах, таким образом, указывая на способность IL-10 снижать воспалительные процессы, которые вовлекают суставы, пораженные остеоартритической дегенерацией (Alaaeddine N. et al., Arthritis & Rheumatism, 1999, 42:710-718). Недавно проведенные исследования подтвердили его терапевтическую эффективность в отношении астматической патологии на моделях бронхиальной гиперреактивности у экспериментальных животных, показывая, что данный цитокин имеет высокую терапевтическую перспективность в плане снижения воспаления, которое характеризует дыхательные пути страдающих астмой пациентов, в которых высокие концентрации TNF, IL-1, IL-5, IL-6 и IL-8 были обнаружены в бронхиальной промывной жидкости, и/или в сыворотке, и/или в тканях (Stankiewicz W. et al., Mediators of Inflammation, 2002, 11:307-312). Поэтому для данного интерлейкина предполагалась важная роль регуляторного цитокина в поддержании иммунологического гомеостаза.
Астма может быть крайне инвалидизирующим заболеванием, которым страдают приблизительно 200 миллионов людей во всем мире при смертности более 5000 случаев ежегодно. Это патология, которая основана на извращенной реакции иммунной системы на факторы внешней среды, в последующем связанной с повышенной продукцией провоспалительных цитокинов для роста и дифференциации тучных клеток и эозинофилов с другими типами клеток иммунной системы. Причины такой разбалансированной активности иммунной системы еще не полностью известны, однако, имеются генетические, экологические, вирусные, а также связанные с питанием факторы, которые различными путями содействуют развитию данной патологии. Следовательно, эффективная терапия (системная и/или местная терапия) для ее профилактики и/или лечения, которая обеспечила бы возможность прекращения или уменьшения применения стероидов (обычной лечебной терапии), могла бы представить обоснованное решение и по поводу более тяжелых форм (поскольку оно в любом случае обеспечило бы возможность снижения применения стероидов), и по поводу менее тяжелых случаев, поскольку можно было бы полностью прекратить терапию стероидами.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Целью настоящего изобретения является новое и неожиданное местное применение HAS в качестве средства, регулирующего активность цитокинов, поскольку заявитель обнаружил ее исключительную способность модулировать активность конкретных цитокинов; был исследован ее механизм действия и выявлено существенное различие между различными типами сульфатированных продуктов, известных в данной области, но, прежде всего, заявитель обнаружил неожиданную активность в отношении различных типов и штаммов вируса герпеса, цитомегаловируса и вируса везикулярного стоматита. Наконец, еще одна цель настоящего изобретения относится к применению HAS в качестве стимулятора всасывания через кожу лекарственных средств, преимущественно противовоспалительной природы, в качестве фибринолитического средства, а также в качестве высокогидратирующего средства для лечения всех патологических состояний кожи, характеризуемых сухостью, раздражением и гиперемией, воспалением и шелушением.
Сульфатированную гиалуроновую кислоту, подходящую для целей настоящего изобретения, получают в соответствии со способом, описанным в патенте EP 702699 B1: сульфатация осуществляется посредством комплекса SO3-пиридин и задействует спиртовые гидроксилы, присутствующие в полисахаридной цепи, исходя из HA, происходящей из любого источника, например, полученной экстракцией из петушиных гребней с использованием или ферментативных, или биотехнологических методов и имеющей молекулярную массу в диапазоне от 400 до 3×106 Да, в частности от 1×104 Да до 1×106 Да, еще конкретнее от 10000 до 50000 Да, от 150000 до 250000 Да и от 500000 до 750000 Да.
Полученное производное сохраняет все физические характеристики исходного неизмененного полимера, в частности молекулярная масса исходной HA не уменьшается за счет сульфатации, таким образом, обеспечивая возможность сохранения всех физико-химических характеристик исходного полисахарида. Сульфатация затрагивает различные гидроксильные группы дисахаридного элемента, и поэтому возможно получение различных степеней сульфатации, от 0,5 до 3,5 (имеется в виду число сульфатных групп на дисахаридный элемент), путем варьирования введенного количества SO3-пиридина, как известно в современном уровне техники.
Производное, использованное во всех выполненных экспериментах, в целом имеет степень сульфатации 1 или степень 3 и далее определяется в настоящем описании как HAS1 и HAS3. Все свободные карбоксильные группы HA могут образовывать соль с катионами органического и/или неорганического происхождения.
Оба вида HAS растворимы в воде, и они могут также стерилизоваться обычными методиками, известными специалистам в данной области, даже если предпочтительна стерилизация с использованием автоклава.
Заявитель описывает и заявляет новое применение HAS для получения лекарственного средства для местного применения:
• для профилактики и/или лечения патологических состояний кожи, связанных с иммунной недостаточностью и, в частности, недостаточностью IL-10, таких как витилиго, экзема, псориаз и дерматит в целом, путем стимуляции синтеза противовоспалительных цитокинов;
• для профилактики и/или местного лечения астмы, связанной с активацией IL-1, IL-6 и TNF, путем ингаляции;
• для профилактики и/или лечения патологических состояний кожи, связанных с повреждением эндотелия и/или стенок кровеносных сосудов вследствие, например, травм, сосудистых кровоизлияний поверхностной природы и/или средней глубины с последующим образованием тромбов и отеков,
• для профилактики и/или лечения нанесением на кожу кожных заболеваний, связанных с увеличением/активацией IL-1, IL-2, IL-6, IL-7, IL-8, IL-12 и TNF, таких как, например, дерматит, атопический дерматит, псориаз, витилиго, фотодерматит, сыпь, все виды раздражения кожи (а также десен) и экзема;
• для профилактики и/или лечения заболеваний аутоиммунной природы, таких как псориаз, астма и кожные проявления системной (LES) и дискоидной красной волчанки;
• для профилактики и/или местного лечения кожных новообразований, таких как, например, базалиома, саркома Капоши, плоскоклеточная карцинома, кожная лимфома, фунгоидный микоз и актиновый кератоз;
• для профилактики и/или местного лечения сосудистых патологических состояний, таких как, например, васкулит и склеродермия, связанных с активацией TNF, IL-1 и IL-6.
Заявитель также в действительности продемонстрировал в описанных ниже экспериментах, что:
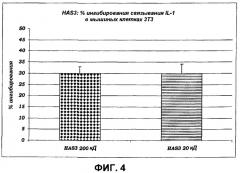
• HAS способна стимулировать продукцию новой мРНК и белковый синтез цитокинов противовоспалительной природы (таких как, например, IL-10), таким образом, увеличивая способность иммунной защиты клеток и, следовательно, всего организма. Противовоспалительное действие указанных выше цитокинов выявляется по способности ингибировать синтез IL-1, IL-6, IL-8, IL-12 и TNF, которые все представляют собой белки с высокой провоспалительной активностью, задействованные при многочисленных патологических состояниях кожи.
• HAS эффективна и при уменьшении синтеза новой мРНК, и при значительном снижении белкового синтеза IL-2, IL-7 и IL-12, в ситуациях, в которых не вызывается иммунный ответ, и в конкретных случаях воспалительного стресса, при которых клетки реагируют продуцированием каскада цитокинов: в частности, в данном случае представленные данные выявляют больший эффект HAS.
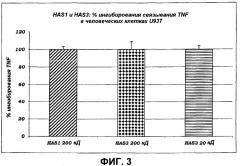
• HAS эффективна в ингибировании связывания TNF, IL-1 и IL-6 с их рецепторами. Эти данные имеют фундаментальное значение, поскольку они доказывают, что поведение сульфатированного продукта полностью аналогично поведению моноклональных антител, специфических в отношении рецепторов указанных выше провоспалительных белков, поэтому способных блокировать их функцию, но в то же самое время обладающих специфичностью к данному антителу. Блокада этих рецепторов представляет наиболее эффективный путь противодействия провоспалительных и опухолевых эффектов фактора TNF, IL-1 и IL-6, таким образом, открывая новые горизонты для клинического экспериментирования, обеспечивающие возможность усовершенствования новых терапевтических подходов при лечении и/или профилактике крайне большого числа патологических состояний с учетом роли, которую играют TNF, IL-1 и IL-6 в возникновении и прогрессировании многочисленных системных и кожных заболеваний.
Заявитель также описывает и заявляет новое применение HAS для получения лекарственного средства для местного применения:
• для профилактики и/или лечения инфекции губ, вызванной вирусом простого герпеса и генитального герпеса;
• для профилактики и/или лечения инфекции, вызванной вирусом везикулярного стоматита;
• для профилактики и/или лечения инфекции, вызванной цитомегаловирусом.
Заявитель действительно продемонстрировал в описанных ниже экспериментах мощное противовирусное действие HAS в отношении различных типов вируса:
• Экспериментальные данные доказывают противовирусное действие HAS1 и HAS3 в отношении вируса простого герпеса 1 и 2 и в отношении вируса везикулярного стоматита (VSV). Первая форма, крайне широко распространенная, ответственна за появление характерных сопровождающихся лихорадочной реакцией пузырьков, которые обычно поражают кожные покровы лица (губы, ноздри); она также называется herpes simplex labialis. Инфекция, вызванная губным герпесом, может легко рецидивировать, поскольку вирус выживает внутри клеток и не устраняется даже при использовании эффективных лекарственных средств. Вторая форма представляет собой генитальную инфекцию, также известную как herpes genitalis. Обе формы передаются посредством физического или полового контакта. Ввиду локализации вирионов в нервных ганглиях, где они могут оставаться в латентном состоянии в течение длительного периода времени, герпетическая инфекция имеет характеристики рецидивирования в соответствии со стрессирующими явлениями, воздействующими на иммунную систему, и обычно рецидивирует в первичном участке. Вирус везикулярного стоматита является РНК-вирусом, он поражает млекопитающих и используется в лаборатории для исследования развития жизненного цикла РНК-вируса. Сравнение HA-NS1 и HAS1 снова показывает, что не все сульфатированные гиалуроновые кислоты эквивалентны, поскольку HA-NS1 оказалась вообще неактивной, тогда как и HAS1, и 3 проявляют очень сильную противовирусную активность в отношении вируса простого герпеса, а также в отношении VSV. Ни один из тестированных образцов не оказался цитотоксичным в отношении клетки-хозяина; полученная минимальная цитотоксическая концентрация в действительности была равна минимальной цитотоксической концентрации эталонных лекарственных средств, обычно применяемых в клинической практике для лечения инфекции вирусом герпеса, и в среднем она оказалась в 100 раз выше, чем минимальная цитотоксическая концентрация, выявленная как активная в ингибировании вирусной репликации.
• Экспериментальные данные, полученные и для HAS1, и для HAS3 выявили отчетливый и значимый противовирусный эффект в отношении Cytomegalovirus: это конкретный тип вируса, который поступает в некоторые типы клеток организма, в которых он паразитически воспроизводит себя, вызывая гибель клеток. Данный вирус относится к тому же семейству, что и herpes labialis и herpes genitalis, вирус ветряной оспы и вирус инфекционного мононуклеоза. Эпителиальные клетки, слизистые оболочки, лимфатические узлы представляют собой участки множественной первичной инфекции. Вирус остается в латентной форме на всю жизнь в периферической крови, в эпителии почечных канальцев и в эпителии слюнных желез. Тяжелые формы обнаруживаются у индивидов с нарушенным иммунитетом (таких как индивиды, пораженные СПИД, и индивиды после трансплантации органов, получающие иммуносупрессивную терапию). Лечебная терапия состоит во введении лекарственных средств, таких как ганцикловир, валганцикловир и фоскарнет (ингибиторы синтеза вирусной ДНК). Также в данном случае HA-NS1 оказалась неэффективной в ингибировании пролиферации вируса, подтверждая абсолютное различие противовирусной активности между двумя типами сульфатированных продуктов.
Еще одна цель настоящего изобретения относится к применению HAS в качестве фибринолитического средства для разрушения фибриновых тромбов, которые образованы на уровне кожи (на поверхности и/или в глубине) после разрушения эндотелия и/или стенок капилляров и/или мелких сосудов, вследствие механических травм и/или кровотечений средней/небольшой интенсивности.
В описанных ниже экспериментах заявитель в действительности продемонстрировал:
• что HAS эффективна в качестве плазмина при фибринолизе/удалении фрагментов сгустков крови и тромбов. Плазмин представляет собой важный фермент, относящийся к группе гидролаз, способный разрушать многие белки плазмы крови, и, в частности, фибрин в тромбах и сгустках крови. Разрушение фибрина называется фибринолизом. Недостаточность плазмина может привести к тромбозу, поскольку тромбы адекватно не разрушаются. Следует отметить существенное различие между процессом антикоагуляции и фибринолитическим процессом: в первом случае антикоагулянтное средство должно предотвратить образование кровяного сгустка, а в последнем случае фибринолитическое средство, с другой стороны, должно вмешаться в ситуацию, при которой кровяной сгусток уже присутствует и поэтому должен быть разрушен для его полного удаления.
Еще одна цель настоящего изобретения относится к новому применению HAS в качестве стимулятора всасывания через кожу лекарственных средств, таких как, например, лекарственные средства противовоспалительной природы, и, наконец, в качестве средства, обладающего выраженным дегидратирующим действием, для лечения патологических состояний кожи, характеризуемых сухостью, лихенизацией, раздражением, зудом и гиперемией кожи, ее воспалением и шелушением.
Заявитель в действительности продемонстрировал, что:
• сульфатация гиалуроновой кислоты существенно увеличивает всасывание через кожу, следовательно,
• гидратирующая сила HAS оказалась значительно выше, чем таковая несульфатированной HA, и поэтому HAS вызывает важное уменьшение шероховатости обработанных кожных поверхностей относительно HA и местных контрольных препаративных форм, таким образом, выявляя ее способность эффективно лечить и защищать кожные поверхности, характеризуемые сухостью, раздражением, лихенизацией, зудом и гиперемией, воспалением и шелушением при всех других патологических состояниях кожи, которые делают кожу более чувствительной к наружным средствам;
• HAS представляет собой мощный и эффективный стимулятор кожного всасывания лекарственных средств. Способность HAS так эффективно проникать сквозь толщу кожи представляет собой научную основу, на которой базируется данное неожиданное новое свойство, которое обеспечивает возможность его включения в состав препаративных форм с фармакологическими средствами различной природы, такими как, например, нестероидные противовоспалительные препараты (в частности, диклофенак, кетопрофен и ибупрофен) или средства стероидного типа, гормоны, сосудорасширяющие средства, холинергические средства, антибиотики и другие лекарственные средства, составленные в различные формы, предпочтительно, в виде гелей, кремов или пластырей для дермального и/или трансдермального всасывания.
Наконец, заявитель описывает получение различных местных фармацевтических препаративных форм/композиций, содержащих HAS в виде единственного действующего начала, или в ассоциации с другими фармакологически и/или биологически активными средствами, такими как, например, стероиды, гормоны, белки, трофические факторы, витамины, нестероидные противовоспалительные лекарственные средства (FANS), такие как, например, диклофенак, кетопрофен или ибупрофен или их соли, химиотерапевтические лекарственные средства для местного применения, антибиотики, противовирусные средства, местные анестетики, антикоагулянты и/или фибринолитические средства и/или ферменты, такие как, например, коллагеназа и/или гиалуронидаза и/или другие протеазы; она может составляться в препаративные формы с полимерами, такими как гиалуроновая кислота и ее производные, карбоксиметилцеллюлоза (CMC) и/или другие полимеры естественной (такой как коллаген) или синтетической природы.
Рассматриваемая фармацевтическая композиция может составляться в виде мази, липогеля, гидрогеля, губной помады, крема, влагалищных суппозиториев и свечей, пены, геля для слизистых оболочек, офтальмологических препаратов, составов для промывания влагалища, полосканий для ротовой полости, пластырей для дермального и/или трансдермального всасывания, в частности FANS и гормонов, растворов; поэтому она может вводиться местным нанесением или путем ингаляции для лечения патологических состояний респираторной системы, таких как, например, астма.
Особое внимание уделяется композициям, содержащим ферменты, такие как гиалуронидаза, в препаративной форме лекарственного средства для лечения кожных гематом, и средств, содержащих нестероидные противовоспалительные препараты или гормоны, в форме гелей, кремов и накладок для дермального и/или трансдермального всасывания лекарственного средства.
Некоторые примеры получения HAS 1 и 3 степени, фармацевтические препаративные формы, содержащие ее, приведены исключительно в описательных и неограничивающих целях, вместе с результатами, полученными экспериментированием in vitro.
Пример 1
Получение тетрабутиламмониевой соли гиалуроновой кислоты (HA), имеющей среднюю молекулярную массу, равную 200 кД (в диапазоне от 150000 до 250000 Да)
5,00 г натриевой соли гиалуроновой кислоты ферментативного происхождения (200 кД) растворяют в 250 мл воды и полученный раствор пропускают через стеклянную колонку, предварительно заполненную 100 см3 смолы Dowex в форме тетрабутиламмония (TBA). Элюированный раствор соли HA-TBA собирают и сублимируют. Получают 7,50 г продукта.
Пример 2
Синтез сульфатированной HA из НА, имеющей среднюю молекулярную массу 200 кД и степень сульфатации, равную 3 сульфатным группам на повторяющееся звено
Способ A
10,0 г TBA соли гиалуроновой кислоты, имеющей среднюю молекулярную массу 200 кД, полученную в соответствии с примером 1, растворяют в 300 мл диметилсульфоксида (DMSO); 26,0 г комплекса SO3-пиридина (триоксида серы и пиридина, далее обозначаемого аббревиатурой PySO3) диспергируют в 150 мл DMSO и затем добавляют к раствору HA. После 20 часов в условиях механического перемешивания при температуре 21°C реакцию прерывают добавлением 0,1 объема воды; неочищенный продукт реакции выделяют осаждением после добавления 2 объемов этанола. Полученное твердое вещество диспергируют в 150 мл воды и pH доводят до нейтральности 1M NaOH. Смесь полностью диализируют против воды через мембрану при отсечке 12-14000 Да. Диализированный продукт подвергают сублимации. Получают 9,7 г продукта со степенью сульфатации, равной 3 сульфатным группам на повторяющееся звено (выход = 88%).
Способ B
32,0 г TBA соли гиалуроновой кислоты, имеющей среднюю молекулярную массу 200 кД, полученную в соответствии с примером 1, растворяют в 900 мл N-метилпирролидона (NMP); 100 г PySO3 диспергируют в 600 мл NMP и затем добавляют к раствору HA. После 20 часов в условиях механического перемешивания при температуре 21±1°C реакцию прерывают добавлением 0,5 объемов воды. pH, который исходно был ниже, чем 2,5, доводят до нейтральности добавлением моля NaOH (в растворе). Неочищенный продукт реакции выделяют осаждением добавлением 2,5 объемов метанола и промывают 2 объемами смеси метанол/вода 8/2. Твердое вещество повторно растворяют и полностью диализируют против воды с использованием мембраны при отсечке 12-14000 Да. Получают 30,4 г продукта со степенью сульфатации, равной 3 сульфатным группам на повторяющееся звено (выход = 86%).
Пример 3
Синтез сульфатированной HA из HA, имеющей среднюю молекулярную массу 200 кД и степень сульфатации, равную 1 сульфатной группе на повторяющееся звено
Используя процедуру, иллюстрируемую в примере 1, получают 10,0 г TBA соли HA, которую растворяют в 350 мл DMSO. 10,0 г комплекса PySO3 диспергируют в 100 мл DMSO и затем добавляют к раствору HA. После 20 часов в условиях механического перемешивания при температуре 21°C реакцию прерывают добавлением 0,1 объема воды; неочищенный продукт реакции выделяют осаждением после добавления 2,5 объемов этанола. Полученное твердое вещество диспергируют в 150 мл воды и pH доводят до нейтральности NaOH 1 моль/л. Смесь полностью диализируют против воды через мембрану при отсечке 12-14000 Да. Диализированный продукт подвергают сублимации. Получают 7,54 г продукта со степенью сульфатации, равной 1,0 сульфатной группе на повторяющееся звено (выход = 93%).
Пример 4
Синтез сульфатированной HA из HA, имеющей низкую молекулярную массу (средняя MW 10 кД, в диапазоне от 5000 до 30000 Да) и степень сульфатации, равную 3 сульфатным группам на повторяющееся звено
Используя процедуру, иллюстрируемую в примере 1, получают 12,4 г TBA соли гиалуроновой кислоты с низкой молекулярной массой, которую растворяют в 300 мл NMP. 40 г PySO3 диспергируют в 100 мл NMP и затем добавляют к раствору HA. После 20 часов в условиях механического перемешивания при температуре 21°C реакцию прерывают добавлением 0,5 объема воды. pH, который исходно был ниже, чем 2,5, доводят до нейтральности добавлением моля 4M NaOH. Неочищенный продукт реакции выделяют осаждением после добавления 2,5 объемов метанола и промывают 2 объемами смеси метанол/вода 8/2. Твердое вещество повторно растворяют и полностью диализируют против воды с использованием мембраны при отсечке 3500 Да. Получают 12,0 г продукта со степенью сульфатации, равной 3,0 сульфатным группам на повторяющееся звено (выход = 85%).
Пример 5
Синтез сульфатированной HA из HA, имеющей низкую молекулярную массу и степень сульфатации, равную 1 сульфатной группе на повторяющееся звено
Используя процедуру, иллюстрируемую в примере 1, получают 12,4 г TBA соли HA и растворяют в 300 мл DMSO. 16,0 г PySO3 диспергируют в 100 мл DMSO и затем добавляют к раствору HA. После 20 часов в условиях механического перемешивания при температуре 21°C реакцию прерывают добавлением 0,1 объема воды; неочищенный продукт реакции выделяют осаждением после добавления 2,5 объемов этанола. Полученное твердое вещество диспергируют в 150 мл воды и pH доводят до нейтральности NaOH 1 моль/л. Смесь полностью диализируют против воды через мембрану при отсечке 3500 Да. Диализированный продукт подвергают сублимации. Получают 9,04 г продукта со степенью сульфатации, равной 1,0 сульфатной группе на повторяющееся звено (выход = 90%).
Пример 6
Синтез сульфатированной HA из HA, имеющей молекулярную массу в пределах диапазона от 500 до 730 Да и степень сульфатации, равную 3 сульфатным группам на повторяющееся звено
21,0 г натриевой соли гиалуроновой кислоты экстрактивного происхождения (500-730 кД) растворяют в 1,5 л воды и полученный раствор пропускают через стеклянную колонку, предварительно заполненную 450 см3 смолы Dowex в форме TBA. Элюированный раствор соли HA-TBA собирают и сублимируют. Получают 32,0 г продукта, который растворяют в 1,35 л NMP; 100 г PySO3 диспергируют в 650 мл NMP и затем