Лиганды сигма-рецепторов для предупреждения или лечения боли, вызванной химиотерапией
Иллюстрации
Показать всеИзобретение относится к комбинации лиганда сигма-рецептора формулы (I) или его фармацевтически приемлемой соли, изомера или сольвата и химиотерапевтического средства, выбранного из группы, образованной таксанами, винкаалкалоидами, лекарственными средствами на основе платины и талидомидом. В формуле (I) радикалы R1-R6 имеют значения, указанные в формуле изобретения, и n выбирают из 2, 3 и 4. Заявленная комбинация может применяться для профилактики или лечения боли, вызванной вышеуказанными химиотерапевтическими средствами, при одновременном, раздельном или последовательном введении. 4 н. и 11 з.п. ф-лы, 18 ил., 4 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к применению группы лигандов сигма-рецепторов для предупреждения или лечения боли, возникающей в результате химиотерапии. Настоящее изобретение также относится к комбинации лиганда сигма-рецептора и химиотерапевтического средства и ее применению при предупреждении или лечении боли, возникающей как следствие химиотерапии.
Уровень техники
Лечение болевых состояний является очень важным в медицине. В настоящее время по всему миру существует необходимость в дополнительной терапии боли. Острая потребность в специальном лечении подтверждается документально в большом количестве научных работ, которые появились недавно в области, связанной с применением анальгетиков.
Международной ассоциацией по изучению боли (IASP) БОЛЬ определяется как «неприятное сенсорное и эмоциональное переживание, связанное с истинным или потенциальным повреждением ткани или описываемое в терминах такого повреждения» (IASP, Classification of chronic pain, 2nd Edition, IASP Press (2002), 210). Хотя боль всегда является субъективной, ее причины и синдромы можно классифицировать. Некоторыми наиболее важными подтипами боли являются невропатическая боль, аллодиния, гипералгезия и периферическая невропатия.
С другой стороны, рак и связанное с ним лечение являются некоторыми из самых больших проблем, вызывающих озабоченность в области здравоохранения. Химиотерапия, в комбинации или в качестве альтернативы хирургическому вмешательству, является методом, который выбирают в большинстве случаев для контролирования или помощи пациентам, пораженным карциномой.
Химиотерапия в общем смысле определяется как применение химических веществ для лечения рака, опухоли или злокачественного новообразования и, по данному изобретению, относится к применению цитотоксических или цитостатических лекарственных средств, называемых химиотерапевтическими агентами. В целом она является системной терапией. Химиотерапия при лечении рака состоит из персонализированной комбинации сильнодействующих химиотерапевтических средств, разработанных для замедления быстрого роста раковой опухоли, сокращения опухоли, уничтожения раковых клеток и предотвращения метастазирования рака. Химиотерапевтические средства не позволяют клеткам реплицироваться типичным для них неконтролируемым образом, которым злокачественные клетки делятся.
Периферическая нейротоксичность является клинически важным осложнением при химиотерапии рака. В случае нескольких наиболее эффективных лекарственных средств (например таксаны, винкаалкалоиды, цисплатин, бортезомиб, талидомид и леналидамид) нейротоксичность является дозозависимой и иногда вынуждает прекратить успешную в других случаях терапию (Polomano и Bennett, Pain Med., 2001, 2(1), 8-14; Park et al., Curr. Med. Chem, 2008, 15(29), 3081-94). Поскольку данные лекарственные средства выбирают для лечения большого числа гемобластозов и солидных опухолей, сотня из тысячи пациентов подвергается их действию ежегодно. Сенсорные нарушения в результате вызываемой противоопухолевыми средствами нейротоксичности варьируют от легкой парестезии или дисестезии у многих пациентов до хронической болезненной периферической невропатии у некоторых (Quasthoff и Hartung, J. Neurol., 2002, 249(1), 9-17). Возникновение и тяжесть невропатии зависят от интенсивности единичной дозы, длительности лечения, кумулятивной дозы, предварительного или одновременного лечения другими средствами против невропатии и сопутствующих состояний, таких как диабет или злоупотребление алкоголем (Alberts et al., Anticancer drugs, 1995, 6(3), 369-83; Postma et al., Ann. Oncol., 1995, 6(5), 489-94; Forsyth et al., J. Neurooncol., 1997, 35(1), 47-53; Quasthoff и Hartung, J. Neurol., 2002, 249(1), 9-17). Из уровня техники известно, что периферическая невропатия, сопровождаемая невропатической болью, аллодинией и гипералгезией, как результат химиотерапии развивается в значительном количестве случаев. Конкретные симптомы возникают из-за нейротоксичности химиотерапевтического средства. Лечение этих симптомов является важным для сохранения качества жизни пораженного болезнью пациента (Mielke et al., Eur. J. Cancer, 2006, 42(1), 24-30; Park et al., Curr. Med. Chem., 2008, 15(29), 3081-94; Argyriou et al., Blood, 2008, 112(5), 1593-9). К сожалению, пока еще не найдено эффективное лечение для вызванной химиотерапией периферической невропатии (Wolf et al., Eur. J. Cancer, 2008, 44(11), 1507-15).
Поэтому существует необходимость в обеспечении новой формы предупреждения и лечения боли, и особенно невропатической боли, аллодинии, гипералгезии и периферической невропатии, развивающихся после химиотерапии.
Сущность изобретения
Авторы настоящего изобретения неожиданно обнаружили и продемонстрировали, что введение некоторых специфических лигандов сигма-рецепторов является высоко эффективным для предупреждения и лечения боли, возникающей как следствие химиотерапии. Они являются особенно полезными, когда боль представляет собой невропатическую боль, аллодинию или гипералгезию. Лиганды сигма-рецепторов являются высоко эффективными для лечения индуцированной химиотерапией невропатической боли при введении после противоопухолевого средства, когда боль уже возникла. Более того, удивительно, что совместное введение данных лигандов сигма-рецепторов и химиотерапевтического средства предупреждает развитие боли, которая обычно могла бы развиваться после химиотерапии. Вследствие этого, лиганды сигма-рецепторов являются эффективными как для лечения (лиганд сигма-рецептора вводиться после химиотерапевтического средства, когда боль уже возникла), так и предупреждения (совместное введение лиганда сигма-рецептора и химиотерапевтического средства) вызываемой химиотерапией невропатической боли.
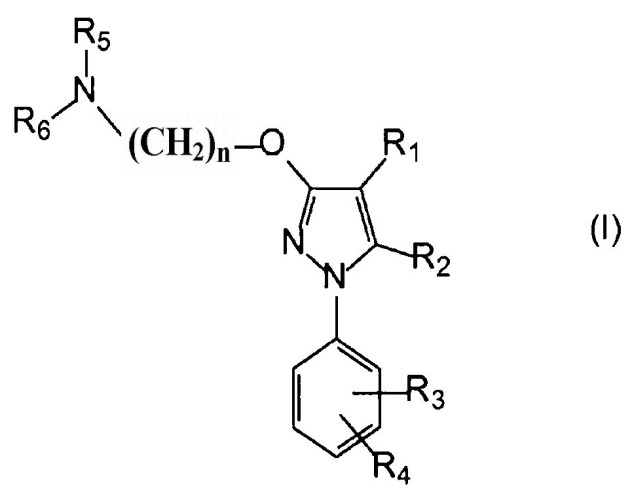
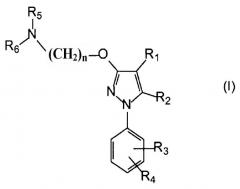
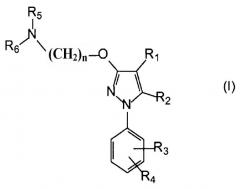
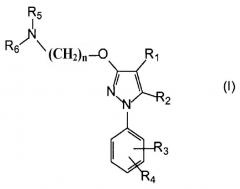
Поэтому в одном аспекте настоящее изобретение относится к комбинации по меньшей мере одного лиганда сигма-рецептора и по меньшей мере одного химиотерапевтического средства для одновременного, раздельного или последовательного введения, где лиганд сигма-рецептора имеет следующую общую формулу (I):
где
R1 выбирают из группы, содержащей водород, замещенный или незамещенный алкил, замещенный или незамещенный циклоалкил, замещенный или незамещенный алкенил, замещенный или незамещенный арил, замещенный или незамещенный арилалкил, замещенный или незамещенный неароматический гетероциклил, замещенный или незамещенный ароматический гетероциклил, замещенный или незамещенный гетероциклилалкил, -COR8, -C(O)OR8, -C(O)NR8R9, -CH=NR8, -CN, -OR8, -OC(O)R8, -S(O)t-R8, -NR8R9, -NR8C(O)R9, -NO2, -N=CR8R9 и галоген;
R2 выбирают из группы, содержащей водород, замещенный или незамещенный алкил, замещенный или незамещенный циклоалкил, замещенный или незамещенный алкенил, замещенный или незамещенный арил, замещенный или незамещенный арилалкил, замещенный или незамещенный, ароматический или неароматический гетероциклил, замещенный или незамещенный гетероциклилалкил, -COR8, -C(O)OR8, -C(O)NR8R9, -CH=NR8, -CN, -OR8, -OC(O)R8, -S(O)t-R8, -NR8R9, -NR8C(O)R9, -NO2, -N=CR8R9 и галоген;
R3 и R4 независимо выбирают из группы, содержащей водород, замещенный или незамещенный алкил, замещенный или незамещенный циклоалкил, замещенный или незамещенный алкенил, замещенный или незамещенный арил, замещенный или незамещенный арилалкил, замещенный или незамещенный, ароматический или неароматический гетероциклил, замещенный или незамещенный гетероциклилалкил, -COR8, -C(O)OR8, -C(O)NR8R9, -CH=NR8, -CN, -OR8, -OC(O)R8, -S(O)t-R8, -NR8R9, -NR8C(O)R9, -NO2, -N=CR8R9 и галоген, или вместе они образуют необязательно замещенную конденсированную кольцевую систему;
R5 и R6 независимо выбирают из группы, содержащей водород, замещенный или незамещенный алкил, замещенный или незамещенный циклоалкил, замещенный или незамещенный алкенил, замещенный или незамещенный арил, замещенный или незамещенный арилалкил, замещенный или незамещенный, ароматический или неароматический гетероциклил, замещенный или незамещенный гетероциклилалкил, -COR8, -C(O)OR8, -C(O)NR8R9, -CH=NR8, -CN, -OR8, -OC(O)R8, -S(O)t-R8, -NR8R9, -NR8C(O)R9, -NO2, -N=CR8R9 и галоген, или вместе они образуют вместе с атомом азота, к которому они присоединены, замещенную или незамещенную, ароматическую или неароматическую гетероциклильную группу;
n выбирают из 1, 2, 3, 4, 5, 6, 7 и 8;
t равно 1, 2 или 3;
R8 и R9 каждый независимо выбирают из водорода, замещенного или незамещенного алкила, замещенного или незамещенного циклоалкила, замещенного или незамещенного алкенила, замещенного или незамещенного арила, замещенного или незамещенного, ароматического или неароматического гетероциклила, замещенного или незамещенного алкокси, замещенного или незамещенного арилокси и галогена;
или его фармацевтически приемлемая соль, изомер, пролекарство или сольват.
В другом аспекте, настоящее изобретение относится к соединению формулы (I), описанному выше, или его фармацевтически приемлемой соли, изомеру, пролекарству или сольвату, применяемому для предупреждения или лечения боли, вызванной химиотерапией.
В другом аспекте, настоящее изобретение относится к комбинации, как описано выше, для ее применения при производстве лекарственного средства.
В другом аспекте, изобретение относится к комбинации, как описано выше, для ее применения при предупреждении или лечении боли, вызванной химиотерапией.
В другом аспекте, изобретение относится к способу лечения пациента, страдающего от боли, вызванной химиотерапией, или который может испытывать боль в результате химиотерапевтического лечения, который включает введение пациенту, нуждающемуся в таком лечении или профилактике, терапевтически эффективного количества лиганда сигма-рецептора формулы (I), описанного выше.
Данные его аспекты и предпочтительные варианты осуществления также дополнительно определены в формуле изобретения.
Краткое описание чертежей
Фиг. 1: Динамика паклитаксел-индуцируемой холодовой аллодинии у мышей. Каждая точка и вертикальная линия означает среднее ± стандартную ошибку среднего показателей, полученных у по меньшей мере 12 мышей. Статистически достоверное различие между показателями для групп, которым инъецировали паклитаксел и носитель: *p<0,05; **p<0,01; и между показателями, полученными в день перед воздействием и в дни после воздействия: #p<0,05; ##p<0,01 (двухфакторный ANOVA с повторными измерениями с последующим сравнением по критерию Ньюмана-Кеулса).
Фиг. 2: Динамика воздействия однократной п/к инъекции Соединения 63 (32, 64 или 128 мг/кг) или физиологического раствора на продолжительность лизания/покусывания задней лапы (тест с ацетоном) у мышей на 10 день после введения паклитаксела. Каждая точка и вертикальная линия означает среднее ± стандартную ошибку среднего показателей, полученных у 14-22 животных. Статистически достоверное различие между группами, которым вводили соединение 63 и физиологический раствор, в тот же самый день после лечения: *p<0,05; **p<0,01; и между показателями, полученными в день перед воздействием и на 10 день в различное время после введения лекарственного вещества или физиологического раствора: #p<0,05; ##p<0,01 (двухфакторный ANOVA с повторными измерениями с последующим сравнением по критерию Ньюмана-Кеулса).
Фиг. 3: Динамика воздействия однократной п/к инъекции Соединения 63 (64 мг/кг) или физиологического раствора на продолжительность лизания/покусывания задней лапы (тест с ацетоном) у мышей на 10 день после введения носителя для паклитаксела. Каждая точка и вертикальная линия означает среднее ± стандартную ошибку среднего показателей, полученных у 11-14 животных. Статистически достоверное различие между двумя группами в любое время наблюдения не наблюдалось. Статистически достоверное различие между показателями, полученными в день перед воздействием и на 10 день в различное время после введения лекарственного вещества или физиологического раствора: ## p<0,01 (двухфакторный ANOVA с повторными измерениями с последующим сравнением по критерию Ньюмана-Кеулса).
Фиг. 4: Динамика воздействия совместного введения паклитаксел + соединение 63 (64 мг/кг) и паклитаксел + физиологический раствор на продолжительность лизания/покусывания задней лапы в тесте с ацетоном. Каждая точка и вертикальная линия означает среднее ± стандартную ошибку среднего показателей, полученных у 25-35 животных. Статистически достоверное различие по сравнению с паклитаксел + физиологический раствор: *p<0,05, **p<0,01 ; и между показателями, полученными в день перед воздействием и в дни после лечения: #p<0,05, ##p<0,01 (двухфакторный ANOVA с повторными измерениями с последующим сравнением по критерию Ньюмана-Кеулса).
Фиг. 5: Динамика воздействия на продолжительность лизания/покусывания задней лапы (тест с ацетоном) совместного введения носителя для паклитаксела + соединение 63 (64 мг/кг) и носителя для паклитаксела + физиологический раствор. Каждая точка и вертикальная линия означает среднее ± стандартную ошибку среднего показателей, полученных у 15-20 животных. Статистически достоверное различие между двумя группами в любое время наблюдения не наблюдалось, или в сравнении с их собственными показателями в день перед воздействием (двухфакторный ANOVA).
Фиг. 6: Динамика паклитаксел-индуцируемой холодовой аллодинии у нокаутированных по сигма-1 рецептору мышей и мышей дикого типа. Каждая точка и вертикальная линия означает среднее ± стандартную ошибку среднего показателей, полученных у 48 (дикого типа) и 21 (нокаутированных) животных. Статистически достоверное различие между нокаутированными по сигма-1 рецептору мышами и мышами дикого типа в один и тот же день после лечения: **p<0,01; и между показателями, полученными в день перед воздействием и в дни после лечения: #p<0,05; ##p<0,01 (двухфакторный ANOVA с повторными измерениями с последующим сравнением по критерию Ньюмана-Кеулса).
Фиг. 7: Динамика воздействия носителя для паклитаксела на продолжительность лизания/покусывания задней лапы в тесте с ацетоном у нокаутированных по сигма-1 рецептору мышей и мышей дикого типа. Каждая точка и вертикальная линия означает среднее ± стандартную ошибку среднего показателей, полученных у 31 (дикого типа) и 15 (нокаутированных) животных. Статистически достоверное различие между двумя группами в любое время наблюдения не наблюдалось, или в сравнении с их собственными показателями в день перед воздействием (двухфакторный ANOVA).
Фиг. 8: Динамика паклитаксел-индуцируемой механической аллодинии у мышей. Каждая точка и вертикальная линия означает среднее ± стандартную ошибку среднего показателей, полученных у 32-34 животных. Статистически достоверное различие между группами, которым инъецировали паклитаксел и носитель, в тот же самый день после лечения: **p<0,01; и между показателями, полученными в день перед воздействием и в дни после лечения: ## p<0,01 (двухфакторный ANOVA с повторными измерениями с последующим сравнением по критерию Ньюмана-Кеулса).
Фиг. 9: Динамика действия однократной п/к инъекции Соединения 63 (64 мг/кг) или физиологического раствора на пороговую силу давления для отдергивания задней лапы у мышей на 10 день после введения паклитаксела. Каждая точка и вертикальная линия означает среднее ± стандартную ошибку среднего показателей, полученных у 10-14 животных. Статистически достоверное различие между группами, которым вводили соединение 63 и физиологический раствор, в тот же самый день после лечения: **p<0,01; и между показателями, полученными в день перед воздействием и на 10 день в различное время после введения лекарственного вещества или физиологического раствора: #p<0,05; ##p<0,01 (двухфакторный ANOVA с повторными измерениями с последующим сравнением по критерию Ньюмана-Кеулса).
Фиг. 10: Динамика действия однократной п/к инъекции Соединения 63 (64 мг/кг) или физиологического раствора на пороговую силу давления для отдергивания задней лапы у мышей на 10 день после введения носителя для паклитаксела. Каждая точка и вертикальная линия означает среднее ± стандартную ошибку среднего показателей, полученных у 7-10 животных. Статистически достоверное различие между двумя группами в любое время наблюдения не наблюдалась, или в пределах каждой группы при сравнении с их собственными показателями, полученными в день перед воздействием (двухфакторный ANOVA).
Фиг. 11: Динамика паклитаксел-индуцируемой механической аллодинии у нокаутированных по сигма-1 рецептору мышей и мышей дикого типа. Каждая точка и вертикальная линия означает среднее ± стандартную ошибку среднего показателей, полученных у 18 (дикого типа) и 20 (нокаутированных) животных. Статистически достоверное различие между нокаутированными по сигма-1 рецептору мышами и мышами дикого типа в один и тот же день после воздействия: *p<0,05; **p<0,01 ; и между показателями, полученными в день перед воздействием и в дни после воздействия: ##p<0,01 (двухфакторный ANOVA с повторными измерениями с последующим сравнением по критерию Ньюмана-Кеулса).
Фиг. 12: Динамика воздействия носителя для паклитаксела на пороговую силу давления для отдергивания задней лапы у нокаутированных по сигма-1 рецептору мышей и мышей дикого типа. Каждая точка и вертикальная линия означает среднее ± стандартную ошибку среднего показателей, полученных у 12 животных. Статистически достоверное различие между двумя группами в любое время наблюдения или в сравнении с их собственными показателями в день перед воздействием и дни после воздействия не наблюдалось (двухфакторный ANOVA).
Фиг. 13: Профилактическое (принцип совместного введения) действие соединения 63 в отношении аллодинии на модели хронической оксалиплатин-индуцированной невропатии у крыс (Тест с ацетоном/Время реакции). Результаты представлены как время реакции отдергивания лапы (среднее ± стандартная ошибка среднего) в с/экспериментальной группе/день тестирования, рассчитанное из результатов измерений времени реакции для одной особи (средние значения из полученных для обеих задних лап времен реакции). ##; ###: p<0,01 и p<0,001 по сравнению с группой, которой вводили ГПМЦ/дистиллированную воду, тест Бонферрони после получения значимого различия в ранговом двухфакторном ANOVA. ***: p<0,001 по сравнению с группой, которой вводили 0,5% ГПМЦ/Оксалиплатин, тест Бонферрони после получения значимого различия в ранговом двухфакторном ANOVA.
Фиг. 14: Эффект соединения 63 в отношении аллодинии (введение после оксалиплатина) на модели хронической оксалиплатин-индуцированной невропатии у крыс (Тест с ацетоном/Время реакции). Результаты представлены как время реакции отдергивания лапы (среднее ± стандартная ошибка среднего) в с/экспериментальной группе/день тестирования, рассчитанное из результатов измерений времени реакции для одной особи (средние значения из полученных для обоих задних лап времен реакции). ##; ###: p<0,01 и p<0,001 по сравнению с группой, которой вводили ГПМЦ/дистиллированную воду, тест Бонферрони после получения значимого различия в ранговом двухфакторном ANOVA. ***, ** и *: p<0,001, p<0,01 и p<0,05 по сравнению с группой, которой вводили 0,5% ГПМЦ/Оксалиплатин, тест Бонферрони после получения значимого различия в ранговом двухфакторном ANOVA.
Фиг. 15: Профилактическое (принцип совместного введения) действие соединения 63 в отношении аллодинии на модели хронической оксалиплатин-индуцированной невропатии у крыс (Тест с ацетоном/Суммарный балл холодовой чувствительности). Результаты (Суммарный балл холодовой чувствительности) представлены как среднее ± стандартная ошибка среднего суммы из 6-ти оценок в баллах, полученных для обеих задних лап/экспериментальной группе/день тестирования. ###: p<0,001 по сравнению с группой, которой вводили ГПМЦ/дистиллированную воду, тест Бонферрони после получения значимого различия в ранговом двухфакторном ANOVA. ***: p<0,001 по сравнению с группой, которой вводили 0,5% ГПМЦ/Оксалиплатин, тест Бонферрони после получения значимого различия в ранговом двухфакторном ANOVA.
Фиг. 16: Эффект соединения 63 в отношении аллодинии (введение после оксалиплатина) на модели хронической оксалиплатин-индуцированной невропатии у крыс (Тест с ацетоном/Суммарный балл холодовой чувствительности). Результаты (Суммарный балл холодовой чувствительности) представлены как среднее ± стандартная ошибка среднего суммы из 6-ти оценок в баллах, полученных для обеих задних лап/экспериментальной группе/день тестирования. ###: p<0,001 по сравнению с группой, которой вводили ГПМЦ/дистиллированную воду, тест Бонферрони после получения значимого различия в ранговом двухфакторном ANOVA. *** и *: p<0,001 и p<0,05 по сравнению с группой, которой вводили 0,5% ГПМЦ/Оксалиплатин, тест Бонферрони после получения значимого различия в ранговом двухфакторном ANOVA.
Фиг. 17: Эффект неотложного лечения с помощью соединения 63 на модели хронической цисплатин-индуцированной невропатии у крыс. Цисплатин (1 мг/кг) вводили один раз в неделю в течение 5 недель и на 5 неделе (за 50 минут до тестирования) вводили соединение 63 (64 мг/кг).
Фиг. 18: Профилактическое действие соединения 63 на модели хронической цисплатин-индуцированной невропатии у крыс. Цисплатин (1 мг/кг) и соединение 63 (25 мг/кг) вводили совместно один раз в неделю в течение 5 недель.
Подробное описание изобретения
В контексте настоящего изобретения следующие термины имеют значение, подробно раскрываемое ниже.
«Алкил» относится к радикалу с прямой или разветвленной углеводородной цепью, состоящему из 1-12 атомов углерода, не содержащему ненасыщенные связи и который присоединен к остальной молекуле одинарной связью, например, метил, этил, н-пропил, изопропил, н-бутил, трет-бутил, н-пентил и так далее. Алкильные радикалы могут быть необязательно замещены одним или несколькими заместителями, такими как арил, галоген, гидрокси, алкокси, карбокси, циано, карбонил, ацил, алкоксикарбонил, амино, нитро, меркапто, алкилтио и так далее. В случае замещения арилом - это соответствует радикалу «арилалкил», такому как бензил и фенэтил. Предпочтительные алкильные радикалы имеют от 1 до 6 атомов углерода.
«Алкенил» относится к алкильному радикалу, состоящему из 2-12 атомов углерода и имеющему одну или несколько ненасыщенных связей.
«Циклоалкил» относится к стабильному 3-10-членному моноциклическому или бициклическому радикалу, который является насыщенным или частично насыщенным и который состоит только из атомов углерода и водорода, такому как циклогексил или адамантил. Если в описании конкретно не указано иное, термин «циклоалкил» предназначен охватывать циклоалкильные радикалы, которые необязательно замещены одним или несколькими заместителями, такими как алкил, галоген, гидрокси, амино, циано, нитро, алкокси, карбокси, алкоксикарбонил и так далее.
«Арил» относится к моноциклическим или полициклическим ароматическим радикалам, включая полициклические радикалы, которые содержат изолированные и/или конденсированные арильные группы. Типичные арильные группы содержат от 1 до 3 изолированных или конденсированных колец и от 6 до приблизительно 18 углеродных атомов в кольце, такие как фенильный, нафтильный, инденильный, фенантрильный или антрацильный радикалы. Арильный радикал может необязательно быть замещен одним или несколькими заместителями, такими как гидрокси, меркапто, галоген, алкил, фенил, алкокси, галогеналкил, нитро, циано, диалкиламино, аминоалкил, ацил, алкоксикарбонил и так далее.
«Гетероциклил» относится к стабильному 3-15-членному циклическому радикалу, который состоит из атомов углерода и от одного до пяти гетероатомов, выбранных из группы, состоящей из азота, кислорода и серы, предпочтительно 4-8-членному циклу с одним или более гетероатомами, более предпочтительно, 5- или 6-членному циклу с одним или более гетероатомами. Он может быть ароматическим или неароматическим. Для целей настоящего изобретения гетероцикл может представлять собой моноциклическую, бициклическую или трициклическую кольцевую систему, которая может включать системы с конденсированными кольцами, и атомы азота, углерода или серы в гетероциклическом радикале могут быть необязательно окислены, атом азота может быть необязательно кватернизованным, а гетероциклический радикал может быть частично или полностью насыщенным или ароматическим. Примеры таких гетероциклов включают, в качестве неограничивающих примеров, азепины, бензимидазол, бензотиазол, фуран, изотиазол, имидазол, индол, пиперидин, пиперазин, пурин, хинолин, тиадиазол, тетрагидрофуран, кумарин, морфолин, пиррол, пиразол, оксазол, изоксазол, триазол, имидазол и так далее.
«Алкокси» относится к радикалу формулы -ORa, где Ra представляет собой алкильный радикал, который определен ранее, например, метокси, этокси, пропокси и так далее.
«Амино» относится к радикалу формулы -NH2, -NHR3 или -NRaRb, необязательно кватернизованному, где Ra и Rb представляют собой, независимо, алкильный радикал, который определен ранее, например, метиламино, этиламино, диметиламино, диэтиламино, пропиламино и так далее.
Термин «галоген» относится к брому, хлору, йоду и фтору.
В настоящем описании под замещенными группами в соединениях по настоящему изобретению подразумевается определенный фрагмент, который может быть замещен по одному или нескольким соответствующим положениям одной или несколькими подходящими группами, например, галогеном, таким как фтор, хлор, бром и йод; циано; гидроксилом; нитро; азидо; алканоилом, таким как C1-6 алканоильная группа, такая как ацил и тому подобное; карбоксамидо; алкильными группами, включая группы с 1 до приблизительно 12 атомами углерода или от 1 до приблизительно 6 атомами углерода и, более предпочтительно, 1-3 атомов углерода; алкенильной и алкинильной группами, включая группы с одной или несколькими ненасыщенными связями и от 2 до приблизительно 12 атомами углерода или от 2 до приблизительно 6 атомами углерода; алкокси группами с одной или несколькими связями с кислородом и от 2 до приблизительно 12 атомами углерода или от 1 до приблизительно 6 атомами углерода; арилокси, таким как фенокси; алкилтио группами, включая фрагменты с одной или несколькими тиоэфирными связями и от 1 до приблизительно 12 атомами углерода или от 1 до приблизительно 6 атомами углерода; алкилсульфинильными группами, включая фрагменты с одной или несколькими сульфинильными связями и от 1 до приблизительно 12 атомами углерода или от 1 до приблизительно 6 атомами углерода; алкилсульфонильными группами, включая фрагменты с одной или несколькими сульфонильными связями и от 1 до приблизительно 12 атомами углерода или от 1 до приблизительно 6 атомами углерода; аминоалкильными группами, такими как группы с одним или более атомами N и от 1 до приблизительно 12 атомами углерода или от 1 до приблизительно 6 атомами углерода; карбоциклическим арилом, имеющим 6 или более атомов углерода, особенно фенилом или нафтилом, и аралкилом, таким как бензил. Если не указано иное, в случае необходимости замещенная группа может иметь заместитель в каждом возможном для замещения положении группы, и каждое замещение является независимым от другого.
Термин «соль» следует понимать как любую форму активного соединения, применяемого согласно настоящему изобретению, в которой указанное соединение находится в ионной форме или является заряженным и связанным с противоионом (катионом или анионом) или находится в растворе. Данное определение также включает четвертичные аммониевые соли и комплексы активной молекулы с другими молекулами или ионами, в частности комплексы, образованные посредством ионных взаимодействий. Определение включает, в частности, физиологически приемлемые соли; данный термин следует понимать как эквивалентный «фармакологически приемлемым солям».
Термин «фармацевтически приемлемые соли» в контексте настоящего изобретения относится к любой соли, которая является физиологически переносимой (обычно означает, что является нетоксичной, в частности благодаря противоиону), когда используется соответствующим образом для лечения, применяется или используется, в частности, у людей и/или млекопитающих. Данные физиологически приемлемые соли, особенно когда используются у людей и/или млекопитающих, могут быть получены с катионами или основаниями и, в контексте настоящего изобретения, следует понимать, что соли формируются по меньшей мере одним соединением, используемым согласно изобретению, - обычно кислотой (депротонированной), таким как анион, и по меньшей мере одним физиологически приемлемым катионом, предпочтительно неорганическим. Особенно предпочтительными являются соли с щелочными и щелочноземельными металлами, а также соли с аммоний-катионами (NH4 +). Предпочтительными солями являются соли, образованные с одним или двумя ионами натрия, одним или двумя ионами калия, магнием или кальцием. Данные физиологически приемлемые соли, особенно когда используются у людей и/или млекопитающих, могут также быть получены с анионами или кислотами и, в контексте настоящего изобретения, следует понимать, что соли формируются по меньшей мере одним соединением, используемым согласно изобретению, - обычно протонированным, например по атому азота, таким как катион, и по меньшей мере одним физиологически переносимым анионом. Данное определение, в частности, охватывает, в контексте настоящего изобретения, соль, образованную физиологически переносимой кислотой, например, соли указанного активного соединения с физиологически переносимыми органическими и неорганическими кислотами, особенно когда используются у людей и/или млекопитающих. Примерами данного типа солей являются соли, образованные с хлороводородной кислотой, бромоводородной кислотой, серной кислотой, метансульфоновой кислотой, муравьиной кислотой, уксусной кислотой, щавелевой кислотой, янтарной кислотой, яблочной кислотой, винной кислотой, миндальной кислотой, фумаровой кислотой, молочной кислотой и лимонной кислотой.
Под термином «сольват», в соответствии с настоящим изобретением, следует понимать любую форму активного соединения согласно изобретению, в которой указанное соединение нековалентно связано с другой молекулой (обычно полярного растворителя), включая гидраты и алкоголяты, подобно, например, метаноляту. Предпочтительным сольватом является гидрат.
Любое соединение, которое является пролекарством соединения формулы I, также находится в пределах объема настоящего изобретения. Термин «пролекарство» используется в его самом широком смысле и охватывает все производные, которые в условиях in vivo превращаются в соединения по изобретению. Примеры пролекарств включают, в качестве неограничивающих примеров, производные и метаболиты соединений формулы I, которые включают биогидролизуемые фрагменты, такие как биогидролизуемые амиды, биогидролизуемые сложные эфиры, биогидролизуемые карбаматы, биогидролизуемые карбонаты, биогидролизуемые уреиды и биогидролизуемые фосфатные аналоги. Предпочтительно, пролекарства соединений с карбоксильными функциональными группами являются сложными эфирами карбоновой кислоты с низшими алкилами. Сложные эфиры карбоновых кислот традиционно получают путем этерификации любой из карбоксильных групп, присутствующих в молекуле. Пролекарства обычно могут быть получены с помощью хорошо известных способов, таких как описанные у Бургера (Burger) в «Medicinal Chemistry and Drug Discovery» 6th ed. (Donald J. Abraham ed., 2001, Wiley) и в «Design and Applications of Prodrugs» (H. Bundgaard ed., 1985, Harwood Academic Publishers).
Используемые здесь термины «лечить», «лечащий» и «лечение» включает ликвидацию, снятие, возвращение к исходному состоянию до, ослабление, изменение, контролирование боли, вызванной химиотерапией, после возникновения боли.
Используемые здесь термины «предупреждение», «предупреждающий», «предупреждать» и профилактика относятся к способности терапевтического вещества не допускать, сводить до минимума или затруднять возникновение или развитие заболевания или состояния перед его началом, в данном случае вызванной химиотерапией боли.
Используемый здесь термин «химиотерапия» или «химиотерапевтическое средство» относится в общих чертах к применению химических средств для лечения рака, опухоли или злокачественного новообразования.
В соответствии с изобретением, «возникающая как следствие химиотерапии» определяется как: a) возникающая после или в начале химиотерапии и b) таким образом, совпадающая или следующая после применения химиотерапевтического средства. Следовательно, подвергаемый лечению симптом, вероятно, вызывается или является следствием токсичности, цитотоксичности или, в особенности, периферической нейротоксичности химиотерапевтического средства.
В предпочтительном варианте осуществления, R1 в соединениях формулы (I) выбирают из H, -COR8 и замещенного или незамещенного алкила. Более предпочтительно, R1 выбирают из H, метила и ацетила. Более предпочтительным вариантом осуществления является вариант, когда R1 представляет собой H.
В другом предпочтительном варианте осуществления, R2 означает H или алкил, более предпочтительно метил.
В еще другом предпочтительном варианте осуществления изобретения, R3 и R4 находятся в мета- и пара-положениях фенильной группы, и предпочтительно, они выбираются независимо от галогена и замещенного или незамещенного алкила.
В особенно предпочтительном варианте осуществления изобретения, оба R3 и R4 вместе с фенильной группой образуют необязательно замещенную систему с конденсированными циклами, более предпочтительно, нафтильную циклическую систему.
Также в отношении настоящего изобретения предпочтительными являются варианты осуществления, где n выбирают из 2, 3, 4, более предпочтительно n равно 2.
В заключение, в другом варианте осуществления предпочтительным является, чтобы R5 и R6 представляли собой, каждый независимо, C1-6алкил или вместе с атомом азота, к которому они присоединены, образовывали группу мофолина, пиперидинила или пирролидинила. Более предпочтительно, R5 и R6 вместе образуют морфолин-4-ильную группу.
В предпочтительных вариантах осуществления комбинация согласно изобретению содержит лиганд сигма-рецептора формулы (I), выбранный из следующих:
[1] 4-{2-(1-(3,4-дихлорфенил)-5-метил-1H-пиразол-3-илокси)этил}морфолина;
[2] 2-[1-(3,4-дихлорфенил)-5-метил-1H-пиразол-3-илокси]-N,N-диэтилэтанамина;
[3] 1-(3,4-дихлорфенил)-5-метил-3-[2-(пирролидин-1-ил)этокси]-1H-пиразола;
[4] 1-(3,4-дихлорфенил)-5-метил-3-[3-(пирролидин-1-ил)пропокси]-1H-пиразола;
[5] 1-{2-[1-(3,4-дихлорфенил)-5-метил-1H-пиразол-3-илокси]этил}пиперидина;
[6] 1-{2-[1-(3,4-дихлорфенил)-5-метил-1H-пиразол-3-илокси]этил}-1H-имидазола;
[7] 3-{1-[2-(1-(3,4-дихлорфенил)-5-метил-1H-пиразол-3-илокси)этил]пиперидин-4-ил}-3H-имидазо[4,5-b]пиридина;
[8] 1-{2-[1-(3,4-дихлорфенил)-5-метил-1H-пиразол-3-илокси]этил}-4-метилпиперазина;
[9] этил-4-{2-[1-(3,4-дихлорфенил)-5-метил-1H-пиразол-3-илокси]этил}пиперазинкарбоксилата;
[10] 1-(4-(2-(1-(3,4-дихлорфенил)-5-метил-1H-пиразол-3-илокси)этил)пиперазин-1-ил)этанона;
[11] 4-{2-[1-(4-метоксифенил)-5-метил-1H-пиразол-3-илокси]этил}морфолина;
[12] 1-(4-метоксифенил)-5-метил-3-[2-(пирролидин-1-ил)этокси]-1H-пиразола;
[13] 1-(4-метоксифенил)-5-метил-3-[3-(пирролидин-1-ил)пропокси]-1H-пиразола;
[14] 1-[2-(1-(4-метоксифенил)-5-метил-1H-пиразол-3-илокси)этил]пиперидина;
[15] 1-{2-[1-(4-метоксифенил)-5-метил-1H-пиразол-3-илокси]этил}-1H-имидазола;
[16] 4-{2-[1-(3,4-дихлорфенил)-5-фенил-1H-пиразол-3-илокси]этил}морфолина;
[17] 1-(3,4-дихлорфенил)-5-фенил-3-[2-(пирролидин-1-ил)этокси]-1H-пиразола;
[18] 1-(3,4-дихлорфенил)-5-фенил-3-[3-(пирролидин-1-ил)пропокси]-1H-пиразола;
[19] 1-{2-[1-(3,4-дихлорфенил)-5-фенил-1H-пиразол-3-илокси]этил}пиперидина;
[20] 1-{2-[1-(3,4-дихлорфенил)-5-фенил-1H-пиразол-3-илокси]этил}-1H-имидазола;
[21] 2-{2-[1-(3,4-дихлорфенил)-5-фенил-1H-пиразол-3-илокси]этил}-1,2,3,4-тетрагидроизохинолина;
[22] 4-{4-[1-(3,4-дихлорфенил)-5-метил-1H-пиразол-3-илокси]бутил}морфолина;
[23] 1-(3,4-дихлорфенил)-5-метил-3-[4-(пирролидин-1-ил)бутокси]-1H-пиразола;
[24] 1-{4-[1-(3,4-дихлорфенил)-5-метил-1H-пиразол-3-илокси]бутил}пиперидин