Молекула, пестицидная композиция на ее основе (варианты) и способ применения молекулы (варианты)
Иллюстрации
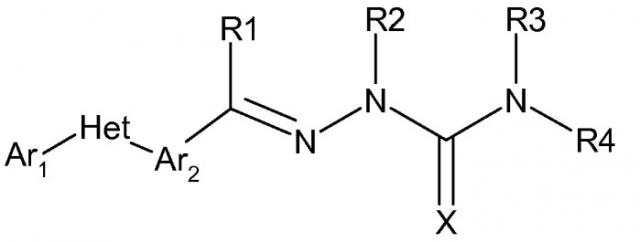
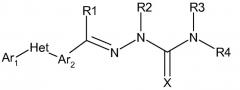
Показать всеИзобретение относится к сельскому хозяйству и ветеринарии. Молекула формулы:
в которой (a) Ar1 представляет собой: (1) фуранил, фенил, пиридазинил, пиридил, пиримидинил, тиенил или (2) замещенный фуранил, замещенный фенил, замещенный пиридазинил, замещенный пиридил, замещенный пиримидинил или замещенный тиенил; (b) Het представляет собой 5 или 6-членное, насыщенное или ненасыщенное, гетероциклическое кольцо, содержащее один или несколько гетероатомов, независимо выбираемых из азота, серы или кислорода; (с) Ar2 представляет собой: (1) фуранил, фенил, пиридазинил, пиридил, пиримидинил, тиенил или (2) замещенный фуранил, замещенный фенил, замещенный пиридазинил, замещенный пиридил, замещенный пиримидинил или замещенный тиенил; (d) X представляет собой О или S; (e), (f) и (h) R1-R4, Rx , Ry представляют собой углеводородные заместители; (g) n=0, 1 или 2. Изобретение позволяет повысить эффективность борьбы с вредителями. 6 н. и 6 з.п. ф-лы, 2 табл., 39 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Данная заявка утверждает приоритет Предварительной Заявки США с серийным номером 61/232152, поданной 7 августа 2009 года, полное содержание которой настоящим включено ссылкой. Изобретение, раскрытое в данном документе, относится к области пестицидов и их применению для контроля вредителей.
УРОВЕНЬ ИЗОБРЕТЕНИЯ
Вредители каждый год вызывают во всем мире миллионы человеческих смертей. Кроме того, имеется более десяти тысяч видов сельскохозяйственных вредителей, которые вызывают потери в сельском хозяйстве. Данные сельскохозяйственные потери каждый год составляют миллиарды долларов США. Термиты наносят повреждения различным структурам, таким как дома. Данные потери от повреждения термитами каждый год составляют миллиарды долларов США. И, наконец, многие вредители хранящихся продуктов питания поедают и портят хранящиеся продукты питания. Данные потери хранящихся продуктов питания каждый год составляют миллиарды долларов США, но более важно, отнимают у людей необходимые продукты питания.
Существует острая потребность в новых пестицидах. Насекомые развивают устойчивость к пестицидам, применяющимся в настоящее время. Сотни видов насекомых являются устойчивыми к одному или нескольким пестицидам. Развитие устойчивости к некоторым из более старых пестицидов, таким как ДДТ, карбаматы и органические фосфаты, хорошо известно. Но устойчивость даже развилась к некоторым из более новых пестицидов. Поэтому существует потребность в новых пестицидах и особенно в пестицидах, которые имеют новые механизмы действия.
ЗАМЕСТИТЕЛИ (НЕПОЛНЫЙ ПЕРЕЧЕНЬ)
Примеры, приведенные для заместителей, являются неполными (кроме галогена) и не должны рассматриваться как ограничение изобретения, раскрытого в данном документе.
“Алкенил” означает ациклический, ненасыщенный (содержащий, по меньшей мере, одну углерод-углеродную двойную связь), разветвленный или неразветвленный заместитель, состоящий из углерода и водорода, например винил, аллил, бутенил, пентенил, гексенил, гептенил, октенил, ноненил и деценил.
“Алкенилокси” означает алкенил, дополнительно содержащий одинарную углерод-кислородную связь, например аллилокси, бутенилокси, пентенилокси, гексенилокси, гептенилокси, октенилокси, ноненилокси и деценилокси.
“Алкокси” означает алкил, дополнительно содержащий одинарную углерод-кислородную связь, например метокси, этокси, пропокси, изопропокси, 1-бутокси, 2-бутокси, изобутокси, трет-бутокси, пентокси, 2-метилбутокси, 1,1-диметилпропокси, гексокси, гептокси, октокси, нонокси и декокси.
“Алкил” означает ациклический, насыщенный, разветвленный или неразветвленный заместитель, состоящий из углерода и водорода, например метил, этил, пропил, изопропил, 1-бутил, 2-бутил, изобутил, трет-бутил, пентил, 2-метилбутил, 1,1-диметилпропил, гексил, гептил, октил, нонил и децил.
“Алкинил” означает ациклический, ненасыщенный (содержащий, по меньшей мере, одну углерод-углеродную тройную связь и любые двойные связи), разветвленный или неразветвленный заместитель, состоящий из углерода и водорода, например этинил, пропаргил, бутинил, пентинил, гексинил, гептинил, октинил, нонинил и децинил.
“Алкинилокси” означает алкинил, дополнительно содержащий одинарную углерод-кислородную связь, например пентинилокси, гексинилокси, гептинилокси, октинилокси, нонинилокси и децинилокси.
“Арил” означает циклический, ароматический заместитель, состоящий из водорода и углерода, например фенил, нафтил и бифенил.
“Циклоалкенил” означает моноциклический или полициклический, ненасыщенный (содержащий, по меньшей мере, одну двойную углерод-углеродную связь) заместитель, состоящий из углерода и водорода, например циклобутенил, циклопентенил, циклогексенил, циклогептенил, циклооктенил, циклодеценил, норборненил, бицикло[2.2.2]октенил, тетрагидронафтил, гексагидронафтил и октагидронафтил.
“Циклоалкенилокси” означает циклоалкенил, дополнительно содержащий одинарную углерод-кислородную связь, например циклобутенилокси, циклопентенилокси, циклогексенилокси, циклогептенилокси, циклооктенилокси, циклодеценилокси, норборненилокси и бицикло[2.2.2]октенилокси.
“Циклоалкил” означает моноциклический или полициклический, насыщенный заместитель, состоящий из углерода и водорода, например циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, циклодецил, норборнил, бицикло[2.2.2]октил, декагидронафтил.
“Циклоалкокси” означает циклоалкил, дополнительно содержащий одинарную углерод-кислородную связь, например циклопропилокси, циклобутилокси, циклопентилокси, циклогексилокси, циклогептилокси, циклооктилокси, циклодецилокси, норборнилокси и бицикло[2.2.2]октилокси.
“Галоген” означает фтор, хлор, бром и иод.
“Галогеналкил” означает алкил, дополнительно состоящий из одного до максимального возможного числа, одинаковых или различных галогенов, например фторметил, дифторметил, трифторметил, 1-фторметил, 2-фторэтил, 2,2,2-трифторэтил, хлорметил, трихлорметил и 1,1,2,2-тетрафторэтил.
“Гетероциклил” означает циклический заместитель, который может быть полностью замещенным, частично незамещенным или полностью незамещенным, где циклическая структура содержит по меньшей мере один углерод и по меньшей мере один гетероатом, где упомянутый гетероатом представляет собой азот, серу или кислород, например бензофуранил, бензоизотиазолил, бензоизоксазолил, бензоксазолил, бензотиенил, бензотиазолил, циннолинил, фуранил, индазолил, индолил, имидазолил, изоиндолил, изохинолинил, изотиазолил, изоксазолил, 1,3,4-оксадиазолил, оксазолинил, оксазолил, фталазинил, пиразинил, пиразолинил, пиразолил, пиридазинил, пиридил, пиримидинил, пирролил, хиназолинил, хинолинил, хиноксалинил, 1,2,3,4-тетразолил, тиазолинил, тиазолил, тиенил, 1,2,3-триазинил, 1,2,4-триазинил, 1,3,5-триазинил, 1,2,3-триазолил и 1,2,4-триазолил.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Соединения данного изобретения имеют следующую формулу:
в которой:
(а) Ar1 представляет собой
(1) фуранил, фенил, пиридазинил, пиридил, пиримидинил, тиенил или
(2) замещенный фуранил, замещенный фенил, замещенный пиридазинил, замещенный пиридил, замещенный пиримидинил или замещенный тиенил,
где указанный замещенный фуранил, замещенный фенил, замещенный пиридазинил, замещенный пиридил, замещенный пиримидинил и замещенный тиенил имеют один или несколько заместителей, независимо выбираемых из следующих: H, F, Cl, Br, I, CN, NO2, C1-C6алкил, С1-С6галогеналкил, С3-С6циклоалкил, С3-С6галогенциклоалкил, С3-С6циклоалкокси, С3-С6галогенциклоалкокси, С1-С6алкокси, С1-С6галогеналкокси, С2-С6алкенил, С2-С6алкинил, S(=O)n(С1-С6алкил), S(=O)n(С1-С6галогеналкил), OSO2(С1-С6алкил), OSO2(С1-С6галогеналкил), С(=O)NRxRy, (C1-C6алкил)NRxRy, C(=O)(C1-C6алкил), С(=O)O(C1-C6алкил), C(=O)(C1-C6галогеналкил), С(=O)O(C1-C6галогеналкил), C(=O)(C3-C6циклоалкил), С(=O)O(C3-C6циклоалкил), C(=O)(C2-C6алкенил), С(=O)O(C2-C6алкенил), (C1-С6алкил)О(C1-C6алкил), (C1-С6алкил)S(C1-C6алкил), С(=O)(C1-C6алкил)С(=О)О(C1-C6алкил), фенил, фенокси, замещенный фенил и замещенный фенокси,
где такой замещенный фенил и замещенный фенокси имеют один или несколько заместителей, независимо выбираемых из следующих: H, F, Cl, Br, I, CN, NO2, C1-C6алкил, С1-С6галогеналкил, С3-С6циклоалкил, С3-С6галогенциклоалкил, С3-С6циклоалкокси, С3-С6-галогенциклоалкокси, С1-С6алкокси, С1-С6галогеналкокси, С2-С6алкенил, С2-С6алкинил, S(=O)n(С1-С6алкил), S(=O)n(С1-С6галогеналкил), OSO2(С1-С6алкил), OSO2(С1-С6галогеналкил), С(=O)NRxRy, (C1-C6алкил)NRxRy, C(=O)(C1-C6алкил), С(=O)O(C1-C6алкил), C(=O)(C1-C6галогеналкил), С(=O)O(C1-C6галогеналкил), C(=O)(C3-C6циклоалкил), С(=O)O(C3-C6циклоалкил), C(=O)(C2-C6алкенил), С(=O)O(C2-C6алкенил), (C1-С6алкил)О(C1-C6алкил), (C1-С6алкил)S(C1-C6алкил), С(=O)(C1-C6алкил)С(=О)О(C1-C6алкил), фенил и фенокси;
(b) Het представляет собой 5 или 6-членное, насыщенное или ненасыщенное, гетероциклическое кольцо, содержащее один или несколько гетероатомов, независимо выбираемых из азота, серы или кислорода, и где Ar1 и Ar2 не находятся в орто-положении друг к другу (но могут быть в мета или пара, а именно, для пятичленного кольца они находятся в 1,3 и для 6-членного кольца они находятся либо в 1,3- либо в 1,4-положениях), и где указанное гетероциклическое кольцо может быть также замещено одним или несколькими заместителями, независимо выбираемыми из следующих: H, ОН, F, Cl, Br, I, CN, NO2, оксо, C1-C6алкил, С1-С6галогеналкил, С3-С6циклоалкил, С3-С6галогенциклоалкил, С3-С6циклоалкокси, С3-С6галогенциклоалкокси, С1-С6алкокси, С1-С6галогеналкокси, С2-С6алкенил, С2-С6алкинил, S(=O)n(С1-С6алкил), S(=O)n(С1-С6галогеналкил), OSO2(С1-С6алкил), OSO2(С1-С6галогеналкил), С(=O)NRxRy, (C1-C6алкил)NRxRy, C(=O)(C1-C6алкил), С(=O)O(C1-C6алкил), C(=O)(C1-C6галогеналкил), С(=O)O(C1-C6галогеналкил), C(=O)(C3-C6циклоалкил), С(=O)O(C3-C6циклоалкил), C(=O)(C2-C6алкенил), С(=O)O(C2-C6алкенил), (C1-С6-алкил)О(C1-C6алкил), (C1-С6алкил)S(C1-C6алкил), С(=O)(C1-C6алкил)С(=О)О(C1-C6алкил), фенил, фенокси, замещенный фенил и замещенный фенокси,
где такой замещенный фенил и замещенный фенокси имеют один или несколько заместителей, независимо выбираемых из следующих: H, F, Cl, Br, I, CN, NO2, C1-C6алкил, С1-С6галогеналкил, С3-С6циклоалкил, С3-С6галогенциклоалкил, С3-С6циклоалкокси, С3-С6галогенциклоалкокси, С1-С6алкокси, С1-С6галогеналкокси, С2-С6алкенил, С2-С6алкинил, S(=O)n(С1-С6алкил), S(=O)n(С1-С6галогеналкил), OSO2(С1-С6алкил), OSO2(С1-С6галогеналкил), С(=О)Н, С(=O)NRxRy, (C1-C6алкил)NRxRy, C(=O)(C1-C6алкил), С(=O)O(C1-C6алкил), C(=O)(C1-C6галогеналкил), С(=O)O(C1-C6галогеналкил), C(=O)(C3-C6циклоалкил), С(=O)O(C3-C6циклоалкил), C(=O)(C2-C6алкенил), С(=O)O(C2-C6алкенил), (C1-С6алкил)О(C1-C6алкил), (C1-С6алкил)S(C1-C6алкил), С(=O)(C1-C6алкил)С(=О)О(C1-C6алкил), фенил и фенокси;
(с) Ar2 представляет собой
(1) фуранил, фенил, пиридазинил, пиридил, пиримидинил, тиенил или
(2) замещенный фуранил, замещенный фенил, замещенный пиридазинил, замещенный пиридил, замещенный пиримидинил или замещенный тиенил,
где упомянутый замещенный фуранил, замещенный фенил, замещенный пиридазинил, замещенный пиридил, замещенный пиримидинил и замещенный тиенил имеют один или несколько заместителей, независимо выбираемых из следующих: H, F, Cl, Br, I, CN, NO2, C1-C6алкил, С1-С6галогеналкил, С3-С6циклоалкил, С3-С6галогенциклоалкил, С3-С6циклоалкокси, С3-С6галогенциклоалкокси, С1-С6алкокси, С1-С6галогеналкокси, С2-С6алкенил, С2-С6алкинил, S(=O)n(С1-С6алкил), S(=O)n(С1-С6галогеналкил), OSO2(С1-С6алкил), OSO2(С1-С6галогеналкил), С(=O)NRxRy, (C1-C6алкил)NRxRy, C(=O)(C1-C6алкил), С(=O)O(C1-C6алкил), C(=O)(C1-C6галогеналкил), С(=O)O(C1-C6галогеналкил), C(=O)(C3-C6циклоалкил), С(=O)O(C3-C6циклоалкил), C(=O)(C2-C6алкенил), С(=O)O(C2-C6алкенил), (C1-С6алкил)О(C1-C6алкил), (C1-С6алкил)S(C1-C6алкил), С(=O)(C1-C6алкил)С(=О)О(C1-C6алкил), фенил, фенокси, замещенный фенил и замещенный фенокси,
где такой замещенный фенил и замещенный фенокси имеют один или несколько заместителей, независимо выбираемых из следующих: H, F, Cl, Br, I, CN, NO2, C1-C6алкил, С1-С6галогеналкил, С3-С6циклоалкил, С3-С6галогенциклоалкил, С3-С6гидроксициклоалкил, С3-С6циклоалкокси, С3-С6галогенциклоалкокси, С1-С6алкокси, С1-С6галогеналкокси, С2-С6алкенил, С2-С6алкинил, S(=O)n(С1-С6алкил), S(=O)n(С1-С6галогеналкил), OSO2(С1-С6алкил), OSO2(С1-С6галогеналкил), С(=О)Н, С(=O)NRxRy, (C1-C6алкил)NRxRy, C(=O)(C1-C6алкил), С(=O)O(C1-C6алкил), C(=O)(C1-C6галогеналкил), С(=O)O(C1-C6галогеналкил), C(=O)(C3-C6циклоалкил), С(=O)O(C3-C6циклоалкил), С(=О)(С1-С6галогеналкил), C(=O)(C2-C6алкенил), С(=O)O(C2-C6алкенил), (C1-С6алкил)О(C1-C6алкил), (C1-С6алкил)S(C1-C6алкил), С(=O)(C1-C6алкил)С(=О)О(C1-C6алкил), фенил и фенокси;
(d) Х представляет собой О или S;
(е) R1 выбран из заместителей: Н, CN, C1-C6алкил, С1-С6галогеналкил, С3-С6циклоалкил, С3-С6галогенциклоалкил, С3-С6циклоалкокси, С3-С6галогенциклоалкокси, С1-С6алкокси, С1-С6галогеналкокси, С2-С6алкенил, С2-С6алкинил, S(=O)n(С1-С6алкил), S(=O)n(С1-С6галогеналкил), OSO2(С1-С6алкил), OSO2(С1-С6галогеналкил), С(=O)NRxRy, (C1-C6алкил)NRxRy, C(=O)(C1-C6алкил), С(=O)O(C1-C6алкил), C(=O)(C1-C6галогеналкил), С(=O)O(C1-C6галогеналкил), C(=O)(C3-C6циклоалкил), С(=O)O(C3-C6циклоалкил), C(=O)(C2-C6алкенил), С(=O)O(C2-C6алкенил), (C1-С6алкил)О(C1-C6алкил), (C1-С6алкил)S(C1-C6-алкил), С(=O)(C1-C6алкил)С(=О)О(C1-C6алкил), фенил, фенокси;
(f) R2, R3 и R4 выбраны из заместителей: Н, C1-C6алкил, С3-С6циклоалкил, С2-С6алкенил, С2-С6алкинил, C(=O)(C1-C6алкил), С(=O)O(C1-C6алкил), C(=O)(C3-C6циклоалкил), С(=O)O(C3-C6циклоалкил), C(=O)(C2-C6алкенил), С(=O)O(C2-C6алкенил), (C1-С6алкил)О(C1-C6алкил), (C1-С6алкил)S(C1-C6алкил), С(=O)(C1-C6алкил)С(=О)О(C1-C6алкил), С(=О)фенил, фенил, С1-С6алкилфенил, С1-С6алкилфенокси, инданил, С(=О)Het-1, Het-1, (C1-C6алкил)Het-1 или С1-С6алкил-О-Het-1,
где каждый алкил, циклоалкил, циклоалкокси, галогенциклоалкокси, алкокси, галогеналкокси, алкенил, алкинил, С1-С6алкилфенил, фенил, фенокси и Het-1 необязательно замещены одним или несколькими заместителями, независимо выбираемыми из следующих: F, Cl, Br, I, CN, NO2, NRxRy, C1-C6алкил, С1-С6галогеналкил, С3-С6циклоалкил, С3-С6галогенциклоалкил, С3-С6циклоалкокси, С3-С6галогенциклоалкокси, С1-С6алкокси, С1-С6галогеналкокси, С2-С6алкенил, C3-C6-циклоалкенил, С2-С6-алкинил, С3-С6-циклоалкинил, S(=O)n(С1-С6алкил), S(=O)n(С1-С6галогеналкил), S(=O)2N(C1-C6алкил)2, OSO2(С1-С6-алкил), OSO2(С1-С6-галогеналкил), С(=О)Н, С(=O)NRxRy, (C1-C6алкил)NRxRy, C(=O)(C1-C6алкил), С(=O)O(C1-C6алкил), C(=O)(C1-C6галогеналкил), С(=O)O(C1-C6галогеналкил), C(=O)(C3-C6циклоалкил), С(=O)O(C3-C6циклоалкил), C(=O)(C2-C6алкенил), С(=O)O(C2-C6-алкенил), (C1-С6-алкил)О(C1-C6-алкил), (C1-С6алкил)S(C1-C6алкил), С(=O)(C1-C6алкил)С(=О)О(C1-C6алкил), фенил, фенокси, О-Het-1 и Het-1,
где Het-1 представляет собой 5- или 6-членное, насыщенное или ненасыщенное, гетероциклическое кольцо, содержащее один или несколько гетероатомов, выбираемых из азота, серы и кислорода;
где R3 и R4 вместе необязательно могут образовывать 3-8-членную насыщенную или ненасыщенную циклическую группу, которая может содержать один или несколько гетероатомов, выбираемых из азота, серы и кислорода;
(g) n=0, 1 или 2;
(h) Rx и Ry независимо выбраны из заместителей: Н, C1-C6алкил, С1-С6галогеналкил, С3-С6циклоалкил, С3-С6галогенциклоалкил, С2-С6алкенил, С2-С6алкинил, S(=O)n(С1-С6алкил), S(=O)n(С1-С6галогеналкил), OSO2(С1-С6алкил), OSO2(С1-С6галогеналкил), С(=O)Н, C(=O)(C1-C6алкил), С(=O)O(C1-C6алкил), C(=O)(C1-C6галогеналкил), С(=O)O(C1-C6галогеналкил), C(=O)(C3-C6циклоалкил), С(=O)O(C3-C6циклоалкил), C(=O)(C2-C6алкенил), С(=O)O(C2-C6алкенил), (C1-С6алкил)О(C1-C6алкил), (C1-С6алкил)S(C1-C6алкил), С(=O)(C1-C6алкил)С(=О)О(C1-C6алкил) и фенил.
В другом варианте осуществления Ar1 представляет собой замещенный фенил, где указанный замещенный фенил имеет один или несколько заместителей, независимо выбираемых из С1-С6алкила, С1-С6галогеналкила и С1-С6галогеналкокси. В более предпочтительном варианте осуществления Ar1 представляет собой замещенный фенил, где указанный замещенный фенил имеет один или несколько заместителей, независимо выбираемых из OCF3, OCF2CF3, CF3.
В другом варианте осуществления Het представляет собой триазолил, имидазолил, пирролил или пиразолил.
В другом варианте осуществления Het представляет собой замещенный пиразолил, где указанный замещенный пиразолил имеет один или несколько заместителей, независимо выбираемых из Н, С(=О)О(С1-С6алкил) или С(=О)NRxRy.
В другом варианте осуществления Ar2 представляет собой фенил.
В другом варианте осуществления R1 представляет собой H или С1-С6алкил.
В другом варианте осуществления R2 представляет собой H или С1-С6-алкил.
В другом варианте осуществления R3 представляет собой H.
В другом варианте осуществления Х представляет собой S.
В другом варианте осуществления R4 представляет собой С1-С6алкил, С3-С6циклоалкил, С2-С6алкенил, С(=О)фенил, С1-С6алкилфенил, Het-1 или (C1-C6алкил)Het-1.
В другом варианте осуществления R4 представляет собой С1-С6алкил, С1-С6алкилфенил, фенил или Het-1, где каждый замещен одним или несколькими заместителями, независимо выбираемыми из следующих: F, Cl, Br, I, CN, NO2, NRxRy, C1-C6алкил, С1-С6галогеналкил, С1-С6алкокси, С1-С6галогеналкокси, C3-C6циклоалкенил, S(=O)n(С1-С6алкил), S(=O)n(С1-С6галогеналкил), S(=O)2N(C1-C6алкил)2, C(=O)(C1-C6алкил), С(=O)O(C1-C6алкил), C(=O)(C1-C6галогеналкил), (C1-С6алкил)О(C1-C6алкил), фенил, О-Het-1 и Het-1.
Хотя были представлены данные варианты осуществления, возможны другие варианты осуществления и комбинации данных показанных вариантов осуществления и других вариантов осуществления.
ПОЛУЧЕНИЕ ТРИАРИЛЬНЫХ ПРОМЕЖУТОЧНЫХ ПРОДУКТОВ
Соединения данного изобретения могут быть получены приготовлением триарильного промежуточного продукта, Ar1-Het-Ar2, и затем присоединением его к требуемому промежуточному продукту для образования целевого соединения. Большое разнообразие триарильных промежуточных продуктов может быть использовано для получения соединений данного изобретения при условии, что такие триарильные промежуточные продукты содержат подходящую функциональную группу на Ar2, к которой может быть присоединен остаток целевого промежуточного продукта. Подходящие функциональные группы включают оксоалкильную или формильную группу. Данные триарильные промежуточные продукты могут быть получены способами, ранее описанными в химической литературе. Некоторые из данных способов описаны ниже.
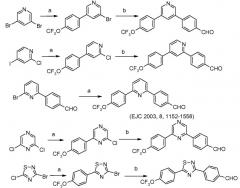
Промежуточные продукты, в которых 'Het' представляет собой дизамещенный пиридин, пиримидин, пиразин или пиридизин, могут быть получены связыванием галоген- или алкилтиозамещенного пиридина, пиримидина или пиразина с арилбороновой кислотой или боратным сложным эфиром, в условиях арилирования Сузуки. См., например, следующее.
Для пиридинов: Couve-Bonnaire et al. Tetrahedron 2003, 59, 2793 и Puglisi et al. Eur. J. Org. Chem. 2003, 1552.
Для пиразинов: Schultheiss and Bosch Heterocycles 2003, 60, 1891.
Для пиримидинов: Qing et al. J. Fluorine Chem. 2003, 120, 21 и Ceide and Montalban Tetrahedron Lett. 2006, 47, 4415.
Для 2,4-диарилпиримидинов: Schomaker and Delia, J. Org. Chem. 2001, 66, 7125.
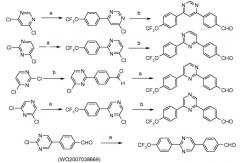
Таким образом, успешные арилирования, катализируемые палладием, с использованием 4-формилфенилбороновой кислоты и 4-трифторметоксифенилбороновой кислоты, могут приводить к фактически конкретным образцам замещения, как показано на схеме ниже:
условия:
а): 4-трифторметоксифенилбороновая кислота, (Ph3P)4Pd;
b): 4-формилфенилбороновая кислота, (Ph3P)4Pd
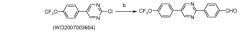
Подобно, диарилпиридины и пиразины и другие дигалогенированные гетероциклические ароматические соединения могут быть получены из дигалогенированных пиридинов и пиразинов и других дигалогенированных гетероциклических ароматическиих соединений при использовании аналогичного протокола:
условия:
а): 4-трифторметоксифенилбороновая кислота, (Ph3P)4Pd;
b): 4-формилфенилбороновая кислота, (Ph3P)4Pd.
Галоген- или алкилтиопиримидиновые и пиридиновые предшественники являются коммерчески доступными или могут быть синтезированы способами, описанными в литературе (Rorig and Wagner U.S. Patent 3149109, 1964; Kreutzberger and Tesch Arzneim.-Forsch. 1978, 28, 235).
Промежуточные соединения, в которых 'Het' представляет собой 1,3-дизамещенный 1,2,4-триазол, могут быть получены по одной из следующих схем.
Путь А: 1,3-Диарил-1,2,4-триазолы были получены из соответствующих-NH 3-арил-1,2,4-триазолов по опубликованному способу для N-арилирования имидазолов (Lin et al. J. Org. Chem. 1979, 44, 4160). Связывание 1,2,4-триазолов с арилгалогенидами было проведено при термальных условиях или, предпочтительно, в условиях микроволнового облучения (Antilla et al. J. Org. Chem. 2004, 69, 5578), (DIBAL представляет собой гидрид диизобутилалюминия).
Путь В: Бромирование гидразонов с последующей обработкой бромгидразона тетразолом приводит к образованию 1,3-диарил-1,2,4-триазола (Butler and Fitzgerald J. Chem. Soc., Perkin Trans. 1 1988, 1587).
Соединения, где 'Het' представляет собой имидазол, могут быть получены по одной из следующих схем:
Путь А (Стадия 1: Lynch et al. J. Am. Chem. Soc. 1994, 116, 11030. Стадия 2: Liu et al. J. Chem. Soc. 2005, 70, 10135):
Путь В. Для галогенарильных групп, которые также содержат активирующую группу, такую как нитро или циано, замещение арилгалогенида имидазолом при использовании основания, такого как карбонат калия, в полярном апротонном растворителе, таком как N,N-диметилформамид (ДМФА) или диметилсульфоксид (ДМСО/DMSO), может быть выполнено следующим способом (Bouchet et al. Tetrahedron 1979, 35, 1331):
Путь С: По процедуре, впервые описанной Porretta et al. (Farmaco, Edizione Scientifica 1985, 40, 404), N-фенациланилин обработан тиоцианатом калия в кислой среде (HСl), и образовавшийся 2-меркаптоимидазол затем превращен в десульфурированный диарилимидазол обработкой азотной кислотой в уксусной кислоте.
Путь D. N-Арилирование 4-бромимидазола в условиях микроволнового облучения (путь А, стадия 2) приводило к промежуточному продукту, 1-арил-4-бромимидазолу, который был превращен в триарильные промежуточные продукты обработкой арилбороновыми кислотами в условиях, катализируемых палладием.
Соединения, где 'Het' представляет собой 1,4-дизамещенный 1,2,3-триазол, могут быть получены по следующей схеме (Feldman et al. Org. Lett. 2004, 6, 3897):
Соединения, где 'Het' представляет собой 3,5-дизамещенный 1,2,4-триазол, могут быть получены по следующей схеме (Yeung et al. Tetrahedron Lett. 2005, 46, 3429).
Соединения, где 'Het' представляет собой 1,3-дизамещенный 1,2,4-триазолин-5-он, могут быть получены по следующей схеме (Pirrung and Tepper J. Org. Chem. 1995, 60, 2461 и Lyga Synth. Commun. 1986, 16, 163). (DPPA представляет собой дифенилфосфорилазид):
Соединения, где 'Het' представляет собой 1,3-диарилпиразолин, могут быть получены по следующей схеме. Моногидразон терефтальальдегида обрабатывают N-хлорсукцинимидом (NCS) в изопропиловом спирте (изо-PrOH) и образовавшийся хлоргидразоновый промежуточный продукт обрабатывают непосредственно основанием и замещенным олефином для образования пиразолина:
Соединения, где 'Het' представляет собой 3,5-дизамещенный изоксазол, могут быть получены по следующей схеме:
Соединения, где 'Het' представляет собой 1,3-дизамещенный пиразол, могут быть получены по следующей схеме. Связывание пиразола с галогенированной ароматикой выполняли при использовании условий микроволнового облучения, описанных Liu et al., путь А, вышеприведенная стадия 2. (DMA представляет собой диметилацеталь).
Соединения, где 'Het' представляет собой 1,4-дизамещенный пиразол, могут быть получены по следующей схеме. 4-Вромпиразол сначала связывают с иодфенильным аналогом и образовавшийся 1-арил-4-бромпиразол затем связывают с фенилбороновой кислотой при использовании условий, описанных ранее для арилирования имидазолов.
Соединения, где 'Het' представляет собой 2,4-дизамещенный тиазол, получены конденсацией тиоамида с α-галогенацетофеноном в протонном растворителе, таком как этанол (например, Potts and Marshall J. Org. Chem. 1976, 41, 129).
Соединения, где 'Het' представляет собой 2,4-дизамещенный оксазолин, получены, исходя из α-бромацетофенона по следующей схеме (Periasamy et al. Synthesis 2003, 1965 и Liu et al. J. Am. Chem. Soc. 2007, 129, 5834).
Соединения, где 'Het' представляет собой 2,5-дизамещенный оксазолин, получены по следующей схеме (Favretto et al. Tetrahedron Lett. 2002, 43, 2581 и Liu et al. J. Am. Chem. Soc. 2007, 129, 5834):
Соединения, где 'Het' представляет собой 3,5-дизамещенный 1,2,4-триазин, получены по следующей схеме (Reid et al. Bioorg. Med. Chem. Lett. 2008, 18, 2455 и Saraswathi and Srinivasan Tetrahedron Lett. 1971, 2315):
ПОЛУЧЕНИЕ ГИДРАЗОНОВЫХ ПРОИЗВОДНЫХ
Гидразовые производные могут быть получены из соответствующих арилальдегидов или кетонов одним из трех способов: (А) взаимодействием с гидразином с последующим взаимодействием с арилизотиоцианатом в тетрагидрофуране (ТГФ/THF) при температурах от 0 до 100°С; (В) взаимодействием с метиловым эфиром гидразиндитиокарбоновой кислоты с последующим взаимодействием с амином в полярном апротонном растворителе, таком как ДМФА, при температурах от 25 до 150°С; или (С) взаимодействием с алкил или арилсемикарбазидом или тиосемикарбазидом, который является коммерчески доступным или может быть получен специалистом в данной области, в полярном протонном растворителе, таком как этиловый спирт (EtOH), при температуре от 0 до 100°С.
ПРИМЕРЫ
Примеры даются для целей иллюстрации и не должны рассматриваться как ограничение данного изобретения, описанного в настоящем документе, только до вариантов осуществления, раскрытых в данных примерах.
Исходные продукты, реагенты и растворители, которые были получены от коммерческих источников, использовали без дополнительной очистки. Безводные растворители были приобретены в виде Sure/Seal™ от Aldrich и были использованы как общепринято. Температуры плавления были получены на капиллярном приборе Thomas Hoover для определения температуры плавления или в автоматизированной системе для определения температуры плавления OptiMelt Automated Melting Point System от Sanford Research Systems и не откорректированы.
Пример 1: Получение 4-[1-(4-трифторметоксифенил)-1Н-пиррол-3-ил]-бензальдегида
Стадия 1. 1-(4-Трифторметоксифенил)-1Н-пиррол. Данное соединение получали по Colotta et al. J. Am. Med. Chem. 2006, 49, 6015. Раствор 4-трифторметоксифениламина (500 миллиграммов (мг), 2,82 миллимолей (ммоль), 1,00 эквивалент (экв.)) и 2,5-диэтокситетрагидрофурана (452 мг, 2,82 ммоль, 1,00 экв.) в ледяной уксусной кислоте (20 миллилитров (мл)) нагревали при 90°С в течение 1 часа (ч) перед сушкой на силикагеле. Остаток затем суспендировали в гексане при кипячении с обратным холодильником, отфильтровывали и концентрировали досуха c получением целевого промежуточного продукта (519 мг, 81%).
Стадия 2. 3-Бром-1-(4-трифторметоксифенил)-1Н-пиррол. Соединение получали по Bray et al. J. Org. Chem. 1990, 55, 6317. К раствору 1-(4-трифторметоксифенил)-1Н-пиррола (519 мг, 2,29 ммоль, 1,00 экв.) в ТГФ (250 мл) при -78°С добавляли 0,05 М раствор N-бромсукцинимида (NBS; 408 мг, 2,29 ммоль, 1,00 экв.) в ТГФ в течение 45 минут (мин). Сосуд медленно нагревали до комнатной температуры перед концентрированием для получения сырого бромпиррола, который, как показано с помощью ГХ-МС, состоит из 55% целевого промежуточного продукта. Продукт использовали на последующей стадии без дополнительной очистки.
Стадия 3. 4-[1-(4-Трифторметоксифенил)-1Н-пиррол-3-ил]-бензальдегид. Суспензию сырого 3-бром-1-(4-трифторметоксифенил)-1Н-пиррола (356 мг, 1,26 ммоль, 1,00 экв.), 4-формилфенилбороновой кислоты (283 мг, 1,89 ммоль, 1,50 экв.), дихлорида бис(трифенилфосфин)палладия(II) (27 мг, 0,04 ммоль, 0,03 экв.), 2 М Na2CO3 (водн.) (1,26 мл, 2,52 ммоль, 2,0 экв.) и 1,4-диоксана (5 мл) нагревали при 150°С в реакционном сосуде с микроволновым облучением в течение 45 мин. Охлажденный раствор затем разбавляли с помощью EtOAc (20 мл), фильтровали через целит®, концентрировали досуха и очищали хроматографией (2:2:1, гексан:EtOAc:ацетон) с получением целевого промежуточного продукта (79 мг, 21%).
Пример 2: Получение 4-[1-(4-трифторметоксифенил)-4,5-дигидро-1Н-пиразол-3-ил]-бензальдегида
Стадия 1. 1-(4-Трифторметоксифенил)-пиразолидин-3-он: Данное соединение получали по Rees and Tsoi Chem. Commun. 2000, 415. Суспензию гидрохлорида (4-трифторметоксифенил)гидразина (300 мг, 1,32 ммоль, 1,00 экв.), 3-хлорпропионилхлорида (167 мг, 1,32 ммоль, 1,00 экв.) и PS-DIEA (1,30 грамм (г), 5,28 ммоль, 4,00 экв.) в ТГФ (20 мл) перемешивали при температуре окружающей среды в течение 12 ч. Раствор затем фильтровали, концентрировали досуха и очищали хроматографией (2:2:1, гексан:EtOAc:ацетон) с получением целевого промежуточного продукта (120 мг, 37%).
Стадия 2. 3-Хлор-1-(4-трифторметоксифенил)-4,5-дигидро-1Н-пиразол: Общую процедуру использовали по Wang et al. Tetrahedron Lett. 2005, 46, 2631. К раствору 1-(4-трифторметоксифенил)пиразолидин-3-она (120 мг, 0,49 ммоль, 1,00 экв.) в толуоле (20 мл) медленно добавляли фосфорилхлорид (22,5 мг, 1,47 ммоль, 3,00 экв.). Смесь затем нагревали при 80°С в течение 1 ч перед охлаждением до комнатной температуры и гашением с помощью Н2О (10 мл). Содержимое сосуда затем перемешивали в атмосфере азота (N2) в течение 8 ч перед тем, как продукт экстрагировали в EtOAc (200 мл), сушили (MgSO4) и концентрировали при пониженном давлении. ГХ-МС давала 88% образование целевого промежуточного продукта, который использовали в последующих реакциях без дополнительной очистки.
Стадия 3. 4-[1-(4-Трифторметоксифенил)-4,5-дигидро-1Н-пиразол-3-ил]-бензальдегид: Суспензию 3-хлор-1-(4-трифторметоксифенил)-4,5-дигидро-1Н-пиразола (114 мг, 0,43 ммоль, 1,00 экв.), 4-формилфенилбороновой кислоты (97 мг, 0,65 ммоль, 1,50 экв.), дихлорида бис(трифенилфосфин)палладия(II) (10 мг, 0,01 ммоль, 0,03 экв.), 2 М Na2CO3 (водн.) (0,43 мл, 0,86 ммоль, 2,0 экв.) и 1,4-диоксана (5 мл) нагревали при 150°С в реакционном сосуде с микроволновым облучением в течение 45 мин. Охлажденный раствор затем разбавляли с помощью EtOAc (20 мл), фильтровали через целит®, концентрировали досуха и очищали хроматографией (2:2:1, гексан:EtOAc:ацетон) с получением целевого промежуточного продукта (50 мг, 0,15 ммоль, 31%).
Пример 3: Получение 4-[1-(4-трифторметоксифенил)-1Н-пиразол-4-ил]-бензальдегида
Стадия 1. 4-Бром-1-(4-трифторметоксифенил)-1Н-пиразол. 4-Бромпиразол (1,5 г, 10 ммоль) и 4-иодтрифторметоксибензол (3,0 г, 10,3 ммоль) перемешивали в ДМФА (8 мл) и обрабатывали фосфатом калия (6,3 г, 30 ммоль) и CuI (0,5 г, 2,6 ммоль). Раствор перемешивали и нагревали до 130°С в течение 30 мин, затем его охлаждали при температуре окружающей среды и выливали в 1 н. NH4OH (50 мл). Твердый осадок выделяли фильтрованием, перерастворяли в простом эфире, фильтровали и концентрировали до желтовато-коричневого твердого вещества. Перекристаллизация из EtOH давала не совсем белое твердое вещество (2,1 г): т.пл. 63-65°С; ЖХМС 308,6 (М+1).
Стадия 2. 4-[1-(4-Трифторметоксифенил)-1Н-пиразол-4-ил]-бензальдегид. Суспензию бромпиразола (0,31 г, 1 ммоль) и 4-формилбороновой кислоты (0,15 г, 1 ммоль), 2 М водного раствора карбоната калия (1 мл) и тетракис(трифенилфосфин)палладия(0) (35 мг, каталитический) в диоксане (6 мл) нагревали до 150°С в реакторе с микроволновым облучением. Остаток затем концентрировали в вакууме и очищали хроматографией (0-100% EtOAc-гексаны) с получением указанного в заголовке соединения (175 мг) в виде желтовато-коричневого твердого вещества: т.пл. 107-109°С; ЖХМС 332,8 (М+1).
Пример 4: Получение 4-[5-(4-пропилфенил)изоксазол-3-ил]-бензальдегида
Стадия 1. 4-(Гидроксииминометил)бензонитрил. Данное соединение получали по Biasotti et al. Bioorg. Med. Chem. 2003, 11, 2247. Суспензию 4-формилбензонитрила (500 мг, 3,81 ммоль, 1,00 экв.), гидрохлорида гидроксиламина (290 мг, 4,19 ммоль, 1,10 экв.) и ацетата натрия (1,56 г, 19,05 ммоль, 5,00 экв.) в МеОН (50 мл) нагревали при 70°С в течение 4 ч перед концентрированием досуха. Остаток затем суспендировали в Et2O, фильтровали и концентрировали с получением целевого промежуточного продукта (496 мг, 3,39 ммоль, 89%).
Стадия 2. 4-(Гидроксииминобромметил)бензонитрил. Данное соединение получали по Tanaka et al. Bull. Chem. Soc. Jpn. 1984, 57, 2184. 0,05 М раствор N-бромсукцинимида (724 мг, 4,07 ммоль, 1,20 экв.) в СН2Сl2 добавляли по каплям при 0°С к раствору 4-(гидроксииминометил)бензонитрила (496 мг, 3,39 ммоль, 1,00 экв.) в СН2Сl2 (50 мл). Раствор нагревали до комнатной температуры перед распределением по объему между двумя различными реакционными сосудами. Содержимое каждого сосуда затем концентрировали и сырые остат