Диагностическая композиция, содержащая катионы плазмы крови, обладающая превосходным профилем безопасности
Иллюстрации
Показать всеИзобретение относится к медицине и описывает рентгеновскую диагностическую композицию, которая демонстрирует превосходный профиль кардиологической безопасности. Композиция содержит Соединение I, фармацевтически приемлемый носитель и растворенные в нем натриевое соединение и кальциевое соединение, обеспечивающие концентрацию ионов натрия 40-50 мМ и концентрацию ионов кальция 0,1-0,7 мМ. Настоящее изобретение также относится к способам визуализации с использованием такой диагностической композиции. 4 н. и 12 з.п. ф-лы, 6 ил., 3 пр., 5 табл.
Реферат
Настоящее изобретение относится к новой рентгеновской диагностической композиции, которая демонстрирует превосходный профиль кардиологической безопасности. Композиция содержит неионный йодированный димер в фармацевтически приемлемом носителе. Изобретение также относится к способам визуализации с использованием такой диагностической композиции.
Вся диагностическая визуализация основана на получении различных уровней сигнала от различных структур в организме. Таким образом, например, в рентгеновской визуализации для заданной структуры организма, визуализируемой на изображении, ослабление рентгеновских лучей этой структурой должно отличаться от ослабления окружающими тканями. Различие в сигнале между структурами организма и окружающими их тканями часто называют контрастом, и значительные усилия посвящены средствам усиления контраста в диагностической визуализации, поскольку чем больше контраст между структурами организма и окружающими тканями, тем выше качество изображений и тем больше их ценность для лечащего врача, осуществляющего диагностику. Кроме того, чем больше контраст, тем более мелкие структуры организма могут быть визуализированы в способах визуализации, т.е. увеличенный контраст может привести к увеличенному пространственному разрешению. Диагностическое качество изображений сильно зависит от внутреннего уровня шума в процедуре визуализации, и, таким образом, отношение уровня контраста к уровню шума может представлять собой эффективный фактор диагностического качества для диагностических изображений. Достижение улучшения такого фактора диагностического качества в течение длительного времени до сих пор остается важной целью. В способах, таких как рентгенологические исследования, один из подходов для улучшения фактора диагностического качества заключается во введении материалов, усиливающих контраст, приготовленных как контрастные среды, в область организма, подвергаемую визуализации. Таким образом, для рентгенологического исследования первые примеры контрастных агентов представляли собой нерастворимые неорганические соли бария, которые усиливали ослабление рентгеновских лучей в зонах организма, в которых они распределены. В течение последних 50 лет в области рентгеновских контрастных агентов доминировали растворимые йодсодержащие соединения. Имеющиеся в продаже контрастные среды (СМ), содержащие йодированные контрастные агенты, обычно классифицируют как ионные мономеры, такие как диатризоат (представленный в продаже, например, под товарным знаком Gastrografen™), ионные димеры, такие как йоксаглат (представленный в продаже, например под товарным знаком Hexabrix™), неионные мономеры, такие как йогексол (представленный в продаже, например, под товарным знаком Omnipaque™), лопамидол (представленный в продаже, например, под товарным знаком Isovue™), йомепрол (представленный в продаже, например, под товарным знаком Iomeron™) и неионный димер йодиксанол (представленный в продаже под товарным знаком Visipaque™). Клиническая безопасность йодированных рентгеновских контрастных сред непрерывно улучшается в течение последних десятилетий путем разработки новых агентов; от ионных мономеров (Isopaque™) к неионным мономерам (например, Omnipaque™) и неионным димерам (например, Visipaque™). Тем не менее, даже высокоочищенные рентгеновские контрастные среды, имеющиеся в настоящее время в продаже, демонстрируют низкую степень нежелательных клинических побочных действий, таких как вызванная контрастным агентом нефропатия (CIN), неблагоприятные кардиологические события и замедленные неблагоприятные реакции (DAR). Следовательно, существует клиническая потребность в новой и безопасной рентгеновской контрастной среде, особенно в отношении диагностических исследований, охватывающих пациентов, у которых имеется высокий риск этих побочных действий.
Применимость контрастных сред в основном зависит от их токсичности, их диагностической эффективности, неблагоприятных действий, которые они могут оказывать на субъекта, которому вводят контрастную среду, и легкости получения, хранения и введения. В токсичность и неблагоприятные биологические действия контрастной среды вносят вклад компоненты среды композиции, т.е. диагностической композиции, например растворитель или носитель, а также сам контрастный агент и его компоненты, такие как ионы для ионных контрастных агентов, и также их метаболиты.
Количество процедур коронарной артериографии продолжает увеличиваться в соответствии с растущими возможностями коронарных процедур, включая перкутанную чреспросветную коронарную ангиопластику, имплантацию зондов и внутрисердечное введение терапевтических агентов. По всему миру ежегодно осуществляют свыше 70 миллионов процедур, основная часть из которых связана с сердцем. Тяжелые побочные действия, вызванные йодированными радиографическими контрастными средами, являются редкими, но могут возникать у пациентов, имеющих высокий риск, а также во время перкутанной коронарной ангиопластики.
При коронарной артериографии кровь в коронарных артериях идеально должна быть полностью заменена болюсом йодированных радиографических контрастных сред для максимизации ослабления рентгенограмм и, таким образом, оптимизации диагностической визуализации. Когда контрастные среды заменяют кровь, молекулы контрастных сред приводят к хемотоксическим и осмотическим эффектам в коронарных сосудах, а также изменениям концентрации электролита, вязкости и давления кислорода. Эти изменения могут влиять на сократительную способность и сердечный ритм и вызвать мерцание желудочков (VF). Избирательная инъекция контрастных сред в коронарные артерии вызывает местные электрофизиологические и гемодинамические эффекты. Серьезные желудочковые аритмии, а также кардиодепрессия, представляют собой известные осложнения коронарной артериографии, которые могут быть связаны с контрастными средами.
WO 91/13636 и WO 90/11094, оба от Nycomed AS (в настоящее время GE Healthcare AS), относятся к рентгеновским контрастным средам и к их композициям, включающим различные соли. В литературе также приведены многочисленные исследования преимуществ композиций рентгеновских контрастных агентов, включающих соли, в основном NaCl. Исследования осуществляли на изолированных сердцах крыс (Jynge et al., Investigative Radiology 1993, 28, 20-25) и кроликов (Baath et al, Investigative Radiology 1993, 28, 223-227), собак (Pedersen et al., Acad. Radio!. 1994, 1, 136-144) и свиней. Особенное значение имеет исследование Chai et al. (Acad. Radiol. 2004, 11, 583-593), в котором показано, что композиция йодиксанола, содержащая 19 мМ NaCl и 0,3 мМ CaCl2, демонстрирует меньшую частоту мерцания желудочков по сравнению только с йодиксанолом.
Jacobsen et al. Investigative Radiology 1993; 28, 917-924 продемонстрировал, что быстро повторяющиеся инъекции контрастных сред собакам приводили в результате к аддитивным действиям на инотропию и монофазный потенциал действия, тогда как раствор Рингера не оказывал действия. Это исследование провели для того, чтобы понять, каким образом ангиография в клинической практике, где повторяющиеся инъекции являются обычными для заполнения всего коронарного дерева, может вызывать изменения в сердечных параметрах и привести к осложнениям.
Имеющаяся в настоящее время в продаже композиция йодиксанола, 320 мг I/мл, содержит 19 мМ ионов натрия и 0,3 мМ ионов кальция (Visipaque™). Экспериментально показано, что эта композиция демонстрирует превосходный профиль кардиологической безопасности по сравнению с йодиксанолом без добавления солей, в основном в исследованиях in vivo в модели сердца свиньи, но также в исследованиях на изолированных сердцах животных. В похожих исследованиях показано, что йогексол также демонстрирует увеличенную сердечную устойчивость при приготовлении с добавлением солей, в основном NaCl.
В WO 2009/008734 от GE Healthcare AS раскрыт новый класс соединений и их применение в качестве рентгеновских контрастных агентов. Эти соединения представляют собой димеры, содержащие две связанные йодированные фенильные группы. Мостиковая связь между двумя йодированными фенильными группами представляет собой прямоцепочечную C3-C8алкиленовую цепь, возможно замещенную группами -ОН или OCH3 в количестве от одной до шести. Объем соединений описан общей формулой (I) заявки на изобретение, и предложено множество конкретных соединений.
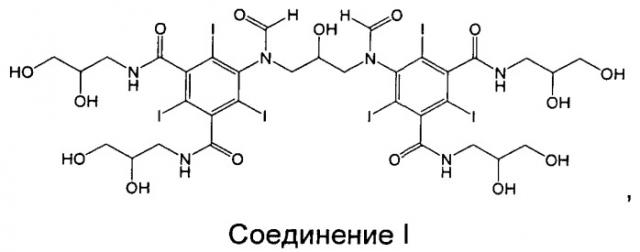
Соединение I, представляющее собой один из специфических димерных рентгеновских контрастных агентов, описываемых формулой I в WO 2009/008734, как обнаружено авторами изобретения, обладает благоприятными свойствами:
Соединение I: 5-[формил-[3-[формил-[3,5-бис(2,3-дигидроксипропилкарбамоил)-2,4,6-трийодфенил]амино]-2-гидроксипропил]амино]-N,N'-бис(2,3-дигидроксипропил)-2,4,6-трийодбензол-1,3-дикарбоксамид.
Авторы изобретения неожиданно обнаружили новую диагностическую рентгеновскую композицию, которая демонстрирует превосходный профиль кардиологической безопасности по сравнению с Visipaque™, как показано в похожих исследованиях in vivo, как указано выше.
Таким образом, в первом аспекте в изобретении предложена диагностическая композиция, содержащая Соединение I
фармацевтически приемлемый носитель
и растворенные в нем натриевое соединение и кальциевое соединение, обеспечивающее концентрацию ионов натрия 40-50 мМ и концентрацию ионов кальция 0,1-0,7 мМ.
Физико-химические свойства Соединения I представлены ниже. Кроме того, информация об используемых способах, дополнительно к информации о биораспределении и острой токсичности, приведена в примере 1.
Связывание белка: связывание Соединения I с человеческим сывороточным альбумином (HSA) определяли с использованием способа равновесного диализа. Связывание соединения I с человеческим сывороточным альбумином определяли как очень низкое, 3,1±1,3%, что подтверждает незначительное взаимодействие вещества с эндогенными белками.
Коэффициент распределения: гидрофильность Соединения I, как определено по распределению между октанолом и водой, демонстрирует, что Соединение I является очень гидрофильным с logP -4,28.
Вязкость: вязкость Соединения I определяли при 20°С и 37°С при трех различных концентрациях. Результаты представлены на Фиг.4. Вязкость при 320 мг I/мл и 20°С составляет приблизительно 24 мПа·с.
Осмоляльность: осмоляльность Соединения I определяли при четырех различных концентрациях 204, 254, 310 и 324 мг I/мл. Осмоляльность Соединения I при 320 мг I/мл составляет 136 мОсм/кг.
Идентифицирована новая диагностическая рентгеновская композиция, которая демонстрирует превосходный профиль кардиологической безопасности по сравнению с Visipaque™. Дополнительно к безопасности самого соединения, т.е. соединения, обеспечивающего контраст, ключевыми являются дополнительные компоненты диагностической композиции.
В исследовании Chai et al. показано, что композиция йодиксанола, содержащая 19 мМ NaCl и 0,3 мМ CaCl2, демонстрирует меньшую частоту мерцания желудочков (VF) по сравнению только с йодиксанолом. Это исследование осуществляли на свиньях, которым среду инъецировали непосредственно в левую коронарную артерию (LCA), предварительно подвергнутую окклюзии. Никакого мерцания желудочков не обнаружено при инъекции Visipaque™. Как часть тестирования безопасности Соединения I и идентификации композиции для этого, композиции Соединения I тестировали и сравнивали с Visipaque™. Поскольку в ранее опубликованном исследовании (выше) внутрикоронарную инъекцию 20 мл йодиксанола осуществляли в течение 40 с, и не возникали VF, объем инъекции увеличивали до 25 мл в течение периода 62,5 с для увеличения частоты случаев VF для задач сравнения. Дополнительно, тестируемый и референсный растворы избирательно инъецировали в левую переднюю межжелудочковую ветвь коронарной артерии (LAD) для дополнительного увеличения чувствительности модели. В этом большом объеме даже Визипак демонстрировал значительную частоту мерцания желудочков, 100%. (Фиг.3). Эксперименты изложены в примере 2.
Неожиданно для авторов изобретения, новый рентгеновский контрастный агент Соединение I, будучи приготовленным в диагностической композиции с 40-50 мМ NaCl и 0,1-0,7 мМ CaCl2, не демонстрировал случаи мерцания желудочков (подробную информацию смотри на Фиг.3 и в таблице 3).
При сравнении результатов двух отличающихся исследований увеличение частоты мерцания желудочков от 0% до 100% обнаружено для Визипак. Тем не менее, даже при высокой дозе димерный рентгеновский контрастный агент Соединение I не демонстрировал мерцания желудочков. Основное различие заключается в том, что Соединение I приготовлено с 45 мМ NaCl в этом исследовании, что значительно выше, чем в случае Визипак (19 мМ). Хотя никакого значительного действия не обнаружено в отношении мерцания желудочков (VF) при концентрации ионов кальция от 0,1 до 0,7 мМ, происходило значительное уменьшение систолического артериального давления (SAP) и систолического давления в левом желудочке (LVP) при уменьшении кальция (таблица 2). Эти данные указывают на то, что основной фактор, влияющий на частоту мерцания желудочков, представляет собой концентрацию хлорида натрия, тогда как кальций оказывал значительное действие на систолическое артериальное давление и систолическое давление в левом желудочке (LVSP). Действительно, исследование на нормальных свиньях продемонстрировало, что тогда как LAD инъекция композиции Соединения I, содержащей 45 мМ NaCl без добавления CaCl2, приводила в результате к уменьшению LVSP от 45 до 70 секунд после инъекции (среднее -5,7 мм рт.ст. (-759,94 Па), нормализованного к Рингер-лактату), инъекция композиции Соединения I, содержащей 45 мМ NaCl и 0,5 мМ CaCl2, поддерживала LVSP подобно Визипак (-0,3 и +0,1 мм рт.ст. (-40 и 13,33 Па), нормализованного к Рингер-лактату, соответственно) (пример 26). Дополнительно, инъекция Лопамидола с той же скоростью и объемом вызывала в каждом случае появление VF (в общем 9 инъекций 3 свиньям) между приблизительно 27-50 секундами после начала инъекции (последнее ограничивало какой-либо анализ LVSP ответа). Эти результаты также указывают на то, что присутствие 0,5 мМ CaCl2 в композиции Соединения I является благоприятным и ограничивает какие-либо отрицательные действия на LVSP, подобно Визипак. Кроме того, добавленные электролиты, присутствующие в диагностической композиции Соединения I и Визипак, могут уменьшать способность вызывать VF по сравнению с Лопамидолом, который не имеет добавленных электролитов. Количества и отношения исследуемых электролитов приведены в таблице 4 примера 26.
В исследовании более быстрых инъекций (40 мл, при 5 мл/с) систолическое давление в левом желудочке поддерживалось и было близким к обнаруженному после введения Рингер-лактата и Визипак, когда Соединение I в композиции с 45 мМ NaCl и 0,5 мМ CaCl2 инъецировали избирательно в LAD нормальной свиньи. Наоборот, инъекции Лопамидола, который не содержит добавленных электролитов, вызывали значительное уменьшение в LVSP (пример 2с). Кроме того, Лопамидол вызывал значительное увеличение в dP/dt (69%), тогда как Соединение I оказывало подобный эффект, что и Рингер-лактат и Визипак в этом отношении (умеренное увеличение до 30%). Полагают, что присутствие и соотношение электролитов натрия (Na) и кальция (Ca) в исследованных композициях Соединения I и Визипак, которые ближе к Na/Ca сбалансированным композициям Рингер-лактата и интерстициальной жидкости, вносит вклад в превосходное поддержание сердечной функции по сравнению с инъекцией Лопамидола, который не содержит добавленных электролитов. Количества и соотношения электролитов приведены в таблице 5 примера 26.
В еще одном воплощении изобретения композиция по изобретению содержит натриевое соединение, обеспечивающее концентрацию ионов натрия 42-47 мМ, и еще более предпочтительно концентрацию ионов натрия 44-46 мМ и наиболее предпочтительно концентрацию ионов натрия 45 мМ.
В еще одном воплощении изобретения композиция по изобретению содержит кальциевое соединение, обеспечивающее концентрацию ионов кальция 0,3-0,6 мМ, и еще более предпочтительно концентрацию кальция 0,4-0,5 мМ и наиболее предпочтительно концентрацию ионов кальция 0,5 мМ.
В этом аспекте соотношение между концентрацией ионов натрия и концентрацией ионов кальция должно быть от 57 до 500, такое как от 63 до 117, более предпочтительно от 70 до 156, более предпочтительно от 85 до 115 и наиболее предпочтительно от 88 до 95.
Во втором аспекте в изобретении предложена диагностическая композиция, содержащая Соединение I
фармацевтически приемлемый носитель
и растворенные в нем натриевое соединение и кальциевое соединение, где отношение между концентрацией ионов натрия и концентрацией ионов кальция составляет от 40 до 45, и предпочтительно составляет 43. Это отражает концентрации электролитов в композиции Рингер-лактат.
Натриевое соединение и кальциевое соединение в композиции могут быть представлены в форме соли, т.е. соединения включают физиологически приемлемые противоионы, например, выбранные из группы хлорида, сульфата, фосфата и гидрокарбоната. Предпочтительно, натриевое соединение представляет собой хлорид натрия, а кальциевое соединение представляет собой хлорид кальция.
Фармацевтически приемлемый носитель представляет собой водный раствор, предпочтительно чистую воду.
Натрий является важным для деполяризации в миокарде, которая зависит от потока Na+ внутрь. Авторы изобретения полагают, что добавление 40-50 мМ натрий-ионов и предпочтительно 45 мМ NaCl, к Соединению I делает его ближе к нормальным интерстициальным концентрациям Na+ по сравнению с йодиксанолом +19 мМ Na+/л. Таким образом, Соединение I может быть более физиологичным и обладает большей способностью поддерживать потенциал действия быстрых натриевых каналов, таким образом, в противоположность потенциалу действия "медленного ответа", вызванного очень низким уровнем натрия или отсутствием натрия.
Предшествующие исследования продемонстрировали, что добавление небольших количеств натрия (10-30 ммоль/л) в неионные контрастные среды может уменьшить риск мерцания желудочков (VF) вследствие этих контрастных сред. Тем не менее, исследования также продемонстрировали, что добавление большего количества натрия в контрастные среды может также увеличить отрицательную инотропию, о чем судят по уменьшенному систолическому артериальному давлению/систолическому давлению в левом желудочке (SAP/LVP). Для поддержания нормальных внеклеточных и внутриклеточных натрий-кальциевых (Na-Ca) отношений, добавление кальция к неионным контрастным средам уменьшает отрицательные инотропные действия. Ключевой вопрос заключается в том, какое количество кальция должно быть добавлено для предотвращения увеличения отрицательной инотропии. Добавление 19 мМ NaCl и 0,3 мМ CaClz к йодиксанолу 320 мг I/мл в композиции Визипак рассматривается как оптимальное для минимизации физиологических расстройств, таких как VF и увеличенная отрицательная инотропия во время коронарной ангиографии.
В исследованиях авторы изобретения подтвердили пользу добавления CaCl2 в Соединение I, содержащее 45 мМ NaCl (таблица 3). Композиция (F1) с 0,1 мМ CaCl2 вызывала значительно меньшие SAP и LVP по сравнению с композицией с 0,3 мМ CaCl2 (F3) или 0,7 мМ CaCl2 (F5), соответственно. Композиция Соединения I с 0,3 мМ CaCl2 вызывала меньшие SAP по сравнению с композицией с 0,7 мМ CaCl2. Из этого следует, что добавление кальций-ионов к контрастным средам может уравновешивать отрицательную инотропию, вызванную добавлением натрия.
Тем не менее, существует критический баланс между ионами натрия и кальция. Добавление правильных концентраций натрия и кальция в неионные контрастные среды уменьшает риск VF и уменьшает неблагоприятные действия в отношении сократительной способности. Добавление слишком большого количества натрия уменьшает сократительную способность миокарда. Это последнее действие уравновешивается путем добавления Ca-ионов. Композиция соединения I, содержащая 45 мМ NaCl и 0,7 мМ CaCl2 (F7), по-видимому, представляет собой самую хорошую композицию, поскольку не взывает каких-либо VF и поддерживает более хорошую инотропию по сравнению с композициями F1 и F3. Тем не менее, гемодинамические действия F5 композиции Соединения I, тем не менее, равны действиям Визипак, поэтому предпочтительной является концентрация кальция между F3 и F5. Таким образом, в особенно предпочтительном воплощении композиция по изобретению содержит 45 мМ NaCl и 0,5 мМ CaCl2.
Внутривенная и внутриартериальная безопасность этих композиций Соединения I показана в отдельном исследовании. В этом исследовании кардиоваскулярные действия Соединения I в композиции 45 мМ NaCl и 0,5 мМ CaCl2 оценивали для трех уровней дозы in vivo в острой модели у свиньи. В общем, отсутствует общее изменение функционирования миокарда при введении композиции внутривенным и внутриартериальным путем. Исследование также описано в примере 3.
В общем, йодированные контрастные среды могут вызывать реакции гиперчувствительности у склонных к этому пациентов в течение от 1 часа до нескольких суток после воздействия. Эти реакции в основном представляют собой нетяжелые кожные высыпания, такие как макулярные, макулопапулезные высыпания и высыпания по типу крапивницы. Индуцированные контрастными средами неблагоприятные реакции замедленного типа (DAR), такие как кожные сыпи, по-видимому, вызваны реактивными в отношении контрастных сред Т-клетками, которые при распознавании контрастных сред пролиферируют и затем контролируют воспалительную реакцию в коже. Авторы изобретения оценили модель T-клеточной пролиферации in vitro, разработанную для предсказания относительной частоты, с которой контрастные среды, такие как Соединение I, вызывают аллергические реакции замедленного типа у пациентов после интраваскулярного введения. Две контрастные среды, йодиксанол и йогексол, обладающие известными уровнями кожных реакций замедленного типа, и новую контрастную среду, Соединение I, оценивали (2 и 5 мг I/мл) в отношении T-клеточной пролиферации in vitro в мононуклеарных клетках периферической крови, истощенных по CD25+, от 100 доноров, представляющих частоты HLA-DR мировой популяции. Положительные T-клеточные ответы оценивали в соответствии с опубликованными протоколами, и значения индекса стимуляции (положительный ответ больше или равен 1,9). Токсичность in vitro тестировали путем измерения клеточной жизнеспособности образцов первых 10 доноров, инкубированных с тестируемыми контрастными средами (5 мг I/мл). Результаты были такие, что представляли все основные аллотипы HLA-DR с частотой, эквивалентной мировой популяции. Никакие из протестированных контрастных сред, по-видимому, не оказывали значительного действия на клеточную жизнеспособность. Соединение I приводило к появлению меньшего числа донорных образцов с положительной T-клеточной пролиферацией по сравнению с йодиксанолом и йогексолом в обеих концентрациях. Для йодиксанола и йогексола ответы в виде T-клеточной пролиферации для большинства доноров возникали на 7 и 8 сутки; статистическая значимость способствовала уменьшенному пролиферативному ответу на Соединение I на 8 сутки. В заключение модель успешно оценивала относительную частоту, с которой контрастные среды вызывали T-клеточную активацию in vitro. Результаты коррелировали с сообщаемой частотой аллергических кожных реакций замедленного типа с двумя представленными в продаже контрастными средами и идентифицировали меньшую частоту для Соединения I.
Таким образом, результаты указывают на то, что Соединение I обладает наименьшей способностью стимулировать T-клеточную пролиферацию in vitro по сравнению с йодиксанолом и йогексолом. Принимая во внимание более частую ассоциацию DAR с димерными контрастными средами, открытие авторов изобретения того, что неионный димер, тесно связанный с йодиксанолом, не стимулирует T-клеточную пролиферацию in vitro в той же самой степени, как йодиксанол, или действительно в той же самой степени, как мономер йогексол, представляет значительный интерес. Поскольку в настоящее время известно, что T-клеточная пролиферация лежит в основе DAR, данные авторов изобретения свидетельствуют о том, что димерная структура сама по себе может не вызывать более высокую частоту T-клеточной пролиферации. Ключевое структурное различие между Соединением I и йодиксанолом заключается в том, что 2 ацетильные группы в йодиксаноле заменены 2 формильными группами в Соединении I. Эта модификация оказывает действие на молекулярную структуру линкера, конформацию и физико-химическое поведение, и неожиданно Соединение I обладает меньшей способностью стимулировать T-клеточную пролиферацию in vitro по сравнению с йодиксанолом и йогексолом. Следовательно, диагностическая композиция в соответствии с первыми аспектами изобретения, как ожидается, вызывает меньше реакций гиперчувствительности замедленного типа по сравнению с имеющимися в продаже контрастными средами, такими как Omnipaque™ (Йогексол) и Visipaque™ (Йодиксанол).
Соединение I может быть получено, как изложено в WO 2009/008734. Общий способ изложен на стр.16-20, и конкретный способ получения приведен в примере 1 в WO 2009/008734. Заявка на изобретение WO 2009/008734 с описанием способа получения включена сюда путем ссылки.
Соединение I может существовать в нескольких изомерных формах вследствие хиральных атомов углерода. Дополнительно, соединение демонстрирует экзо/эндо изомерию вследствие ограниченного вращения связи N-CO в формильной функциональной группе, вызванной близостью объемного атома йода. Под энантиомерно чистыми продуктами также включены смеси оптических изомеров.
Диагностическая композиция по изобретению находится в концентрации, готовой для применения. В общем, композиции в готовой для применения форме имеют концентрацию йода по меньшей мере 100 мг I/мл, предпочтительно по меньшей мере 150 мг I/мл, с предпочтительной концентрацией по меньшей мере 300 мг I/мл, например 320 мг I/мл. Диагностическая композиция предпочтительно дополнительно включает фармацевтически приемлемые носители или эксципиенты. Их примеры включают этилендиаминтетрауксусную кислоту (EDTA) и трис(гидроксиметил)аминометан (TRIS).
Диагностическая композиция по изобретению является предпочтительной для применения в качестве рентгеновской контрастной среды в рентгенологической диагностике или рентгенологической визуализации. Композиция может быть введена в виде инъекции болюса или путем инфузии. Кроме того, композиция может быть введена интраваскулярным, внутривенным или внутриартериальным путем. Альтернативно, композиция может также быть введена перорально.
В третьем аспекте в изобретении предложено применение Соединения I
в изготовлении диагностической композиции для использования в рентгенологической диагностике, где композиция содержит
фармацевтически приемлемый носитель
и растворенные в нем натриевое соединение и кальциевое соединение, обеспечивающее концентрацию ионов натрия 40-50 мМ и концентрацию ионов кальция 0,1-0,7 мМ.
В еще одном аспекте в изобретении предложен способ диагностики, включающий введение диагностической композиции по изобретению в организм человека или животного, исследование организма посредством диагностического устройства и сбор данных в результате исследования. В способе диагностики в организм может также быть предварительно введена диагностическая композиция.
В еще одном аспекте в изобретении предложен способ обнаружения путем визуализации in vivo, включающий следующие стадии:
1) введения обнаруживаемого количества диагностической композиции по изобретению;
2) обеспечения распределения введенной композиции;
3) обнаружения сигналов, испускаемых Соединением I из распределенной композиции,
4) формирования изображения, демонстрирующего расположение и/или количество указанного сигнала.
Способ визуализации представляет собой способ рентгенологической визуализации, и в предпочтительном воплощении этого аспекта способ обнаружения представляет собой способ коронарной артериографии, и более предпочтительно диагностическую композицию вводят в виде болюсной инъекции в коронарные артерии.
В еще одном аспекте в изобретении предложена композиция по изобретению для применения в рентгенологической визуализации или диагностике, такой как коронарная артериография.
Краткое описание графических материалов.
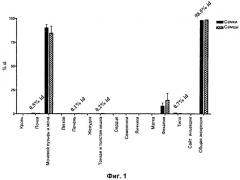
На Фиг.1 изображено сравнение распределения радиоактивности у самцов и самок крыс Wistar через 48 часов после введения Соединения I,
меченного [123I]. Общая экскреция равна сумме радиоактивности в мочевом пузыре и моче, а также фекалиях.
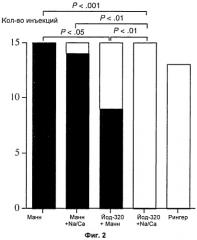
На Фиг.2 изображена частота мерцания желудочков, вызванная путем инъекции маннита (Манн; 275 мМ), маннита + добавленный натрий и кальций (Манн + Na/Ca; 240 мМ маннит, 19 мМ NaCl и 0,3 мМ CaCl2), йодиксанола+маннит (Йод-320 + Манн; 320 мг I/мл йодиксанол и 50 мМ маннит), Visipaque™ (Йод-320; 320 мг I/мл йодиксанол, 19 мМ NaCl и 0,3 мМ CaCl2) и раствора Рингера (Рингер, Ацетат Рингера, KabiVitrum AB, Sweden). Черные столбцы обозначают VF, белые обозначают отсутствие VF. Данные взяты из Chai et al.
На Фиг.3 изображена частота мерцания желудочков, вызванная путем инъекции композиции Соединения I, содержащей различные концентрации хлорида кальция, по сравнению с инъекциями Визипака:
Соединение I, 0,1 мМ CaCl2 (F1, 320 мг I/мл Соединения I, 45 мМ NaCl и 0,1 мМ CaCl2);
Соединение I, 0,3 мМ CaCl2 (F3, 320 мг I/мл Соединения I, 45 мМ NaCl и 0,3 мМ CaCl2);
Соединение I, 0,7 мМ CaCl2 (F5, 320 мг I/мл Соединения I, 45 мМ NaCl и 0,7 мМ CaCl2),
Визипак.
Объем инъекции составлял 25 мл в течение периода 62,5 с, и растворы избирательно инъецировали в LAD.
На Фиг.4 изображена зависимость вязкости Соединения I при 20°С (▲) и 37°С (○) в зависимости от концентрации.
На Фиг.5 изображено действие Соединения I (с добавлением и без добавления Ca) и Визипак на LVSP на 45-70 секунды от начала инъекции в LAD нормальной свиньи, нормализованное к инъекции Рингер-лактата (LR). Объем инъекции составлял 25 мл (0,4 мл/с). "GE-145 Ca+" представляет собой композицию Соединения I, содержащую 45 мМ Na, 0,5 мМ Ca, и "GE-145 Ca-" представляет собой композицию Соединения I, содержащую 45 мМ Na, без добавления Ca. Среднее ± СО* = p<0,05 значимое различие с GE-145 Ca+ с использованием двухстороннего теста Даннетта.
На Фиг.6 изображено влияние на кардиоваскулярные параметры после инъекции 40 мл (5 мл/с) Рингер-лактата, Соединения I, Визипак или Лопамидола в LAD нормальных свиней, (а) Изменение в LVSP, нормализованное к базовой линии, (б) Изменение в dP/dt, нормализованное к базовой линии. Среднее ± СО* = значимое различие с Рингер-лактатом, *p<0,05, **p<0,01 с использованием 2-стороннего ANOVA с последующим тестом Бонферрони.
Примеры
Пример 1. Физико-химические свойства, острая токсичность и данные по биораспределению для Соединения I.
Связывание с белком:
Связывание Соединения I с человеческим сывороточным альбумином (HSA) определяли с использованием способа равновесного диализа. Концентрированный раствор соединения I (5,0 мг/мл в забуференном фосфатом физиологическом растворе (PBS)) смешивали со смесью цитрат:человеческая плазма в соотношении 1:9. Уравновешивание осуществляли в диализаторе Diachem Dianorm Dialyser против водного забуференного фосфатом физиологического раствора с использованием мембраны Diachem 10,17 с отсечением 10000 MM и осуществляли в течение 25 часов. Анализ растворов осуществляли с использованием прибора ICP-AES (атомно-эмиссионного спектрометра с индуктивно связанной плазмой). Дополнительно, растворы PBS также уравновешивали против растворов человеческой плазмы с цитратом для обеспечения того, что достигается равновесие. Связывание Соединения I с человеческим сывороточным альбумином определяли как очень низкое, 3,1±1,3%, подтверждая незначительное взаимодействие вещества с эндогенными белками. Для сравнения определили, что связывание йодиксанола с HSA составляет 0,4±0,9%.
Коэффициент распределения:
В качестве меры гидрофильности Соединения I определяли коэффициент распределения между октанолом и водой. Воду (5 мл), содержащую тестируемое вещество (0,3 мг/мл), встряхивали с 15 мл н-октанола до достижения равновесия. Водную фазу отделяли путем центрифугирования и анализировали при помощи HPLC (высокоэффективной жидкостной хроматографии) (НР1100, оборудованный колонкой Discovery C18, 100×2,1 мм) с использованием УФ-детекции при 244 нм и потоком 0,3 мл/мин. Использовали изократические условия HPLC, 8% ацетонитрил в воде (об./об.). Октанольную фазу (12,5 мл) экстрагировали водой (0,75 мл) до достижения равновесия, и фазы разделяли путем центрифугирования. Водную фазу анализировали при помощи HPLC с использованием условий, подробно описанных выше. Как октанол, так и воду предварительно насыщали водой и октанолом, соответственно, перед проведением экспериментов с коэффициентом распределения. Гидрофильность Соединения I, определенная путем распределения между октанолом и водой, демонстрирует, что Соединение I является весьма гидрофильным с logP -4,28. Для сравнения, определенное значение logP для йодиксанола составляет -4,02. Приведенное в литературе значение составляет -4,05. Повышенная гидрофильность Соединения I по сравнению с йодиксанолом подверждается его поведением в HPLC.
Вязкость:
Вязкость Соединения I определяли при двух различных температурах, 20°С и 37°С и трех различных концентрациях 246, 295 и 313 мг I/мл. Тестируемые растворы были изотоническими путем корректирования осмоляльности при помощи NaCl, и их стерилизовали путем автоклавирования. Вязкость растворов определяли с использованием измерителя вязкости DMA58 (Anton Paar). Использовали способ с калиброванной U-пробиркой, в которой время опускания использовали для измерения динамической вязкости. Вязкость Соединения I определяли при 20°С и 37°С для трех различных концентраций. Результаты представлены на Фиг.4. В сравнении с Визипаком вязкость при 320 мг I/мл и 20°С близка и составляет приблизительно 24 мПа·с.
Осмоляльность:
Осмоляльность Соединения I определяли для четырех различных концентраций 204, 254, 310 и 324 мг I/мл. Использовали осмометр на основе давления паров Vapro 5520 от Vapro Inc. Осмоляльность Соединения I демонстрирует взаимосвязь с концентрацией, которая близка к линейной. Осмоляльность Соединения I при 320 мг I/мл меньше, чем йодиксанола, 136 мОсм/кг по сравнению с 210 мОсм/кг при 320 мг I/мл.
Острая токсичность:
Молодым взрослым самцам крыс Sca:SD (Scanbur, Sweden), имеющим массу 200±20 г, внутривенно инъецировали со скоростью 1,2 мл/мин Соединение I (340 мг I/мл, 286 мОсмоль/кг), йодиксанол (321 мг I/мл, 284 мОсмоль/кг), маннит в качестве осмотического контроля (283 мОсмоль/кг) или физиологический раствор (290 мОсмоль/кг), вводимые в виде 2 отдельных доз с интервалом 4 часа. Для животных, умерщвляемых в течение эксперимента (2 сутки после обработки), Соединение I и йодиксанол вводили в дозе 8, 10 и 12,8 г I/кг, что соответствует общим дозируемым объемам 23,7, 29,7 и 38,0 мл/кг и 25, 31,3 и 40 мл/кг, соответственно, тогда как для маннита и физиологического раствора объем дозы составлял 40 мл/кг. Для животных, окончательно умерщвляемых на 7 сутки, существовали 4 группы доз: Соединение I и йодиксанол (12,8 г I/кг) и физиологический раствор и маннит (40 мл/кг). Во всех случаях каждая группа включала 8 животных.
В течение исследования делались следующие оценки: клинические симптомы, масса организма и кровь на гематологию и клиническую химию на 0, 2 и 7 сутки и общие наблюдения: масса органа и гистоморфологическое исследование тканей животных, убитых путем внутривенной инъекции избытка тиопентала на 2 или 7 сутки. Сутки введения дозы определяли как Сутки 0. Параметры клинической биохимии (Na, K, Cl, PO4, Ca, AST (аспартатаминотрансфераза), ALT (аланинаминотрансфераза), ALP (щелочная фосфатаза), холестерин, креатинин, CK (креатинкиназа), GGT (гамма-глутамилтранспептидаза), TG (триглицериды), общий билирубин, общий белок, мочевина, альбумин, LDH (лактатдегидрогеназа) и GLDH (глутаматдегидрогеназа) измеряли на Beckman Synchron CX5 при 37°С. Гематологические параметры (WBC (лейкоциты), дифференцированные WBC, RBC (эритроциты), отношение WBC/RBC, Hgb (гемоглобин), PLT (тромбоциты), НСТ (гематокрит), МСН (среднее содержание гемоглобина в эритроцитах), МСНС (средняя кон