Способ лечения хронического остеомиелита длинных костей конечностей
Иллюстрации
Показать всеИзобретение относится к травматологии и ортопедии и может быть применимо для лечения остеомиелита длинных костей конечностей. Производят резекцию всех склеротически измененных эндостальных костных тканей за пределами санированного остеомиелитического очага изнутри через секвестральный костный дефект до опорного кортикального слоя, в котором формируют пористую структуру костной ткани, микроперфорируя ее со стороны интрамедуллярной костной полости на всем протяжении склеротических изменений в пределах надкостницы. Все микроперфорационные отверстия и секвестральный костный дефект в кортикальном слое заполняют интраоперационно затвердевающим бактерицидным остеогенным костно-пластическим материалом. Пластику оставшегося интрамедуллярного костного дефекта производят отсроченно в момент созревания в костной ране грануляционных тканей, вводя под рентгенологическим контролем остеогенный бактерицидный костно-пластический материал через одну из двух дренажных трубок. Способ позволяет улучшить остеогенные возможности костно-пластического материала, уменьшить риск остеонекроза. 1 пр., 19 ил.
Реферат
Изобретение относится к области медицины, а именно к травматологии и ортопедии и может быть применено при лечении хронического остеомиелита длинных костей конечностей.
Известно, что причиной развития и рецидивирующего течения остеомиелита являются стойкие нарушения микроциркуляции и нарушение репаративных процессов, связанных с тяжестью повреждений, ослабление общего и местного иммунитета, создающие условия для присоединения патологической микрофлоры. По данным научной литературы хронический остеомиелит в общей структуре заболеваний опорно-двигательного аппарата составляет 12-25% [1, 11, 12, 7, 4]. Вероятность его развития после хирургического лечения открытых переломов составляет 21-46,2%, а после закрытых переломов 7,6-13,2% [13, 10]. Учитывая, что до 80% этих больных представлены лицами молодого, работоспособного возраста и преимущественно мужчинами, проблема лечения хронического остеомиелита является не только медицинской, но и социальной.
Лечение хронического рецидивирующего остеомиелита длинных костей, или воспаления костного мозга, обычно распространяющегося на компактное и губчатое вещество кости и надкостницу независимо от этиологии и клинического течения имеет общие принципы. Таковыми являются вскрытие гнойных очагов, секвестрнекрэктомия, промывание очага антисептическими растворами, заполнение образовавшихся костных дефектов, антибактериальная терапия.
Известен способ хирургического лечения остеомиелита, ставший основополагающим принципом лечения этой патологии, заключающийся в выполнении очистки гнойного очага от некротических и нежизнеспособных мягких тканей, секвестрэктомии, частичной краевой продольной или поднадкостничной сегментарной резекции кости в сочетании с активным промыванием и вакуум-аспирацией раневого отделяемого [8].
С учетом исключительной сложности лечения остеомиелита с высоким процентом неудовлетворительных результатов один из ведущих специалистов по данной проблеме George Cierny (США) популяризировал концепцию лечения остеомиелита по аналогии с лечением опухолей костей, согласно которой очаг остеомиелита должен удаляться единым блоком, как в костной онкологии [20].
И действительно, поднадкостничная сегментарная резекция кости, описанная в способе [8] имеет однозначно наивысшую эффективность, поскольку радикально решает проблему за счет удаления всех патологически измененных остеомиелитическим процессом костных тканей, однако приводит к образованию сегментарного дефекта кости с полным нарушением опороспособности конечности и создает большие сложности в последующем восстановлении ее целостности.
В этом отношении выполнение частичной краевой продольной остеотомии по данному способу является более щадящим, однако также приводит к достаточно большому костному дефекту, в данном случае части кортикальной кости. Это требует меньших усилий для его полноценного замещения, но оставляет возможность рецидива остеомиелита в массиве оставшейся патологически измененной кости.
Известно, что одним из механизмов возникновения рецидива хронического остеомиелита является остеонекроз, некроз костной ткани вместе с содержимым ее каналов и полостей, который преимущественно имеет остроишемический генез [6]. В условиях патологических изменений, развивающихся в кости на достаточно большом протяжении вокруг непосредственно самого остеомиелитического очага при длительно протекающем гнойно-воспалительном процессе и характеризующихся высокой склеротической плотностью костных тканей, обедненных сосудами, вероятность развития ишемического остеонекроза повышается многократно. Нарастание интерстициального отека как следствия закономерно развивающегося воспаления в очаге остеонекроза приводит к ишемии окружающих тканей и способствует расширению его размеров. Небольшие очаги, без присоединения инфекции, способны в ходе остеобластической резорбции к самоперестройке и реоссификации. Более крупные, особенно при присоединении инфекции, подвергаются гнойному расплавлению с образованием секвестров и прорывом содержимого наружу с формированием свищей. Дальнейшее распространение гнойно-некротического процесса в костной ткани ограничивается образованием демаркационной линии и фиброзной капсулы вокруг очага. Обширность первичного ишемического и вторичного инфекционно-воспалительного остеонекроза, топографическая неоднородность воспалительных изменений вследствие неравномерности бактериальной обсемененности тканей кости затрудняют санацию очага [6].
В этой связи, интересным и близким к предлагаемому способу лечения можно признать способ лечения хронического остеомиелита длинных костей, включающий выкраивание костного лоскута на мягкотканных питающих ножках в проекции патологического очага, откидывание лоскута поворотом вокруг собственной оси, санацию патологического очага через сформированное окно в пределах здоровых тканей и возвращение лоскута в “материнское ложе”, отличающийся тем, что после санации патологического очага изнутри со стороны костномозгового канала выполняют остеоперфорации до надкостницы на всем протяжении доступа и на лоскуте с расстоянием друг от друга 1,5 см, при этом остеоперфорации имеют конусовидную форму с основанием, обращенным кнутри костномозгового канала, после чего лоскут фиксируют в “материнском ложе” спицей с упорной площадкой и оперированный сегмент стабилизируют аппаратом внешней фиксации [16].
Однако этот способ имеет целый ряд существенных недостатков:
1. Остеоперфорация кортикального слоя до надкостницы со стороны костномозгового канала на всем протяжении доступа и на лоскуте выполняется с промежутком друг от друга в 1,5 см, что оставляет существенные по размеру склерозированные костные участки между перфорационными отверстиями, где сохраняются все условия для образования и распространения новых очагов остеонекроза, а соответственно и появления рецидивов остеомиелита.
2. Перфорационные отверстия сами по себе не несут антибактериального и остеогенного воздействия на окружающие их костные ткани кортикального слоя, способствуя только активизации ангиогенеза и направленному росту грануляций.
3. Эндостальная резекция кости проводится только в очаге остеомиелитического ее поражения, поскольку «Патологический очаг удаляют единым блоком в пределах здоровых тканей при помощи желобоватых долот, изогнутых в продольной плоскости. Стенки образовавшейся костной полости и костного лоскута на мягкотканных питающих ножках обрабатывают фрезами до точечного кровотечения и промывают антисептиками». В результате остаются еще и эндостально расположенные вокруг санированного гнойно-некротического очага склерозированные костные ткани, потенциально являющиеся источником новых рецидивов остеомиелита.
4. При наиболее распространенной свищевой форме посттравматического остеомиелита в гнойно-некротический процесс вовлечена и кортикальная кость с некрозом и деструкцией ее участка, прилежащего к очагу остеомиелита. Таким образом, чаще всего уже изначально имеется кортикальный дефект, неустранимый способом формирования кортикального васкуляризованного лоскута с одной стороны, а с другой - установленный на место костный лоскут сам по себе не обладает бактерицидными свойствами и требует для обеспечения прочности его фиксации и восстановления опороспособности кости применения аппарата внешней фиксации.
Вторым по значимости механизмом развития рецидивов гнойно-некротического заболевания костей является наличие остаточной полости и вялотекущей инфекции.
Для пластики образующихся костных дефектов применяются различные способы, среди которых наиболее широкое распространение получила транспозиция мышечных лоскутов, что создает хорошие условия для реваскуляризации остеомиелитического очага и обеспечивает равномерное заполнение костной полости стойкими к инфекции васкуляризированными тканями. Однако мышечная пластика имеет ряд существенных недостатков, связанных, во-первых, с тем, что мышечная ткань в костной полости рубцово перерождается и препятствует регенерации кости в зоне дефекта, во-вторых, с естественным ограничением аутогенного пластического материала.
В качестве альтернативы известны способы пластики остаточных полостей аутогенными, аллогенными и ксеногенными тканями и имплантатами [2, 8, 11], например измельченным формалинизированным хрящом [1]. Однако, как и мышечная пластика, эти способы также имеют ряд существенных недостатков, связанных с ограничением пластического материала, усложнением и повышением травматичности операции. В то же время свободный костный трансплантат, несомненно обладая наилучшими остеоиндуктивными и остеокондуктивными свойствами, активизируя репаративный процесс, все же в ходе репаративной регенерации закономерно резорбируется с замещением новообразующейся костной тканью. При этом, в случае наличия неудовлетворительных условий для остеогенного течения регенерации, его потенций зачастую оказывается недостаточно, и он, рассасываясь, замещается фиброзно-хрящевой мозолью. Кроме того, в костной ране остеомиелитического очага, будучи аваскулярным объектом, трансплантат может стать хорошей питательной средой для бактериальной флоры и, как следствие, вызвать обострение остеомиелитического процесса.
Попытка избежать применения свободных неваскуляризованных костных аутотрансплантатов при лечении посттравматического костного гнойно-некротического заболевания привело к развитию микрохирургических технологий замещения остаточных полостей, что позволяет одновременно устранять обширные комбинированные дефекты практически любых размеров и локализации [14].
Однако эти микрохирургические вмешательства отличаются высокой сложностью и трудоемкостью, а также травматичностью и длительностью вмешательства, что само по себе увеличивает риск гнойно-септических осложнений. В то же время их серьезным и достаточно частым осложнением является тромбоз микроанастомозов, процент возникновения которых может достигать, особенно в области голени и стопы, 17% с частотой полных некрозов лоскута до 10%, что, в свою очередь, приводит к ампутации конечности в 21-36% случаев [2, 19]. Кроме того, помимо естественного дефицита аутопластического материала немаловажным становится еще и привнесение дополнительного косметического и функционального урона пациенту в зоне мобилизации подобных лоскутов.
Недостатки вышеописанных видов пластики костных полостей вынуждают хирургов прибегать к поиску новых способов хирургического лечения и материалов для пластического восполнения остеомиелитических костных дефектов.
Современным направлением в замещении костных полостей считается формирование сложных «пломб», которые принято называть композициями. Биополимерные композиции содержат кальций и фосфор, которые формируют эндогенные центры кристаллизации с усилением костной репарации [9].
Известен способ заполнения дефекта длинных трубчатых костей гемопломбой по Шеде. Применение гемопломбы возможно в сочетании с антибиотиками. Однако рамки использования этой методики ограничены. В основном она применяется у детей и в ранние сроки (до 6 месяцев) с момента заболевания, когда костная полость имеет незначительные размеры [23]. Она малоустойчива к инфекции, довольно часто нагнаивается, что нередко приводит к рецидиву заболевания [10].
Известна также гемопломба с гидроксиапатитом. В ней используется твердый материал для заполнения небольших костных дефектов [18]. Однако она не обладает антибактериальными свойствами, что способствует развитию гнойно-воспалительных осложнений.
Известен способ лечения хронического рецидивирующего остеомиелита длинных костей с применением коллапана, заключающийся в том, что осуществляют хирургическую обработку патологического очага и последующее заполнение костного дефекта имплантатом. При лечении в стадии обострения проводят секвестрнекрэктомию, промывание антисептиками, вакуумирование. Затем заполняют костный дефект гранулами коллапана. При формировании после секвестрнекрэктомии полости заполнение гранулами коллапана производят без утрамбовки до ограничивающего полость уровня кромки. В случае формирования обширных костных дефектов в виде полости заполнение гранулами коллапана дополняют мышечной пластикой. При резекционной секвестрнекрэктомии гранулы коллапана укладывают между костными отломками и производят остеосинтез компрессионно-дистракционным аппаратом. При лечении в стадии ремиссии осуществляют тоннелизацию области патологически измененных костей. Затем заполняют сформированные каналы коллапаном в виде геля через катетер под давлением. Способ позволяет произвести заполнение костного дефекта со стимуляцией остеогенеза и длительным и локальным обеспечением антибактериальной среды [17].
Этот способ принят за прототип.
Однако данный способ, позволяя произвести заполнение костного дефекта со стимуляцией остеогенеза в сочетании с длительным и локальным обеспечением антибактериальной среды в костной полости, все же имеет ряд недостатков:
во-первых, не устраняется одна из важных причин развития рецидивов остеомиелита, связанная с сохранением окружающих склерозированных костных масс, где имеются все условия для возникновения остеонекроза и формирования новых секвестров;
во-вторых, сохраняется открытая в мягкие ткани костная полость, что способствует с одной стороны миграции материала в окружающие ткани, а с другой, прилегающие регенерирующие мягкие ткани, формируя специфическое белковое микроокружение, управляющее направленностью регенерации, способны нивелировать остеогенные свойства материала, вызвать его постепенную резорбцию с замещением фиброзными тканями. Это убедительно показано в ряде научных работ, которые позволили ввести понятие «фиброзно-пластический барьер», отражающее отрицательное влияние на остеогенез проникающих из окружающих мягких тканей в костную полость рубцовых тканей [5, 21, 22];
в-третьих, способ не позволяет повысить прочность кости к нагрузкам, оставляя дефект кортикальной пластинки, что создает угрозу перелома в зоне секвестральной коробки.
в-четвертых, установленный костно-пластический материал в момент операции оказывается в условиях развивающегося послеоперационного экссудативного воспаления, адсорбирует продукты этого воспаления, ограничивает его эвакуацию из раны и снижает остеогенные потенции костно-пластического материала.
Задачей изобретения является повышение эффективности способа хирургического лечения хронического остеомиелита длинных костей конечностей.
Это достигается за счет того, что производят резекцию всех склеротически измененных эндостальных костных тканей за пределами санированного остеомиелитического очага изнутри через секвестральный костный дефект до опорного кортикального слоя, в котором формируют пористую структуру костной ткани, микроперфорируя ее со стороны интрамедуллярной костной полости на всем протяжении склеротических изменений в пределах надкостницы, все микроперфорационные отверстия и секвестральный костный дефект в кортикальном слое заполняют интраоперационно затвердевающим бактерицидным остеогенным костно-пластическим материалом, при этом пластику оставшегося интрамедуллярного костного дефекта производят отсрочено в момент созревания в костной ране грануляционных тканей, вводя под рентгенологическим контролем остеогенный бактерицидный костно-пластическим материал через одну из двух дренажных трубок.
Технический результат состоит в том, что, во-первых, устраняются условия образования и распространения очагов ишемического остеонекроза во всей патологически измененной костной ткани с сохранением непрерывности кости; во-вторых, одномоментно восстанавливается непрерывность и опороспособность кортикального слоя кости на участке секвестрального костного дефекта и в третьих, создаются оптимальные условия для остеогенного течения репаративных процессов в зоне интрамедуллярного костного дефекта.
Условия образования и распространения очагов ишемического остеонекроза устраняются во всей патологически измененной костной ткани и при этом сохраняется непрерывность кости, что достигается за счет полного удаления всех эндостально расположенных склерозированных костных масс, как в зоне самого остеомиелитического очага, так и на всем протяжении рентгенологически определяемых костных изменений до опоронесущей части кортикального слоя, в котором условия для возникновения и распространения остеомиелитических процессов в свою очередь устраняются микроперфорацией его на всем протяжении изнутри в пределах надкостницы до достижения пористости костной структуры кортикального слоя и заполнением всех микроперфорационных отверстий интраоперационно затвердевающим бактерицидным остеогенным костно-пластическим материалом с повышением прочности кортикальной кости, активизацией костных репаративных процессов и ускорением перестройки костной ткани в условиях пролонгированно действующей антибактериальной среды.
Непрерывность и опороспособность кортикального слоя кости на участке секвестрального костного дефекта восстанавливается одномоментно интраоперационно затвердевающим бактерицидным остеогенным костно-пластическим материалом, который в пластичной фазе позволяет точно смоделировать отсутствующую кортикальную часть кости, а в фазе затвердевания прочно самофиксируется в костной ране, обеспечивая прочность кости без применения фиксирующих металлоконструкций, и формирует замкнутую внутрикостную полость, что блокирует участие в репаративных процессах интрамедуллярного пространства фибробластических клеток из окружающих кость мягких тканей.
Оптимизация условия для остеогенного течения репаративных процессов в зоне интрамедуллярного дефекта, способствующих полноценному восстановлению кости в зоне интрамедуллярного дефекта в кратчайшие сроки, создается за счет предварительного формирования грануляционных тканей на стенках костной полости и введения остеогенного бактерицидного костно-пластического материала при их созревании через трубки дренажной проточно-промывной системы одновременно с их удалением без повторного хирургического вмешательства.
Изобретение поясняется следующими фигурами:
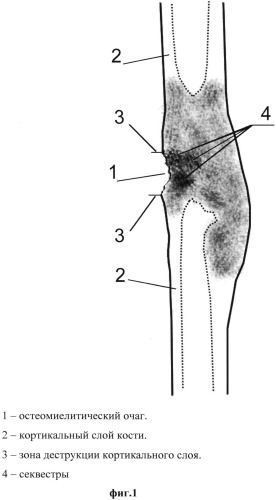
фиг.1 - остеомиелитический очаг с наличием секвестров и деструкцией участка кортикальной слоя кости;
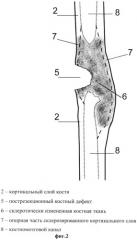
фиг.2 - резекция эндостально расположенных склерозированных костных тканей через пострезекционный секвестральный дефект в кости;
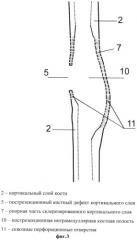
фиг.3 - остеоперфорация склерозированного кортикального слоя кости изнутри через пострезекционный кортикальный дефект со стороны пострезекционной интрамедуллярной костной полости;
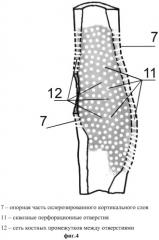
фиг.4 - нанесение микроперфорационных отверстий с созданием мелкоячеистой пористой костной структуры склерозированного кортикального слоя кости;
фиг.5 - заполнение перфорационных отверстий интраоперационно затвердевающим бактерицидным костно-пластическим материалом;
фиг.6 - дренирование пострезекционного интрамедуллярного костного пространства;
фиг.7 - пластика пострезекционного дефекта в кортикальном слое кости интраоперационно затвердевающим бактерицидным костно-пластическим материалом;
фиг.8 - отсроченное закрытое введение бактерицидного костно-пластического материала в пострезекционную интрамедуллярную костную полость через трубки дренажной системы;
фиг.9 - контролируемое равномерное заполнение пострезекционной интрамедуллярной костной полости с одновременным удалением дренажных трубок;
фиг.10 - изменения кожных покровов при хроническом течении посттравматического остеомиелита правого бедра;
фиг.11 - рентгенологические проявления хронического посттравматического остеомиелита правого бедра;
фиг.12 - пострезекционные кортикальный и эндостальный костные дефекты;
фиг.13 - пластика интраоперационно затвердевающим бактерицидным костно-пластическим материалом пострезекционного дефекта в кортикальном слое кости;
фиг.14 - герметичная фиксация дренажных трубок с закрытием раны швами;
фиг.15 - послеоперационный рентгенологический контроль;
фиг.16 - закрытое отсроченное заполнение интрамедуллярной пострезекционной костной полости бактерицидным костно-пластическим материалом;
фиг.17 - полная опороспособность оперированной конечности через 3 месяца после операции;
фиг.18 - функциональное состояние оперированной конечности к 3 месяцам после операции;
фиг.19 - отсутствие рентгенологических признаков остеомиелита бедренной кости через 18 месяцев после операции.
Способ осуществляется следующим образом.
Под общим обезболиванием в асептических условиях выполняют стандартный санирующий этап операции, заключающийся в резекции разрушенной части 1 кортикального слоя кости 2 в пределах непораженных гнойно-деструктивным процессом костных тканей 3 с удалением костных секвестров 4 (фиг.1).
Через образовавшийся пострезекционный костный дефект 5 под визуально-рентгенологическим контролем производят резекцию всей внутренней части склеротически измененной костной ткани 6 в пределах опорной части 7 кортикального слоя кости 2 со вскрытием костномозгового канала 8 (фиг.2).
Вместо резекции оставшиеся склерозированные костные ткани 7 кортикального слоя кости 2, сохраняющие непрерывность и опороспособность кости, изнутри через пострезекционный кортикальный костный дефект 5 со стороны пострезекционной интрамедуллярной костной полости 10 перфорируют на всем их протяжении, создавая множественные сквозные отверстия 11 (фиг.3).
Сквозные перфорационные отверстия 11 наносят равномерно в плоскости кости с минимальным диаметром в зависимости от толщины перфорируемой кости таким образом, чтобы сформировать мелкоячеистую костную структуру без потери ее опорной целостности с равным распределением в объеме кости одинаковых по размеру сквозных пустот отверстий 11 и окружающей сети костных промежутков 12, что ограничивает возможность ползущего распространения очагов остеонекроза в костной ткани и уменьшает общую склеротическую плотность патологически измененного опорного кортикального слоя кости 7 (фиг.4).
Повышают механическую прочность измененного опорного кортикального слоя 7 с созданием пролонгированной антибактериальной среды и активизацией костных репаративных процессов для чего пространства перфорационных отверстий 11 заполняют интраоперационно затвердевающим бактерицидным костно-пластическим материалом 13 (фиг.5).
Миниинвазивно транскутантно под рентгенологическим контролем трепанируют кость 14 в пределах неизмененных костных тканей и в интрамедуллярное костное пространство 10 устанавливают две дренажные трубки 15 для проточно-промывной системы и производят пластику пострезекционного дефекта 5 в кортикальном слое кости 2 (фиг.6) интраоперационно затвердевающим бактерицидным костно-пластическим материалом 16, который затвердевая в дефекте, герметизирует интрамедуллярную костную полость 10 и восстанавливает целостность и механическую прочность кортикального слоя кости 2 на этом ослабленном участке (фиг.7). Рана промывается антисептиками, послойно наглухо ушивается.
В послеоперационном периоде на фоне общей антибиотикотерапии проводят проточно-промывное дренирование интрамедуллярной костной полости с использованием антисептиков и активизирующих репаративные процессы лекарственных препаратов в условиях закрытой стерильной системы.
После ликвидации операционного травматического воспаления и очищения выделяющегося промывного раствора через одну из трубок 15 дренажной системы вводят эндоскоп 17 и контролируют развитие грануляционных тканей 18 на стенках эндостальной костной полости 10 и при их созревании без повторного хирургического вмешательства в асептических условиях под эндовизуальным контролем эндоскопом 17 вводят бактерицидный остеогенный костно-пластический материал 19 через вторую дренажную трубку 15 (фиг.8). После равномерного заполнения костной полости костно-пластическим материалом 19 эндоскоп и дренажные трубки через трепанационные отверстия 14 в кортикальном слое кости 2 удаляют (фиг.9).
Предложенный способ предназначен для лечения хронического остеомиелита длинных костей конечностей.
Его применение позволяет ликвидировать гнойно-деструктивный воспалительный процесс в костной ткани, устранить патологические условия, лежащие в основе развития рецидивов заболевания, сохранить и увеличить опороспособность кости, повысить лечебный эффект со снижением травматичности вмешательства и сократить сроки реабилитации больных.
Клинический пример.
Больной М., 36 лет, в 2009 году в результате ДТП получил закрытый оскольчатый перелом правого бедра в средней и проксимальной трети, правой голени, ЗЧМТ, перелом 4-5 ребра справа. Доставлен в городскую клиническую больницу г. Москвы, где был произведен остеосинтез бедренной кости пластиной и винтами, большеберцовой кости - штифтом. Швы сняты в срок, раны зажили первичным натяжением. Послеоперационный период без особенностей. Проведено восстановительное лечение, включающее ходьбу с костылями с дозированной, постепенно увеличивающейся нагрузкой на оперированную конечность.
В отдаленном послеоперационном периоде отметил повышение температуры тела, появление боли при нагрузке и в покое по наружной поверхности правого бедра с открытием свища в проксимальной трети послеоперационного рубца. Динамический рентгенконтроль в этот период демонстрировал замедленную консолидацию перелома бедренной кости. Выставлен диагноз: Посттравматический свищевой остеомиелит правого бедра, проведено стационарное консервативное лечение при котором удалось купировать воспалительный процесс с закрытием свищевого хода. Перелом бедра сросся, однако в течение 1,5 лет свищ периодически открывался вновь, несмотря на проводимое лечение.
В связи с развитием хронического рецидивирующего остеомиелитического процесса больной в августе 2011 года был госпитализирован в нашу клинику. При осмотре на наружной поверхности средней трети правого бедра определялся точечный свищ 20, располагающийся по линии послеоперационного рубца 21 со скудным гнойно-серозным отделяемым (фиг.10). При посеве отделяемого из раны был высеян золотистый стафилококк, чувствительный к гентамицину и цефазолину. На рентгенограмме на фоне сросшегося перелома определялась деструкция участка 1 кортикального слоя кости 2, располагающегося под фиксирующей кость металлической пластиной 22 и внутрикостно расположенные секвестры 4 (фиг.11). 23.08.11 г. под спинальным обезболиванием проведено окрашивание свищевого хода раствором бриллиантовой зелени, продольным разрезом по старому послеоперационному рубцу послойно выделена наружная поверхность бедра в зоне деструкции кортикального слоя с иссечением прокрашенных тканей свищевого хода. Удалена пластина. В зоне деструкции произведена резекция кортикального слоя кости с удалением секвестров и патологических грануляций. Рана многократно промыта антисептиками, после чего через пострезекционный дефект в кортикальном слое кости под рентгенологическим и эндовизуальным контролем с помощью изогнутых под разными углами долот произведена резекция всей эндостально расположенной склерозированной кости до опоронесущей части кортикального слоя кости. После чего с помощью спицы Киршнера и стоматологического бора произведена множественная точечная остеоперфорация всего склеротически измененного кортикального слоя со стороны пострезекционного пострезекционной интрамедуллярной костной полости через пострезекционный кортикальный дефект. Все микроперфорационные отверстия заполнены с помощью шпателя интраоперационно затвердевающим бактерицидным костно-пластическим материалом. После установки через трепанационные отверстия в кости 14 дренажных трубок 15 пострезекционная интрамедуллярная костная полость 10 была герметизирована с помощью пластики пострезекционного кортикального дефекта 5 (фиг.12) интраоперационно затвердевающим костным цементом с гентамицином 16 с восстановлением опороспособности кортикального слоя кости 2 на этом участке (фиг.13). После послойного ушивания раны узловыми швами 23, дренажные трубки 15 герметично фиксированы к коже 24 (фиг.14). На контрольной рентгенограмме после операции костный цемент 16 полностью восполняет дефект кортикального слоя бедра 2, хорошо прослеживается интрамедуллярная костная полость 10, образованная в результате выполненной эндостальной резекции кости (фиг.15).
В послеоперационном периоде проводилось проточно-промывное дренирование с использованием 1% раствора лавасепта. После очищения раны и созревания грануляционных тканей под эндовизуальным контролем через проксимальную дренажную трубку 15 интрамедуллярная костная полость заполнена костно-пластическим материалом 19 в виде желеобразной смеси порошкообразного коллагенового материала Коллост™ с цефазолином и аутогенным костным мозгом (фиг.16), после чего оба дренажа были удалены.
Рана зажила первичным натяжением, швы сняты на 14 сутки. В последующем в течение месяца дозированная нагрузка на оперированную конечность с костылями, затем без ограничений. К трем месяцам после операции опороспособность оперированного бедра 25 восстановлена (фиг.17) и пациент ходит с полной нагрузкой на оперированную конечность, болей нет. Движения в смежных с оперированным бедром 25 тазобедренном и коленном суставах не ограничены (фиг.18). Через 18 месяцев после операции при контрольном рентгенологическом исследовании проходимость костномозгового канала 8 сохраняется, определяется костная репарация с заполнением интрамедуллярного костного дефекта 10, полная интеграция костного цемента 16 с костной тканью кортикального слоя 2 бедренной кости, очагов деструкции и признаки секвестрации не определяется (фиг.19).
В течение последующих 2 лет наблюдения рецидивов остеомиелитического процесса нет.
Список литературы
1. Авторское свидетельство СССР №700115, A61B 17/00, 1979 г.
2. Азолов В.В., Александров Н.М., Алейников А.В. Использование лоскутов с осевым кровоснабжением для устранения обширных костно-мягкотканных дефектов конечностей в условиях измененного реципиентного ложа. // Тезисы докладов VII съезда травматологов-ортопедов России. - Новосибирск, 2002. - T.1 - С.378-379.
3. Акжигитов Г.Н., Галеев М.А., Сахаутдинов В.Г., Юдин Я.Б. // Остеомиелит. - М.: Медицина, 1986. - С.193.
4. Батаков Е.А., Ишутов И.В. Современные аспекты комплексного лечения хронического остеомиелита. // Казанский медицинский журнал. - 2008. - Т.89, №1. - С.41-43.
5. Белендир Э.Н., Салмачамбетов И.У., Советова Н.А., Лукашевич Т.А. Роль мягких тканей в заживлении костных дефектов и перестройки трансплантатов. // Ортопедия, травматология. - 1972. - №7. - С.42-48.
6. Григоровский В.В. Современные представления о патологии и патанатомии гематогенного остеомиелита и их значение для клинической практики. // Международный медицинский журнал. - 2003. - №1. - С.104-108.
7. Ерюхин И.А., Гельфанд Б.Р., Шляпников С.А. Хирургические инфекции: практическое руководство. - М.: Литтера, 2006. - 736 с.
8. Каплан А.В., Махсон Н.Е., Мельникова В.М. // Гнойная травматология костей и суставов. - М.: Медицина, 1985. - 384 с.
9. Козлов И.В. Пластическое замещение остеомиелитических дефектов голени и стопы лоскутами с осевым типом кровоснабжения: автор, дис. … канд. мед. наук. - СПб, 2007. - 20 с.
10. Кононов B.C. “Гематогенный остеомиелит у детей”. - М.: Медицина, 1974.
11. Никитин Г.Д., Рак А.В., Линник С.А. и др. // Хирургическое лечение остеомиелита. - Санкт-Петербург, 2000. - 287 с.
12. Оноприенко Г.А., Буачидзе О.Ш., Еренин А.В., Савицкая К.И. и др. Хирургическое лечение больных с хроническим гнойным поражением костей и крупных суставов конечностей. // Хирургия. - 2005. - №8. - С.29-35.
13. Соколов В.А. Множественные и сочетанные травмы. - М.: ГОЭТАР-Медиа, 2006. - 512 с.
14. Тихилов P.M., Кочиш А.Ю., Филимонова М.Н., Козлов И.В. Несвободная пластика осевыми мышечными лоскутами при остеомиелите стопы (обзор литературы). // Травматология и ортопедия России. - 2009. - №2(52) - С.136-143.
15. Уразгильдеев З.И., Бушуев О.М., Роскидайло А.С., Лялин В.А. и др. Комплексное одноэтапное лечение несросшихся переломов, ложных суставов и дефектов длинных костей конечностей, осложненных остеомиелитом. // Вестник травматологии и ортопедии им. Н.Н. Приорова. - 2002. - №4. - С.33-38.
16. RU патент №2236188, МПК A61B 17/56, опубликовано 20.09.2004.
17. RU патент №2155552, МПК A61B 17/56, A61L 27/24, опубликовано 10.09.2000.
18. Япония, патент N5088623 B4 “Изобретения стран мира” №N15, 1996 г.
19. Benacquista T., Kasabian A.K., Karp N.S. The fate of lower extremities with failed free flaps. // Plast. Recostr. Surg. - 1999. - Vol.98, N5. - P.834-840.
20. Cierny G. Chronic osteomyelitis: Results of treatment. // Instr. Course Lect. - 1990. - 1:39 - P.495-508.
21. Hurley Y.A., Stinchfild F.E., Bassetts A.E., Lyon W.H. The role of soft tissues in osteomyelitis. // J. Bone Joint Surg. - 1959. - Vol.41-A, №10. - P.1243-1254.
22. Marray Y., Holden R., Rosculau W. Experimental and clinical study of new bone in a cavity. // Amer. J. Surg. - 1957. - Vol.93. - P.385-387.
23. Reinehr T., Burk G., Michel E., Andler W. Chronic osteomyelitis in childhood: is surgery always indicated? // Infection. - 2000. - Vol.28, №5. - P.282-286.
Способ лечения остеомиелита длинных костей конечностей, заключающийся в выполнении секвестрэктомии, санации гнойного очага, проточно-промывного дренирования, заполнении костного дефекта костно-пластическим материалом, содержащим антибиотик, отличающийся тем, что производят резекцию всех склеротически измененных эндостальных костных тканей за пределами санированного остеомиелитического очага изнутри через секвестральный костный дефект до опорного кортикального слоя, в котором формируют пористую структуру костной ткани, микроперфорируя ее со стороны интрамедуллярной костной полости на всем протяжении склеротических изменений в пределах надкостницы, все микроперфорационные отверстия и секвестральный костный дефект в кортикальном слое заполняют интраоперационно затвердевающим бактерицидным остеогенным костно-пластическим материалом, при этом пластику оставшегося интрамедуллярного костного дефекта производят отсроченно в момент созревания в костной ране грануляционных тканей, вводя под рентгенологическим контролем остеогенный бактерицидный костно-пластический материал через одну из двух дренажных трубок.