Способы синтеза спиро-оксиндольных соединений
Иллюстрации
Показать всеИзобретение касается способа получения спиро-оксиндольных производных формулы 1 или его фармацевтически приемлемой соли в виде отдельного стереоизомера, или энантиомера, или их смеси, включающего а) обработку соединения формулы (7) или его фармацевтически приемлемой соли основанием в подходящих условиях с образованием соединения формулы (8) или его фармацевтически приемлемой соли и b) обработку соединения формулы (8) или его фармацевтически приемлемой соли соединением формулы (9) или его фармацевтически приемлемой солью в подходящих условиях с получением соединения формулы (I) или его фармацевтически приемлемой соли в виде отдельного стереоизомера, или энантиомера, или их смеси. Соединения формулы 1 являются полезными при лечении и/или профилактике опосредованных натриевыми каналами заболеваний или состояний, таких как боль. 5 з.п. ф-лы, 2 табл., 5 пр.
Реферат
Перекрестная ссылка на родственную заявку
По данной формуле изобретения к заявке согласно § 119(e) 35 U.S.C. испрашивается приоритет по предварительной заявке на патент США № 61/251335, поданной 14 октября 2009 г. Раскрытие указанной заявки полностью включено сюда путем ссылки.
Область техники, к которой относится изобретение
Настоящее изобретение касается улучшенных способов получения некоторых спиро-оксиндольных соединений, а также соответствующих различных промежуточных соединений. В частности, настоящее изобретение касается способов получения спиро-оксиндольных соединений, и соответствующих фармацевтически приемлемых солей, полезных при лечении опосредованных натриевыми каналами заболеваний или состояний, таких как боль, а также других заболеваний или состояний, связанных с посредничеством натриевых каналов.
Уровень техники изобретения
Натриевые каналы выполняют многочисленные функции в поддержании нормальных и патологических состояний, включая давно общепризнанную роль, которую потенциалзависимые натриевые каналы играют в генерации аномальной неврональной активности и невропатической или патологической боли. Повреждение периферических нервов после травмы или болезни может привести к изменениям активности натриевого канала и развитию аномальной афферентной активности, включая эктопические разряды от аксотомизированных афферентов и спонтанную активность сенсибилизированных интактных ноцицепторов. Такие изменения могут стать причиной длительной аномальной гиперчувствительности к обычно безвредному стимулу, или аллодинии. Примеры невропатической боли включают, но не в порядке ограничения, такие заболевания или состояния, как постгерпетическая невралгия, тригеминальная невралгия, диабетическая невропатия, хронический пояснично-крестцовый радикулит, фантомная боль в ампутированных конечностях и боль, возникающая при раке и химиотерапии, хроническая тазовая боль, комплексный региональный болевой синдром и сопутствующие невралгии.
Некоторые успехи в лечении симптомов невропатической боли были достигнуты при использовании лекарственных средств, таких как габапентин и, совсем недавно, прегабалин, в качестве краткосрочной терапии первой линии. Однако фармакотерапия невропатической боли обычно имеет ограниченный успех с незначительным откликом на обычно используемые болеутоляющие средства, такие как НПВС и опиаты. Следовательно, по-прежнему существует значительная потребность в изыскании новых методов терапии.
Продолжает существовать ограниченное число высокоэффективных блокаторов натриевых каналов с минимальными нежелательными клиническими действиями. Существует также нереализованная потребность медицины в эффективном и без нежелательных побочных действий лечении невропатической боли и других, связанных с натриевыми каналами патологических состояний.
Опубликованная патентная заявка PCT № WO 2006/110917, опубликованная патентная заявка PCT № WO 2010/45251 и патентная заявка PCT № PCT/US2010/040187 описывают некоторые спиро-оксиндольные соединения. Указанные соединения раскрыты там, как полезные для лечения заболеваний, опосредованных натриевыми каналами, преимущественно заболеваний, связанных с болью, состояний центральной нервной системы, таких как эпилепсия, тревожность, депрессия и биполярное расстройство; состояний сердечно-сосудистой системы, таких как аритмия, мерцательная аритмия и фибрилляция желудочков; состояний нервно-мышечной системы, таких как синдром усталых ног; для нейропротекции при ударе, травматическом повреждении нервов и рассеянном склерозе; и при каналопатиях, таких как эритромелалгия и наследственный синдром боли в прямой кишке.
Способы получения таких соединений и фармацевтические композиции, содержащие указанные соединения, также описаны в опубликованной патентной заявке PCT № WO 2006/110917, опубликованной патентной заявке PCT № WO 2010/45251 и патентной заявке PCT № PCT/US2010/040187.
Таким образом, существует потребность в улучшенных способах получения некоторых спиро-оксиндольных соединений.
Краткое описание изобретения
Настоящее изобретение касается способов получения некоторых спиро-оксиндольных соединений в виде отдельных стереоизомеров или отдельных энантиомеров, или их смесей, или в виде соответствующих фармацевтически приемлемых солей. Такие соединения полезны при лечении опосредованных натриевыми каналами заболеваний или состояний, таких как боль.
Таким образом, в одном из аспектов настоящее изобретение касается способа получения соединения формулы (I):
или его фармацевтически приемлемой соли в виде отдельного стереоизомера, или энантиомера, или их смеси;
где способ включает обработку соединения формулы (8):
или его фармацевтически приемлемой соли соединением формулы (9):
или его фармацевтически приемлемой солью, в подходящих условиях, с получением соединения формулы (I) или его фармацевтически приемлемой соли в виде отдельного стереоизомера, или энантиомера, или их смеси.
В другом аспекте настоящее изобретение касается способа получения соединения формулы (I-S):
или его фармацевтически приемлемой соли и соединения формулы (I-R):
или его фармацевтически приемлемой соли, где способ включает разделение соединения формулы (I):
или его фармацевтически приемлемой соли в виде отдельного стереоизомера, или энантиомера, или их смеси в подходящих условиях с получением соединения формулы (I-S), или его фармацевтически приемлемой соли, и соединения формулы (I-R), или его фармацевтически приемлемой соли.
В другом аспекте настоящее изобретение касается способа получения соединения формулы (II):
или его фармацевтически приемлемой соли в виде отдельного стереоизомера, или энантиомера, или их смеси;
где способ включает обработку соединения формулы (15):
или его фармацевтически приемлемой соли соединением формулы (16):
или его фармацевтически приемлемой солью в подходящих условиях с получением соединения формулы (II) или его фармацевтически приемлемой соли в виде отдельного стереоизомера, или энантиомера, или их смеси.
В другом аспекте настоящее изобретение касается способа получения соединения формулы (II-S):
или его фармацевтически приемлемой соли и соединения формулы (II-R):
или его фармацевтически приемлемой соли, где способ включает разделение соединения формулы (II):
или его фармацевтически приемлемой соли в виде отдельного стереоизомера, или энантиомера, или их смеси в подходящих условиях с получением соединения формулы (II-S) или его фармацевтически приемлемой соли и соединения формулы (II-R) или его фармацевтически приемлемой соли.
Подробное описание изобретения
Определения
Как использовано в описании и приложенных пунктах, если не указано иное, следующие термины имеют приведенные значения:
"Амино" означает заместитель -NH2.
"Циано" означает заместитель -CN.
"Гидроксил" означает заместитель -OH.
"Имино" означает заместитель =NH.
"Нитро" означает заместитель -NO2.
"Оксо" означает заместитель =O.
"Трифторметил" означает заместитель -CF3.
"Аналгезия" означает отсутствие боли в ответ на стимул, который обычно должен причинять боль.
"Аллодиния" означает состояние, при котором обычно безвредное ощущение, такое как давление или легкое прикосновение, воспринимается как чрезвычайно болезненное.
Подразумевается, что "устойчивое соединение" и "устойчивая структура" означают соединение, являющееся достаточно прочным для того, чтобы выдерживать выделение до полезной степени чистоты из реакционной смеси и включение в состав эффективного терапевтического средства.
"Млекопитающее" включает людей и как домашних животных, таких как лабораторные животные и домашние животные (например, кошки, собаки, свинья, рогатый скот, овцы, козы, лошади и кролики), так и недомашних животных, таких как дикие животные и тому подобное.
"Фармацевтически приемлемая соль" включает как кислотно-, так и основно-аддитивные соли.
"Фармацевтически приемлемая кислотно-аддитивная соль" означает те соли, которые сохраняют биологическую эффективность и свойства свободных оснований, которые не являются биологически или иным образом нежелательными и которые образованы неорганическими кислотами, такими как, но не в порядке ограничения, соляная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и тому подобное, и органическими кислотами, такими как, но не в порядке ограничения, уксусная кислота, 2,2-дихлоруксусная кислота, адипиновая кислота, альгиновая кислота, аскорбиновая кислота, аспарагиновая кислота, бензолсульфоновая кислота, бензойная кислота, 4-ацетамидобензойная кислота, камфорная кислота, камфор-10-сульфоновая кислота, каприновая кислота, капроновая кислота, каприловая кислота, угольная кислота, коричная кислота, лимонная кислота, цикламовая кислота, додецилсерная кислота, этан-1,2-дисульфоновая кислота, этансульфоновая кислота, 2-гидроксиэтансульфоновая кислота, муравьиная кислота, фумаровая кислота, галактаровая кислота, гентизиновая кислота, глюкогептоновая кислота, глюконовая кислота, глюкуроновая кислота, глутаминовая кислота, глутаровая кислота, 2-оксоглутаровая кислота, глицерофосфорная кислота, гликолевая кислота, гиппуровая кислота, изомасляная кислота, молочная кислота, лактобионовая кислота, лауриновая кислота, малеиновая кислота, яблочная кислота, малоновая кислота, миндальная кислота, метансульфоновая кислота, слизевая кислота, нафталин-1,5-дисульфоновая кислота, нафталин-2-сульфоновая кислота, 1-гидрокси-2-нафтойная кислота, никотиновая кислота, олеиновая кислота, оротовая кислота, щавелевая кислота, пальмитиновая кислота, памовая кислота, пропионовая кислота, пироглутаминовая кислота, пировиноградная кислота, салициловая кислота, 4-аминосалициловая кислота, себациновая кислота, стеариновая кислота, янтарная кислота, винная кислота, тиоциановая кислота, п-толуолсульфоновая кислота, трифторуксусная кислота, ундециленовая кислота и тому подобное.
"Фармацевтически приемлемая основно-аддитивная соль" означает те соли, которые сохраняют биологическую эффективность и свойства свободных кислот, которые не являются биологически или иным образом нежелательными. Такие соли получают добавлением неорганического основания или органического основания к свободной кислоте. Соли, образованные неорганическими основаниями, включают, но не в порядке ограничения, соли натрия, калия, лития, аммония, кальция, магния, железа, цинка, меди, марганца, алюминия и тому подобное. Предпочтительными неорганическими солями являются соли аммония, натрия, калия, кальция и магния. Соли, образованные органическими основаниями, включают, но не в порядке ограничения, соли первичных, вторичных и третичных аминов, замещенных аминов, включая замещенные амины природного происхождения, циклических аминов и основных ионообменных смол, таких как аммиак, изопропиламин, триметиламин, диэтиламин, триэтиламин, трипропиламин, диэтаноламин, этаноламин, деанол, 2-диметиламиноэтанол, 2-диэтиламиноэтанол, дициклогексиламин, лизин, аргинин, гистидин, кофеин, прокаин, гидрабамин, холин, бетаин, бенетамин, бензатин, этилендиамин, глюкозамин, метилглюкамин, теобромин, триэтаноламин, трометамин, пурины, пиперазин, пиперидин, N-этилпиперидин, полиаминовые смолы и тому подобное. В особенности предпочтительными органическими основаниями являются изопропиламин, диэтиламин, этаноламин, триметиламин, дициклогексиламин, холин и кофеин.
"Лечение" или "терапия", как использовано здесь, охватывает лечение рассматриваемого заболевания или состояния у млекопитающего, преимущественно человека, с соответствующим заболеванием или состоянием, и включает:
(i) предупреждение развития заболевания или состояния у млекопитающего, в частности, когда указанное млекопитающее предрасположено к состоянию, которое еще не диагностировано;
(ii) ингибирование заболевания или состояния, т.е. купирование развития;
(iii) облегчение заболевания или состояния, т.е. обеспечение регрессии заболевания или состояния, или
(iv) ослабление симптомов, обусловленных заболеванием или состоянием, т.е. обезболивание без устранения основного заболевания или состояния.
Как использовано здесь, термины "заболевание" и "состояние" могут быть использованы взаимозаменяемо или могут отличаться тем, что конкретное заболевание или состояние может не иметь известного возбудителя (следовательно, этиология еще не выяснена) и поэтому пока расценивается не как заболевание, а лишь как нежелательное состояние или синдром, для которого некоторое количество специфических симптомокомплексов установлено клиницистами.
Полученные согласно данному описанию соединения могут содержать один или несколько асимметрических центров и могут, таким образом, приводить к энантиомерам, которые могут быть определены, с точки зрения абсолютной стереохимии, как (R)-, или (S)-, или как (D)-, или (L)- для аминокислот. Подразумевается, что настоящее изобретение включает все возможные такие энантиомеры, равно как рацемические и оптически чистые формы указанных энантиомеров. Оптически активные (+) и (-), (R)- и (S)- или (D)- и (L)-изомеры могут быть получены использованием хиральных синтонов или хиральных реагентов, либо разделением с использованием общепринятых методов, например хроматографии и фракционированной кристаллизации, либо описанными здесь методами. Обычные методы получения/выделения отдельных энантиомеров включают хиральный синтез из подходящего, оптически чистого, предшественника или разделение рацемата (или рацемата соли или производного) с использованием, например, хиральной высокоэффективной жидкостной хроматографии (ВЭЖХ).
"Стереоизомер" означает соединение, состоящее из одних и тех же атомов, соединенных теми же самыми связями, но имеющее различные трехмерные структуры, которые не являются взаимозаменяемыми. Настоящее изобретение рассматривает различные стереоизомеры и смеси таких стереоизомеров и включает "энантиомеры", что относится к двум стереоизомерам, молекулы которых являются несовместимыми при наложении зеркальными отображениями друг друга.
Используемые здесь химические названия в схемах синтеза и структурных формулах являются модифицированной формой номенклатурной системы ИЮПАК, использующей программу ACD/Name Version 9.07, в соответствии с которой соединения по изобретению названы как производные от структуры центрального ядра, т.е. структуры 2-оксиндола. В случае сложных химических названий, используемых здесь, группу заместителя называют перед группой, с которой связан заместитель. Например, циклопропилэтил включает основную этильную цепь с заместителем циклопропилом. В химических структурных формулах указаны все связи, за исключением некоторых углеродных атомов, которые, как подразумевается, связаны с достаточным количеством водородных атомов для заполнения валентности.
Так, например, соединение формулы (I):
носит название 1'-{[5-(трифторметил)-2-фурил]метил}спиро[фуро[2,3-f][1,3]бензодиоксол-7,3'-индол]-2'(1'H)-он.
Варианты осуществления изобретения
Из числа различных аспектов изобретения, изложенных выше в кратком описании изобретения, некоторые варианты осуществления описанных здесь способов являются предпочтительными.
Для способа получения соединения формулы (I), изложенного выше в кратком описании изобретения, или его фармацевтически приемлемой соли в виде отдельного стереоизомера или энантиомера или их смеси один вариант осуществления представляет собой способ, дополнительно включающий получение соединения формулы (8) или его фармацевтически приемлемой соли, по которому соединение формулы (7):
или его фармацевтически приемлемую соль обрабатывают основанием в подходящих условиях с образованием соединения формулы (8) или его фармацевтически приемлемой соли.
Для данного варианта осуществления дополнительный вариант осуществления представляет собой способ, включающий получение соединения формулы (7) или его фармацевтически приемлемой соли, по которому соединение формулы (6):
или его фармацевтически приемлемую соль обрабатывают в стандартных условиях реакции Мицунобу с образованием соединения формулы (5) или его фармацевтически приемлемой соли.
Для данного варианта осуществления еще один вариант осуществления представляет собой способ, дополнительно включающий получение соединения формулы (6) или его фармацевтически приемлемой соли, по которому соединение формулы (5):
или его фармацевтически приемлемую соль обрабатывают альдегидом в подходящих условиях с образованием соединения формулы (6) или его фармацевтически приемлемой соли.
Для данного варианта осуществления еще один вариант осуществления представляет собой способ, дополнительно включающий получение соединения формулы (5) или его фармацевтически приемлемой соли, по которому соединение формулы (4):
или его фармацевтически приемлемую соль обрабатывают в подходящих условиях с образованием соединения формулы (5) или его фармацевтически приемлемой соли.
Для данного варианта осуществления еще один вариант осуществления представляет собой способ, дополнительно включающий получение соединения формулы (4) или его фармацевтически приемлемой соли, по которому соединение формулы (2):
или его фармацевтически приемлемую соль обрабатывают реактивом Гриньяра формулы (3):
в подходящих условиях с образованием промежуточного продукта и промежуточный продукт затем подвергают взаимодействию с соединением формулы (1):
или его фармацевтически приемлемой солью в подходящих условиях с образованием соединения формулы (4) или его фармацевтически приемлемой соли.
Для способа получения соединения формулы (II), изложенного выше в кратком описании изобретения, или его фармацевтически приемлемой соли в виде отдельного стереоизомера, или энантиомера, или их смеси один вариант осуществления представляет собой способ, дополнительно включающий получение соединения формулы (15) или его фармацевтически приемлемой соли, по которому соединение формулы (14):
или его фармацевтически приемлемую соль обрабатывают алкилирующим агентом в подходящих условиях с образованием соединения формулы (15) или его фармацевтически приемлемой соли.
Для данного варианта осуществления еще один вариант осуществления представляет собой способ, дополнительно включающий получение соединения формулы (14) или его фармацевтически приемлемой соли, по которому соединение формулы (13):
или его фармацевтически приемлемую соль обрабатывают в подходящих условиях с образованием соединения формулы (14) или его фармацевтически приемлемой соли.
Для данного варианта осуществления еще один вариант осуществления представляет собой способ, дополнительно включающий получение соединения формулы (13) или фармацевтически приемлемой соли, по которому соединение формулы (12):
обрабатывают реактивом Гриньяра формулы (3):
в подходящих условиях с образованием промежуточного продукта и затем промежуточный продукт подвергают взаимодействию с соединением формулы (1):
или его фармацевтически приемлемой солью в подходящих условиях с образованием соединения формулы (13) или его фармацевтически приемлемой соли.
Для данного варианта осуществления еще один вариант осуществления представляет собой способ, дополнительно включающий получение соединения формулы (12) или его фармацевтически приемлемой соли, по которому соединение формулы (11):
обрабатывают окисляющим агентом в подходящих условиях с образованием соединения формулы (12) или его фармацевтически приемлемой соли.
Для данного варианта осуществления еще один вариант осуществления представляет собой способ, дополнительно включающий получение соединения формулы (11), по которому соединение формулы (10):
обрабатывают алкилирующим реагентом в подходящих условиях с образованием соединения формулы (11).
Конкретные варианты осуществления способов по изобретению, включающие подходящие условия для каждой из вышеуказанных стадий, описаны более подробно ниже в разделе способы по изобретению.
Способы по изобретению
Способы по изобретению касаются способов получения соединений формул (I) и (II) и соединений формул (I-S), (I-R), (II-S) и/или (II-R), как описано здесь, или их фармацевтически приемлемых солей.
В большинстве случаев исходные компоненты могут быть получены из таких источников, как Sigma Aldrich, Lancaster Synthesis, Inc., Maybridge, Matrix Scientific, TCI и Fluorochem USA, и проч., или синтезированы согласно известным специалистам в данной области источникам (см., например, Smith, M.B. and J. March, Advanced Organic Chemistry: Reactions, Mechanisms, and Structure, 5th edition (Wiley, December 2000)), или получены, как описано здесь, либо способами, описанными в опубликованной патентной заявке PCT № WO 2006/110917, описанными в опубликованной патентной заявке PCT № WO 2010/45251 и патентной заявке PCT № PCT/US2010/040187.
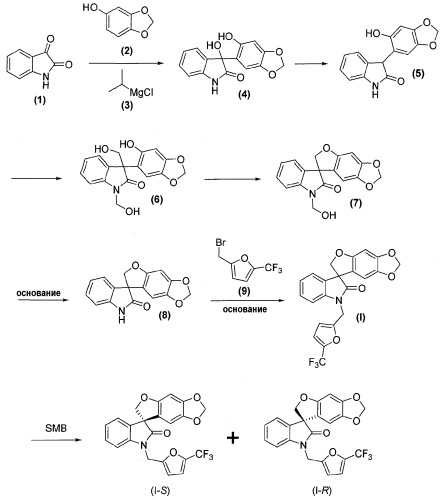
Получение соединений формул (I), (I-S) и (I-R)
Соединения формул (I), (I-S) и (I-R) получают, как представлено ниже реакционной схемой 1:
Реакционная схема 1
Соединения формулы (1), формулы (2), формулы (3) и формулы (9) являются коммерчески доступными, либо могут быть получены способами, известными специалистам в данной области.
Как правило, соединения формул (I), (I-S) и (I-R) получают способом, описанным выше реакционной схемой 1, первоначально взаимодействием соединения формулы (2) с подходящим реактивом Гриньяра (таким как реактив Гриньяра формулы (3)) в подходящих условиях, таких как при температуре в диапазоне примерно от -25°C до 25°C, предпочтительно примерно при 0°C, что обеспечивает образование магнийгалогенидного промежуточного продукта. Полученный промежуточный продукт подвергают реакции нуклеофильного присоединения с кетокарбонильной группой изатинового соединения формулы (1) в подходящих условиях, таких как в растворителе, предпочтительно, но не в порядке ограничения, тетрагидрофуране или дихлорметане, с получением оксиндольного соединения формулы (4).
Удаление гидроксильной группы в C-3-положении оксиндольного цикла соединения формулы (4) достигается обработкой соединения формулы (4) в подходящих условиях, таких как обработка силановым реагентом, таким как триэтилсилан, в присутствии кислоты, такой как, но не в порядке ограничения, трифторуксусная кислота, с получением соединения формулы (5). Удаление гидроксильной группы может также быть достигнуто обработкой соединения формулы (4) в подходящих условиях, таких как обработка SOCl2/NEt3, с последующим восстановлением полученного промежуточного соединения Zn-пылью, с получением соединения формулы (5). Альтернативно, удаление может быть достигнуто обработкой соединения формулы (4) йодистоводородной кислотой, что дает соединение формулы (5).
Затем соединение формулы (5) обрабатывают в подходящих условиях, таких как обработка основанием, предпочтительно, но не в порядке ограничения, таким как диизопропиламин, диизопропилэтиламин, диизопропиламид лития, гидроксид лития или гидроксид натрия, с последующим осуществлением взаимодействия с формальдегидом или параформальдегидом, получая гидроксиметильное промежуточное соединение формулы (6).
Внутримолекулярная циклизация соединения формулы (6), приводящая к соединению формулы (7), достигается обработкой соединения формулы (6) в стандартных условиях реакции Мицунобу, таких как использование фосфинового реагента, предпочтительно, но не в порядке ограничения, трифенилфосфина или трибутилфосфина, и азо-реагента, предпочтительно, но не в порядке ограничения, такого как диэтилазодикарбоксилат, диизопропилазодикарбоксилат, ди-трет-бутилазодикарбоксилат или тетраметилдиазендикарбоксамид, в растворителе, предпочтительно, но не в порядке ограничения, таком как тетрагидрофуран, дихлорметан или этилацетат. Полученное соединение формулы (7) может быть выделено из реакционной смеси стандартными методами выделения или использовано непосредственно на следующей стадии без выделения из реакционной смеси.
Альтернативно, внутримолекулярная циклизация достигается обработкой соединения формулы (6) подходящим бис-электрофилом, таким как, но не в порядке ограничения, хлорйодметан, в присутствии основания, такого как, но не в порядке ограничения, карбонат цезия, в подходящем растворителе, таком как, но не в порядке ограничения, N,N-диметилформамид или метилэтилкетон, с получением соединения формулы (8).
Удаление гидроксиметильной группы от азота соединения формулы (7) достигается обработкой соединения формулы (7) основанием, предпочтительно, но не в порядке ограничения, таким как гидроксид натрия, гидроксид лития или гидроксид аммония, в подходящих условиях с получением соединения формулы (8), которое может быть выделено из реакционной смеси стандартными методами выделения.
Затем соединение формулы (8) подвергают взаимодействию с электрофилом формулы (9) в подходящих условиях, таких как в присутствии основания, предпочтительно, но не в порядке ограничения, такого как гидрид натрия, карбонат цезия или гидроксид натрия, в растворителе, предпочтительно, но не в порядке ограничения, таком как N,N-диметилформамид, ацетонитрил, тетрагидрофуран или ацетон, получая соединение формулы (I), которое может быть выделено из реакционной смеси стандартными методами выделения.
Соединение формулы (I) может быть разделено на (S)-энантиомер (т.е. соединение формулы (I-S)) и соответствующий (R)-энантиомер (т.е. соединение формулы (I-R)) в подходящих условиях, например, хиральным хроматографическим разделением, таким как, но не в порядке ограничения, хроматография с псевдодвижущимся слоем или хиральная ВЭЖХ.
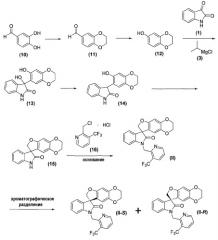
Получение соединений формул (II), (II-S) и (II-R)
Соединения формул (II), (II-S) и (II-R) получают, как представлено ниже реакционной схемой 2:
Реакционная схема 2
Соединения формулы (10), формулы (11), формулы (12), формулы (1), формулы (3) и формулы (16) являются коммерчески доступными либо могут быть получены способами, известными специалистам в данной области.
Как правило, соединения формул (II), (II-S) и (II-R) получают способом, описанным выше реакционной схемой 2, первоначально, нагреванием дигидроксиальдегида формулы (10) с подходящим бис-алкилирующим реагентом, таким как, но не в порядке ограничения, 1,2-дибромэтан, в присутствии основания, такого как, но не в порядке ограничения, карбонат калия, в растворителе, таком как, но не в порядке ограничения, ацетон, с получением соединения формулы (11).
Соединения формулы (12) получают обработкой соединения формулы (11) окисляющим агентом, таким как, но не в порядке ограничения, 3-хлорпероксибензойная кислота, в присутствии основания, такого как, но не в порядке ограничения, бикарбонат натрия, в подходящем растворителе, таком как, но не в порядке ограничения, дихлорметан, с последующей обработкой водой и основанием, таким как, но не в порядке ограничения, гидроксид натрия, с получением соединения формулы (12).
Соединение формулы (12) обрабатывают затем подходящим реактивом Гриньяра, таким как, но не в порядке ограничения, реактив Гриньяра формулы (3), в подходящих условиях, таких как при температуре в диапазоне примерно от -25°C до 25°C, предпочтительно, примерно при 0°C, с образованием фенилоксимагнийгалогенидного промежуточного продукта, который затем подвергают взаимодействию с соединением формулы (1) в подходящих условиях, таких как в полярном непротонном растворителе, предпочтительно, но не в порядке ограничения, дихлорметане или тетрагидрофуране, с получением оксиндольного соединения формулы (13).
Удаление гидроксильной группы в C-3-положении оксиндольного соединения формулы (13) достигается обработкой соединения формулы (13) в подходящих условиях, таких как обработка силановым реагентом, предпочтительно, но не в порядке ограничения, триэтилсиланом, в присутствии кислоты, предпочтительно, но не в порядке ограничения, такой как трифторуксусная кислота, с получением соединения формулы (14). Удаление гидроксильной группы в C-3-положении оксиндольного соединения формулы (13) может также быть достигнуто первоначальной обработкой соединения формулы (13) SOCl2/NEt3, затем восстановлением полученного промежуточного соединения Zn-пылью с получением соединения формулы (14). Альтернативно, удаление может быть достигнуто обработкой соединения формулы (13) йодистоводородной кислотой с получением соединения формулы (14).
Внутримолекулярная циклизация достигается обработкой соединения формулы (14) бис-алкилирующим агентом, предпочтительно, но не в порядке ограничения, хлорйодметаном, в подходящих условиях, таких как в присутствии основания, предпочтительно, но не в порядке ограничения, карбоната цезия, с получением соединения формулы (15), которое выделяют из реакционной смеси стандартными методами выделения.
Соединение формулы (15) затем подвергают взаимодействию с электрофилом формулы (16) в подходящих условиях, таких как в присутствии основания, предпочтительно, но не в порядке ограничения, такого как гидрид натрия, карбонат цезия или гидроксид натрия, в растворителе, предпочтительно, но не в порядке ограничения, таком как N,N-диметилформамид, ацетонитрил, тетрагидрофуран, 1,4-диоксан или ацетон, с получением соединения формулы (II), которое может быть выделено из реакционной смеси стандартными методами выделения.
Соединение формулы (II) может быть хроматографически разделено на (S)-энантиомер (т.е. соединение формулы (II-S)) и соответствующий (R)-энантиомер (т.е. соединение формулы (II-R)) хроматографией с псевдодвижущимся слоем, с применением подходящей хиральной неподвижной фазы, такой как, но не в порядке ограничения, ChiralPAK®-IC, и подходящей подвижной фазы, такой как, но не в порядке ограничения, смесь дихлорметан/ацетон.
Все вышеописанные соединения, которые на момент получения могут существовать в виде свободной основной или кислотной формы, могут быть превращены в соответствующие фармацевтически приемлемые соли путем обработки подходящим неорганическим или органическим основанием или подходящей неорганической или органической кислотой. Соли полученных выше соединений могут быть превращены в свободную основную или кислотную форму стандартными способами. Понятно, что все полиморфы, аморфные формы, ангидраты, гидраты, сольваты и соли соединений формул (I) и (II) рассматриваются, как охватываемые рамками объема изобретения. Кроме того, все соединения формул (I) и (II), которые содержат кислотную или сложноэфирную группу, могут быть превращены в соответствующий сложный эфир или кислоту соответственно способами, известными специалисту в данной области, или описанными здесь способами.
Следующие конкретные подготовительные синтезы (получение исходных веществ и промежуточных соединений) и синтетические примеры (получение соединения формулы (I) и формулы (II) способами по изобретению) представляют собой руководство, способствующее практическому воплощению изобретения, и не рассматриваются как ограничивающие рамки объема изобретения. Когда один или несколько спектров ЯМР приведены для конкретного соединения, каждый ЯМР-спектр может представлять отдельный стереоизомер, нерацемическую смесь стереоизомеров или рацемическую смесь стереоизомеров соединения.
Подготовительный синтез 1
Синтез 3-гидрокси-3-(6-гидрокси-1,3-бензодиоксол-5-ил)-1,3-дигидро-2H-индола
Соединение формулы (4)
В реактор на 630 л загружают сезамол (42,6 кг, 299 моль). Добавляют тетрагидрофуран (400 кг) и полученный раствор охлаждают до 1°C за 42 минуты. Изопропилмагнийхлорид (2 М раствор в тетрагидрофуране, 173 кг, 337 моль) добавляют за 2 ч так, чтобы внутренняя температура поддерживалась в диапазоне от 0 до 4°C. После завершения добавления внутреннюю температуру снижают до -5°C и добавляют четырьмя порциями изатин (37,9 кг, 250 моль). Реакционную смесь перемешивают 2,75 ч при 1-3°C. В реактор на 1000 л загружают хлорид аммония (72 кг) с последующим добавлением деионизованной воды (356 кг). Смесь перемешивают при 15°C до полного растворения твердого вещества и полученный раствор охлаждают до 1°C за 1 ч. Содержимое реактора на 630 л переносят в реактор на 1000 л за 1 ч так, чтобы внутренняя температура оставалась в диапазоне 3-4°C. Реактор на 630 л промывают толуолом (133 кг) и промывочный раствор вносят в реактор на 1000 л. Содержимому реактора на 1000 л дают нагреться до 20-25°C за период 29 минут и перемешивают еще 15 минут. Перемешивание прекращают и содержимое реактора выдерживают при 25°C в течение 15 минут, давая фазам разделиться. Водную фазу удаляют и добавляют раствор хлорида натрия (42 кг) в деионизованной воде (218 кг) за 25 минут при внутренней температуре 22-24°C. Перемешивание прекращают и смесь выдерживают при 25°C в течение 1 ч, давая фазам разделиться. Органическую фазу дегазируют в течение 0,5 ч азотом и добавляют толуол (89 кг). В реакторе создают вакуум в 300 мбар и внутреннюю температуру реактора выводят на 50-60°C. Летучие компоненты смеси удаляют перегонкой за период 12 ч, собирая при этом 670 л дистиллята. Внешнюю температуру реактора устанавливают на 20-25°C. При охлаждении выпадает оранжевый осадок. Добавляют толуол (114 кг) и суспензию перемешивают 10 минут. Твердое вещество собирают фильтрованием, промывают трет-бутилметиловым эфиром (171 кг) и гептаном (85 кг) и сушат при 55-60°C, при пониженном давлении от 170 до 4 мбар, за период 10,5 ч, получая 3-гидрокси-3-(6-гидрокси-1,3-бензодиоксол-5-ил)-1,3-дигидро-2H-индол-2-он (73,5 кг, количественный выход) в виде бледно-розового твердого вещества: чистота (ВЭЖХ-УФ при 300 нм) 99,3% a/a; 1Н ЯМР (300 МГц, ДМСО-d6) δ 10,18 (c, 1H), 9,08 (c, 1H), 7,21-7,07 (м, 2H), 6,88-6,74 (м, 3H), 6,38 (ушир.c, 1H), 6,23 (c, 1H), 5,92 (c, 2H); 13C ЯМР (75 МГц, ДМСО-d6) δ 178,4, 148,4, 146,6, 143,0, 139,4, 133,2, 128,6, 123,8, 121,1, 120,1, 109,0, 106,8, 100,8, 97,4, 75,1.
Подготовительный синтез 2
Синтез 3-(6-гидрокси-1,3-бензодиоксол-5-ил)-1,3-дигидро-2H-индол-2-она
Соединение формулы (5)
В реактор на 1600 л загружают 3-гидрокси-3-(6-гидрокси-1,3-бензодиоксол-5-ил)-1,3-дигидро-2H-индол-2-он (113,1 кг, 396 моль), откачивают воздух и заполняют азотом. Добавляют двумя порциями трифторуксусную кислоту (679 кг) за 20 минут и внутреннюю температуру снижают до 10°C за 1 ч. Добавляют триэтилсилан (69,2 кг, 595 моль) за 2 ч 05 мин при 10-11°C и смесь перемешивают дополнительно 0,5 ч при 10-11°C. В реактор на 1000 л загружают гептан (524 кг) и трет-бутилметиловый эфир (63 кг). Содержимое реактора на 1000 л переносят в реактор на 1600 л за 13 мину