Очистка полипептидов
Иллюстрации
Показать всеИзобретение относится к очистке различных гамма-карбоксилированных форм полипептида с использованием ионообменной хроматографии. В частности, согласно изобретению предложен способ очистки полипептида, имеющего желаемое содержание гамма-карбоксиглутаминовой кислоты, из образца, содержащего смесь вариантов указанного полипептида, имеющих различные содержания гамма-карбоксиглутаминовой кислоты, при этом указанный способ включает стадии: (а) загрузки указанного образца на анионообменный хроматографический материал; (b) элюирования указанного полипептида с использованием раствора при рН менее чем 9,0, содержащего по меньшей мере одну соль, выбранную из ацетата аммония, хлорида аммония и ацетата натрия; и (с) отбора фракции, полученной после указанного элюирования, при этом полипептиды в данной фракции имеют желаемое содержание гамма-карбоксиглутаминовых кислот. 7 з.п. ф-лы, 13 ил., 6 табл., 7 пр.
Реферат
Область изобретения
Настоящее изобретение относится к очистке полипептидов. В частности, настоящее изобретение относится к способам, использующим ионообменную хроматографию, посредством которых могут быть очищены разные гамма-карбоксилированные формы полипептидов.
Предшествующий уровень техники
γ-Карбоксиглутаминовая кислота (Gla) является уникальной аминокислотой, которая связывается с кальцием. Она представляет собой модифицированную форму глутаминовой кислоты (Glu) и может быть получена в результате посттрансляционной модификации in vivo глутаматных остатков. Карбоксилирование глутаминовой кислоты таким способом облегчает связывание с кальцием и делает возможным присоединение таких белков, как прокоагулянты и антикоагулянты, к фосфолипидам. Такая ферментативной опосредованная реакция, известная как γ-карбоксилирование (гамма-карбоксилирование), требует присутствия витамина K в качестве кофактора.
Некоторые зрелые белки содержат домен, обогащенный аминокислотами, которые были превращены в γ-карбоксиглутаминовую кислоту таким способом. Он известен как GLA-домен. Этот GLA-домен часто отвечает за высокоаффинное связывание ионов кальция белком. Такой GLA-домен может быть обнаружен у ряда разных белков. Например, факторы свертывания крови VII, IX и Х и протромбин все включают GLA-домен, который содержит много остатков аминокислоты Gla.
Краткое описание изобретения
Авторы настоящего изобретения обнаружили, что существует возможность разделения или очистки различных вариантов полипептида, отличающихся по степени гамма-карбоксилирования или по количеству остатков гамма-карбоксиглутаминовой кислоты, которые они содержат. Изобретение относится к конкретному хроматографическому разделению полипептидных вариантов, имеющих различные содержания гамма-карбоксиглутаминовой кислоты.
Таким образом, согласно изобретению предложен способ очистки полипептида, имеющего желаемое содержание гамма-карбоксиглутаминовой кислоты, из образца, содержащего смесь вариантов указанного полипептида, имеющих различные содержания гамма-карбоксиглутаминовой кислоты, при этом указанный способ включает стадии:
(a) загрузки указанного образца на анионообменный хроматографический материал;
(b) элюирования указанного полипептида с использованием раствора при рН менее чем 9,0, содержащего по меньшей мере одну соль, выбранную из ацетата аммония, хлорида аммония и ацетата натрия;
(c) отбора фракции, полученной после указанного элюирования, при этом полипептиды в данной фракции имеют желаемое содержание гамма-карбоксиглутаминовых кислот.
Предпочтительный вариант такого способа включает следующие стадии:
(а) уравновешивания анионообменного материала буфером при рН менее 9,0;
(b) загрузки указанного образца на анионообменный материал;
(c) возможно промывки анионообменного материала буфером при рН менее 9,0;
(d) элюирования указанного полипептида из анионообменного материала с использованием раствора при рН менее 9,0, содержащего по меньшей мере одну соль, выбранную из ацетата аммония, хлорида аммония и ацетата натрия; и
(e) отбора фракции, полученной после указанного элюирования, при этом полипептиды в данной фракции имеют желаемое содержание гамма-карбоксиглутаминовых кислот.
Подходящие полипептиды для очистки таким способом включают фактор IX, фактор VII, фактор VIIa, фактор X, протромбин, белок-S, белок-С, белок Z, остеокальцин, матриксный gla-белок, продукты 6 генов блокировки роста, пролин-обогащенный Gla-1, пролин-обогащенный Gla-2, пролин-обогащенный Gla-3 и пролин-обогащенный Gla-4. В предпочтительном способе полипептид представляет собой фактор IX, фактор X, фактор VII или фактор VIIa.
Если полипептид представляет собой фактор IX, то данный способ может включать отбор фракции, полученной после указанного элюирования, которая характеризуется увеличением доли форм (1-11)-Gla и/или (1-12)-Gla фактора IX по сравнению с долей форм (1-11)-Gla и/или (1-12)-Gla фактора IX в образце перед его очисткой.
Если полипептид представляет собой фактор Х или фактор VII, то данный способ может включать отбор фракции, полученной после указанного элюирования, которая характеризуется увеличением доли форм (1-10)-Gla и/или (1-11)-Gla фактора Х или фактора VII по сравнению с долей форм (1-10)-Gla и/или (1-11)-Gla фактора Х или VII в образце перед его очисткой.
Если полипептид представляет собой фактор IX, то данный способ может включать отбор фракции, полученной после указанного элюирования, которая характеризуется уменьшением доли формы (1-10)-Gla фактора IX по сравнению с долей формы (1-10)-Gla фактора IX в образце перед его очисткой.
Если полипептид представляет собой фактор Х или фактор VII, то данный способ может включать отбор фракции, полученной после указанного элюирования, которая характеризуется уменьшением доли формы (1-9)-Gla фактора Х или фактора VII по сравнению с долей формы (1-9)-Gla фактора Х или фактора VII в образце перед его очисткой.
В способах по изобретению могут быть применены любое одно или более чем одно из следующего:
- элюирующий буфер может иметь рН от 5,0 до 8,5;
- ацетат аммония, хлорид аммония или ацетат натрия могут присутствовать в элюирующем буфере в концентрации от 0,1 М до 2,0 М, предпочтительно при приблизительно 0,6 М;
- для ионообменной хроматографии может быть использован уравновешивающий буфер при рН от 5,0 до 8,5.
Настоящее изобретение также распространяется на композиции полипептидов, изготовленные способами, изложенными в данном описании, то есть композиции, в которых количество одного или более вариантов полипептида меняется, при этом данные варианты отличаются по степени гамма-карбоксилирования или по количеству остатков гамма-карбоксиглутаминовой кислоты, которые они содержат.
Краткое описание графических материалов
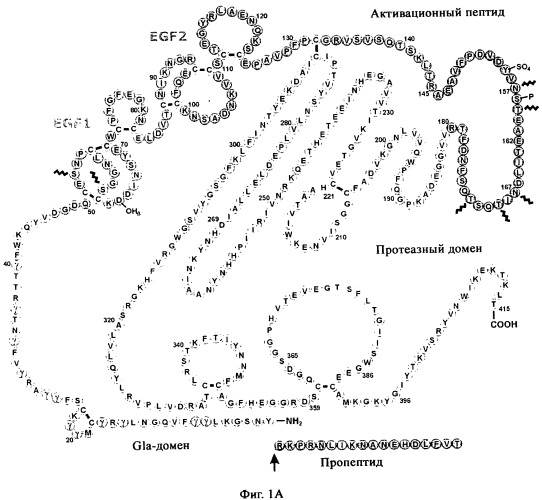
На Фиг.1А показана первичная структура фактора IX человека (hFIX) с идентифицированными субдоменами. GLA-домен соответствует аминокислотам 1-46; домен, подобный EGF1 (эпидермальному фактору роста), соответствует аминокислотам 47-83, домен, подобный EGF2, соответствует аминокислотам 84-124, активационный пептид соответствует аминокислотам 146-180 и протеазный домен соответствует аминокислотам 181-415. 12 аминокислот в GLA-домене, представляющие собой потенциальный объект для гамма-карбоксилирования, указаны меткой "γ" и локализованы в положениях 7, 8, 15, 17, 20, 21, 26, 27, 30, 33, 36 и 40 аминокислот.
На Фиг.1В показано выравнивание части аминокислотных последовательностей полипептидов фактора VII, фактора IX и фактора Х человека. Эти выровненные участки относятся к GLA-домену каждого из этих полипептидов, и локализация остатков Gla указана посредством *.
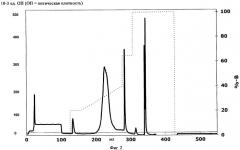
На Фиг.2 показана хроматограмма, полученная в результате анионообменной хроматографии образца rhFIX (рекомбинантного hFIX), как описано в Примере 2.
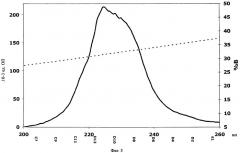
На Фиг.3 показан развернутый участок Фиг.2.
На Фиг.4 показан анализ распределения Gla-содержащих вариантов до и после анионообменного хроматографического разделения соединения из Примера 2. "До" относится к распределению Gla-содержащих вариантов в образце rhFIX, использованном в качестве образца для "нанесения" в Примере 2. Этот образец очищали посредством иммуноаффинной адсорбции с получением образца rhFIX с чистотой более 95%. "После" относится к распределению Gla-содержащих вариантов в пуле фракций C12-D3, полученном в Примере 2.
На Фиг.5 показана хроматограмма, полученная в результате анионообменной хроматографии образца rhFIX, как описано в Примере 3.
На Фиг.6 показан развернутый участок Фиг.5.
На Фиг.7 показана хроматограмма, полученная в результате анионообменной хроматографии образца FVII, как описано в Примере 4.
На Фиг.8 показан развернутый участок Фиг.7.
На Фиг.9 показана хроматограмма, полученная в результате анионообменной хроматографии образца rhFIX, как описано в Примере 5.
На Фиг.10 показан развернутый участок Фиг.9.
На Фиг.11 показана хроматограмма, полученная в результате анионообменной хроматографии образца rhFIX, как описано в Примере 6.
На Фиг.12 показан развернутый участок Фиг.11.
На Фиг.13 показана хроматограмма, полученная в результате анионообменной хроматографии образца FX, как описано в Примере 7.
Подробное описание изобретения
Настоящее изобретение проистекает из таких обнаруженных фактов, что варианты полипептида, имеющие разные уровни гамма-карбоксилирования, могут иметь разные уровни активности и что такие различные варианты могут быть очищены или разделены с использованием ионообменной хроматографии.
Увеличивая долю более активных вариантов полипептида и/или уменьшая долю менее активных или неактивных вариантов полипептида в образце, можно получить в результате очищенную композицию с повышенной удельной активностью.
"Полипептид" используется в данном описании в его самом широком смысле для обозначения соединения, состоящего из двух или более субъединиц - аминокислот, аминокислотных аналогов или других пептидомиметиков. Таким образом, термин "полипептид" включает в себя короткие пептидные последовательности, а также более длинные полипептиды и белки. Как он использован в данном описании, термин "аминокислота" относится или к природным и/или к неприродным либо синтетическим аминокислотам, включая глицин и оба оптических D- или L-изомера, и аминокислотным аналогам, и пептидомиметикам. "Зрелый" белок представляет собой полипептид, который был подвержен посттрансляционному процессингу, как, например, карбоксилированию, гликозилированию или отщеплению пропептидных участков, таких как направляющие последовательности. Таким образом, полипептид по изобретению, который находится в форме зрелого белка, может быть подвергнут гамма-карбоксилированию, и один или более остатков Glu в его транслированной последовательности могут быть преобразованы в Gla.
Способы, изложенные в данном описании, могут быть использованы для очистки любого полипептида, который является или может являться гамма-карбоксилированным.
Полипептид для применения в способах по изобретению может представлять собой полипептид, который содержит один или более остатков гамма-карбоксиглутаминовой кислоты. Такой полипептид может быть идентифицирован посредством изучения аминокислотной последовательности полипептида и определения наличия Gla.
Известны несколько полипептидов, содержащих гамма-карбоксиглутаминовую кислоту. Ряд белков системы свертывания крови и регуляторных белков, включая протромбин, фактор VII (в том числе фактор VIIa), фактор IX, фактор X, белок С и белок S, включают в себя остатки Gla. Эти белки могут содержать 10-12 остатков гамма-карбоксиглутаминовой кислоты в GLA-домене, локализованных в пределах первых 40 остатков N-конца зрелого белка. Белки кости, такие как остеокальцин и матриксный Gla-белок, и другие витамин K-зависимые белки млекопитающих, такие как продукты 6 генов блокировки роста (Gas6), белок Z, пролин-обогащенный Gla-1 (PRGP1), пролин-обогащенный Gla-2 (PRGP2), пролин-обогащенный Gla-3 (PRGP3) и пролин-обогащенный Gla-4 (PRGP4), также содержат несколько остатков Gla. Остатки гамма-карбоксиглутаминовой кислоты также обнаружены в белках, не являющихся белками млекопитающих, таких как конопептиды конантокин G и конантокин Т. Любой из этих полипептидов может быть очищен в соответствии с данным изобретением.
Для применения в способах по изобретению полипептид может представлять собой полипептид, который может быть посттрансляционно модифицирован с включением одного или более остатков гамма-карбоксиглутаминовой кислоты. Например, такие остатки могут быть образованы в результате гамма-карбоксилирования остатков глутаминовой кислоты в полипептиде. Аминокислотная последовательность полипептида может содержать, таким образом, один или более остатков глутаминовой кислоты (Glu). Полипептид, который может быть посттрансляционно модифицирован таким способом, может представлять собой природный полипептид. Такой полипептид может происходить из любого подходящего организма. Например, полипептид может быть природным полипептидом млекопитающих, таким как полипептид грызунов, приматов, кошек, собак, овец, коров, свиней или других млекопитающих. Предпочтительно полипептид представляет собой полипептид мышей, крыс или человека. Наиболее предпочтительно полипептид представляет собой полипептид человека. Полипептид может происходить из видов, не являющихся млекопитающими. Например, некоторые конотоксины могут содержать гамма-карбоксиглутамат. Таким образом, полипептид может представлять собой природный полипептид из моллюска, такого как брюхоногий моллюск. Брюхоногим моллюском может являться улитка, например коническая улитка. Полипептид, который может быть посттрансляционно модифицирован таким способом, может представлять собой вариант природного полипептида, такой как вариант одного из известных гамма-карбоксилированных белков, рассмотренных выше, искусственно созданным полипептидом, таким как синтетический полипептид, или полученным рекомбинантным способом мутантным белком или вариантом белка.
Полипептид может представлять собой полипептид, который имеет GLA-домен. GLA-домен является белковым доменом, который содержит посттрансляционные модификации множественных остатков глутаминовой кислоты (Glu) с образованием гамма-карбоксиглутамата (Gla). Обычно эти остатки Gla располагаются в единственном участке или домене полипептида. Зачастую он локализован на N-конце полипептида или зрелого белка.
Например, на Фиг.1А показана первичная белковая структура фактора IX человека. Этот белок включает GLA-домен с аминокислотами от 1 до 46. Этот домен включает в себя 12 аминокислотных остатков, которые могут быть модифицированы из состояния глутамата до Gla. Они локализованы в положениях 7, 8, 15, 17, 20, 21, 26, 27, 30, 33, 36 и 40. Ввиду этого он способен содержать до 12 остатков Gla включительно. Таким образом, полипептидом для очистки в соответствии с настоящим изобретением может быть фактор IX. На Фиг.1 В показано выравнивание, основанное на сравнении GLA-домена белков человека - фактора VII, IX и X. Положения аминокислотных остатков, которые могут быть модифицированы из состояния глутамата до Gla в каждой последовательности, идентифицированы посредством *. Таким образом, полипептидом для очистки в соответствии с настоящим изобретением может быть фактор VII или фактор X.
Для применения в данном изобретении полипептид может содержать GLA-домен от известного гамма-карбоксилированного белка, как, например, GLA-домен от фактора IX, фактора VII или фактора X, или от любого из других известных гамма-карбоксилированных белков, рассмотренных выше, как, например, от другого фактора свертывания крови.
Для применения в способах по изобретению полипептид может представлять собой полипептид, который содержит или способен содержать один или более остатков гамма-карбоксиглутаминовой кислоты. Например, полипептид может содержать или быть способным содержать 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 или более остатков Gla. Предпочтительно полипептид содержит или способен содержать более 1 остатка Gla, как, например, более 1, более 2, более 5 или более 9 остатков Gla. Полипептид может содержать или быть способным содержать до 10, до 12, до 15 или до 20 остатков Gla включительно. Как дополнительно обсуждается ниже, способы по изобретению позволяют проводить очистку различных молекулярных вариантов данного полипептида, в которых встречаются разные уровни гамма-карбоксилирования. Приведенные в настоящем описании цифры представляют собой общее количество остатков Gla, которые могут присутствовать в таком полипептиде. То есть если полипептид является полностью гамма-карбоксилированным, эти цифры указывают на количество имеющихся остатков Gla. Например, для случая гамма-карбоксилирования в GLA-домене эти цифры относятся к общему количеству возможных сайтов гамма-карбоксилирования в этом GLA-домене, как, например, общему количеству остатков Glu в транслированном полипептиде или максимальному количеству остатков Gla, которые могут быть получены под действием фермента, такого как γ-глутамилкарбоксилаза. Также могут существовать дополнительные варианты одного и того же полипептида, в которых имеется меньшее количество остатков гамма-карбоксиглутаминовой кислоты по сравнению с этим максимальным количеством.
Таким образом, полипептид может содержать множественные остатки Glu в пределах 40 N-концевых остатков своей транслированной аминокислотной последовательности. Например, аминокислотная последовательность экспрессированного полипептида может содержать 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 или более остатков Glu в пределах 40 аминокислот, расположенных близко к N-концу полипептида или в пределах 40 аминокислот, расположенных близко к N-концу зрелого белка.
Гамма-карбоксилирование может быть обеспечено путем использования фермента. Так, известно, что в гамма-карбоксилирование многих полипептидов in vivo вовлечен фермент γ-глутамилкарбоксилаза. γ-Глутамилкарбоксилаза представляет собой эндоплазматический фермент, который катализирует посттрансляционную модификацию Glu в Gla в GLA-домене ряда витамин К-зависимых факторов свертывания крови. Таким образом, для применения в настоящем изобретении полипептиды могут быть идентифицированы путем определения того, являются ли они гамма-карбоксилированными под действием γ-глутамилкарбоксилазы.
Считается, что фермент γ-глутамилкарбоксилаза связывается со своим белковым субстратом путем взаимодействия с последовательностью мотива, расположенного с аминоконцевой стороны глутаматных остатков, подлежащих карбоксилированию. Затем фермент может карбоксилировать множественные глутаматные остатки в этой области, например все глутаматные остатки в GLA-домене, после чего субстрат высвобождается. Таким образом, для применения в настоящем изобретении полипептид может содержать мотив или сайт, который распознается γ-глутамилкарбоксилазой или другим ферментом, способным осуществлять гамма-карбоксилирование. Этот сайт распознавания может быть локализован на N-концевом участке полипептида, например в пределах 18, 19, 20, 21, 22, 23, 24, 25, 30, 35 или 40 аминокислот, расположенных близко к N-концу транслируемого полипептида, или к тому, что будет представлять собой N-конец зрелого белка. Сайт распознавания может быть локализован с аминоконцевой стороны глутаматных остатков, подлежащих карбоксилированию. Например, у многих гамма-карбоксилированных белков природного происхождения фермент γ-глутамилкарбоксилаза распознает сайт в относящемся к пропептиду участке и связывается с ним. Затем этот участок отщепляется от остальной части полипептида в ходе посттрансляционного процессинга. Таким образом, сайт распознавания гамма-карбоксилазой у зрелого белка может отсутствовать.
В протромбине и факторе IX сайт, вовлеченный в распознавание ферментом γ-глутамилкарбоксилазой, определяется остатками -18, -17, -16, -15 и -10. Аналогичный сайт распознавания обнаружен у других гамма-карбоксилированных белков. Фенилаланин в положении -16 и аланин в положении -10 являются крайне консервативными среди пропептидов субстратов карбоксилазы, как и алифатические остатки, такие как изолейцин, лейцин и валин в положениях -17 и -15. Лейцин, валин или лизин в положении -16 также могут способствовать карбоксилированию. Для применения в данном изобретении полипептид может содержать сайт распознавания для гамма-карбоксилирования от известного гамма-карбоксилированного белка, такой как сайт распознавания для гамма-карбоксилирования от фактора IX, фактора X, фактора VII или любого из других известных гамма-карбоксилированных белков, рассмотренных выше. Например, пропептидный участок от любого такого белка, который содержит сайт распознавания для гамма-карбоксилирования, может присутствовать на N-конце транслируемого полипептида для обеспечения подходящего посттрансляционного процессинга полипептида под действием у-глутамилкарбоксилазы.
Полипептид, способный подвергаться гамма-карбоксилированию, предпочтительно удовлетворяет одному или двум следующим критериям:
(1) полипептид содержит сайт распознавания для гамма-карбоксилирования, и
(2) среди 40 остатков сайта распознавания для гамма-карбоксилирования имеются остатки глутаминовой кислоты.
Считается, что фермент γ-глутамилкарбоксилаза проявляет активность в шероховатом эндоплазматическом ретикулуме. Что касается полипептида, который будет подвержен гамма-карбоксилированию под действием этого фермента, то такой полипептид предпочтительно должен проходить через шероховатый эндоплазматический ретикулум клетки, экспрессирующей фермент γ-глутамилкарбоксилазу. Поэтому данный полипептид может содержать последовательности, создающие возможность перемещению вновь синтезированного полипептида через шероховатый эндоплазматический ретикулум. Сигнальные последовательности, обладающие способностью направлять полипептид к эндоплазматическому ретикулуму, хорошо известны. Такие сигнальные последовательности часто обнаруживают на аминоконце полипептида, длина их может составлять 16-30 аминокислот, и они могут содержать от 4 до 12 гидрофобных остатков. Такие сигнальные пептиды обычно отщепляются от молекулы полипептида под действием сигнальной пептидазы и поэтому не присутствуют в зрелом белке.
Чтобы осуществилось гамма-карбоксилирование полипептида, этот полипептид предпочтительно должен экспрессироваться в клетке. Для применения в данном изобретении полипептид может быть синтезирован путем экспрессии в такой клетке. Предпочтительно, чтобы клетка, в которой экспрессируется полипептид, включала необходимый клеточный аппарат, обеспечивающий гамма-карбоксилирование полипептида. Например, клетка может экспрессировать γ-глутамилкарбоксилазу. Предпочтительно, чтобы клетка, в которой синтезируется данный белок, имела фермент гамма-карбоксилазу, ассоциированную с шероховатым эндоплазматическим ретикулумом. Клетку можно культивировать в присутствии кофакторов фермента, таких как витамин К. Предпочтительно клетка, в которой синтезируется белок, содержит внутриклеточный витамин К.
Полипептиды, которые способны подвергаться гамма-карбоксилированию, можно идентифицировать, проводя их экспрессию в такой клетке и определяя, осуществляется ли гамма-карбоксилирование. Например, полипептид может быть экспрессирован в клетке, как изложено в данном описании, и может быть направлен к шероховатому эндоплазматическому ретикулуму такой клетки, например, посредством использования сигнального пептида, как описано выше. Осуществляя экспрессию полипептида в такой клетке и определяя, содержит ли экспрессированный и подвергнутый посттрансляционному процессингу полипептид остатки Gla, можно идентифицировать полипептид, способный быть гамма-карбоксилированным.
Способы по изобретению включают очистку одного или более вариантов полипептида от других вариантов такого полипептида, имеющего другие степени гамма-карбоксилирования. Если полипептид может быть подвержен гамма-карбоксилированию более чем в одном сайте, то могут встречаться различные варианты этого полипептида, в которых присутствуют разные количества гамма-карбоксиглутаматных аминокислотных остатков или в которых присутствуют гамма-карбоксиглутаматные остатки во всевозможных местах расположения в молекуле данного полипептида.
Например, некоторые варианты полипептида могут быть полностью гамма-карбоксилированными. То есть в результате гамма-карбоксилирования может быть осуществлено превращение глутамата в гамма-карбоксиглутамат во всех остатках в полипептиде, где это возможно, например во всех остатках Glu в GLA-домене. Другие варианты полипептида могут быть частично гамма-карбоксилированными. То есть в результате гамма-карбоксилирования может быть осуществлено превращение глутамата в гамма-карбоксиглутамат в некоторых, но не во всех остатках в полипептиде, где это возможно, как, например, в некоторых, но не во всех остатках Glu в GLA-домене.
Можно идентифицировать целый ряд различных частично гамма-декарбоксилированных вариантов. Их можно классифицировать разными способами. Например, уровень гамма-декарбоксилирования можно определить по тем остаткам в полипептиде, которые являются гамма-декарбоксилированными, или можно определить по общему количеству гамма-карбоксиглутаматных аминокислотных остатков, присутствующих в полипептиде. Последняя классификация может означать, что количество структурно различных молекулярных вариантов полипептида учитываются совместно исходя из общего количества остатков гамма-карбоксиглутаминовой кислоты, которые они содержат. Например, вариант полипептида, в котором присутствуют все кроме одного из возможных гамма-карбоксиглутаматных остатков, может содержать много разных подвариантов полипептида, в которых глутамат располагается в разных положениях, которые могли быть подвержены гамма-карбоксилированию.
Обусловленное механизмом действия γ-глутамилкарбоксилазы гамма-карбоксилирование обычно начинается в остатке Glu, расположенном ближе всего к сайту распознавания для гамма-карбоксилирования, и продвигается далее от N-конца полипептида. В том случае, когда полипептид не является полностью гамма-карбоксилированным, причина обычно состоит в том, что гамма-карбоксилирование приостанавливается или фермент отделяется от полипептида до того, как наиболее удаленные остатки Glu будут преобразованы. Обычно это относится к остаткам Glu, наиболее удаленным от сайтов связывания для осуществления гамма-карбоксилирования или наиболее удаленным от N-конца белка, которые не являются гамма-карбоксилированными в частично гамма-карбоксилированном полипептиде.
Например, как показано на Фиг.1, фактор IX человека включает в себя до 12 гамма-карбоксиглутаматных остатков включительно. Реальное количество присутствующих остатков Gla будет варьировать в разных полипептидных молекулах в зависимости от степени посттрансляционной модификации в результате гамма-карбоксилирования, которому данная молекула была подвержена. Это значит, что образец фактора IX человека может содержать варианты фактора IX, которые являются полностью гамма-декарбоксилированными, то есть которые имеют все 12 возможных гамма-карбоксиглутаматных остатков ((1-12)Gla).
Образец также может содержать один или более вариантов фактора IX, имеющих 11 из 12 возможных гамма-карбоксиглутаматных остатков. Для них наиболее вероятной является ситуация, когда 11 остатков Glu, расположенных близко к N-концу полипептида, преобразуются в Gla, а 12-й остаток Glu в положении 40, как показано на Фиг.1, остается в виде Glu. Таким образом, в этой ситуации только остатки Glu от 1 до 11 преобразованы в Gla ((1-11)Gla).
Образец также может содержать один или более вариантов фактора IX, имеющего 10 из 12 возможных гамма-карбоксиглутаматных остатков. Для них наиболее вероятной является ситуация, когда 10 остатков Glu, расположенных близко к N-концу полипептида, преобразуются в Gla, а 11-й и 12-й остатки Glu в положениях 36 и 40, как показано на Фиг.1, остаются в виде Glu. Таким образом, в этой ситуации только остатки Glu от 1 до 10 преобразованы в Gla ((1-10)Gla).
Образец также может содержать один или более вариантов фактора IX, имеющего 9 из 12 возможных гамма-карбоксиглутаматных остатков, как, например, (1-9)Gla. Образец также может содержать один или более вариантов фактора IX, имеющего менее 9, как, например, 8, 7, 6, 5, 4, 3, 2, 1, или не имеющего ни одного из 12 возможных гамма-карбоксиглутаматных остатков.
Согласно настоящему изобретению предложены способы очистки такого варианта полипептида. В частности, вариант полипептида можно очистить от других вариантов этого полипептида в образце. Таким образом, способ по изобретению может приводить к увеличению относительной доли представляющего интерес варианта в образце полипептида. Этого можно достичь путем удаления одного или более чем одного другого варианта полипептида из образца и, таким образом, увеличения в целом доли полипептида, образованного из представляющего интерес варианта. Этого можно достичь в результате специального удаления из образца одного или более чем одного конкретного варианта путем удаления из образца одного или более вариантов, не являющихся вариантами, представляющими интерес, или путем удаления фракции образца, в которой доля представляющего интерес варианта ниже, чем в исходном образце. Любой из этих подходов может приводить к увеличению в целом доли варианта, представляющего интерес. Таким образом, способы по изобретению могут приводить к увеличению или уменьшению доли конкретного варианта полипептида в образце, содержащем смесь различных вариантов этого полипептида.
Увеличение доли полипептидного варианта может быть равно увеличению доли этого варианта в образце полипептида в целом на величину до 5%, до 10%, до 20%, до 30% или более. Уменьшение доли полипептидного варианта может быть равно уменьшению доли этого варианта в образце полипептида в целом на величину до 5%, до 10%, до 20%, до 30%, до 50%, до 70%, до 90% или более. Уменьшение доли полипептидного варианта может быть равно уменьшению на величину до 5%, до 10%, до 20%, до 30%, до 50%, до 70%, до 90% или более количества этого варианта, которое присутствует, по сравнению с количеством, присутствующим в исходном образце. Уменьшение доли полипептидного варианта может быть полным или представлять собой существенное уменьшение этого варианта в образце. Например, с использованием способа по изобретению можно очистить образец полипептида путем удаления из образца всего или по существу всего детектируемого полипептида конкретного варианта. Количество такого варианта, остающегося в образце, может составлять менее 10%, менее 5%, менее 2% или менее 1% от количества, присутствующего в исходном образце.
Таким образом, задачей способов по изобретению является обеспечение возможности изменения относительных долей различных вариантов в образце полипептида. Различные варианты могут иметь разные свойства или разные активности. Изменяя количество или долю таких вариантов в образце полипептида, можно изменять свойства или активность образца в целом. Например, в том случае, когда различные варианты полипептида имеют разные уровни активности, путем изменения долей различных вариантов с целью увеличения доли вариантов, имеющих более высокие уровни активности, и/или путем уменьшения доли вариантов, имеющих более низкую активность или не имеющих никакой активности, можно увеличить удельную активность образца, например среднюю активность на одну молекулу полипептида или процент максимально возможной активности для этого количества полипептида.
Например, обнаружено, что полученный рекомбинантным способом фактор IX человека (rhFIX) показывает удельную активность, составляющую приблизительно 50%. Фракционирование такого образца показало, что он содержал индивидуальные варианты rhFIX с преобладанием (1-8)-, (1-9)-, (1-10)-, (1-11)- и (1-12)-Gla. Обнаружено, что (1-11)- и (1-12)-Gla полностью активны в анализе коагулирующей активности и в 2-стадийном анализе активности. Для (1-8)-, (1-9)- и (1-10)-Gla-содержащих вариантов было продемонстрировано уменьшение активности до величины приблизительно 2-5%, 14-22% и 27-36% в зависимости от используемого анализа.
Таким образом, можно видеть, что различные варианты rhFIX, которые варьируют только по степени их гамма-карбоксилирования, показывают отличающиеся уровни активности. Ожидается, что образец с большей долей (1-11)- и/или (1-12)-Gla будет показывать более высокую удельную активность, нежели образец, имеющий более низкую долю этих вариантов. Ожидается, что образец с большей долей (1-8)-, и/или (1-9)-, и/или (1-10)-Gla будет показывать более низкую удельную активность, нежели образец, имеющий более низкую долю этих вариантов.
Таким образом, общую удельную активность образца фактора IX можно менять путем изменения долей таких вариантов в образце. В этом случае можно предсказывать, что общая удельная активность образца фактора IX может быть увеличена посредством любого одного или более чем одного из следующего:
- увеличения доли (1-12)-Gla в образце;
- увеличения доли (1-11)-Gla в образце;
- уменьшения доли (1-10)-Gla в образце;
- уменьшения доли (1-9)-Gla в образце;
- уменьшения доли (1-8)-Gla в образце;
- уменьшения доли (1-7)-Gla в образце;
- уменьшения доли (1-6)-Gla в образце;
- уменьшения доли (1-5)-Gla в образце;
- уменьшения доли (1-4)-Gla в образце;
- уменьшения доли (1-3)-Gla в образце;
- уменьшения доли (1-2)-Gla в образце и
- уменьшения доли (1-1)-Gla в образце.
Любое одно или более чем одно из этих изменений может быть выбрано в случае очистки образца фактора IX в соответствии с настоящим изобретением.
Предпочтительный образец фактора IX будет содержать только (1-11)-Gla и (1-12)-Gla, и в нем будут отсутствовать или по существу отсутствовать варианты, имеющие более низкие степени гамма-карбоксилирования, то есть такие, как (1-10)-, (1-9)- и (1-8)-Cla-содержащие варианты.
Этот подход может быть применен к существующим композициям ППХ. Например, как объясняется в данном описании, обнаружено, что hFIX, использованный в Примере 2, имеет 45,6% (1-12)-Gla, 36,0% (1-11)-Gla, 13,6% (1-10)-Gla, 3,3% (1-9)-Gla и 1,6% (1-8)-Gla. rhFIX поступает в продажу от Wyeth под торговым названием Benefix®. Benefix® имеет содержание (1-10)-, (1-11)- и (1-12)-Gla приблизительно 8-10%, 25-31% и 60-67% соответственно. Можно заметить, что способы, изложенные в данном описании, могут быть использованы для увеличения доли (1-11)-Gla и/или (1-12)-Gla в таких композициях. Способы, изложенные в данном описании, могут быть использованы для уменьшения в таких композициях доли менее гамма-карбоксилированных вариантов, таких как (1-10)-Gla, (1-9)-Gla и (1-8)-Gla. Ожидается, что это приведет к улучшению удельной активности hFIX в такой композиции.
Аналогичный подход можно использовать в отношении других Gla-содержащих полипептидов. Например, фактор VII и фактор Х могут включать в себя до 11 остатков Gla. Как показано в Примере 4, способы по настоящему изобретению можно использовать для изменения долей, например, (1-9)-, (1-10)-или (1-11)-фактора VII. Таким образом, способы, изложенные в данном описании, можно использовать для изменения долей различных вариантов фактора VII в зависимости от содержания в них Gla. Например, способы, изложенные в данном описании, можно использовать для увеличения в таких композициях доли (1-10)-Gla и/или (1-11)-Gla. Способы, изложенные в данном описании, можно использовать для уменьшения доли менее гамма-карбоксилированных вариантов, например, (1-9)-Gla и ниже, в таких композициях.
Аналогично, в Примере 7 показано, что композиция, содержащая несколько вариантов фактора X, может быть подвергнута обработке в соответствии со способом по изобретению с целью изменения долей различных Gla-содержащих вариантов фактора X. Отбирая в процессе анионообменной хроматографии подходящие фракции, можно отобрать образцы, содержащие разные доли различных Gla-вариантов. Например, из Примера 7 можно видеть, что способы, изложенные в данном описании, можно использовать для увеличения доли (1-10)-Gla и/или (1-11)-Gla в таких композициях. Способы, изложенные в данном описании, можно использовать для уменьшения доли менее гамма-карбоксилированных вариантов, таких как (1-9)-Gla и ниже.
Таким образом, согласно изобретению предложены способы, которые дают возможность очистить один вариант полипептида от остальных вариантов того же полипептида, причем данные варианты отличаются по степени, до которой осуществлено их гамма-карбоксилирование, или по количеству остатков Gla в их аминокислотной последовательности.
В способах по изобретению используется анионообменная хроматография. Изобретение относится, в частности, к способам, где представляющий интерес полипептид связывается с анионообменным материалом и элюирование полипептида с анионообменного материала осуществляется с использованием буфера, который содержит ацетат аммония, хлорид аммония или ацетат натрия.
Анионообменный материал представляет собой ионообменный материал, который является положительно заряженным. Ввиду этого он содержит свободные анионы, которые могут обмениваться с анионами в водном растворе, пропускаемом сквозь или через анионообменный материал. Присутствие заряда может быть обеспечено путем присоединения одного или более заряженных лигандов к твердой фазе, или заряд может представлять собой неотъемлемое свойство твердой фазы. Твердой фазой может быть, н