Способ защиты клеток от повреждения при гипоксии путем глутатионилирования каталитической субъединицы na, к-атфазы
Иллюстрации
Показать всеИзобретение относится к способам защиты клеток и тканей от гипоксического повреждения и может быть использовано для разработки средств защиты от повреждения при гипоксии и ишемии. Разработанный способ защиты основан на обработке клеток веществами, увеличивающими уровень глутатионилирования каталитической субъединицы Na,K-АТФазы, что приводит к снижению ее активности. Предлагаемый способ может быть использован для проведения научно-исследовательских работ, направленных на создание терапевтических средств для снижения повреждения тканей, в частности, ткани миокарда при гипоксии и гипоксии/реоксигенации. Полученные результаты могут быть востребованы научно-исследовательскими организациями биологического профиля, медицинскими учреждениями, в особенности кардиологическими клиниками, а также биотехнологическими компаниями, работающими в сфере трансплантологии и тканевой инженерии. 6 ил.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к области медицины, в частности к хирургии и трансплантологии, и может быть использовано для разработки средств защиты от повреждения при гипоксии и ишемии.
Уровень техники
Гипоксия тканей, то есть снижение содержания кислорода в тканях ниже физиологического уровня, наблюдается при целом ряде патологических процессов, включая сердечно-сосудистые и нейрососудистые заболевания, развитие которых может приводить к инфаркту миокарда и инсульту, а также при диабете, различных легочных патологиях, хирургических вмешательствах и неизбежно приводит к повреждению тканей. Повреждение сердца и головного мозга вследствие острой и хронической гипоксии является одной из основных причин смертности и инвалидизации населения России. Восстановление кровообращения в гипоксических тканях может приводить к их дополнительному повреждению из-за развития окислительного стресса (1).
При гипоксии одной из главных причин повреждения и гибели клеток является нарушение работы ион-транспортирующих систем и ионного баланса, необходимого для нормальной жизнедеятельности клеток (2-6). Основным ион-транспортирующим белком плазматической мембраны клеток животных является Na,K-АТФаза, которая создает градиент Na+ и K+, необходимый для жизнеспособности клеток. Функциональный мономер Na,K-АТФазы состоит из каталитической альфа-субъединицы, которая содержит сайт связывания АТФ, Na+ K+ и ответственна за гидролиз АТФ и транспорт ионов и регуляторной бета-субъединицы, важной для встраивания альфа-субъединицы в мембрану и окклюзии ионов калия. На поддержание работы Na,K-АТФазы тратится существенная часть внутриклеточных запасов АТФ, от 20% в мышечной ткани до 80% в ткани мозга (2). Ингибирование активности Na,K-АТФазы при гипоксии является одним из самых ранних и критичных событий для жизнеспособности клеток (6-8). Краткосрочное ингибирование Na,K-АТФазы носит адаптивный характер, в частности, позволяет сэкономить АТФ, образование которой снижается в условиях гипоксии, а также приводит к увеличению концентрации внутриклеточного натрия, ингибированию Na+-Са2+-обменника, возрастанию концентрации внутриклеточного кальция, что в случае кардиомиоцитов ведет к усилению сердечных сокращений, позволяя улучшить кровоснабжение тканей. Однако длительное нарушение ионного баланса вследствие ингибирования Na,K-АТФазы приводит к гибели клеток. В настоящее время широкое распространение получило использование сердечных гликозидов (таких как уабаин, дигоксин), действие которых основано на ингибировании Na,K-АТФазы. Сердечные гликозиды используются при застойной сердечной недостаточности, кардиогенном шоке, аритмии сердца. Многие исследования выявляют положительное действие сердечных гликозидов при ишемии-реперфузии, обусловленное ингибированием активности Na,K-АТФазы (9). Описано влияние ингибирования Na,K-АТФазы сердечным гликозидом уабаином на апоптоз клеток. В последнее время стало очевидно, что связывание сердечных гликозидов, кроме непосредственного ингибирования Na,K-АТФазы, приводит также к активации целого ряда сигнальных каскадов (10,11). В силу всего вышеперечисленного длительное применение сердечных гликозидов приводит к развитию патологии, гиперкалемии, гипертрофии сердца и т.д. Более того, при применении сердечных гликозидов существуют большие сложности при определении диапазона их терапевтических и отравляющих концентраций. Ингибируя Na,K-АТФазу, данные вещества никак не снижают риска ее необратимого повреждения активными формами кислорода при гипоксии, а реактивация Na,K-АТФазы в таких условиях затруднена.
В связи с вышесказанным представляется перспективным поиск альтернативных регуляторов активности Na,K-АТФазы, обратимо регулирующих активность фермента и защищающих его от окисления. Совокупность данных, полученных в последние несколько лет, свидетельствует о том, что таким физиологическим регулятором ион-транспортирующих систем (Са2+-АТФазы, рианодиновых рецепторов, потенциал-зависимых и АТФ-зависимых K+-каналов) является внутриклеточный трипептид глутатион (12, 13). Присоединение глутатиона к белкам не только защищает их тиоловые группы от необратимого окисления и потери функции, но и регулирует активность целого ряда белков (12). Для Na,K-АТФазы показано глутатионилирование регуляторных субъединиц бета и FXYD, приводящих к частичному ингибированию фермента (14, 15). Показано, что уровень глутатионилирования β-субъединицы Na,K-АТФазы увеличивается при инфаркте. Нами было обнаружено глутатионилирование каталитической альфа-субъединицы Na,K-АТФазы (16). Установлено, что при гипоксии происходит увеличение уровня глутатионилирования α-субъединицы Na,K-АТФазы, сопровождающееся ингибированием фермента (16). На препаратах очищенного белка нами впервые продемонстрировано, что каталитическая субъединица Na,K-АТФазы способна глутатионилироваться и что индукция глутатионилирования каталитической субъединицы белка приводит к полному ингибированию Na,K-АТФазы (16). Кроме того, полученные нами данные свидетельствуют о том, что эффективность глутатионилирования повышается при снижении уровня АТФ (16). Таким образом, глутатионилирование Na,K-АТФазы при гипоксии может защищать белок от необратимого окисления, а при снижении АТФ приводить к выключению фермента, что позволяет снизить потребление клеткой АТФ, предотвращая истощение клеток по АТФ в условиях гипоксии, когда ее синтез снижен. Накопленные данные позволяют считать управляемую регуляцию ион-транспортирующих белков, в частности, Na,K-АТФазы, с помощью глутатионилирования новым и перспективным способом защиты тканей от гипоксии. В связи с этим не вызывает сомнений актуальность исследований, направленных на создание метода управляемого глутатионилирования Na,K-АТФазы для защиты тканей от гипоксии.
В патенте США US 20050187181 (международная заявка WO/2006/022901) описаны методы обработки или предотвращения геморрагического шока, основанные на применении инозина, гуанозина, деоксиоинозина, деоксигуанозина или их смесей, приводящих к увеличению активности Na,K-АТФазы в эритроцитах и других клетках животных. Острый геморрагический шок, обусловленный кровопотерей, сопровождается гипоксией, увеличением в плазме калия, снижением трансмембранного потенциала и набуханием клеток, что вызвано ингибированием активности Na,K-АТФазы вследствие увеличения циркулирующих в крови эндогенных ингибиторов. В международной заявке WO/2011/034772 описаны синтетические вещества, ингибирующие Na,K-АТФазу, но не приводящие к активации сигнальных каскадов, что позволяет уменьшить риск токсического действия этих агентов. Описаны также антагонисты уабаина, которые могут быть использованы для лечения при отравлении сердечными гликозидами. В базе данных ФИПС документов по защите клеток путем регуляции активности Na,K-АТФазы не было найдено.
В патенте США US 20060135443 (международная заявка опубликована как WO/2006/044916) описано применение ингибиторов Na,K-АТФазы, таких как сердечные гликозиды отдельно или в комбинации с другими стандартными терапевтическими средствами для применения при патологиях связанных с гипоксией. Существенным недостатком данного аналога является вышеописанные побочные эффекты и активация целого ряда внутриклеточных каскадов.
Наиболее близким аналогом является патент Австралии AU 2009905055, международная заявка опубликована как WO/2011/044636. В данном патенте описаны способы модуляции активности Na,K-АТФазы путем регуляции образования комплекса Na,K-АТФазы с регуляторной субъединицей FXYD, а также путем глутатионилирования ее регуляторных субъединиц β (14) и FXYD (R15), увеличение уровня глутатионилирования показано при инфаркте. Основным недостатком данного аналога является незначительное изменение активности фермента при глутатионилировании регуляторных субъединиц β и FXYD около 20%.
Документов по защите клеток от гипоксии путем глутатионилирования каталитической альфа-субъединицы Na,K-АТФазы, которая ответственна за осуществление гидролитической и транспортной функции фермента и глутатионилирование которой, согласно нашим данным (16), способно полностью ингибировать фермент, в настоящее время не обнаружено.
Задачей, на решение которой направлено настоящее изобретение, является разработка нового способа защиты клеток млекопитающих от гипоксии путем глутатионилирования каталитической субъединицы Na,K-АТФазы, изменяющего активность фермента.
Сущность изобретения
Настоящее изобретение относится к области медицины и является способом защиты клеток млекопитающих от гипоксии, отличающимся тем, что защитный эффект достигается обработкой клеток веществами, изменяющими уровень глутатионилирования каталитической субъединицы Na,K-АТФазы. Преимуществом такого способа регуляции активности Na,K-АТФазы является возможность полного выключения фермента, а также обратимость ингибирования фермента, обусловленная редокс-зависимым деглутатионилированием при нормализации внутриклеточного редокс-статуса. Дополнительным преимуществом является защита тиоловых групп каталитической субъединицы при гипоксии и гипоксии/реоксигенации от необратимого окисления.
Технический результат
Технический результат, достигаемый при использовании патентуемого изобретения, заключается в создании средств защиты от повреждения при гипоксии и ишемии.
Изобретение иллюстрируется примерами, которые не ограничивают объем и сущность притязаний, связанных с ним.
Пример осуществления изобретения
Защитное действие веществ, изменяющих уровень глутатионилирования Na,K-АТФазы на выживаемость клеток в условиях гипоксии, было протестировано на клетках яичника китайского хомячка линии СНО; эмбриональных клетках мыши линии SC1 и остеобластических стромальных клетках мыши из свода черепа линии BAL/c. Клетки выращивали в питательной среде ДМЕМ с высоким содержанием глюкозы (4,5 г/л) (Invitrogen), содержащей 10% эмбриональной телячьей сыворотки (Invitrogen), 2 мМ глутамина (ПанЭко), 100 Ед/мл пенициллина и 100 мкг/мл стрептомицина (Invitrogen), при 37°C в атмосфере 5% CO2. Клеточные культуры рассаживали в стерильные чашки Петри (размер 35×10 мм) для адгезивных клеточных культур (Corning-Costar) по следующим вариантам плотности: СНО, SC-1-400 000, 400 000 клеток в чашку; BAL/c - 600000 клеток в чашку.
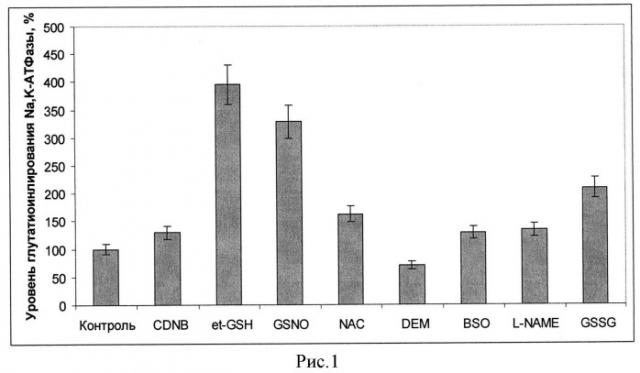
В первую очередь оценивали влияние веществ, изменяющих редокс-статус клеток, в частности, изменяющих уровень глутатиона и/или активность глутатион-зависимых ферментов на уровень глутатионилирования фермента. Были рассмотрены следующие вещества, изменяющие редокс-статус клетки: хлординитробензен (CDNB), диэтилмалеат (DEM) - вещества, образующие конъюгаты с глутатионом и приводящие к его снижению внутри клеток, нитрозоглутатион (GSNO) - производное глутатиона, приводящее к возрастанию его уровня в клетке, но при этом оказывающее влияние как на глутатионилирование, так и нитрозилирование белков, NAC - N-ацетил цистеин-проникающее в клетку производное цистеина, который является восстановителем и увеличивает пул глутатиона, GSSG - окисленный глутатион, et-GSH - этилглутатион - проникающий аналог восстановленного глутатиона. Кроме того, дополнительно были проверены бутионинсульфоксимин (BSO) - ингибитор синтеза глутатиона и L-NAME-ингибитор NO синтаз. При проведении экспериментов клетки инкубировали с данными веществами в течение часа, после чего пробы центрифугировали и осадок замораживали для последующего проведения иммуноблотинга. Перед проведением иммуноблотинга образцы размораживали. Для лизирования 1 млн клеток брали 30 мкл RIPA-буфера. Полученную суспензию клеток инкубировали в течение 30 мин при +4°C при постоянном перемешивании. Полученный клеточный лизат центрифугировали в течение 10 мин при 16000 g. Отбирали супернатант и определяли в нем концентрацию белка по методу Лоури. Затем проводили электрофорез по методу Лэммли и электроперенос белков с геля на нитроцеллюлозную мембрану. Иммуноблотинг лизатов клеток проводили с использованием антител на глутатион в составе белков МАВ5310 (Chemicon Millipore), которые брали в разведении 1:1000, как описано нами ранее (16). После проведения стрипинга проводили иммуноблотинг на каталитическую альфа-субъединицу с использованием антител на альфа1 субъединицу С464-6 (Upstate Millipore) в разведении 1:10000. Интенсивность полосы глутатионилирования каталитической субъединицы нормировали на количество данной субъединицы в полосе. На рисунке 1 приведено изменение уровня глутатионилирования каталитической альфа-субъединицы Na,K-АТФазы относительно контроля после инкубации клеток SC1 в течение 60 минут с веществами: 3 мМ CDNB, 5 мМ et-GSH, 200 мкМ GSNO, 5 мМ NAC, 1 мМ DEM, 100 мкМ BSO, 100 мкМ L-NAME, 1 мМ GSSG. Уровень глутатионилирования в контроле принят за 100%.
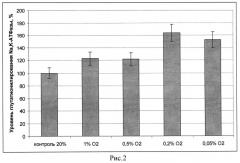
Из приведенных (рисунок 1) данных видно, что инкубация с et-GSH, NAC, GSNO и GSSG приводит к возрастанию уровня глутатионилирования каталитической субъединицы Na,K-АТФазы. При этом ингибитор синтеза глутатиона BSO и ингибитор NO синтаз L-NAME в данных условиях не приводили к возрастанию глутатионилирования, что согласуется с данными об отсутствии влияния этих веществ на уровень глутатиона, полученными нами ранее (17). Вещества, истощающие клетки по глутатиону, также не вызывали увеличения уровня глутатионилирования белка. Наибольшее возрастание уровня глутатионилирования наблюдалось при инкубации клеток с et-GSH. Этот результат вместе с данными по ингибированию активности фермента при глутатионилировании (16) согласуется с данными, по ингибированию Na,K-АТФазы этил глутатионом, полученными нами ранее на нейрональных клетках (17), и объясняет их. Увеличение глутатионилирования каталитической субъединицы Na,K-АТФазы, показанное нами в культуре клеток при гипоксии (рисунок 2), свидетельствует о важности данной модификации в адаптации клеток. На рисунке 2 приведен уровень глутатионилирования Na,K-АТФазы в клетках SC1, проинкубированных при разном содержании кислорода (1% O2; 0,5% O2; 0,2% O2; 0,05 02%) через 3,5 часа инкубации в процентах от контроля. За 100% принят уровень глутатионилирования Na,K-АТФазы в условиях 20% О2 кислорода.
Вещества, индуцирующие увеличение уровня глутатионилирования Na,K-АТФазы: et-GSH, GSSG, NAC, использовали для снижения повреждения клеток в условиях гипоксии. Инкубацию с веществами проводили в течение часа перед инкубацией в гипоксических условиях.
Для проведения инкубации клеток при содержании кислорода ниже 1% для 96-луночных планшетов использовали герметичный бокс из материала, непроницаемого для кислорода, заполняя его готовыми газовыми смесями в баллонах, содержащими фиксированное, точно заданное содержание кислорода, а также азот и 5% углекислого газа. После окончания времени инкубации клетки в 96-луночных планшетах использовали для определения выживаемости, которую оценивали по дыхательной активности с использованием МТТ теста (Invitrogen). Краситель МТТ разводили в фосфатном буфере до концентрации 12 мМ. В каждую лунку планшета добавляли 10 мкл красителя, перемешивали и убирали планшет с клетками на 4 часа в бокс, в прежние условия инкубации при заданной концентрации кислорода и температуре 37°C. После окончания времени инкубации в каждую лунку добавляли 150 мкл диметилсульфоксида (ДМСО), перемешивали и инкубировали 10 минут при 37°C. Затем каждый образец перемешивали и измеряли оптическую плотность на длине волны 540 нм.
Уровень АТФ определяли в клетках с помощью метода хемилюминисценции в системе люцеферин-люцефераза, используя Набор для определения АТФ (АТР Determination kit, Invitrogen). Регистрацию хемилюминесценции проводили с помощью планшетного Анализатора Plate Chameleon «Hidex Oy» 425-106. Инкубацию клеток проводили в 96-луночных планшетах. После завершения инкубации проводили лизис клеток и определение уровня АТФ.
Для оценки внутриклеточных параметров с помощью проточной цитометрии клетки переводили в суспензию. Для этого клетки снимали с 12-луночных планшетов с помощью трипсина и помещали в колбы, каждая из которых герметично закрывается пробкой, имеющей входное и выходное отверстие незначительного диаметра (менее 2 мм). Для снятия клеток отбирали ростовую среду; промывали клетки раствором Версена (~120 мкл на 1,9 см2); заливали монослой раствором для снятия клеток (0,25% стерильный раствор Трипсина с солями Хенкса (без Са2+ и Mg2+) (~120 мкл на 1,9 см2); инкубировали при 37°С, периодически аккуратно покачивая, ~1-2 мин; когда клетки полностью отделились от субстрата, добавляли полной среды 500 мкл и тщательно диспергировали клетки; затем проводили подсчет количества клеток в счетной камере Горяева под инвертированным микроскопом с предварительным окрашиванием трипановым синим. Суспензию клеток разносили в колбы.
Колбы с суспензией клеток помещали в водяную баню с температурой 37°C, соединив последовательно входные и выходные отверстия колб шлангами по три колбы в одно последовательное соединение и к первой из колб подводили газ из газового баллона с фиксированным содержанием кислорода (5% CO2, х% O2, 95-х% N2). Перед поступлением в первую колбу газ из баллона проходил через три аналогичные колбы с водой высокой степени очистки (Millipore), стоящие в бане, для того чтобы поступающая к клеткам газовая смесь была необходимой влажности и температуры. Выходной шланг из каждой колбы был подсоединен к колбе с водой, что позволяло регистрировать ток газа в системе. Инкубацию проводили в течение 3,5 часов при непрерывном токе газа и включенной качалке.
Цитометрический анализ клеток проводили на проточном цитофлуориметре GALLIOS (Bechkanm Coulter). Оценку уровня активных форм кислорода проводили с помощью дигидрородамина 123 (DHR) (Invitrogen, Ex/Em 507/525), который способен детектировать активные формы кислорода не только в цитозоле, но и в митохондриях. Клетки центрифугировали, удалив супернатант, и ресуспендировали в 100 мкл фосфатного буфера PBS. Для окрашивания клеток к ним добавляли DHR 123 до конечной концентрации 10 мкМ (17) и инкубировали в течение 30 минут при 37°C в темноте. За 1 минуту до измерения добавляли пропидий йодид до конечной концентрации 10 мкг/мл (Sigma), Ex/Em 535/617 нм для определения клеток с поврежденной мембраной. Уровень активных форм кислорода определяли по средней интенсивности зеленой флуоресценции в клетках с неповрежденной мембраной, не окрашиваемых пропидий йодидом.
Оценку уровня глутатиона проводили с помощью CMFDA (5-Chloromethylfluorescein Diacetate) (Invitrogen), Ex/Em 488/535 нм (17). Для этого клетки центрифугировали, удаляли супернатант и ресуспендировали в 100 мкл буфера PBS. Для окрашивания клеток к ним добавляли CMFDA до конечной концентрации 7,5 мкМ и инкубировали в течение 30 минут при 37°C в темноте. За 1 минуту до измерения добавляли пропидий йодид. Уровень глутатиона определяли по средней интенсивности зеленой флуоресценции, возбуждаемой лазером 488 нм, в клетках с неповрежденной мембраной, не окрашиваемых пропидий йодидом.
Оценку уровня NO проводили с помощью красителя DAF-FM DA (4-Amino-5-Methylamino-2',7'-Difluorofluorescein Diacetate) (7). DAF-FM диацетат проникает в клетку и там превращается форму, не способную проникнуть через клеточную мембрану. Квантовый выход DAF FM после взаимодействия с NO возрастает в 160 раз (Ex/Em DAF-FM: ~495/515 нм), что приводит к существенному возрастанию интенсивности его флуоресценции и позволяет оценить уровень NO в клетке. Для окраски клетки центрифугировали, затем ресуспендировали в 100 мкл буфера PBS и инкубировали с 5 мкМ DAF-FM в течение 30 минут при 37°C. За 1 минуту до измерения с помощью проточной цитометрии добавляли пропидий йодид. Уровень NO определяли по средней интенсивности зеленой флуоресценции, возбуждаемой лазером 488 нм, в клетках с неповрежденной мембраной, не окрашиваемых пропидий йодидом.
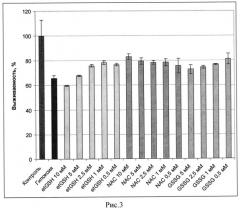
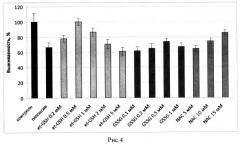
Оценка выживаемости клеток по МТТ тесту в условиях нормоксии при 20% кислорода и гипоксии, при 0,05% и 0,2% кислорода, показала, что et-GSH, GSSG и NAC предотвращают падение выживаемости клеток. Клетки предварительно инкубировали с данными веществами в течение 1 часа, затем вещества удаляли и клетки подвергали гипоксическому воздействию. На рисунках 3 и 4 представлены значения выживаемости для клеток СНО и SC1 соответственно, оцененные по дыхательной активности (МТТ тест) в процентах от контроля (зеленый столбец) после инкубации в условиях гипоксии (0,05% и 0,2% соотвественно) в отсутствие веществ (красный столбец) и клеток в присутствии различных концентраций этил глутатиона et-GSH (желтые столбцы), окисленного глутатиона (GSSG) (синие столбцы), N-ацетил цистеина (NAC) (розовые столбцы). Из представленных на рисунках 3 и 4 данных видно, что эффективность действия et-GSH и GSSG выше при концентрациях около 0,5 мМ, тогда как защитное действие NAC реализуется при более высоких концентрациях, составляющих около 15 мМ.
Определение уровня АТФ, проведенное в клетках, проинкубированных в гипоксических условиях, показало (рисунок 5), что в клетках, прошедших гипоксическую обработку после проведения преинкубации с веществами, индуцирующими глутатионилирование Na,K-АТФазы, уровень АТФ выше, чем в контроле. Таким образом, ингибирование Na,K-АТФазы вследствие глутатионилирования действительно приводит к снижению затрат АТФ. На рисунке 5 приведено изменение уровня АТФ в клетках СНО после инкубации в течение 3,5 часов при гипоксии (рО2 0,2%) в присутствии и отсутствие различных концентраций et-GSH, GSSG и NAC: GSSG (0,1 мМ, 0,2 мМ, 0,5 мМ); et-GSH (0,5; 1; 2; 5 мМ); NAC (5 мМ, 10 мМ, 15 мМ). Преинкубацию с веществами проводили в течение 1 часа, после чего была проведена смена среды и клетки подвергались гипоксическому воздействию.
Цитофлуометрическое исследование параметров, характеризующих редокс-статус клеток, продемонстрировало, что преинкубация с данными веществами нормализует редокс-статус клеток. На рисунке 6 представлены параметры, характеризующие изменение редокс-статуса клеток: уровень активных форм кислорода, уровень внутриклеточного глутатиона, уровень оксида азота для контрольных клеток и клеток после гипоксической обработки при 0,05% O2 в течение 3,5 часов. Клетки в гипоксических условиях были предварительно проинкубированы с et-GSH, NAC и GSSG в течение 1 часа. Из представленных на рисунке 6 данных видно, что преинкубация с выбранными веществами в указанных концентрациях приводит к снижению уровня активных форм кислорода, нормализации уровня глутатиона, возрастающего при гипоксии, и в случае et-GSH и GSSG к снижению уровня NO.
Приведенный пример демонстрирует, что предлагаемый способ защиты клеток от повреждения при гипоксии путем глутатионилирования каталитической субъединицы Na,K-АТФазы повышает выживаемость клеток при гипоксии и нормализует их редокс-статус. Способ основан на использовании веществ, увеличивающих уровень глутатионилирования Na,K-АТФазы: этил глутатиона et-GSH, оксиленного глутатиона GSSG и N-ацетил цистеина NAC. Установлен концентрационный диапазон, в котором данные вещества обладают максимальным защитным эффектом и не проявляют выраженных цитотоксических свойств: для et-GSH от 0,2-0,5 мМ, для GSSG от 0,2-1 мМ, для NAC от 10 до 15 мМ. Данные вещества в выбранных концентрациях увеличивают жизнеспособность клеток и приводят к снижению уровня активных форм кислорода и нормализации уровня глутатиона в клетках в условиях гипоксии.
Список использованной литературы
1. Allen BS, Ilbawi MN. (2001) Hypoxia, reoxygenation and the role of systemic leukodepletion in pediatric heart surgery. Perfusion, Suppl. 19-29.
2. Boutilier RG Mechanisms of cell survival in hypoxia and hypothermia J. Exp. Biol. 2001; 204, 3171-3181.
3. Lehotsky J, Kaplan P, Matejovicova M, Murin R, Racay P, Raeymaekers L. (2002) Ion transport systems as targets of free radicals during ischemia reperfusion injury. Gen. Physiol. Biophys. 21(1), 31-37.
4. Weir EK, Olschewski A. (2006) Role of ion channels in acute and chronic responses of the pulmonary vasculature to hypoxia. Cardiovasc. Res. 71, 630-641.
5. Wang YX, Zheng YM. (2010) Role of ROS signaling in differential hypoxic Ca2+ and contractile responses in pulmonary and systemic vascular smooth muscle cells. Respir. Physiol. Neurobiol. 174, 192-200.
6. Fuller W, Parmar V, Baton P, Bell JR, Shattock MJ. (2003) Cardiac ischemia causes inhibition of the Na/K ATPase by a labile cytosolic compound whose production is linked to oxidant stress. Cardiovasc Res. 57, 1044-51.
7. Petrushanko IY, Bogdanov NB, Lapina N, Boldyrev AA, Gassmann M, Bogdanova AY (2007) Oxygen-induced Regulation of Na/K ATPase in cerebellar granule cells. J Gen Physiol. 130, 389-398.
8. Bogdanova A, Petrushanko I, Boldyrev A, Gassmann M (2006) Redox- and oxygen-induced regulation of Na/K ATPase. Curr. Enzyme Inhibition 2, 37-59.
9. Pasdois P, Quinlan CL, Rissa A, Tariosse L, Vinassa B, Costa AD, Pierre SV, dos Santos P, Garlid KD. (2007) Ouabain protects rat hearts against ischemia-reperfusion injury via pathway involving src kinase, mitoKATP, and ROS. Am. J. Physiol. Heart Circ. Physiol. 292(3): H 1470-8.
10. Kulikov A, Eva A, Kirch U, Boldyrev A, Scheiner-Bobis G. (2007) Ouabain activates signaling pathways associated with cell death in human neuroblastoma. Biochim Biophys Acta; 1768(7): 1691 - 702.
11. Bai Y, Morgan ЕЕ, Giovannucci DR., Pierre SV, Philipson KD, Askari A, Liu L. (2013) Different roles of the cardiac Na+/Ca2+ - exchanger in ouabain-induced inotropy, cell signaling, and hypertrophy. // Am. J. Physiol. Heart. Circ. Physiol.; 304(3): H427-H435.
12. Mieyal JJ, Gallogly MM, Qanungo S, Sabens EA, and Shelton MD (2008) Molecular mechanism and clinical implications of reversible protein S-glutathionylation. Antioxidants & redox signaling, 10, 1941-1988.
13. Xiong Y, Uys JD, Tew KD, Townsend DM. S-glutathionylation: from molecular mechanisms to health outcomes. Antioxid Redox Signal. 15, 233-270
14. Figtree GA, Liu CC, Bibert S, Hamilton EJ, Garcia A, White CN, Chia KK, Cornelius F, Geering K, Rasmussen HH (2009) Reversible oxidative modification: a key mechanism of Na+ - K+ pump regulation. Circ. Res. 105, 185-193.
15. Bibert S, Liu CC, Figtree GA, Garcia A, Hamilton EJ, Marassi FM, Sweadner KJ, Cornelius F, Geering K, Rasmussen HH (2011) FXYD proteins reverse inhibition of the Na+-K+ pump mediated by glutathionylation of its betal subunit. J Biol Chem. 286, 18562-18572.
16. Petrushanko IYu, Yakushev S, Mitkevich VA, Kamanina YuV, Ziganshin RH, Meng X, Anashkina AA, Makhro A, Lopina OD, Gassmann M, Makarov AA, Bogdanova A (2012) S-glutathionylation of the Na,K-ATPase catalytic a subunit is a determinant of the enzyme redox-sensitivity. J. Biol. Chem. 287(38), 32195-205.
17. Petrushanko I, Bogdanov N, Bulygina E, Grenacher B, Leinsoo T, Boldyrev A, Gassmann M, Bogdanova A (2006) Na-K-ATPase in rat cerebellar granule cells is redox sensitive. Am. J. Physiol. Regul. Integr. Сотр. Physiol. 290, R916-925.
Способ защиты клеток млекопитающих от гипоксии, отличающийся тем, что защитный эффект достигается обработкой клеток веществами, увеличивающими уровень глутатионилирования каталитической субъединицы Na,К-АТФазы, в концентрациях, повышающих уровень глутатионилирования, но не оказывающих цитотоксического действия.