Способ получения 4-амино-5-фтор-3-галоген-6-(замещенных)пиколинатов
Иллюстрации
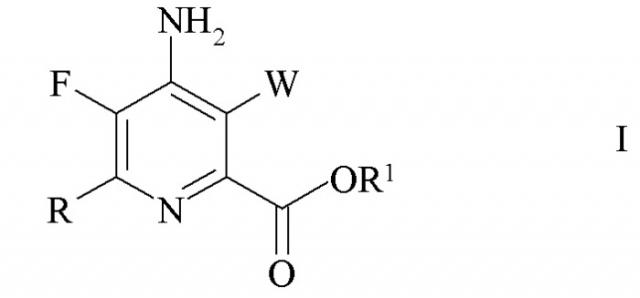
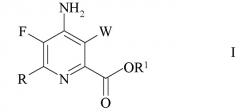
Показать всеИзобретение относится способу получения 4-амино-5-фтор-3-галоген-6-(замещенного)пиколината формулы I
где W представляет собой Cl, Br или I; R представляет собой C1-C4 алкил, циклопропил, C2-C4 алкенил или фенил, замещенный 1-4 заместителями, независимо выбранными из галогена, C1-C4 алкила, C1-C4 галогеналкила, C1-C4 алкокси или C1-C4 галогеналкокси; и R1 представляет собой C1-C12 алкил или незамещенный или замещенный C7-C11 арилалкил; который включает следующие стадии: обмен фтором, аминирование, обмен галогеном, галогенирование и связывание при помощи переходного металла. 4 н. и 3 з.п. ф-лы, 6 пр.
Реферат
Настоящее изобретение относится к способу получения 4-амино-5-фтор-3-галоген-6-(замещенных)пиколинатов. Более конкретно, настоящее изобретение относится к способу получения 4-амино-5-фтор-3-галоген-6-(замещенных)пиколинатов, в которых заместитель 5-фтор вводится путем замены галогена в начале схемы способа.
Патент США 6297197 B1 описывают inter alia конкретные соединения 6-(алкокси или арилокси)-4-амино-3-хлор-5-фторпиколинатов и их применение в качестве гербицидов. Патенты США 6784137 B2 и 7314849 B2 описывают inter alia конкретные соединения 6-(арил)-4-амино-3-хлор-5-фторпиколинатов и их применение в качестве гербицидов. Патент США 7432227 B2 описывает inter alia конкретные соединения 6-(алкил)-4-амино-3-хлор-5-фторпиколинатов и их применение в качестве гербицидов. Каждый из этих патентов описывает получение исходных веществ для 4-амино-3-хлор-5-фторпиколината путем фторирования соответствующих 5-незамещенных пиридинов 1-(хлорметил)-4-фтор-1,4-диазонийбицикло[2.2.2]октан бис(тетрафторборатом). Было бы выгодно получать 4-амино-5-фтор-3-галоген-6-(замещенные)пиколинаты, без необходимости прямого фторирования положения 5 пиридинового кольца дорогим агентом фторирования, таким как 1-(хлорметил)-4-фтор-1,4-диазонийбицикло[2.2.2]октан бис(тетрафторборатом).
Настоящее изобретение относится к способу получения 4-амино-5-фтор-3-галоген-6-(замещенных)пиколинатов из 4,5,6-трихлорпиколинатов. Более конкретно, настоящее изобретение относится к способу получения 4-амино-5-фтор-3-галоген-6-(замещенного)пиколината формулы I
где
W представляет собой Cl, Br или I;
R представляет собой C1-C4 алкил, циклопропил, C2-C4 алкенил или фенил, замещенный 1-4 заместителями, независимо выбранными из галогена, C1-C4 алкила, C1-C4 галогеналкила, C1-C4 алкокси или C1-C4 галогеналкокси; и
R1 представляет собой C1-C12 алкил или незамещенный или замещенный C7-C11 арилалкил;
который включает следующие стадии:
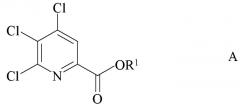
a) фторирование 4,5,6-трихлорпиколината формулы A
где R1 является таким, как определено ранее;
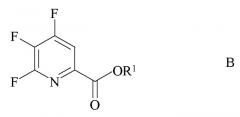
источником фторид-иона с получением 4,5,6-трифторпиколината формулы B
где R1 является таким, как определено ранее;
b) аминирование 4,5,6-трифторпиколината формулы B аммиаком с получением 4-амино-5,6-дифторпиколината формулы C
где R1 является таким, как определено ранее;
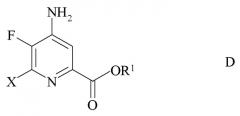
c) замена фтор-заместителя в положении 6 4-амино-5,6-дифторпиколината формулы C на йод, бром или хлор-заместитель путем обработки источником ионов йода, брома или хлора с получением 4-амино-5-фтор-6-галогенпиколината формулы D
где X представляет собой Cl, Br или I; и
R1 является таким, как определено ранее;
d) галогенирование 4-амино-5-фтор-6-галогенпиколината формулы D источником галогена с получением 4-амино-3,6-дигалоген-5-фторпиколината формулы E
где W и X независимо представляют собой Cl, Br или I и
R1 является таким, как определено ранее; и
e) связывание 4-амино-3,6-дигалоген-5-фторпиколината формулы E с арильным, алкильным или алкенильным металлическим соединением формулы F
где R является таким, как определено ранее, и Met представляет собой Zn-галогенид, Zn-R, три-(C1-C4 алкил)олово, медь или B(OR2)(OR3), где R2 и R3 независимо представляют собой водород, C1-C4 алкил или, взятые вместе, образуют этиленовую или пропиленовую группу в присутствии катализатора на основе переходного металла с получением 4-амино-5-фтор-3-галоген-6-(замещенного)пиколината формулы I.
Стадии a)-e) могут быть выполнены в перечисленном порядке, как изображено на схеме I.
Схема I
Альтернативно, порядок, в котором выполняют стадии, может быть перегруппирован так, как проиллюстрировано, например, на схемах II и III.
Схема II
В соответствии со схемой II настоящее изобретение относится к способу получения 4-амино-5-фтор-3-галоген-6-(замещенного)пиколината формулы I
где
W представляет собой Cl, Br или I;
R представляет собой C1-C4 алкил, циклопропил, C2-C4 алкенил или фенил, замещенный 1-4 заместителями, независимо выбранными из галогена, C1-C4 алкила, C1-C4 галогеналкила, C1-C4 алкокси или C1-C4 галогеналкокси; и
R1 представляет собой C1-C12 алкил или незамещенный или замещенный C7-C11 арилалкил;
который включает следующие стадии:
a) фторирование 4,5,6-трихлорпиколината формулы A
где R1 является таким, как определено ранее;
источником фторид-иона с получением 4,5,6-трифторпиколината формулы B
где R1 является таким, как определено ранее;
b) аминирование 4,5,6-трифторпиколината формулы B аммиаком с получением 4-амино-5,6-дифторпиколината формулы C
где R1 является таким, как определено ранее;
c) замена фтор-заместителя в положении 6 4-амино-5,6-дифторпиколината формулы C на йод, бром или хлор-заместитель путем обработки источником ионов йода, брома или хлора с получением 4-амино-5-фтор-6-галогенпиколината формулы D
где X представляет собой Cl, Br или I и
R1 является таким, как определено ранее;
d) связывание 4-амино-5-фтор-6-галогенпиколината формулы D с арильным, алкильным или алкенильным металлическим соединением формулы F
где R является таким, как определено ранее, и Met представляет собой Zn-галогенид, Zn-R, три-(C1-C4 алкил)олово, медь или B(OR2)(OR3), где R2 и R3 независимо друг от друга представляют собой водород, C1-C4 алкил, или, взятые вместе, образуют этиленовую или пропиленовую группу в присутствии катализатора на основе переходного металла с получением 4-амино-5-фтор-6-(замещенного)пиколината формулы G.
где R и R1 являются такими, как определено ранее; и
e) галогенирование 4-амино-5-фтор-6-(замещенного)пиколината формулы G источником галогена с получением 4-амино-5-фтор-3-галоген-6-(замещенного)пиколината формулы I.
Схема III
На схеме III стадия c) замены йода, брома или хлора не является необходимой. Таким образом, настоящее изобретение также относится к способу получения 4-амино-5-фтор-3-галоген-6-(замещенного)пиколината формулы I
где
W представляет собой Cl, Br или I;
R представляет собой C1-C4 алкил, циклопропил, C2-C4 алкенил или фенил, замещенный 1-4 заместителями, независимо выбранными из галогена, C1-C4 алкила, C1-C4 галогеналкила, C1-C4 алкокси или C1-C4 галогеналкокси; и
R1 представляет собой C1-C12 алкил или незамещенный или замещенный C7-C11 арилалкил;
который включает следующие стадии:
a) связывание 4,5,6-трихлорпиколината формулы A
где R1 является таким, как определено ранее;
с арильным, алкильным или алкенильным металлическим соединением формулы F
где R является таким, как определено ранее, и Met представляет собой Zn-галогенид, Zn-R, три-(C1-C4 алкил)олово, медь или B(OR2)(OR3), где R2 и R3 независимо друг от друга представляют собой водород, C1-C4 алкил, или, взятые вместе, образуют этиленовую или пропиленовую группу в присутствии катализатора на основе переходного металла с получением 4,5-дихлор-6-(замещенного)пиколината формулы H
где R и R1 являются такими, как определено ранее;
b) фторирование 4,5-дихлор-6-(замещенного)пиколината формулы H источником фторид-ионов с получением 4,5-дифтор-6-(замещенного)пиколината формулы J
где R1 является таким, как определено ранее;
c) аминирование 4,5-дифтор-6-(замещенного)пиколината формулы J аммиаком с получением 4-амино-5-фтор-6-(замещенного)пиколината формулы K
где R и R1 являются такими, как определено ранее; и
d) галогенирование 4-амино-5-фтор-6-(замещенного)пиколината формулы K источником галогена с получением 4-амино-5-фтор-3-галоген-6-(замещенного)пиколината формулы I.
На любой стадии на схемах I-III заместитель сложного эфира R1 может необязательно быть заменен на другой заместитель R1. Эти сложные эфиры, включая незамещенные или замещенные сложные C7-C11 арилалкиловые эфиры, могут быть получены этерификацией без катализатора или посредством реакций переэтерификации с применением способов, известных в области техники.
Другим аспектом настоящего изобретения являются новые промежуточные продукты, получаемые в настоящем способе, то есть соединения, выбранные из группы, состоящей из:
a)
где R представляет собой C1-C4 алкил, циклопропил, C2-C4 алкенил или фенил, замещенный 1-4 заместителями, независимо выбранными из галогена, C1-C4 алкила, C1-C4 галогеналкила, C1-C4 алкокси или C1-C4 галогеналкокси, и R1 представляет собой C1-C12 алкил или незамещенный или замещенный C7-C11 арилалкил;
b)
где X представляет собой I, Br, Cl или F, Y1 представляет собой H, Cl, Br или I, при условии, что, когда X представляет собой Cl, Y1 представляет собой H, Br или I, и R1 представляет собой C1-C12 алкил или незамещенный или замещенный C7-C11 арилалкил;
c)
где Y2 представляет собой H, Br или I и R представляет собой C1-C4 алкил, циклопропил, C2-C4 алкенил или фенил, замещенный 1-4 заместителями, независимо выбранными из галогена, C1-C4 алкила, C1-C4 галогеналкила, C1-C4 алкокси или C1-C4 галогеналкокси, и R1 представляет собой C1-C12 алкил или незамещенный или замещенный C7-C11 арилалкил; и
d)
где R представляет собой C1-C4 алкил, циклопропил, C2-C4 алкенил или фенил, замещенный 1-4 заместителями, независимо выбранными из галогена, C1-C4 алкила, C1-C4 галогеналкила, C1-C4 алкокси или C1-C4 галогеналкокси, и R1 представляет собой C1-C12 алкил или незамещенный или замещенный C7-C11 арилалкил.
Термины «алкил», «алкенил» и «алкинил», а также производные термины, такие как «алкокси», «ацил», «алкилтио» и «алкилсульфонил», как используется в настоящем описании, охватывают фрагменты с неразветвленной, разветвленной цепью и циклические фрагменты. Если конкретно не указано иначе, каждый может быть незамещенным или замещенным одним или более заместителями, выбранными из, но не ограничиваясь ими, галогена, гидрокси, алкокси, алкилтио, C1-C6 ацила, формила, циано, арилокси или арила, при условии, что заместители являются стерически совместимыми и соблюдаются правила образования химической связи и энергии деформации. Термины «алкенил» и «алкинил» предназначены для обозначения включения одной или более ненасыщенных связей.
Термин «арилалкил», как используется в настоящем описании, относится к фенилзамещенной алкильной группе, содержащей в общей сложности 7-11 углеродных атомов, такой как бензил (-CH2C6H5), 2-метилнафтил(-CH2C10H7) и 1- или 2-фенэтил (-CH2CH2C6H5 или -CH(CH3)C6H5). Фенильная группа может быть сама по себе незамещенной или замещенной одним или более заместителями, независимо выбранными из галогена, нитро, циано, C1-C6 алкила, C1-C6 алкокси, галогенированного C1-C6 алкила, галогенированной C1-C6 алкокси, C1-C6 алкилтио, C(O)OC1-С6алкил, или где два смежных заместителя, взятые вместе, представляют собой O(CH2)nO-, где n=1 или 2, при условии, что заместители являются стерически совместимы и соблюдаются условия образования химической связи и энергии деформации.
Если конкретно не указано иначе, термин «галоген», а также производные термины, такие как «гало», относятся к фтору, хлору, брому и йоду.
6-Фенильные группы, замещенные 1-4 заместителями, независимо выбранными из галогена, C1-C4 алкила, C1-C4 галогеналкила, C1-C4 алкокси или C1-C4 галогеналкокси, могут иметь любую ориентацию, но предпочтительны изомеры 4-замещенный фенил, 2,4-двузамещенный фенил, 2,3,4-трехзамещенный фенил, 2,4,5-трехзамещенный фенил и 2,3,4,6-четырехзамещенный фенил.
4-Амино-5-фтор-3-галоген-6-(замещенные)пиколинаты получают из 4,5,6-трихлорпиколинатов серией стадий, включающих замену фтора, аминирование, замену галогена, галогенирование и связывание при помощи переходного металла. Индивидуальные стадии могут быть выполнены в различных последовательностях.
Исходные вещества для 4,5,6-трихлорпиколината являются известными соединениями; см., например, пример 3 в патенте США 6784137 B2. Высшие сложные эфиры, включая незамещенные или замещенные сложные C7-C11 арилалкиловые эфиры, могут быть получены реакциями прямой этерификацией или переэтерификации с применением способов, известных в области техники.
В реакции замены фтора фторированный пиколинат получают взаимодействием соответствующего хлорированного пиколината с по меньшей мере одним эквивалентом источника фторид-ионов для замены каждого заменяемого хлора-заместителя в кольце.
Типичные источники фторид-ионов представляют собой фториды щелочных металлов, включающие фторид натрия (NaF), фторид калия (KF) и фторид цезия (CsF), где предпочтительными являются KF и CsF. Также могут быть применены фторидные соли, такие как фторид тетрабутиламмония (н-Bu4NF). Предпочтительно реакцию проводят в полярном апротонном растворителе или такой реакционной среде, как диметилсульфоксид (ДМСО), N-метилпирролидинон (ΝΜΡ), NN-диметилформамид (ДМФ), гексаметилфосфорамид (HMPA) или сульфолан. Также могут быть применены добавки, такие как краун-эфиры или агенты фазового переноса, которые, как известно, увеличивают скорость обмена фторидом. Температура, при которой проводят реакцию, не является важной, но обычно составляет от 70°C до 180°C и предпочтительно от 80°C до 120°C. Оптимальная температура будет меняться в зависимости от того, какой применяют растворитель в конкретной реакции. В общем, чем ниже температура, тем медленнее будет протекать реакция. Реакция по настоящему изобретению, как правило, проводится при энергичном перемешивании, достаточном для поддержания по существу однородной дисперсной смеси реагентов.
При проведении реакции фторирования ни скорость, ни порядок добавления реагентов не являются важными. Обычно растворитель и фторид щелочного металла смешивают до того, как в реакционную смесь добавляют хлорированный пиколинат. Типовая реакция, как правило, занимает от 2 до 100 часов и обычно проводится при атмосферном давлении.
В то время как точные количества реагентов не важны, предпочтительно применение такого количества фторида щелочного металла, которое обеспечит по меньшей мере эквимолярное количество атомов фтора по отношению к количеству замещаемых атомов хлора в исходном веществе, то есть по меньшей мере эквимолярного количества фторида щелочного металла. После завершения реакции требуемый продукт регенерируют путем применения стандартных способов разделения и очистки.
При аминировании 4-фторпиколинату позволяют реагировать с аммиаком для замещения атома фтора аминогруппой:
В то время как необходимо только стехиометрическое количество аммиака, часто удобно применять большой избыток аммиака. Реакцию проводят в инертном растворителе, предпочтительно полярном апротонном растворителе или в реакционной среде, такой как ДМСО, NMP, ДМФ, HMPA или сульфолан. Альтернативно, может быть применен водный гидроксид аммония с использованием или без использования органического растворителя. Температура, при которой проводят реакцию, не является важной, но, как правило, составляет от 0°C до 45°C и предпочтительно от 10°C до 30°C.
При проведении реакции аминирования 4-фторпиколинат растворяют в растворителе, и в реакционную смесь добавляют аммиак с охлаждением. Избыток газа аммиака, как правило, барботируют через реакционную смесь. Типичная реакция, как правило, занимает от 0,5 до 5 часов и обычно проводится при атмосферном давлении.
Аминсодержащие продукты или промежуточные продукты, получаемые любым из этих способов, могут быть регенерированы обычными способами, такими как выпаривание или экстракция, и могут быть очищены стандартными способами, такими как перекристаллизация или хроматография. На очистку аминсодержащих продуктов или промежуточных продуктов может также влиять протонирование кислотой с образованием соли, которую выделяют с высокой чистотой путем кристаллизации, осаждения или экстракции. Может быть применено множество кислот, таких как соляная кислота, бромистоводородная кислота, азотная кислоты, уксусная кислота или серная кислота. Безводная соляная кислота является предпочтительной кислотой. Очищенную соль затем нейтрализуют основанием с образованием нейтрального аминсодержащего продукта или промежуточного продукта. Могут быть применены неорганические основания, такие как гидроксид натрия, гидроксид калия, карбонат калия, карбонат натрия или гидрокарбонат натрия. Предпочтительны органические основания, такие как триэтиламин. Очистка аминсодержащего продукта или промежуточного продукта может быть выполнена таким образом незамедлительно после стадии аминирования или после проведения последующих реакций, например, галогенирования, связывания.
В реакции обмена галогеном (йодом, бромом или хлором), 6-йодированный, 6-бромированный или 6-хлорированный пиколинат получают взаимодействием соответствующего 6-фторированного пиколината с по меньшей мере одним эквивалентом иона йодида, бромида или хлорида.
Как правило, реакцию обмена галогеном проводят в присутствии большого избытка безводного йодоводорода (HI), бромводорода (HBr) или хлороводорода (HCl). Реакцию, как правило, проводят в отсутствие воды для снижения образования побочных продуктов. Для обмена галогеном, как правило, требуется от 5 до 50 эквивалентов HI, HBr или HCl, предпочтительно от 10 до 20 эквивалентов. Реакция проводят в инертном растворителе, предпочтительно полярном растворителе, таком как диоксан или уксусная кислота. Температура, при которой проводят реакции, не является важной, но, как правило, составляет от 75°C до 150°C и предпочтительно от 100°C до 125°C. Реакцию, как правило, проводят в герметично закрытом реакторе под давлением, в котором могут удерживаться газы HI, HBr или HCl. Типичная реакция занимает, как правило, от 0,5 до 5 часов.
В реакции галогенирования атом хлора, брома или йода вводят в положение 3 молекулы пиколината путем реакции 3-незамещенного пиколината источником галогена в инертном растворителе:
Когда атомом галогена в положении 3 является Cl, источником хлора может быть собственно хлор (Cl2) или реагенты, такие как сульфурилхлорид, N-хлорсукцинимид или 1,3-дихлор-5,5-диметилгидантоин. При использовании хлора или сульфурилхлорида применяют большой избыток хлорирующего агента. При применении хлоргаза реакцию проводят в инертном растворителе, предпочтительно таком растворителе, как дихлорметан, дихлорметан-вода или уксусная кислота. При использовании сульфурилхлорида реакция можно проводить в инертном растворителе, таком как дихлорметан или беспримесный сульфурилхлорид. Температура, при которой проводят реакцию, не является важной, но, как правило, составляет от 0°C до 45°C и предпочтительно от 10°C до 30°C. Типичная реакция, как правило, занимает от 0,5 до 5 часов. Реакцию хлорирования, как правило, проводят при атмосферном давлении.
Когда применяемый хлорирующий агент представляет собой N-хлорсукцинимид или 1,3-дихлор-5,5-диметилгидантоин, реакцию проводят с применением стехиометрического количества хлорирующего реагента. Обнаружено, что в реакциях хлорирования с применением 1,3-дихлор-5,5-диметилгидантоина в качестве хлорирующего агента реагируют оба хлора в гидантоине. Реакцию проводят в инертном полярном растворителе, таком как ДМФ или ацетонитрил. Температура, при которой проводят реакцию, не является важной, но, как правило, составляет от 20°C до 85°C и предпочтительно от 50°C до 80°C. Когда ацетонитрил применяют в качестве растворителя, удобно проводить реакцию при температуре кипения с обратным холодильником. Типичная реакция, как правило, занимает от 0,5 до 5 часов. Реакцию хлорирования, как правило, проводят при атмосферном давлении.
Когда атом галогена в положении 3 является бромом, источником брома может быть собственно бром (Br2) или реагенты, такие как сульфурилбромид, N-бромсукцинимид или 1,3-дибром-5,5-диметилгидантоин. Когда Br2 применяют в качестве агента бромирования, может быть использован большой избыток, и реакцию проводят в инертном растворителе, предпочтительно таком растворителе, как дихлорметан, дихлорметан-вода или уксусная кислота. Температура, при которой проводят реакцию, не является важной, но, как правило, составляет от 0°C до 45°C и предпочтительно от 10°C до 30°C. Типичная реакция, как правило, занимает от 0,5 до 5 часов. Реакцию бромирования обычно проводят при атмосферном давлении.
Когда применяемый агент бромирования представляет собой N-бромсукцинимид или 1,3-дибром-5,5-диметилгидантоин, реакцию проводят с применением стехиометрического количества реагента бромирования. Реакцию проводят в инертном полярном растворителе, таком как ДМФ или ацетонитрил. Температура, при которой проводят реакцию, не является важной, но, как правило, составляет от 20°C до 85°C и предпочтительно от 50°C до 80°C. Когда ацетонитрил применяют в качестве растворителя, удобно проводить реакцию при температуре флегмы. Типичная реакция, как правило, занимает от 0,5 до 5 часов. Реакцию бромирования, как правило, проводят при атмосферном давлении.
Когда атом галогена в положении 3 представляет собой I, источником йода может быть собственно йод (I2) или реагенты, такие как монохлорид йода или N-йодсукцинимид. Йодная кислота может быть использована вместе с I2. Когда I2 используют в качестве йодирующего реагента, может быть использован большой избыток I2, и реакцию проводят в инертном растворителе, предпочтительно, таком растворителе, как дихлорметан, дихлорметан-вода, метиловый спирт или уксусная кислота. Температура, при которой проводят реакцию, не является важной, но, как правило, составляет от 0°C до 45°C и предпочтительно от 10°C до 30°C. Типичная реакция, как правило, занимает от 0,5 до 5 часов. Реакцию йодирования, как правило, проводят при атмосферном давлении.
В реакции связывания 6-йод, бром или хлорпиколинат реагирует с арильным, алкильным или алкенильным металлическим соединением, где металлом является Zn-галогенид, Zn-R, три-(C1-C4 алкил)олово, медь или B(OR2)(OR3), где R2 и R3 независимо друг от друга представляют собой водород, C1-C4 алкил или, взятые вместе, образуют этиленовую или пропиленовую группу, в присутствии катализатора на основе переходного металла:
«Катализатор» представляет собой катализатор на основе переходного металла, в частности, палладиевый катализатор, такой как диацетат палладия или дихлоридбис(трифенилфосфин)палладия(II) или никелевый катализатор, такой как никель(II), ацетилацетонат или дихлорид бис(трифенилфосфин)никеля(II). Кроме того, катализаторы могут быть получены in situ из солей металлов и лигандов, таких как ацетат палладия и трифенилфосфин или хлорид никеля(II) и трифенилфосфин. Эти in situ катализаторы могут быть получены предварительным взаимодействием соли металла и лиганда с последующим добавлением к реакционной смеси, или отдельным добавлением соли металла и лиганда непосредственно в реакционную смесь.
Как правило, реакции связывания проводят в отсутствие кислорода с применением инертного газа, такого как азот или аргон. Способы, применяемые для удаления кислорода из реакционных смесей, где происходит связывание, такие как барботирование инертным газом, известны специалистам в области техники. Примеры таких способов описаны в The Manipulation of Air-Sensitive Compounds, 2-е издание; Редакторы Shriver, D. F., Drezdzon, М. A.; Wiley-Interscience, 1986. Применяют субстехиометрические количества катализатора, как правило, от 0,0001 эквивалента до 0,1 эквивалента. Дополнительные количества лиганда могут быть необязательно добавлены для увеличения устойчивости катализатора и его действия. Дополнительно, добавки, такие как Na2CO3, K2CO3, KF, CsF и NaF, как правило, добавляют к реакции связывания. Реакция связывания, как правило, требует от 1 до 5 эквивалентов такой добавки, предпочтительно от 1 до 2 эквивалентов. Вода может быть необязательно добавлена к реакции связывания для увеличения растворимости этих добавок. Реакция связывания, как правило, требует от 1 до 3 эквивалентов арильного, алкильного или алкенильного металлического соединения, предпочтительно от 1 до 1,5 эквивалентов. Реакцию проводят в инертном растворителе, таком как толуол, тетрагидрофуран (ТГФ), диоксан или ацетонитрил. Температура, при которой проводят реакцию, не является важной, но, как правило, составляет от 25°C до 150°C и предпочтительно от 50°C до 125°C. Типичная реакция, как правило, занимает от 0,5 до 24 часов. Никакого специфического порядка добавления реагентов, как правило, не требуется. На практике часто проще объединять все реагенты кроме катализатора и затем удалять кислород из реакционной смеси, в которой будет протекать реакция связывания. После удаления кислорода может быть добавлен катализатор для инициирования реакции связывания.
Когда Met часть арильного, алкильного или алкенильного металлического соединения представляет собой Zn-галогенид, Zn-R или медь, может быть необходимой защита реакционноспособных функциональных групп. Например, если присутствует амино-заместитель (-NHR или -NH2), может быть необходимой защита этих реакционноспособных групп. В области техники известно множество групп для защиты аминогрупп от реакции с металлорганическими реагентами. Примеры таких блокирующих групп описаны в Protective Groups in Organic Synthesis, 3-е издание; Редакторы Greene, T. W.; Wuts, P. G. M.; Wiley-Interscience, 1999. Выбором применяемого металла в R-Met зависит от многих факторов, таких как стоимость, устойчивость, реакционная способность и необходимость в защите реакционноспособных функциональных групп.
Продукты, полученные любым из этих способов, могут быть регенерированы обычными способами, такими как выпаривание или экстракция, и могут быть очищены стандартными способами, такими как перекристаллизация или хроматография.
Следующие примеры представлены для иллюстрации настоящего изобретения.
Примеры
Получение исходного вещества
Пример A. Пропан-2-ил 4,5,6-трихлорпиколинат
Метил 4,5,6-трихлорпиколинат (14,19 граммов (г), 59,0 миллимоль (ммоль)) суспендировали в 2-пропаноле (150 миллилитров (мл)) в круглодонной колбе объемом 250 мл, оборудованной ловушкой Дина-Старка и обратным холодильником. Добавляли серную кислоту (98% H2SO4; 8,07 г, 82 ммоль) и реакционную смесь нагревали с обратным холодильником. Через 20 часов (ч) нагревания с обратным холодильником, большая часть 2-пропанола (100 мл) отгонялась в первую фракцию дистиллята. Содержимое резервуара отвердевало при охлаждении до комнатной температуры. Полученное твердое вещество перемешивали с этилацетатом (EtOAc; 500 мл) и насыщенным (насыщ.) водным (водн.) раствором гидрокарбоната натрия (NaHCO3; 500 мл). Органический слой отделяли, промывали солевым раствором и затем фильтровали через целит. Органический экстракт концентрировали до 150 мл на роторном испарителе. Добавляли гексан (100 мл) и раствор оставляли при -20°C в течение ночи. Кристаллы собирали, промывали гексаном и высушивали на воздухе (7,58 г, температура плавления 10,6-105,7°C). Второй продукт получали путем концентрации фильтрата с получением в общей сложности 10,36 г (65%) 1H ЯМР (400 МГц, ДМСО-d6) δ 8,23 (с, 1H, пиридин H), 5,16 (септет, J=6,3 Гц, 1H, CHMe2), 1,34 (д, J=6,3 Гц, 6H, CHMe2); 13C{1H} ЯМР (101 МГц, CDCl3) δ 161,9 (CO2R), 150,6, 145,9, 145,0, 133,1, 125,4 (C3), 70,7 (CHMe2), 21,7 (Me). Аналитически рассчитано для C9H8Cl3NO2: C, 40,26; H, 3,00; N, 5,22. Обнаружено: C, 40,25; H, 3,02; N, 5,22.
Пример B. Бензил 4,5,6-трихлорпиколинат
Смесь метил 4,5,6-трихлорпиколината (25 г, 0,10 моль (моль)) и бензилового спирта (100 г, 0,2 моль) в трехгорлой круглодонной колбе объемом 250 мл нагревали в атмосфере азота до 100°C. Добавляли изопропилат титана (0,6 г, 0,02 моль). Через 4 ч при 100°C почти бесцветный раствор охлаждали и переносили в одногорловую круглодонную колбу объемом 250 мл. Избыток бензилового спирта удаляли под вакуумом с получением почти белого твердого вещества (31 г, 94%): температура плавления 125-126,5°C; 1H ЯМР (400 МГц, CDCl3) δ 8,08 (с, 1H, пиридин H), 7,42 (м, 2H, фенил), 7,31 (м, 3H, фенил), 5,40 (с, 2H, CH2Ph); 13C{1H} ЯМР (101 МГц, CDCl3) δ 162,0 (CO2R), 150,4, 145,0, 144,9, 134,7, 133,1, 128,3 (фенил CH), 125,4 (пиридин CH), 67,88 (CH2Ph).
Пример C. Бензил 4,5,6-трихлорпиколинат
Круглодонная колба на 22 л была оснащена термопарой, механической мешалкой и ловушкой Дина-Старка, связанной с азотным барботером. Сосуд продували азотом и затем добавляли 4,5,6-трихлорпиколинат (2547 г, 10,07 моль), п-толуолсульфоната пиридиния (PPTS; 130 г, 0,52 моль), бензиловый спирт (2249 г, 20,8 моль) и ксилолы (10278 г). Начинали перемешивание и резервуар нагревали до 140-145°C. Азеотропную смесь ксилолы/вода собирали в ловушке Дина-Старка в течение 5 ч. Общее количество дистиллята составляло 4750 г (415 г составляла вода). После того как вода прекращала переходить в первую фракцию дистиллята, из реактора отбирали образец и анализировали высокоэффективной жидкостной хроматографией (ВЭЖХ), чтобы гарантировать остаток исходной карбоновой кислоты менее 1,5% площади хроматограммы. Реакционную смесь оставляли охлаждаться до комнатной температуры и перемешивали в течение ночи. Ксилолы (4000 г) удаляли перегонкой под вакуумом. Раствор охлаждали до 85-100°C и затем вакуумно переносили в сосуд с рубашкой для кристаллизации объемом 30 л, оснащенный механической мешалкой и термопарой. Вакуум наполняли азотом и азотный барботер помещали на сосуд для кристаллизации. В течение 15 минут (мин) к раствору кслилола добавляли изопропиловый спирт (IPA; 6200 г). Полученной взвеси позволяли медленно охладиться до комнатной температуры и затем охлаждали дополнительно до 5°C. Твердое вещество собирали путем фильтрации и фильтровальный осадок промывали холодным (5-10°C) IPA (3731 г). Твердое вещество высушивали на воздухе до постоянной массы с получением белых кристаллов (2765 г, газовая хроматография (ГХ) внутренний стандарт чистоты 96,5%, 84,3%).
Обмен фтором
Пример 1a. Пропан-2-ил 4,5,6-трифторпиколинат
Трехгорлая колба объемом 250 мл была оборудована механической мешалкой, ловушкой Дина-Старка со входом для азота и термопарой. Колбу продували азотом и добавляли CsF (23,38 г, 154 ммоль). Добавляли безводный ДМСО (124 мл) и атмосферу над суспензией разрежали при помощи вакуумного насоса/заполняли (5×) азотом. Суспензию нагревали при 80°C в течение 30 минут. ДМСО (20 мл) отгоняли под вакуумом при 75°C для удаления любой остаточной воды. Добавляли пропан-2-ил 4,5,6-трихлорпиколинат (13,45 г, 50,1 ммоль) на фоне продувки азотом. Атмосферу над реакционной смесью разрежали при помощи вакуумного насоса/заполняли (3×) азотом и нагревали при 100°C в течение 1 ч при энергичном перемешивании.
Вторая трехгорлая колба объемом 250 мл была оборудована механической мешалкой, ловушкой Дина-Старка со входом для азота и термопарой. Колбу продували азотом и добавляли CsF (24,41 г, 0,160 ммоль). Добавляли безводный ДМСО (30 мл) и атмосферу над суспензией разрежали при помощи вакуумного насоса/заполняли (5×) азотом. Суспензию нагревали при 80°C в течение 30 минут. ДМСО (22 мл) отгоняли под вакуумом при 75°C для удаления остаточной воды. Охлажденную реакционную смесь из первой колбы фильтровали через канюлю во вторую колбу в атмосфере азота. Атмосферу над реакционной смесью разрежали при помощи вакуумного насоса/заполняли азотом (5×) и затем нагревали при 100°C в течение 1 ч и затем в течение еще 90 минут при 110°C. ГХ аликвоту образца анализировали при помощи ГХ, анализ показал присутствие 96% пропан-2-ил 4,5,6-трифторпиколината с примесью только 1,4% пропан-2-ил 5-хлор-4,6-дифторпиколината. Раствор неочищенного продукта применяли непосредственно на стадии аминирования без дополнительной очистки. Альтернативно, продукт может быть выделен путем обработки водой, экстракцией при помощи EtOAc и высушиванием с получением светлого желто-коричневого масла: 1H ЯМР (400 МГц, CDCl3) δ 7,94 (дд, JF-H=4,5, 8,7 Гц, 1H, H3), 5,30 (септет, JH-H=6,3 Гц, 1H, CHMe2), 1,44 (д, JΗ-Η=6,3 Гц, 6H, CHMe2); 13C {1H} ЯМР (101 МГц, CDCl3) δ 161,2 (с, CO2iPr), 157,3 (ддд, JF-C=266, 8, 6 Гц, C4/C6), 152,2 (ддд, JF-C=241, 12, 5 Гц, C4/C6), 141,1 (дт, JF-C=14, 7 Гц, C2), 137,0 (ддд, JF-C=270, 31, 13 Гц, C5), 113,8 (дд, JF-C=17, 4 Гц, C3), 70,4 (с, CHMe2), 21,33 (с, ME); 19F ЯМР (376 МГц, CDCl3) δ -74,29 (дд, JF-F=24, 22 Гц, F6), -112,67 (ддд, JF-F=22, 19, JF-H=8,3 Гц, F4), -151,58 (ддд, JF-F=24, 19, JF-H=4,7 Гц, F5).
Пример 1b. Пропан-2-ил 4,5-дифтор-6-(4-хлор-2-фтор-3-метоксифенил)пиколинат
Трехгорлая колба объемом 250 мл была оборудована дефлегматором, входом для азота, механической мешалкой и термопарой. Колбу заполняли CsF (14,2 г, 93,0 ммоль), добавляли безводный ДМСО (80 мл) и атмосферу над суспензией разрежали при помощи вакуумного насоса/заполняли (5×) азотом. Суспензию нагревали при 80°C в течение 30 минут. ДМСО (20 мл) отгоняли под вакуумом для удаления любой остаточной воды. Добавляли твердый пропан-2-ил 4,5-дихлор-6-(4-хлор-2-фтор-3-метоксифенил)пиколинат (10,44 г, 26,6 ммоль), и атмосферу над раствором разрежали при помощи вакуумного насоса/заполняли (5×) азотом. Реакционную смесь нагревали до 105°C в атмосфере азота. Через 4 ч при 105°C ГХ анализ аликвоты образца показал отношение 91:6 дифторзамещенных к монофторзамещенным продуктам. Реакционную смесь оставляли охлаждаться до комнатной температуры.
Вторая трехгорлая колба объемом 250 мл была оборудована механической мешалкой, дефлегматором с входом для азота и термопарой. Колбу продували азотом и добавляли CsF (7,5 г, 49,4 ммоль). Добавляли безводный ДМСО (20 мл) и атмосферу над суспензией разрежали при помощи вакуумного насоса/заполняли (5×) азотом. Суспензию нагревали при 80°C в течение 30 минут. ДМСО (15 мл) отгоняли под вакуумом для удаления остаточной воды. Охлажденную реакционную смесь из первой колбы фильтровали через канюлю во вторую колбу в атмосфере азота. Атмосферу над реакционной смесью разрежали при помощи вакуумного