Производные хромонов, способ их получения и их терапевтические применения
Иллюстрации
Показать всеИзобретение относится к новым производным хромонов общей формулы 1, где: R1 представляет собой один или более чем один из идентичных или различных заместителей на бензольном кольце, каждый из которых независимо представляет собой атом водорода, или атом галогена, или С1-4 алкокси группу, или ОН группу, или группу -O(СН2)nO-, в которой n=1 или 2, R2 представляет собой атом водорода или С1-4 алкильную группу, А и В независимо представляют собой либо атом азота, либо атом углерода, R3 представляет собой атом водорода или один или более чем один из идентичных или различных заместителей, выбранных из группы, состоящей из: атома галогена, С1-4 алкильной группы, С1-4 алкоксигруппы, группы -O(СН2)nO-, в которой n=1 или 2, группы NO2, группы NHSO2R4, группы NHR5, ОН группы, C1-4 галогеноалкильной группы, CN группы, либо R3 составляет кольцо, конденсированное с бензольным кольцом, несущим его, выбранное из группы, состоящей из индола, бензимидазола, карбостирила, бензоксазолона и бензимидазолона, R4 представляет собой С1-4алкильную группу, или С1-4 диалкиламиногруппу, или С1-4 алкоксиалкильную группу, или С1-4 диалкиламиноалкильную группу, R5 представляет собой атом водорода, или С1-4 алкилкарбонильную группу, или С1-4 алкоксикарбонильную группу, и его фармацевтически приемлемым солям, а также к способам их получения и фармацевтическим композициям на их основе и к их применению в качестве лекарственного средства для расстройств центральной нервной системы, поскольку обладают свойствами дофаминергических лигандов D3. 4 н. и 13 з.п. ф-лы, 1 ил., 2 табл., 33 пр.
Реферат
Настоящее изобретение относится к производным хромонов, к способам их получения, к содержащим их фармацевтическим композициям и к их терапевтическим применениям в качестве агонистов, частичных агонистов или антагонистов рецептора дофамина D3 (DRD3) для лечения различных неврологических и психиатрических состояний.
Шизофрения является термином, используемым для описания группы патологий неизвестного происхождения, которые поражают примерно 1% всего населения. Данная патология характеризуется разнообразием симптомов, классифицируемых как позитивные симптомы (галлюцинации, бред, беспорядочные мысли) и негативные симптомы (социальная самоизоляция и аффективная тупость) в пубертатном возрасте начала или в возрасте начала полового созревания, и может персистировать в хронической форме с эпизодами обострения в течение многих лет.
Пациентов, больных шизофренией, можно лечить лекарственными средствами, называемыми нейролептиками, также известными под названием антипсихотические средства. Терапевтический эффект антипсихотических средств общеизвестен как результат блокады рецепторов нейромедиатора дофамина в головном мозге. Существует пять подтипов рецепторов дофамина, называемых D1, D2, D3, D4 и D5 (Sokoloff, P. et al., Novel dopamine receptor subtypes as targets for antipsychotic drugs. Annals New-York Academy of Sciences 1995, 757, 278), и общепринятые антипсихотические средства представляют собой антагонисты рецепторов D2 и D3. Однако антипсихотические средства часто ответственны за нежелательные экстрапирамидальные побочные эффекты (ЭПЭ) и аномальные движения, называемые поздними дискинезиями, которые присущи блокаде рецептора D2 в стриарной области головного мозга. Предположили, что блокада рецептора D3 (DRD3) ответственна за терапевтические эффекты антипсихотических средств (Schwartz J.C. et al., Eur. Neuropsychopharmacol. 2003, 13 fsuppl. 4): S 166). Следовательно, фармакологические агенты, которые селективно модулируют функцию DRD3, считают эффективными антипсихотическими средствами, свободными от неврологических побочных эффектов (международная заявка на патент WO91/15513).
Селективное модулирование рецепторов DRD3 может быть достигнуто с помощью молекул, которые селективно связываются с DRD3 и которые действуют как агонисты, как антагонисты или как частичные агонисты. Антипсихотическая активность в результате модулирования функции DRD3 может быть предсказана на животных путем использования моделей шизофрении на мышах (Leriche L. et al., Neuropharmacology 2003, 45, 174). Кроме того, продемонстрировано, что селективная блокада DRD3, но не одновременная блокада DRD2 и DRD3, повышает внеклеточные уровни дофамина и ацетилхолина, другого нейромедиатора, в префронтальной коре (Lacroix L.P. et al., Neuropsychophamacol. 2003, 28, 839). Дофамин и ацетилхолин в данной области головного мозга являются существенными для когнитивной функции. Следовательно, считают, что селективные антагонисты DRD3 могут улучшить познавательную способность, которая нарушена при шизофрении, а также при нейродегенеративных патологиях, таких как болезнь Альцгеймера.
Антипсихотические средства в целом и арипипразол, кветиапин и оланзапин в частности применяют при лечении острой маниакальной фазы биполярного расстройства. Антагонисты или частичные агонисты DRD3, следовательно, также рассматривают как лекарственные средства для лечения биполярного расстройства.
Генетически модифицированные мыши, несущие мутацию, которая выводит из строя DRD3 (DRD3 "нокаут"), являются менее тревожными в поведенческих тестах, предсказывающих анксиогенную или анксиолитическую активность (Steiner H. et al., 1: Physiol Behav. 1997, 63, 137-41). Следовательно, фармакологическое выведение из строя DRD3, такое как получают путем применения антагониста DRD3, описанного в настоящем изобретении, также является лечением тревоги.
Депрессия представляет собой общую патологию настроения, которая характеризуется ощущениями глубокой тоски, пессимистическими мыслями и занижением самооценки, часто сопровождается утратой энергии, энтузиазма и либидо. Неспособность чувствовать удовольствие от обычно приятных впечатлений, также известную под названием ангедония, также рассматривают как общий симптом при депрессии. Значительную роль в удовольствии и мотивации приписывают дофаминергическим нейронам в области головного мозга, называемой прилежащим ядром (Koob G.F. etal., Sem. Neurosci. 1992, 4, 139; Salamone J.D. et al., Behav. Brain Res. 1994, 61, 117). Следовательно, предполагают, что эти нейроны вовлечены в нейробиологию депрессии, в частности ангедонии, и в терапевтические эффекты некоторых антидепрессивных лекарственных средств (Kapur S. and Mann J. Biol. Psychiatry 1992, 32, 1-17; Willner P., Int. Clin. Psychopharmacol. 1997, 12, S7-S14). Продемонстрировано, что различные антидепрессивные терапии селективно повышают экспрессию DRD3 в прилежащем ядре (Lammers C.H. et al., Mol. Psychiatry 2000, 5, 378), что позволяет предположить, что повышение функции DRD3 могло бы быть новым способом антидепрессивной терапии. Повышение функции рецептора D3 DRD3 может быть достигнуто путем применения агонистов или частичных агонистов DRD3, которые могут, следовательно, быть эффективной терапией для депрессии.
Зависимость от лекарств или веществ, вызывающих привыкание, также известная как наркозависимость, представляет собой хроническую и рецидивирующую патологию, при которой поведение, включающее рискованный прием и поиск веществ, вызывающих привыкание, и навязчивое поведение приема лекарств персистирует несмотря на негативные последствия, получаемые пациентом (Deroche-Gamonet V. Et al., Science 2004, 305, 1014; Vanderschuren L.J. et al., Science 2004, 305, 1017). Феномен отмены, который происходит во время абстиненции от веществ, вызывающих привыкание, может запускаться или обостряться за счет стимулов окружающей среды, которые приобретают мотивационную силу в результате того, что они неоднократно связаны с эффектами лекарства, как у человека (Childress A.R. et al., Am. J. Psychiatry 1999, 156, 11; Robinson Т.Е. et al., Brain Research Reviews 1993, 18, 247), так и у животных (Goldberg S.R. et al., NIDA Res. Monogr. 1981, 37, 241; Arroyo M. Psychopharmacology 1999, 140, 331). У животных высокоселективные агонисты или частичные антагонисты DRD3 специфично снижают ответы на стимулы, связанные с кокаином (Pilla M. Nature, 1999, 400, 371; Le Foil, В. Eur. J. Neurosci. 2002, 15, 2016; Vorel S.R. J. Neurosci. 2002, 22, 9595), с опиатом (Frances H. et al., Neuroreport 2004, 15, 2245) или с никотином (Le FoilB. et al., Mot. Psychiatry 2002, 8, 225), в то же время не влияя на первичные эффекты этих лекарств. Плотность DRD3 является аномально высокой в головном мозге кокаиновых наркоманов (Staley J.K. et al., J. Neurosci. 1996, 16, 6106). Поэтому частичные агонисты или антагонисты DRD3 считают эффективными лекарственными средствами для облегчения абстиненции и снижения риска рецидива.
Болезнь Паркинсона представляет собой патологию, характеризующуюся тремором в покое, ригидностью конечностей и акинезией (затруднениями при начале движений). Это заболевание вызвано дегенерацией дофаминергических нейронов. Лечение болезни Паркинсона основано на замещении дофамина посредством введения L-дигидроксифениламина (L-ДОФА) или прямых агонистов дофамина. Длительное применение L-ДОФА, однако, ассоциировано с очень большим числом случаев появления аномальных движений, называемых дискинезиями. В модели болезни Паркинсона на нечеловекообразных приматах продемонстрировано, что модулирование DRD3 высокоселективными частичным агонистом ослабляет дискинезии (Bezard E. et al., Nat. Med. 2003, 6, 762). Соединения, описанные в настоящем документе, следовательно, рассматривают как аддитивные терапевтические средства при болезни Паркинсона. Однако продемонстрировано, что агонист DRD3 повышает нейрогенез у крыс, поэтому агонисты DRD3 также могут быть лекарственными средствами, которые замедляют прогрессирование этого заболевания.
Мутация в гене DRD3 ассоциирована и сегрегирует совместно с эссенциальным тремором, распространенным и наследуемым неврологическим расстройством, которое характеризуется тремором действия всех частей или части тела в отсутствие какой-либо другой неврологической патологии (Jeanneteau et al., Proc. Natl. Acad. Sci. USA 2006, 103, 10753). Эта мутация повышает функцию DRD3. Нормализация функции DRD3 посредством применения частичных агонистов или антагонистов DRD3 могла бы, следовательно, быть эффективной терапией для эссенциального тремора.
Дофамин контролирует эректильную функцию, и дофаминергические агенты предложены в качестве терапии для эректильной дисфункции (Guiliano F., Ramplin О. Physiol Behav. 2004, 63, 189-201). Более конкретно, проэректильные эффекты дофаминергических агонистов опосредованы рецептором D3 у грызунов (Collins G.T. et al., J. Pharmacol. Exp. Ther., 2009, 329, 210-217), и селективный антагонист рецептора D3 задерживает эякуляцию во время коитуса у крысы (Clement P. et al., J. Sex. Med., 2009, 6, 980-988). Агонисты, частичные агонисты и антагонисты DRD3, такие как описаны в настоящем изобретении, могут, таким образом, быть терапией для различных дисфункций эректильной функции.
В литературе упомянуты фенилпиперазинхромоны для применения при борьбе с малярией в Biochemical and Biophysical Research Communications 2007, 358(3), 686. В Indian J. Chem., section B, 2002, 41 B(4), 817, описаны соединения фенилпиперазинометилхромона. Манниховы основания, использующие метоксихромоны, известны из Farmaco Edizione Scientifica 1977, 32(9), 635. В описании патента US 3410851 описаны флавоны, обладающие противосудорожными, анальгезирующими и бронходилататорными свойствами. Соединения по настоящему изобретению отличаются тем фактом, что они имеют углеродную цепь из 4 метиленов между хромоновой группировкой и фенилпиперазином, которая придает им свойство лигандов дофаминергического рецептора D3.
В заявках на патенты WO 2003028728, WO 2004004729 и WO 2006077487 и в описании патента ЕР 1841752 описаны гетероарилфенилпиперазинбутилкарбоксамиды в качестве лигандов DRD3. В заявке на патент WO 2008009741 упомянуты хромен- и тиохроменкарбоксамиды, демонстрирующие сродство к дофаминергическому рецептору D3, для применения в качестве антипсихотических средств. В заявке на патент WO 2006072608 упомянуты арилпиперазины, обладающие модулирующими свойствами в отношении дофаминергических и серотонинергических рецепторов, для применения при нейропсихиатрических расстройствах, таких как шизофрения. В публикации J. Med. Chem. 2009, 52, 151 также упомянуты те же производные. Все эти продукты, описанные в цитируемых выше описаниях патентов, имеют карбоксамидную цепь в своей структуре. Продукты по настоящему изобретению отличаются от описанных соединений тем, что они не имеют карбоксамидной цепи, но неожиданно являются эффективными лигандами дофаминергического рецептора D3.
Как использовано выше, термин "рецептор дофамина D3", "рецептор D3" или "DRD3" означает подтип рецептора дофамина, главным образом экспрессирующийся в лимбической системе (Sokoloff P et al., Nature, 1990, 347, 146-151). DRD3 описан в международной заявке на патент WO 91/15513.
Как использовано выше, термин "частичный агонист рецептора D3" означает соединение, которое образует комплекс с DRD3 и действует как комбинированный агонист-антагонист, то есть он индуцирует физиологический ответ более низкой интенсивности, чем природный медиатор, дофамин. In vitro в клетке, экспрессирующей DRD3, частичный агонист DRD3 продуцирует активный ответ, максимальная интенсивность которого ниже, чем у ответа, продуцируемого дофамином или полным агонистом, например квинпиролом (транс(-)-4aR-4,4а,5,6,7,8,8а,9-октагидро-5-пропил-1Н(или 2Н)пиразоло [3,4g]хинолином). Частичный агонист DRD3 может также частично предотвращать ответ, продуцируемый дофамином или его полными агонистами. In vivo частичный агонист DRD3 продуцирует дофаминергические ответы, в частности, когда уровень дофамина снижен, как в случае у крыс, имеющих повреждения, вызванные 6-гидроксидофамином, или у обезьян с интоксикацией 1-метил-4-фенил-1,2,3,6-тетрагидропиридином (МФТП). Кроме того, in vivo частичный агонист DRD3 может действовать как антагонист, в частности, когда DRD3 подвергается ограниченной стимуляции дофамином.
"Антагонист DRD3" означает молекулу, которая образует комплекс с DRD3 и способна к предотвращению ответа, запускаемого дофамином или его агонистом в клетке, экспрессирующей DRD3.
Как используют в данной заявке, термин "соли" означает соли присоединения неорганической кислоты или основания соединений по настоящему изобретению. Предпочтительно соли являются фармацевтически приемлемыми, то есть они нетоксичны для пациента, которому их вводят.
Выражение "фармацевтически приемлемый" относится к молекулярным субстанциям и композициям, которые не производят какого-либо вредного аллергического эффекта или другой нежелательной реакции при введении животному или человеку.
При использовании в данной заявке выражение "фармацевтически приемлемый эксципиент" включает любой разбавитель, адъювант или эксципиент, такой как консервант, наполнитель, разрыхлитель, увлажняющий агент, эмульгатор, диспергирующий агент, антибактериальный или противогрибковый агент, либо также агенты, которые дадут возможность замедления всасывания и резорбции в тонком кишечнике и пищеварительной системе. Применение этих сред или векторов хорошо известно в данной области техники. За исключением тех случаев, где агент химически несовместим с производным хромона, рассматривают его применение в фармацевтических композициях, содержащих соединения в соответствии с изобретением.
В контексте изобретения термин "лечение", как используют в данной заявке, означает предупреждение или ингибирование возникновения или прогрессирования состояния, к которому применяют этот термин, или одного или более чем одного симптома этого состояния.
"Терапевтически эффективное количество" означает количество производного хромона, которое эффективно при получении желаемого терапевтического эффекта в соответствии с изобретением. Согласно изобретению термин "пациент" относится к человеку или к млекопитающему, отличному от человека, пораженному или склонного к поражению патологией. Предпочтительно пациент является человеком.
В контексте настоящего изобретения С1-4алкильную группу понимают как нормальную или разветвленную углеводородную цепь, содержащую от 1 до 4 атомов углерода, например метильную группу, этильную группу, пропильную группу или бутильную группу.
В контексте настоящего изобретения С1-4алкокси группу понимают как нормальную или разветвленную углеводородную цепь, содержащую от 1 до 4 атомов углерода и атом кислорода, например метокси группу, этокси группу, пропокси группу или бутокси группу.
В контексте настоящего изобретения С1-4тиоалкокси группу понимают как нормальную или разветвленную углеводородную цепь, содержащую от 1 до 4 атомов углерода, атом кислорода и атом серы, например тиометокси группу, тиоэтокси группу, тиопропокси группу или тиобутокси группу.
В контексте настоящего изобретения С1-4диалкиламиногруппу понимают как амин, двузамещенный нормальными или разветвленными С1-4алкильными группами, например группу диметиламино, группу диэтиламино, группу дипропиламино или группу дибутиламино.
В контексте настоящего изобретения галоген понимают как фтор, хлор или бром.
В контексте настоящего изобретения С1-4алогеноалкильную группу понимают как С1-4алкильную группу, монозамещенную, двузамещенную или тризамещенную галогеном, например группу CF3, группу CHF2, группу CH2F, группу CCl3, группу CHCl2, группу CH2Cl, группу CBr3, группу CHBr2 или группу CH2Br group.
В контексте настоящего изобретения С1-4диалкиламиноалкильную группу понимают как С1-4диалкиламиногруппу, как определено выше, связанную с С1-4алкильной группой атомом углерода, например диметиламинометильную группу, диметиламиноэтильную группу, диэтиламинометильную группу или диэтиламиноэтильную группу. В контексте настоящего изобретения C1-4алкоксиалкильную группу понимают как С1-4алкильную группу, как определено выше, связанную с С1-4алкильной группой атомом углерода, например метоксиметильную группу, этоксиметильную группу, метоксиэтильную группу или этоксиэтильную группу.
В контексте настоящего изобретения С1-4гидроксиалкильную группу понимают как алкильную группу, как определено выше, в которой атом водорода замещен гидроксильной группой, например группу CH2OH, группу C2H4OH, группу С3Н6ОН или группу С4Н8ОН.
В контексте настоящего изобретения С1-4алкилкарбонильную группу понимают как алкильную группу, как определено выше, связанную с карбонильной группой атомом углерода, например группу СОСН3, группу СОС2Н5, группу СОС3Н7 или группу COC4H9.
В контексте настоящего изобретения С1-4алкоксикарбонильную группу понимают как алкокси группу, как определено выше, связанную с карбонильной группой атомом углерода, например группу СООСН3, группу СООС2Н5, группу СООС3Н7 или группу COOC4H9.
В контексте настоящего изобретения С1-4фенилалкильную группу понимают как фенильную группу, связанную атомом углерода с алкильной группой, как определено выше.
Изобретение относится к производным хромонов, к способам их получения и к их применению в качестве лекарственного средства, в качестве лигандов рецептора DRD3, для лечения неврологических или психиатрических заболеваний, состояний или расстройств. Эти соединения соответствуют общей формуле 1:
общая формула 1
где:
R1 представляет собой один или более чем один из идентичных или различных заместителей на бензольном кольце, каждый из которых независимо представляет собой атом водорода или атом галогена, или С1-4алкокси группу, или ОН группу, или С1-4алкильную группу или группу -O(СН2)nO-, в которой n=1 или 2.
- R2 представляет собой атом водорода или С1-4алкильную группу.
- А и В независимо представляют собой либо атом азота, либо атом углерода.
- R3 представляет собой атом водорода или один или более чем один из идентичных или различных заместителей, выбранных из группы, состоящей из: атома галогена, С1-4алкильной группы, С1-4алкокси или С1-4тиоалкокси группы, группы -O(СН2)nO-, в которой n=1 или 2, группы NO2, группы NHSO2R4, группы NHR5, ОН группы, С1-4алогеноалкильной группы, CN группы, C1-4алкоксикарбонильной группы, С1-4алкилкарбонильной группы, C1-4гидроксиалкильной группы и бензильного или фенильного заместителя, необязательно замещенного С1-4алкокси или С1-4алкильной группой, или атомом галогена,
- либо R3 составляет кольцо, конденсированное с бензольным кольцом, несущим его, выбранное из группы, состоящей из нафталина, индола, бензимидазола, карбостирила, бензоксазолона и бензимидазолона.
- R4 представляет собой С1-4алкильную группу, или C1-4диалкиламиногруппу, или С1-4алкоксиалкильную группу, или C1-4диалкиламиноалкильную группу либо фенильную или фенил-С1-4алкильную группу,
- R5 представляет собой атом водорода, или С1-4алкилкарбонильную группу, или С1-4алкоксикарбонильную группу,
а также их фармацевтически приемлемые соли.
В соответствии с изобретением соединения общей формулы (I) представляют собой соединения, где:
- R1 представляет собой один или более чем один из идентичных или различных заместителей, выбранных из группы, состоящей из С1-4алкокси группы, ОН группы и группы -O(СН2)nO-, в которой n=1 или 2.
В соответствии с изобретением соединения общей формулы (I) представляют собой соединения, где:
- R2 представляет собой атом водорода.
В соответствии с другим воплощением изобретения соединения общей формулы (I) представляют собой соединения, где R3 представляет собой атом водорода, когда А и/или В представляет собой атом азота.
В соответствии с изобретением соединения общей формулы (I) представляют собой соединения, где:
- А и В одновременно представляют собой атом углерода. В соответствии с изобретением соединения общей формулы (I) представляют собой соединения, где:
- R3 представляет собой один или более чем один из идентичных или различных заместителей, выбранных из группы, состоящей из: атома галогена, С1-4алкокси группы, группы -O(СН2)nO-, в которой n=1 или 2, группы NHSO2R4, ОН группы и CN группы.
В соответствии с другим воплощением изобретения соединения общей формулы (I) представляют собой соединения, где:
-R3 вместе с бензольным кольцом, несущим его, представляет собой индольную группу, или бензимидазольную группу, или карбостирильную группу.
В соответствии с другим воплощением изобретения соединения общей формулы (I) представляют собой соединения, где:
- R1 представляет собой один или два идентичных или различных заместителя, где каждый независимо представляет собой метокси группу или группу -O(СН2)nO-, в которой n=1, или ОН группу.
- R2 представляет собой атом водорода.
- А представляет собой атом углерода и В представляет собой атом азота или атом углерода.
- когда А и В представляют собой атом углерода:
- R3 представляет собой один или два идентичных или различных заместителя, выбранных из группы, состоящей из: атома водорода, CN группы, атома хлора, атома фтора, ОН группы, группы NO2, группы NHSO2R4, группы NHR5, группы CF3, метокси группы,
- или R3 образует кольцо, конденсированное с бензольным кольцом, несущим его, выбранное из группы, состоящей из: бензимидазола, бензоксазолона, индола, бензимидазолона и карбостирила.
-когда А представляет собой атом углерода и В представляет собой атом азота:
- R3 представляет собой атом водорода
- R4 представляет собой метильную группу, или этильную группу, или диметиламиноэтильную группу, или этоксиметильную группу.
- R5 представляет собой атом водорода, группу СОСН3 или группу СООСН3.
Ниже приведены примеры соединений в соответствии с изобретением:
- 6,7-диметокси-3-{4-[4-(2-метоксифенил)-пиперазин-1-ил]-бутил}-хромен-4-он
- 3-{4-[4-(6,7-диметокси-4-оксо-4Н-хромен-3-ил)-бутил]-пиперазин-1-ил}-бензонитрил
- 3-{4-[4-(2,3-дихлорфенил)-пиперазин-1-ил]-бутил}-6,7-диметоксихромен-4-он
- 3-{4-[4-(3-гидроксифенил)-пиперазин-1-ил]-бутил}-6,7-диметоксихромен-4-он
- 6,7-диметокси-3-[4-(4-пиримидин-2-ил-пиперазин-1-ил)-бутил]-хромен-4-он
- 6,7-диметокси-3-[4-(4-пиридин-2-ил-пиперазин-1-ил)-бутил]-хромен-4-он
- 3-{4-[4-(2,3-дифторфенил)-пиперазин-1-ил]-бутил}-6,7-диметоксихромен-4-он
- 3-{4-[4-(1 Н-бензимидазол-4-ил-)пиперазин-1-ил]-бутил}-6,7-диметоксихромен-4-он
- 3-{4-[4-(1Н-индол-4-ил)-пиперазин-1-ил]-бутил}-6,7-диметоксихромен-4-он
- 5-{4-[4-(6,7-Диметокси-4-оксо-4Н-хромен-3-ил)-бутил]-пиперазин-1-ил}-1Н-хинолин-2-он
- 6,7-диметокси-3-{4-[4-(3-нитрофенил)-пиперазин-1-ил]-бутил}-хромен-4-он
- 3-{4-[4-(3-аминофенил)-пиперазин-1-ил-]-бутил}-6,7-диметоксихромен-4-он
- N-(3-{4-[4-(6,7-диметокси-4-оксо-4Н-хромен-3-ил)-бутил]-пиперазин-1-ил}-фенил)-метансульфонамид
- N-(3-{4-[4-(6,7-диметокси-4-оксо-4Н-хромен-3-ил)-бутил]-пиперазин-1-ил}-фен ил)-ацетамид
- метил-(3-{4-[4-(6,7-диметокси-4-оксо-4Н-хромен-3-ил)-бутил]-пиперазин-1-ил}-фенил)-карбамат
- 7-{4-[4-(2,3-дихлорфенил)-пиперазин-1-ил]-бутил}-[1,3]диоксоло[4,5-g]хромен-8-он
- 7-{4-[4-(2,3-дифторфенил)-пиперазин-1-ил]-бутил}-[1,3]диоксоло[4,5-g]хромен-8-он
- 7-{4-[4-(3-нитрофенил)-пиперазин-1-ил]-бутил}-[1,3]диоксоло[4,5-g]хромен-8-он
- 7-{4-[4-(3-аминофенил)-пиперазин-1-ил]-бутил}-[1,3]диоксоло[4,5-g]хромен-8-он
- N-(3-{4-[4-(8-оксо-8Н-[1,3]диоксоло[4,5-g]хромен-7-ил)-бутил]-пиперазин-1-ил}-фенил-ацетамид
- N-(3-{4-[4-(8-оксо-8Н-[1,3]диоксоло[4,5-g]хромен-7-ил)-бутил]-пиперазин-1-ил}-фенил)-метансульфонамид
- N-(3-{4-[4-(8-оксо-8Н-[1,3]диоксоло[4,5-g]хромен-7-ил)-бутил]-пиперазин-1-ил}-фенил)-этансульфонамид
- 2-диметиламиноэтансульфоновой кислоты (3-{4-[4-(8-оксо-8Н-[1,3]диоксоло[4,5-g]хромен-7-ил)-бутил]-пиперазин-1-ил}-фенил)-амид
- 2-метоксиэтансульфоновой кислоты (3-{4-[4-(8-оксо-8Н-[1,3]диоксоло[4,5-g]хромен-7-ил)-бутил]-пиперазин-1-ил}-фенил)-амид
- 7-{4-[4-(1Н-индол-4-ил)-пиперазин-1-ил]-бутил}-[1,3]диоксоло[4,5-g]хромен-8-он
- 3-{4-[4-(3-трифторметилфенил)-пиперазин-1-ил]-бутил}-6,7-диметоксихромен-4-он
- 6-метокси-3-[4-(4-фенилпиперазин-1-ил)-бутил]-хромен-4-он
- 6-метокси-3-{4-[4-(2-метоксифенил)-пиперазин-1-ил]-бутил}-хромен-4-он
- 6-метокси-3-{4-[4-(3-трифторметилфенил)-пиперазин-1-ил]-бутил}-хромен-4-он
- 7-{4-[4-(2,3-дихлорфенил)пиперазин-1-ил-]-бутил}-6-метил-[1,3]диоксоло[4,5-g]хромен-8-он
- 6,7-метокси-7,6-гидрокси-3-{4-[4-(2-метоксифенил)-пиперазин-1-ил]-бутил}-хромен-4-он
- 7-{4-[4-(6,7-диметокси-4-оксо-4Н-хромен-3-ил)-бутил]-пиперазин-1-ил}-3Н-бензоксазо1-2-он
- 4-{4-[4-(6,7-диметокси-4-оксо-4Н-хромен-3-ил)-бутил]-пиперазин-1-ил}-1,3-дигидробензимидазол-2-он.
Изобретение также относится к их фармацевтически приемлемым солям, а также к содержащим их фармацевтическим композициям и к их применению в качестве лекарственных средств, предназначенных для лечения расстройств центральной нервной системы.
Изобретение также относится к способу получения этих соединений.
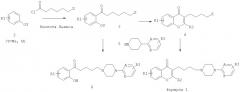
Соединения общей формулы 1 получают в соответствии со схемой 1.
Схема 1
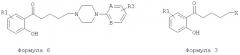
Реакция Фриделя - Крафтса или реакция Фриса с замещенным ароматическим метокси соединением 2 (Y=Me) или замещенным соединением фенола 3 (Y=Н) дает ароматический кетон 3 (Y= Me, H). В этой реакции используют галогенид омега-галогенированной гексановой кислоты, такой как 6-бромгексаноилхлорид. Конденсация происходит с растворителем или без растворителя в присутствии кислоты Льюиса, такой как AlCl3, в соответствии со способом, аналогичным описанному в Chem. Ber. 1939, 72, 1414, или J. Org. Chem. 1955, 20, 38, с хлор- или бромацетилхлоридом или бромидом. В данной заявке в этой реакции используют бромгексаноилхлорид, который конденсируется в орто-положении фенольной функциональной группы с образованием производного 3. Где используют растворитель, можно использовать хлорированный растворитель, такой как метиленхлорид, для реакции при температуре окружающей среды или при низкой температуре либо для реакции при более высокой температуре можно, например, использовать дихлорэтан или 1,1,2,2-тетрахлорэтан. Используемые фенолы с соответствующими заместителями либо имеются в продаже, либо известны из литературы, и их получают путем деметилирования в присутствии агентов, обычно используемых для деметилирования ароматических метокси соединений, такие как НВг и кислоты Льюиса (AlCl3, BBr3). Реакцию Фриделя - Крафтса можно также проводить на метоксилированном ароматическом кольце, богатом электронами. Стадия деметилирования с получением промежуточного соединения 3 может идти после стадии ацилирования. Фенол 3 (Y=Н), ацилированный таким образом, можно циклизировать ацеталем диметилформамида (=ДМФ) или диметиламина (=ДМА) при нагревании с получением галогенированного хромона 4. Эту реакцию замыкания кольца с образованием хромона можно также осуществлять в ДМФ в присутствии PCl5 и эфирата BF3, а также с этилформиатом в присутствии натрия в соответствии с Bull. Soc. Chim. Fr. 1944, 5, 302. Затем галогенобутил-производное хромона 4 объединяют с замещенными арилпиперазинами или гетероарилпиперазинами формулы 5 стандартным способом в присутствии основания, такого как К2СО3 или карбонат цезия, в ацетонитриле или метилэтилкетоне с получением производных формулы 1. Этот метод используют с пиперазинами формулы 5, где А, В и R3 являются такими, как определено выше. Можно использовать вариант этого способа, который включает введение пиперазиновой группировки перед образованием хромонового кольца: таким образом, конденсация пиперазина формулы 5 с галогенированным фенолом формулы 3 в таких же обычных условиях алкилирования в щелочной среде (K2CO3/CH3CN или метилэтилкетон) дает соединения формулы 6. Затем образование хромонового кольца можно осуществлять путем замыкания кольца с ДМФ или ацеталем ДМФ или ДМА. Используя этот способ, введение пиперазина перед циклизацией до хромона дает возможность получить более чистое циклизированное соединение, чем способом образования хромона, начиная с производного 3 (Y=Н). Действительно, условия нагревания для образования кольца ДМФ при повышенной температуре образует диметиламин, который может взаимодействовать с галогенированным производным 3 с получением вторичного продукта (формула 4, Х=NMe2) и требует дополнительной очистки. Специалист в данной области техники сможет выбрать подходящий способ в соответствии с заместителями, которые несет фенилпиперазин 5. Модификации заместителей пиперазина можно также осуществлять на последних стадиях, как, например, используя пиперазин формулы 5 (А=В=С, R3=3-NO2). Восстановление нитрогруппы в продукте формулы 1 (А=В=С, R3=3-NO2) обычно осуществляют путем каталитического восстановления водородом, используя палладий на углероде или никель Ренея, либо путем обработки металлом, таким как железо, в кислой среде с получением соответствующего анилина (формула 1, А=В=С, R3=3-NH2). Анилиновую группу можно, таким образом, ацилировать в присутствии пиридина или другого основания ацетилхлоридом с получением производного ацетамида, метилхлорформиатом с получением метилкарбамата или метансульфонилхлоридом с получением метилсульфонамида. Взаимодействие хлорэтилсульфонилхлорида можно осуществлять таким же путем, а затем виниловое промежуточное соединение можно объединять с диметиламином или с метоксидом натрия с получением соответственно заместителя диметиламиноэтилсульфонамида или метоксиэтилсульфонамида. В литературе упомянуты гетероциклические арилпиперазины, такие как 4-пиперазин-1-ил-1Н-индол, пиперазин-1-ил-1Н-бензимидазол, 7-пиперазин-1-ил-3Н-бензоксазол-2-он, 4-пиперазин-1-ил-1,3-дигидробензимидазол-2-он, 5-пиперазин-1-ил-1Н-хинолин-2-он. Гетероциклические пиперазины могут быть получены путем взаимодействия соответствующих анилинов с азотистыми ипритами (бисхлорэтиламинами). Эти азотистые иприты могут быть N-замещенными защитной группой бензила, которую можно удалить путем простого гидрогенолиза с Pd/C в атмосфере водорода, когда осуществлена конденсация с пиперазином (Fr2504532; Fr2524884; Bioorg. Med. Chem. Lett. 1998, 8, 2675; Bioorg. Med. Chem. Let. 2001, 11, 2345, J. Med. Chem. 2002, 45, 4128; J. Med. Chem. 2004, 47, 871; Synth. Commun. 2006, 36, 1983; Synthesis 1977, 33; Tet Let. 1970, 5265; Chem. Pharm. Bull. 1981, 29, 651 или 1979, 27, 2627; Tet. 2000, 56, 3245).
Таким образом, изобретение также относится к описанным ниже способам получения:
Способ получения соединений общей формулы 1, характеризующийся тем, что получают возможно замещенный хромон формулы 4 (X=Cl, Br, I), который подвергают взаимодействию с пиперазином формулы 5.
Радикалы R1, R2, R3, А и В имеют значения, приведенные выше. Способ получения соединений общей формулы 1, характеризующийся тем, что получают возможно замещенное производное фенола формулы 6, начиная с соединения формулы 3 (X=Cl, Br), и подвергают взаимодействию с ДМФ (=диметилформамид), или диметилацеталем ДМФ, или ДМА (= диметиламин).
Радикалы R1, R3, А и В имеют значения, приведенные выше, в условиях алкилирования в присутствии основания, такого как К2СО3, Cs2CO3 или NEt3, в растворителе, таком как ацетонитрил или метилэтилкетон.
Изобретение также относится к фармацевтической композиции, содержащей по меньшей мере одно соединение общей формулы (I) или его фармацевтически приемлемую соль и фармацевтически приемлемый эксципиент.
С учетом селективного модулирования передач сигналов дофамина, осуществляемых посредством рецептора DRD3 в лимбических областях, которые вовлечены в эмоциональные и когнитивные процессы, соединения по изобретению пригодны при различных терапевтических применениях и не препятствуют дофаминергическим передачам сигналов экстрапирамидальной системы, системы передней доли гипофиза или вегетативной системы (например, самого заднего поля). Соединения по изобретению можно, таким образом, применять для получения фармацевтических композиций и лекарственных средств для лечения неврологических или психиатрических заболеваний, состояний или расстройств, в которые вовлечен рецептор DRD3, таких как психотические состояния.
Кроме того, поскольку эффект антидепрессивных лекарственных средств состоит в повышении экспрессии рецептора DRD3 в областях головного мозга, вовлеченных в мотивацию, соединения по изобретению также способны имитировать действие антидепрессивных лекарственных средств. Соединения по изобретению можно, таким образом, применять для получения фармацевтических композиций и лекарственных средств для лечения депрессии.
С учетом роли рецептора DRD3 в состояниях лекарственной зависимости фармацевтические композиции или лекарственные средства на основе соединений, описанных в настоящем изобретении, можно с пользой вводить при состояниях, ассоциированных с абстиненцией, и/или чтобы способствовать детоксикации индивидуумов, зависимых от кокаина, героина, алкоголя, табака и других веществ, вызывающих привыкание.
Соединения в соответствии с изобретением подобно частичным агонистам рецептора DRD3 в целом можно также применять в качестве дополнительного лечения к лечению болезни Паркинсона L-ДОФА.
Соединения в соответствии с изобретением подобно частичным агонистам и антагонистам рецептора DRD3 в целом можно также применять для лечения эссенциального тремора.
Соответственно, соединения формулы 1, основания или соли можно применять для лечения неврологических или психиатрических состояний, в частности состояний, которые можно лечить агонистами, частичными агонистами или антагонистами рецептора DRD3.
Изобретение также относится к способу лечения неврологических или психиатрических состояний, заболеваний или расстройств, который включает введение соединения формулы 1 в терапевтически эффективном количестве пациенту, которому требуется лечение. Изобретение, кроме того, относится к соединениям формулы 1 для их применения в качестве лекарственных средств.
Изобретение также относится к соединениям формулы 1 для получения лекарственного средства для лечения неврологического или психиатрического заболевания или расстройства, либо эректильной дисфункции, либо зависимости от лекарств или от веществ, вызывающих привыкание.
Изобретение относится к соединениям общей формулы (I) для получения лекарственного средства для лечения болезни Паркинсона, психоза, шизофрении, дискинезий, ассоциированных с болезнью Паркинсона, когнитивной недостаточности, возможно ассоциированной с возрастом или с болезнью Альцгеймера, расстройства настроения, эссенциального тремора, тревоги, депрессии, биполярного расстройства, половой импотенции, преждевременной эякуляции, алкоголизма и никотиновой зависимости.
Соединения формулы 1 в соответствии с изобретением можно вводить пероральным, системным, парентеральным, назальным или ректальным путем. Соединение можно, в частности, вводить пероральным путем в соответствующем препарате. Дозировки соединений формулы 1 в композициях по изобретению можно регулировать до получения количества активного вещества, которое эффективно при получении желаемого терапевтического ответа для композиции, характерной для способа введения. Выбранный уровень дозировки, таким образом, зависит от желаемого терапевтического эффекта, пути введения, желаемой продолжительности лечения и других факторов.
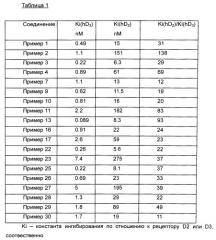
Соединения формулы 1 оценивали in vitro в качестве лигандов DRD3 и модуляторов активности этого рецептора в соответствии с изобретением в клетках, экспрессирующих рекомбинантный рецептор DRD3 человека. Константы ингибирования (Ki) измеряли на основании ингибирования связывания [3H] спиперона, как описано авторами Cussac et al., в Naunyn-Schmiedeberg's Arch. Pharmacol. 2000, 361, 569. Авторы изобретения продемонстрировали, что соединения формулы 1 ведут себя как эффективные лиганды со значениями Ki от 0,1 до 30 наномоль·литр-1. Те же соединения проявляют заметное сродство к рецептору дофамина D2, которое является в 10-200 раз более слабым. Соединения формулы 1. оценивали на их агонистическую, частичную агонистическую или антагонистическую активность путем использования МАР-киназного теста на активность на рекомбинантных рецепторах человека, как описано Cussac D. et al., Mol. Pharmacol. 1999, 56, 1025-1030. Собственные активности соединений формулы 1 составляют от 0 (антагонист) до 0,80 (агонист).
Соединения формулы 1 оценивали in vivo в тесте гиперактивности, индуцированной МК-801, у мыши (Leriche L. et al., Neuropharmacology 2003, 45, 174). Значения ED50 соединений формулы 1 составляют от 0,01 до 6 мг/кг.