Способ прогнозирования риска кардиальных осложнений после ишемического инсульта
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к неврологии и кардиологии. Оценку вариабильности сердечного ритма осуществляют методом суточного холтеровского мониторирования на 21 сутки от момента развития ишемического инсульта. Затем с помощью спектрального анализа определяют мощность низкочастотного спектра и при его значении менее 117 мс2 прогнозируют высокий риск кардиальных осложнений после ишемического инсульта. Способ позволяет повысить точность прогнозирования риска развития кардиальных осложнений после ишемического инсульта за счет выявления определенного значения НЧ - самостоятельного прогностического фактора. 2 прим., 4 таб., 2 ил.
Реферат
Изобретение относится к медицине, в частности, к неврологии и кардиологии при лечении больных, перенесших инсульт.
Инсульт после ишемической болезни сердца (ИБС) является второй по частоте причиной смертности в мире (Murray C.J., Lopez A.D. Global mortality, disability, and the contribution of risk factors: Global Burden of Disease Study. Lancet 1997; 349: 1436-1442). В ряде крупных исследований и мета-анализов было показано, что у пациентов, перенесших ишемический инсульт, частота кардиальных осложнений превалирует над частотой повторных мозговых нарушений (Touze Е. et al. Risk of myocardial infarction and vascular death after transient ischemic attack and ischemic stroke: A systematic review and meta-analysis. Stroke 2005; 36: 2748-2755; Dhamoon M.S. et al. Recurrent stroke and cardiac risks after first ischemic stroke: The Northen Manhattan Study. Neurology 2006; 66: 641-646). Перенесенный инсульт рассматривают как самостоятельный прогностический фактор кардиальных осложнений наравне с ИБС, сахарным диабетом (СД), периферическим атеросклерозом и т.д. (Chaturvedi S. Should stroke be considered both a brain attack and a heart attack? Stroke. 2007; 38: 1713-1714; Dhamoon M.S., Elkind M.S. Inclusion of stroke as an outcome and risk equivalent in risk scores for primary and secondary prevention of vascular diseases. Circulation. 2010; 121: 2071-2078). Так, в одном из исследований на протяжении 2 лет после перенесенного инсульта было обнаружено значительное увеличение риска инфаркта миокарда (ИМ) даже при отсутствии клинических проявлений ИБС (Towfighi A. et al. Utility of Framingham coronary heart disease risk score for predicting cardiac risk after stroke. Stroke. 2012; 43: 2942-2947).
У большинства пациентов с ишемическим инсультом имеется сопутствующий скрытый или манифестирующий коронарный атеросклероз, наличие которого может объяснять повышенный риск коронарных осложнений в постинсультном периоде (Amarenco P. et al. Prevalence of coronary atherosclerosis in patients with cerebral infarction. Stroke. 2011; 42: 22-29). Еще одним из вероятных прогностических факторов кардиальных осложнений называется непосредственное церебральное повреждение, а одним из возможных механизмов его реализации может стать стойкое расстройство вегетативной регуляции ритма сердца (Robinson T.G. et al. Cardiac baroreceptor sensitivity predicts long-term outcome after acute ischemic stroke. Stroke 2003; 34: 705-712). Сердечный ритм является наиболее ярким индикатором изменений состояния вегетативной нервной системы, поэтому исследования вариабельности сердечного ритма (BCP) как показателя, отражающего автономную регуляцию и влияющего на кардиальный прогноз после ишемического инсульта, имеют важное практическое значение (Makikallio A.M. et al. Heart rate dynamics predict poststroke mortality. Neurology 2004; 62: 1822-1826).
Исследования вариабельности сердечного ритма (BCP) при ишемическом инсульте, как предиктора риска внезапной сердечной смерти (BCC) в основном ограничивались изучением влияния локализации очага поражения головного мозга на состояние вегетативной нервной системы (Tokgozoglu S.L. et al. Effect of stroke localization on cardiac autonomic balance and sudden death. Stroke 1999; 30: 1307-1311). В основу дизайна исследований была положена гипотеза о том, что топические особенности церебрального ишемического поражения вызывают грубую дизрегуляцию симпато-вагальных взаимодействий, что может ассоциироваться с развитием кардиальных аритмий. Показано, что вовлечение в поражение правого полушария головного мозга и, особенно, правого островка значительно увеличивает вероятность внезапной кардиальной смерти (Naver Н.K. et al. Reduced heart rate variability after right-sided stroke. Stroke 1996; 27: 247-251). В другом проспективном исследовании BCC и РИМ чаще регистрировались в группе пациентов с ишемическим инсультом и поражением левого островка (Laowattana S. et al. Left insular stroke is associated with adverse cardiac outcome. Neurology. 2006; 66: 477-483). В повышении смертности (сердечнососудистой и вызванной другими причинами) в отдаленном постинсультном периоде также была выявлена прогностическая роль снижения такого показателя BCP, как стандартное отклонение нормальных кардиоинтервалов (SDNN) (Colivicchi F. et al. Prognostic implications of right-sided insular damage, cardiac autonomic derangement, and arrhythmias after acute ischemic stroke. Stroke 2005; 36: 1710-1715).
Следует отметить, что основной целью большинства выполненных работ было продемонстрировать самостоятельное влияние поражения мозговых структур на состояние BCP и на постинсультный прогноз. Поэтому данные исследования имели жесткие критерии отбора, например не включались пациенты с повторным инсультом, СД, предшествующими церебральными изменениями, нарушениями ритма сердца, бронхолегочной патологией. Однако у большинства пациентов с ишемическим поражением головного мозга выявляется сопутствующая кардиальная, бронхолегочная, эндокринная патология, наличие инсульта в анамнезе, что может самостоятельно влиять на течение постинсультного периода и выживаемость больных.
В качестве прототипа мы использовали работу Makikallio A.M. et al. «Heart rate dynamics predict poststroke mortality». Neurology 2004; 62: 1822-1826, где у больных после инсульта в рамках 7-летнего проспективного наблюдения анализировались все причины летальных исходов, включая кардиальные нарушения. При изучении временных и спектральных характеристик BCP была выявлена значимость снижения логарифмической производной композитного спектра очень низких (ОНЧ) и ультранизких частот (УНЧ) BCP как предиктора повышенной смертности в отдаленном постинсультном периоде. Однако в исследование отбирались больные только с первым инсультом, не имеющие другой цереброваскулярной патологии. Оценивались только смертельные случаи. Логарифмическая производная композитного спектра ОНЧ и УНЧ изучалась только в отношении смертности у разной категории исследуемых, включая здоровых лиц и кардиологических больных (Bigger J.T. Jr. et al. Power law behavior of R-R-interval variability in healthy middle-aged persons, patients with recent acute myocardial infarction, and patients with heart transplants. Circulation 1996; 93: 2142-2151). Кроме того, физиологическая интерпретация и прогностическое значение собственно низкочастотных компонентов BCP (ОНЧ и УНЧ) неизвестны и требуют дальнейшего изучения (Вариабельность сердечного ритма. Стандарты измерения, физиологической интерпретации и клинического использования. Рабочая группа Европейского Кардиологического общества и Северо-Американского общества стимуляции и электрофизиологии., Вестник аритмологии, 1999; 11: 53-78).
С учетом данных обстоятельств возникла необходимость поиска универсального предиктора повышенного риска любых кардиальных осложнений после ишемического инсульта для персонификации профилактических мероприятий и улучшения отдаленного прогноза заболевания.
Техническим результатом изобретения является высокая информативность и универсальность прогнозирования риска кардиальных осложнений после ишемического инсульта у пациентов с сопутствующими цереброваскулярными, кардиальными, эндокринными заболеваниями на раннем этапе заболевания (на 21 сутки от момента развития инсульта).
Технический результат достигается тем, что больному на 21 сутки ишемического инсульта с помощью суточного непрерывного холтеровского мониторирования (ХМ) осуществляют спектральный анализ BCP и оценивают значения мощности низких частот (НЧ). При выявлении мощности НЧ<117 мс2 прогнозируют высокий риск кардиальных осложнений после ишемического инсульта и осуществляют коррекцию медикаментозной терапии для профилактики сердечных нарушений.
Способ осуществлялся следующим образом. Всем больным на 21 сутки ишемического инсульта проводили суточное ХМ с оценкой BCP методом спектрального анализа. Анализ в частотной области (спектральная плотность мощности) показывает периодические колебания сигналов частоты сердечных сокращений в разрезе различных частот и амплитуд; а также предоставляет информацию касательно относительной интенсивности колебаний (называемой изменчивостью или мощностью) синусового ритма сердца. Мощность в диапазоне низких частот отражает низкочастотную составляющую BCP, что характеризует симпатический тонус. Для спектрального анализа использовали отечественные кардиорегистраторы «Кардиотехника 4000» и «Кардиотехника-04» (ИНКАРТ, Санкт-Петербург) с трехканальной записью ЭКГ (отведения V4, Y, V6). При обнаружении на 21 сутки от момента развития ишемического инсульта мощности НЧ<117 мс2 диагностировали высокий риск кардиальных осложнений после ишемического инсульта и принимали необходимые меры по их профилактике. Таким образом, использование значения мощности НЧ<117 мс2 в качестве универсального прогностического фактора кардиальных осложнений может быть перспективным для персонификации профилактических мероприятий и улучшения прогноза жизни пациента.
Всего в наблюдение было включено 148 пациентов с ишемическим инсультом; из них 94 (64%) мужчины и 54 (36%) женщины. Возраст пациентов на момент включения в исследование варьировал от 22 до 83 лет, в среднем составил - 60±14 лет. Атеротромботический инсульт был диагностирован у 56 (38%) пациентов, кардиоэмболический - у 38 (26%), лакунарный - у 42 (28%) пациентов. У 5 (3%) больных были выявлены другие уточненные подтипы (гемодинамический и по типу гемореологической микроокклюзии), у 7 (5%) больных причина инсульта не была уточнена (криптогенный инсульт). Имеющаяся у больных сопутствующая сердечно-сосудистая патология представлена в таблице 1.
Всем больным проводилась суточное ХМ, выполненное с помощью носимого портативного монитора с непрерывной регистрацией ЭКГ в течение 24 часов. Для исключения острых цереброгенных влияний на BCP ХМ выполнялось на 21-22-е сутки от момента развития инсульта. Использованы отечественные кардиорегистраторы «Кардиотехника 4000» и «Кардиотехника-04» (ИНКАРТ, Санкт-Петербург) с трехканальной записью ЭКГ (отведения V4, Y, V6). Осуществлялась непрерывная запись в течение всего времени наблюдения с предоставлением визуальной информации об ЭКГ в любом месте записи.
| Таблица 1. | |
| Заболевания сердечно-сосудистой системы | |
| Заболевание сердечно-сосудистой системы | Число больных (%) |
| Артериальная гипертония | 129 (87%) |
| Атеросклероз | 124 (84%) |
| Хроническая сердечная недостаточность | 87 (59%) |
| Ишемическая болезнь сердца | 49 (33%) |
| Пароксизмальная форма фибрилляции предсердий | 34 (23%) |
| Сахарный диабет | 32 (22%) |
| Инсульт в анамнезе | 26 (18%) |
| Пороки сердца (ревматические, дегенеративные) | 20 (14%) |
| Пролапс митрального клапана, открытое овальное окно | 18 (12%) |
| Инфекционный эндокардит | 4 (3%) |
С помощью спектрального анализа BCP в соответствии с рекомендациями рабочей группы Европейского кардиологического общества и Североамериканского общества стимуляции и электрофизиологии (Вариабельность сердечного ритма. Стандарты измерения, физиологической интерпретации и клинического использования. Рабочая группа Европейского Кардиологического общества и Северо-Американского общества стимуляции и электрофизиологии. Вестник аритмологии 1999; 11: 53-78) на основании 24-часовой записи ЭКГ в настоящей работе проводился анализ спектральных характеристик BCP, таких как мощность (мс2) в диапазоне высокочастотных колебаний (ВЧ, 0,15-0,4 Гц, средний уровень активности парасимпатического звена регуляции), низкочастотных колебаний (НЧ, 0,04-0,15 Гц, средний уровень активности симпатического и парасимпатического звена).
Компьютерную статистическую обработку полученных результатов проводили на основе пакета программ STATISTICA 7.0 (StatSoft, США). Для определения предикторов неблагоприятного исхода заболевания были построены кривые времени наступления кардиальных осложнений (по методу Каплана-Мейера), а также использовался регрессионный анализ в моделях пропорционального риска Кокса. Многофакторному анализу предшествовал однофакторный. В многофакторный анализ включались переменные, для которых значения критерия статистической значимости при однофакторном анализе составили <0,05. Многофакторный регрессионный анализ выполнялся пошаговым методом. Статистически достоверными различия считали при значениях p<0,05.
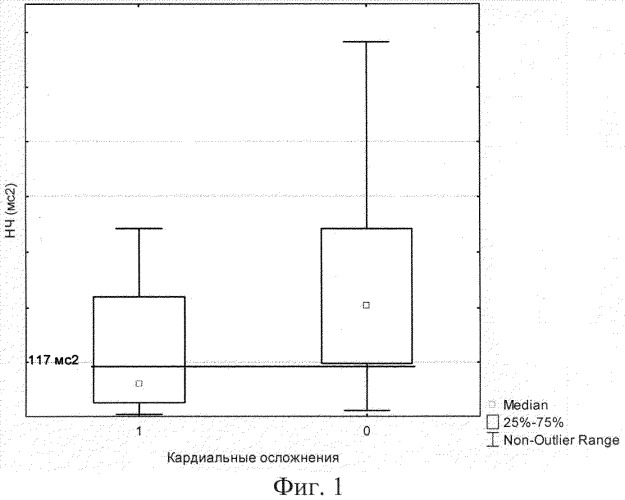
При сопоставлении значений медиан, 25- и 75-процентилей показателей НЧ у больных, перенесших (1) и не переносивших кардиальные осложнения (0), установлена пороговая величина параметра - НЧ≤117 мс2. (фиг.1).
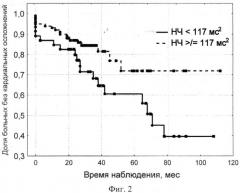
Далее выполнен анализ выживаемости пациентов без кардиальных осложнений (по методу Каплана-Мейера) в зависимости от величины НЧ для оценки предиктивной роли установленного порогового значения. В качестве «отрезных точек» количественных признаков выбирались значения переменных, обеспечивающие оптимальное соотношение чувствительности и специфичности. Выделенные прогностически неблагоприятные значения переменных включались в однофакторный регрессионный анализ и выбирались те из них, для которых связь с неблагоприятным исходом стала наиболее выраженной. Для выявления факторов риска были построены кривые времени наступления неблагоприятного исхода (Каплана-Мейера). Доля больных без кардиальных осложнений в постинсультном периоде в зависимости от показателей мощности спектра НЧ показана на фигуре 2.
Как видно, расхождение кривых, характеризующих 50-процентную долю больных свободных от кардиальных осложнений, при показателе НЧ меньше 117 мс2 наступало достоверно раньше. У остальных пациентов с НЧ равным или более 117 мс2 частота осложнений была достоверно меньше и не превышала 29% при продолженном наблюдении (до 10 лет).
Длительность проспективного наблюдения после ишемического инсульта варьировала от 1 года до 10 лет, в среднем составила 35±12 месяцев. За время наблюдения у 17 (11,5%) пациентов зарегистрировано 19 кардиальных осложнений (табл.2).
| Таблица 2. | |
| Кардиальные осложнения за период проспективного наблюдения | |
| Кардиальные осложнения | Число случаев (Σ=19) |
| Нестабильная стенокардия | 7 |
| Острая сердечная недостаточность | 5 |
| Инфаркт миокарда | 4 |
| Внезапная сердечная смерть | 3 |
При сопоставительном анализе был получен ряд качественных различий между пациентами, перенесшими кардиальные осложнения и без таковых. Для уточнения прогностического значения с помощью однофакторного анализа для каждого признака был рассчитан относительный риск (ОР) кардиальных осложнений и получены статистически значимые величины р-значения и доверительные интервалы (ДИ) (табл.3).
| Таблица 3. | |||
| Прогностические факторы и относительные риски кардиальных осложнений после ишемического инсульта | |||
| Показатель | ОР | р | 95% ДИ |
| Возраст >67 лет | 1,74 | 0,005 | -0,03-1,00 |
| Поражение островка | 3,14 | 0,009 | -0,85-3,139 |
| Инсульт в анамнезе | 2,312 | 0,04 | 0,08-1,6 |
| Мощность НЧ <117 мс2 | 0,46 | 0,004 | 0,24-0,889 |
| Мощность ВЧ <43 мс2 | 0,55 | 0,02 | 0,3-0,98 |
Очевидно, что влияние прогностических факторов может быть в ряде случаев сочетанным, и перекрываться при одновременном их наличие у одного больного. Поэтому был выполнен многофакторный анализ с помощью моделей пропорционального риска Кокса для определения независимых прогностических факторов кардиальных осложнений после ишемического инсульта с учетом выявленных предикторов по данным однофакторного анализа. Также осуществлено уравнивание пациентов по длительности наблюдения, полу, подтипу инсульта, получаемой медикаментозной терапии, наличию артериальной гипертензии, СД, ИБС, хронической сердечной недостаточности, фибрилляции предсердий и атеросклероза, (табл.4).
| Таблица 4. | |
| Многофакторный анализ прогностических факторов кардиальных осложнений в постинсультном периоде |
| Показатель | Beta | Standard | t-value | exponent | Wald | p |
| Возраст >67 лет | 0,97125 | 0,53504 | 1,81528 | 2,641243 | 3,2952 | 0,0694 |
| Поражение островка | 0,98396 | 0,60448 | 1,62778 | 2,675034 | 2,6496 | 0,1035 |
| Инсульт в анамнезе | 0,83594 | 0,57442 | 1,45527 | 2,306986 | 2,1178 | 0,1456 |
| Мощность НЧ <117 мс2 | -1,9201 | 0,50199 | -2,37456 | 0,303611 | 5,6385 | 0,0175 |
| Мощность ВЧ <43 мс2 | -0,54949 | 0,64218 | -0,85567 | 0,577240 | 0,7321 | 0,3921 |
Столбцы таблицы содержат значения следующих параметров модели Кокса: 1. Beta - коэффициент (его оценка) при соответствующем факторе в регрессионном уравнении. Значение коэффициента и есть вклад соответствующего фактора в совокупный риск. 2. Standard - стандартная ошибка оценки коэффициента. 3. t-value - значение t-критерия для оценки коэффициента (отношение оценки коэффициента к его стандартной ошибке). 4. exponent - значение exp(Beta) - значения относительного риска, связанного с изменением фактора на n единиц. 5. Wald - значение критерия Вальда для оценки коэффициента. 6. p - значение вероятности ошибки оценки коэффициента.
Результаты мультивариантного анализа по Коксу (таблица 4) показали, что при оценке влияния на повышенный риск кардиальных осложнений в многофакторной модели единственным статистически значимым (p=0,0175) было воздействие мощности НЧ<117 мс2.
Таким образом, значения мощности НЧ<117 мс2 являются самостоятельным прогностическим фактором кардиальных осложнений после ишемического инсульта. Прогностическое значение мощности НЧ<117 мс2 сохраняется после введения поправки на другие факторы риска, т.е. является независимым предиктором повышенного риска кардиальных осложнений после ишемического инсульта.
Пример реализации способа:
Пример 1: Больная Ж., 59 лет, перенесла острое ишемическое нарушение мозгового кровообращения на фоне атеросклероза сосудов головного мозга. На 21 сутки от момента развития ишемического инсульта было проведено суточное ХМ. По его результатам мощность НЧ составила 57 мс2, что соответствовало высокой степени риска кардиальных осложнений в постинсультном периоде. После выписки из стационара больная получала антигипертензивные и антитромботические препараты. Через 10 месяцев перенесла острый инфаркт миокарда. Находилась на стационарном лечении, где к базисному лечению добавлены гиполипидемические средства (статины). В последующие 2 года наблюдения кардиальные осложнения зарегистрированы не были.
Пример 2: Больной М., 63 года, перенес острое ишемическое нарушение мозгового кровообращения на фоне сахарного диабета и хронической сердечной недостаточности. На 21 сутки от момента развития ишемического инсульта было проведено суточное ХМ. По его результатам мощность НЧ составила 249 мс2, что соответствовало низкой степени риска кардиальных осложнений в постинсультном периоде. После выписки из стационара больной находился на базисной медикаментозной терапии. В течение 3 лет проспективного наблюдения кардиальных осложнений у пациента не зарегистрировано.
Таким образом, появилась возможность прогнозировать риск кардиальных осложнений методом суточного ХМ с помощью автоматического спектрального анализа BCP и изучения мощности спектра НЧ на 21 сутки от момента развития ишемического инсульта. Использование недорогой методики по стандартно заданным условиям позволяет выявлять больных с повышенным риском кардиальных осложнений в постинсультном периоде. Предложенный способ суточного ХМ с автоматическим спектральным анализом BCP и изучением мощности спектра НЧ является информативным в прогнозировании риска кардиальных осложнений, что поможет оптимизировать тактику ведения пациента в постинсультном периоде с целью улучшения сердечно-сосудистого прогноза.
Способ прогнозирования риска кардиальных осложнений после ишемического инсульта, заключающийся в том, что больному проводят оценку вариабельности сердечного ритма (ВСР), отличающийся тем, что оценку ВСР осуществляют методом суточного холтеровского мониторирования на 21 сутки от момента развития ишемического инсульта, затем с помощью спектрального анализа определяют мощность низкочастотного спектра и при его значении менее 117 мс2 прогнозируют высокий риск кардиальных осложнений после ишемического инсульта.