Способ моделирования атеросклероза
Иллюстрации
Показать всеИзобретение относится к экспериментальной медицине, патофизиологии и может быть использовано при изучении атеросклеротического процесса. Для этого проводят моделирование атеросклероза путем кормления исследуемых животных атерогенным рационом. В качестве атерогенного рациона в течение 12 месяцев у крыс используют питьевую воду, свеклу, морковь, картофель и зерно пшеницы из Присурского субрегиона Чувашской республики, неблагополучного в отношении распространенности атеросклероза, ишемической болезни сердца, смертности от острого инфаркта миокарда. Способ обеспечивает создание модели атеросклероза, максимально приближенной к естественным условиям среды проживания людей, что позволяет выявлять специфические механизмы патогенеза и разрабатывать эффективные мероприятия первичной профилактики заболевания. 4 табл., 8 ил.
Реферат
Изобретение относится к экспериментальной медицине, патофизиологии и может быть использовано в целях диагностики, профилактики и лечения атеросклеротического процесса.
Экспериментальные исследования составляют неотъемлемую часть биологических и медицинских исследований. Экспериментальные модели болезней человека широко используются для изучения механизмов формирования и развития патологии, выяснения роли экзогенных и эндогенных факторов в становлении патологических процессов, дают возможность изучить патогенез на тканевом и клеточном уровне, изыскать новые средства лечения и профилактики.
Известно создание моделей инфаркта миокарда на животных (Патент RU №2243595, МПК G09B 23/28, опубл. 27.12.2004 г.; Патент RU №2286606, МПК G09B 23/28, опубл. 27.10.2006 г.). Однако известные способы моделирования инфаркта миокарда являются инвазивными, травматичными, не обеспечивают раскрытие причинно-следственных связей возникновения заболевания.
В современной медицине доминирует экологическая модель происхождения болезней, в соответствии с которой болезни возникают вследствие действия на организм разнообразных факторов внешней среды, главным образом питьевой воды и пищи. Например, экспериментальными исследованиями была доказана связь между дефицитом магния в диете и атеросклеротическими изменениями в сосудах, функциональными нарушениями сердечного ритма (Lasserre В., Durlach J. Magnesium a Relevantion. - 1994. - Vol.4. - P.411-421.). Полученные данные показывают, что баланс минерального обмена, обусловленный соотношением K/Na и Mg/Ca, должен рассматриваться как важный фактор, оказывающий влияние на инфарктоидные повреждения сердечной мышцы. Но в современном понимании этиопатогенеза хронических неинфекционных заболеваний и их последствий необходимо учитывать установленные ранее корреляционные связи атеросклероза и его последствий с макро- и микроэлементами почв, питьевых вод и суточных рационов питания. Для доказательства их пусковой, причинной роли в процессе «здоровье↔атеросклероз» необходимо изучение причинно-следственных связей в условиях экспериментального моделирования.
Известен способ моделирования атеросклероза (патент RU №2500041, МПК G09B 23/28, опубликовано 27.11.2013 г.), при котором лабораторным животным - крысам добавляют в корм порошок холестерина в количестве 1%, маргарин 10%, мерказолил 10 мг/кг и витамин D - 2,5 ME на кг массы тела. Дополнительно животным проводят операцию, состоящую из наложения лигатуры на почечную ножку левой почки нерассасывающимся шовным материалом и прошивания верхнего полюса правой почки, оставляя 2/3 органа. Однако известный способ является инвазивным, не отражает механизмы развития атеросклероза в естественных условиях.
Задачей изобретения является создание экспериментальной модели атеросклероза, наиболее точно отражающей связь этиопатогенеза атеросклероза и его последствий со средовыми факторами.
Техническим результатом является создание модели атеросклероза у животных, например крыс, максимально приближенной к экологической модели атеросклероза, развивающейся у людей, длительно проживающих в конкретном субрегионе.
Технический результат достигается тем, что моделирование осуществляют кормлением животных (крыс) опытной группы водно-пищевым рационом среды обитания людей, длительно проживающих в зоне эколого-биогеохимического бедствия, статистически неблагополучным в отношении распространенности атеросклероза, ишемической болезни сердца и смертности от острого инфаркта миокарда (Присурский субрегион Чувашской республики). Для кормления животных контрольной группы использовали продукты питания, привезенные из зоны эколого-биогеохимического оптимума, который отличается более низкими показателями распространенности атеросклероза и его последствий среди постоянно проживающего населения (Прикубниноцивильский субрегион Чувашской республики). (Сусликов В.Л. Эколого-биогеохимическое районирование территорий - методологическая основа для оценки среды обитания и здоровья населения. - Чебоксары. ЧГУ. 2001. - 40 с.).
В эксперименте были использованы беспородные крысы-самцы с начальной массой 131,0±12,0 г. Крыс разделили на две группы. Пятнадцать животных получали питьевую воду из эколого-биогеохимической зоны бедствия (колодец с. Кудеиха Порецкого района ЧР), пятнадцать животных контрольной группы получали питьевую воду из зоны оптимума (колодец с. Тюмерево Янтиковского района). В качестве корма использовали овощи (свеклу, морковь, картофель) и зерно пшеницы. Кормление крыс осуществлялось по нормам, утвержденным для лабораторных животных МЗ РФ.
Уровень содержания микроэлементов в питьевых водах и кормах определяли методом прямой атомно-абсорбционной спектрометрии. (Ермаченко Л.А, Атомно-абсорбционный анализ в санитарно-гигиенических исследованиях: Методическое пособие. - Чеб. ЧГУ. 1997. - 220 с.). Метод основан на способности микроэлементов поглощать ультрафиолетовые лучи длиной волны 285-295 нм после осаждения белков пробы с помощью терморегуляции. Для каждого определяемого элемента использовали источник резонансного излучения, определяемый элемент переводили в элементарное состояние с помощью атомизации (t - 2000-3000°C), для получения количественного результата проводили серию предварительных измерений, по которым строили градуировочный график. Предварительно проводили пробоподготовку методом автоклавной минерализации в автоклаве «АНКОН-АТ-2». Метод основан на полной минерализации пробы смесью азотной кислоты и пероксида водорода в реакционной камере автоклава. Полученные пробы взвешиваются с точностью до 1 мг, помещаются в стерильные пробирки и хранятся при температуре - 18°C. Для исследования микроэлементов использовали атомно-абсорбционный спектрометр «Квант - Z. ЭТА». Преимуществами данного метода являются высокая чувствительность и избирательность, невысокая вероятность совпадения спектральных линий разных элементов, соответственно более высокая селективность определений. Определение количества йода и фтора проводили ионоселективным методом с применением прибора «Эксперт-1», предназначенного для измерения активности (PX, Ph), массовой концентрации ионов (C), (E) - окислительно-восстановительного потенциала. Измерение величины производилось потенциометрическим методом при помощи ионоселективных электродов, который заключается в измерении разности потенциалов электродвижущей силы измерительного электрода и электрода сравнения. Для анализа брали не менее 100 мл воды исследуемых территорий. Химический состав воды оценивали трехкратно в течение эксперимента (осень, зима, весна). Определение хлоридов, сульфатов, общей жесткости воды осуществляли титрометрическим методом. Изучение полостной и пристеночной микрофлоры всех отделов толстого и тонкого кишечника методом посева на специально приготовленные среды.
Забор крови у крыс проводили из хвостовой вены, путем обрезания кончика хвоста (Георгиева С.А., Беликина Н.В. Физиология. - М.: Медицина. 1981. - С.191-192; Западнюк И.П., Западнюк В.И., Захария Е.А. Лабораторные животные. Киев. 1974. С.204-209). Выделение микроорганизмов осуществляли в соответствии с «Методическими рекомендациями по диагностике и лечению дисбактериоза кишечника» (1986), разработанными в НИИ эпидемиологии и микробиологии им. Г.Н. Габричевского (Краткий определитель бактерий Берджи // Под ред. Д. Хоулта, Н. Крига, пер. с англ. под ред. чл.-корр. АН СССР Г.А. Заварзина. - М.: Мир. - 1997. - Т.1-2. - 800 с.). Идентификацию микроорганизмов проводили на основании «Определителя микроорганизмов Берджи» и «Справочника по микробиологическим и вирусологическим методам исследования» на стандартных дифференциально-диагностических средах с помощью «Систем индикаторных бумажных», выпускаемых Нижегородским научно-исследовательским институтом микробиологии и эпидемиологии (Справочник по микробиологическим и вирусологическим методам исследования // Под ред. Бигера М.О. - М.: Медицина. - 1992. - 462 с.). Материал помещали в стерильный флакон. Для приготовления основного разведения (1:10) после взвешивания материала во флаконы добавляли недостающее количество фосфатного буферного раствора и тщательно встряхивали в течение не менее 5 минут до получения однородной массы фекалий. Для определения количества кишечных палочек и бактерий, относящихся к группе кишечной палочки в 1 г фекалий, производили посев из основного разведения на среду Эндо и на кровяной агар по методу Голда в модификации Ю.М. Фельдмана. Для выделения стафилококков материал засевали на желточно-солевой агар, бифидобактерий - на среду Блаурокка, лактобактерий - на стерильное молоко, условно-патогенных грибов - на среду Сабуро, других факультативно-анаэробных микроорганизмов - на шоколадный агар (Краткий определитель бактерий Берджи // Под ред. Д. Хоулта, Н. Крига, пер. с англ. под ред. чл.-корр. АН СССР Г.А. Заварзина. - М: Мир. - 1997. - Т.1-2. - 800 с.; Справочник по микробиологическим и вирусологическим методам исследования // Под ред. Бигера М.О. - М: Медицина. - 1992. - 462 с.).
С целью выявления взаимосвязи между микроэлементным составом питьевых вод, кормов и возможностью развития атеросклеротических процессов в организме экспериментальных животных нами были определены эластазоподобная активность, активность α1-ПИ и α2-МГ в крови крыс. Кровь у животных брали из хвостовой артерии через 9 мес. после начала эксперимента. По окончании эксперимента крыс подвергали патологоанатомическому вскрытию под эфирным наркозом. Аорту, взятую на уровне дуги и бифуркации, фиксировали в 10% растворе нейтрального формалина и заливали в парафин. Эластические волокна окрашивали резорцион-фуксином. В работе использовали нитрофениловый эфир N-бутилоксикарбонил L-аланина (БАНЭ), этиловый эфир N-бензоил-L-аргинина (БАЭЭ) фирмы "Reanal" (Венгрия), трипсин фирмы (Чехословакия). Эластазоподобную активность измеряли методом L. Visser (Нартикова В.Ф. Активность эластазоподобных протеаз. / В.Ф. Нартикова, T.C. Пасхина // Вопр. мед. химии. - 1979. Т.25. - С.494-500): к 0,06 мл сыворотки крови приливали 2,85 мл 0,05 М натрий-фосфатного буфера pH 6,5 и 0,1 мл 10-3М БАНЭ. Изменение оптической плотности определяли спектрофотометрически при 345,5 нм при 25°С против 3,3-10-5М раствора субстрата через 2-3 мин на 1 мл сыворотки крови. Активность эластазоподобных протеаз выражали в наномолях гидролизированного БАНЭ за 1 мин на 1 мл сыворотки крови.
Активность α1-ПИ и α2-МГ в сыворотке крови определяли методом В.Ф. Нартиковой, Т.С. Пасхиной (Нартикова В.Ф. Активность эластазоподобных протеаз. / В.Ф. Нартикова, Т.С. Пасхина // Вопр. мед. химии. - 1979. Т.25. - С.494-500) по торможению гидролиза БАЭЭ трипсином. Активность α1-ПИ и α2-МГ выражали в условных ингибиторных единицах (ИЕ).
Для наноскопических исследований использовались криостатные срезы аорты животных толщиной 15 мкм, которые изучались на приборе «Femtoscan» в режиме атомно-силовой микроскопии в программе «Femtoscan Onlaine».
Состояние липидного обмена у экспериментальных животных оценивали по результатам исследований общего холестерина, липопротеидов и триглицеридов по стандартизованной методике Центра профилактической медицины РАМН (г. Москва). Полученные результаты подвергались статистической обработке в пространстве Microsoft Excel XP; достоверность различий оценивали с помощью критерия Стьюдента при p<0,05.
В Таблице 1 приведены данные микроэлементного состава питьевых вод из колодцев эколого-биогеохимической зоны оптимума и эколого-биогеохимической зоны бедствия. Представленные данные указывают на наличие существенной разницы как в количественном содержании исследованных микроэлементов, так и в их соотношениях к йоду.
В Таблице 2 приведены данные микроэлементов в кормах, выращенных в эколого-биогеохимической зоне оптимума и в эколого-биогеохимической зоне бедствия. Представленные данные микроэлементного состава кормов указывают на наличие существенной разницы, как в количественном содержании исследованных микроэлементов, так и в их соотношениях к йоду.
В Таблице 3 приведены показатели уровней содержания холестерина и липопротеидов в сыворотке крови крыс контрольной и опытной групп через 6 месяцев и через 12 месяцев с начала эксперимента. Особый интерес представляют данные о закономерностях изменения липидного обмена, которые свидетельствуют о том, что эти изменения появляются позже по времени. Так, через 6 месяцев мы не обнаруживали изменений в уровнях содержания общего холестерина и липопротеидов в сыворотке крови как в контрольной, так и в опытной группе, но через 12 месяцев в крови у крыс опытной группы достоверно повысились уровни общего холестерина (ОХ), липопротеидов очень низкой плотности (ЛПОНП) и липопротеидов низкой плотности (ЛПНП), снизились уровни липопротеидов высокой плотности (ЛПВП).
В Таблице 4 приведены показатели активности эластазоподобных протеаз и их ингибиторов в крови экспериментальных животных.
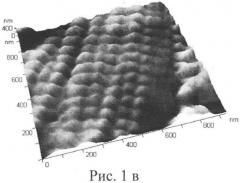
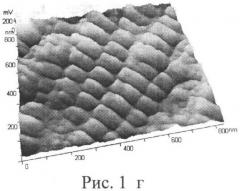
Данные протеиназно-ингибиторного баланса, полученные у экспериментальных животных, показывают, что у животных, употреблявших воду и корма из зоны эколого-биогеохимического бедствия, выявлен достоверно (p<0,01) более высокий уровень эластазоподобных протеаз в сыворотке крови по сравнению с животными, употреблявшими воду и корма из зоны эколого-биогеохимического оптимума. Активность α-ПИ оказалась достоверно сниженной (p<0,01), в то время как активность α1-МГ достоверно (p<0,01) повышенной у крыс из эколого-биогеохимической зоны бедствия по сравнению с контрольной группой крыс. Анализ эластазо-ингибиторного баланса крови у животных, употреблявших воду и корма с различными уровнями и соотношениями микроэлементов, показал, что степень компенсации протеиназно-ингибиторной системы крови контрольной группы выше, чем у опытной группы животных, т.к. соотношение активности α1-ПИ и активности эластазоподобных протеаз (ЭПП) в 2 раза выше. Патоморфологический анализ аорты, взятой у крыс, получавших воду и корм из зоны эколого-биогеохимического бедствия, обнаружил явления дезорганизации эластических волокон: во внутренней и средней части меди имелись фрагментация и распад на мелкие глыбки отдельных волокон с частичным расширением и деформацией промежутков между ними. Обнаруженные изменения в структуре эластических волокон характерны для начальной стадии атеросклероза. Морфологическая характеристика состояния аорты отражает степень функционирования практически всех систем организма и позволяет адекватно оценить степень флуктуации гомеостаза. Результаты проведенных наноскопических исследований срезов аорты экспериментальных крыс приведены на Рис.1а, Рис.1б, Рис.1в, Рис.1г, где на Рис.1а и Рис.1б приведены нанограммы контрольной и опытной групп крыс соответственно, а на Рис.1в и Рис.1г приведены трехмерные изображения срезов аорты контрольной и опытной групп крыс соответственно. На нанограмме аорты животных контрольной группы отчетливо видны «жгуты» из отдельных эластических волокон, причем каждое волокно состоит из большого числа секторов правильной квадратоподобной фрагментации с четким взаимопереплетением как отдельных волокон, так и «жгутов».
На Рис.2а и Рис.2б приведены изображения обработки периодических структур эластического каркаса аорты экспериментальных животных контрольной и опытной группы соответственно. В исследованиях аорты животных опытной группы (Рис.2б) наблюдается заметная расплывчатость контуров отдельных эластических волокон и их веретенообразность и отсутствие «взаимопереплетения». Указанные изображения, трансформированные методом статистического сложения, показывают организованность структур эластических волокон в контрольной группе животных (Рис.2а). Выделенный полезный сигнал у животных опытной группы подтверждает дезорганизацию эластического каркаса аорты (Рис.2б).
С целью выявления взаимосвязи между микроэлементным составом питьевых вод и кормов с качественным и количественным составом аутомикрофлоры кишечника экспериментальных животных были исследованы фоновые характеристики микрофлоры толстого кишечника. Исследования кала проводили через 5-6 месяцев и 9-10 месяцев от начала эксперимента. Динамика изменений количественного и видового состава аутомикрофлоры толстого кишечника контрольной группы и опытной группы животных представлена на Рис.3а и Рис 3б соответственно. Как видно из Рис.3а и Рис.3б, через 5-6 месяцев у животных из опытной и контрольной групп не произошло заметных изменений в количественном и качественном составе аутомикрофлоры толстого кишечника, в то время как через 9-10 месяцев у крыс в опытной группе обнаружилось достоверное (p<0,05) снижение количества кишечных палочек с нормальной ферментативной активностью, бифидо- и лактобактерий, возросло количество Proteus mirabilis. Через 10 месяцев у крыс из опытной группы были обнаружены гемолитические стафилококки, отсутствующие у крыс из контрольной группы, в этот же период заметно возросло микробиологическое разнообразие в толстом кишечнике опытных животных за счет появления таких микроорганизмов, как Вас. Cereus, Staphilococcus epidermalis, Staphylococcus aurus и другие условно-патогенные микроорганизмы. Полученные данные убедительно свидетельствуют об участии микрофлоры толстого кишечника в регуляции липидного обмена. Данные о повышении уровня холестерина и липопротеидов полностью согласуются с материалами о существовании холестеринзависимых кишечных палочек (Панчишина М.В. Клинико-экспериментальные материалы об участии кишечной микрофлоры в обмене холестерина при некоторых внутренних заболеваниях: Автореф. докт. мед. наук. - Львов, 1987. - 47 с.). О том, что изменения в видовом составе могут происходить под влиянием аномально-нерегулируемых соотношений макро- и микроэлементов, из литературных данных ранее было неизвестно. Таким образом, заявленный способ моделирования атеросклероза позволяет получить экспериментальную модель атеросклероза, наиболее точно отражающую связь этиопатогенеза атеросклероза и его последствий со средовыми факторами. Принципиальной особенностью данного способа моделирования является то, что при данной модели атеросклероз рассматривается как природно-средовое явление.
Заявленный способ моделирования атеросклероза отличается от известного способа тем, что водно-кормовой режим животных максимально приближен к естественным условиям питания населения, проживающего на определенной территории. Донозологические сдвиги развиваются постепенно к концу эксперимента, что позволяет детально оценить нарушения липидного и минерального обмена, гормонального статуса, нарушений микробиоценоза. Заявленный способ моделирования несложен в техническом отношении и достаточно точно отражает предпатологические сдвиги в организме животных, позволяет получить модель атеросклероза, максимально приближенную к экологической модели атеросклероза, развивающейся у людей, проживающих на территориях с различными средовыми факторами, что в дальнейшем позволит разработать научные рекомендации по первичной профилактике атеросклероза, проводить изыскание новых средств лечения и профилактики с учетом средовых факторов.
| Таблица 1 | ||
| Микроэлементы (мг/л) | ЭБ зона бедствияКол-во / соотношение к йоду (мг/л) | ЭБ зона оптимумаКол-во / соотношение к йоду (мг/л) |
| Йод | 0,01/1 | 0,01/1 |
| Железо | 0,6/60,0 | 0,7/70,0 |
| Фтор | 1,3/130,0 | 0,7/70,0 |
| Кальций | 86,0/8600,0 | 110,0/1100,0 |
| Магний | 9,0/900,0 | 32,0/3200,0 |
| Стронций | 0,7/70,0 | 0,36/36,0 |
| Натрий | 46,0/4600,0 | 4,0/400,0 |
| Калий | 6,7/670,0 | 1,0/100,0 |
| Литий | 0,0095/0,95 | 0,0085/0,85 |
| Цинк | 0,06/6,0 | 0,04/4,0 |
| Свинец | 0,06/6,0 | 0,03/3,0 |
| Кобальт | 0,06/6,0 | 0,2/2,0 |
| Медь | 0,07/7,0 | 0,06/6,0 |
| Кадмий | 0,07/7,0 | 0,04/4,0 |
| Никель | 0,07/7,0 | 0,04/4,0 |
| Хром | 0,6/60,0 | 1,0/100,0 |
| Кремний | 14,6/1460,0 | 3,0/300,0 |
| Барий | 6,0/600,0 | 60,0/6000,0 |
| Таблица 2 | ||||
| Микроэлементы | Зона оптимума | Соотношение к йоду | Зона Бедствия | Соотношение к йоду |
| Медь (Cu), мг/кг | 0,81 | 0,12 | 0,97 | 0,14 |
| молибден (Mo), мг/кг | 0,031 | 0,004 | 0,041 | 0,058 |
| Кадмий (Cd), мг/кг | 0,01276 | 0,00181 | 0,01434 | 0,14030 |
| кобальт (Co), мг/кг | 0,02387 | 0,00339 | 0,03789 | 0,00531 |
| кремний (Si), мг/кг | 30,01 | 4,26 | 35,53 | 4,98 |
| Йод (I), мкг/кг | 7,05 | 1 | 7,13 | 1 |
| Фтор (F), мг/кг | 2,10 | 0,29 | 2,80 | 0,39 |
| селен (Se), мг/кг | 0,111 | 0,016 | 0,072 | 0,011 |
| Таблица 3 | ||||
| Показатели, ммоль/л | Через 6 месяцевКонтрольная Опытная | Через 12 месяцевКонтрольная Опытная | ||
| Холестерин | (10)1,51+0,08 | (9)1,52+0,10 | (9)1,49+0,12 | (9)1,85+0,11* |
| ЛПОНП | (10)0,45+0,21 | (9)0,48+0,12 | (9)0,48+0,11 | (9)0,62+0,06* |
| ЛПНП | (10)0,94+0,33 | (9)0,95+0,41 | (9)1,04+0,20 | (9)1,58+0,17* |
| ЛПВП | (10)2,46+0,22 | (9)2,51+0,25 | (9)2,55+0,31 | (9)1,77+0,47* |
| Таблица 4 | |||||
| п/п | Показатели активности эластазо-ингибиторного баланса | Опытная группа | Контрольная группа | ||
| n | M±m | n | M±m | ||
| 1 | Эластазоподобные протеазы (ЭПП) (нмоль/мин/мл) | 10 | 2137±6* | 7 | 1558±8 |
| 2 | Ингибитор (ИЕ/мл) | 10 | 6,31±0,3* | 7 | 7,98±0,2 |
| 3 | Ингибитор (ИЕ/мл) | 10 | 1,06±0,1* | 7 | 0,83±0,02 |
| 4 | Величина | 0,03 | 0,06 | ||
| Примечание: * - p<0,01 |
Способ моделирования атеросклероза, включающий кормление исследуемых животных атерогенным рационом, отличающийся тем, что в качестве атерогенного рациона в течение 12 месяцев у крыс используют питьевую воду, свеклу, морковь, картофель и зерно пшеницы из Присурского субрегиона Чувашской республики, известного в соответствии со статистическими данными как неблагополучный субрегион в отношении распространенности атеросклероза, ишемической болезни сердца, смертности от острого инфаркта миокарда.