Состав для стабилизации липидов к окислению
Иллюстрации
Показать всеИзобретение относится к получению состава, стабилизирующего процесс окисления липидов, липидосодержащих пищевых добавок, лечебно-косметических средств, лекарственных. В качестве антиоксиданта используют N-(4'-гидрокси-3',5'-ди-трет-бутилфенил)амид 2-гидрокси-3-трет-бутил-5-этилбензойной кислоты, добавляемый в количестве 0,01-0,14% от массы липидов. Изобретение позволяет получить состав для стабилизации липидов к окислению с помощью антиоксиданта, обладающего высокой эффективностью и низкой токсичностью. 2 табл., 2 пр.
Реферат
Изобретение относится к области пищевой технологии, а именно к способам защиты липидов, масел, жиров от окисления и окислительной деструкции, и может быть использовано в пищевой, косметической и химико-фармацевтической промышленности для получения стабильных липидосодержащих пищевых добавок (нутрицевтиков), лечебно-косметических средств и лекарственных препаратов.
Для торможения процессов окисления применяют антиоксиданты (ингибиторы окисления), которые находят все более широкое применение для предотвращения окислительных превращений липидов и содержащих их препаратов in vitro, а также in vivo в комплексной терапии широкого круга заболеваний (Герчук М.П. Антиокислители в пищевой промышленности // Журн. Всесоюз. хим. общества им. Д.И. Менделеева. - 1960. - N.4. - С.395-402), (Авакумов В.М., Ковлер М.А., Кругликова-Львова Р.П. Лекарственные средства метаболической терапии на основе витаминов и ферментов (Обзор) // Вопросы мед. химии. - 1992. - Т.38. - N4. - С.14-21). (Дурнев А.Д., Середенин С.В. Антиоксиданты как средства защиты генетического аппарата // Хим.-фарм. журн. - 1990. - N2. - С.92-100). Таким образом, антиоксиданты, присутствующие в лекарственном или косметическом препарате, являются не только действующим началом этих средств, но могут значительно тормозить их окисление в процессе длительного хранения, способствуя сохранению в нативном состоянии легкоокисляемых биологически активных компонентов. Известны составы для стабилизации липидов к окислению различного происхождения путем введения антиоксидантов токоферолов (US №2564106, опубл. 14.08.1951), (Эмануэль Н.М., Лясковская Ю.Н. Торможение процессов окисления жиров. М.: Пищепромиздат, 1961. - 360 с.).
В качестве прототипа выбран состав для стабилизации липидов к окислению с помощью введения токоферолов (US №2564106, опубл. 14.08.1951). Указанный состав тормозит процесс окисления липидов за счет антиоксидантного действия ингибитора природного происхождения α-токоферола (6-гидрокси-2,5,7,8-тетраметил-2-фитил-хромана, витамина E). Известно, что α-токоферол характеризуется чрезвычайно высокой константой скорости реакции с пероксильными радикалами k7=(3,3-3,5)×106 M-1×с-1 (Бурлакова Е.Б., Крашаков С.А., Храпова Н.Г. Кинетические особенности токоферолов как антиоксидантов. Черноголовка, 1992. - 56 с).
Недостатком этого состава (прототипа) является сложный механизм действия α-токоферола в липидных субстратах, его участие не только в реакциях обрыва цепей, но и реакциях продолжения цепей, что приводит к снижению антиоксидантной активности α-токоферола и промотированию процесса окисления.
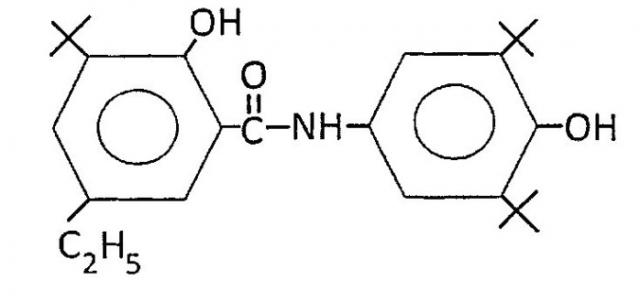
Предлагаемое соединение N-(4′-гидрокси-3′,5′-ди-трет-бутилфенил)амид 2-гидрокси-3-трет-бутил-5-этилбензойной кислоты синтезировано в Новосибирском Институте органической химии им. Н.Н. Ворожцова СО РАН с целью расширения ассортимента нетоксичных биологически активных ингибиторов окисления. Соединение не обладает местным и общетоксическим действием (Перевозкина М.Г. Кинетика и механизм ингибирующего действия производных фенозана, салициловой кислоты и их синергических смесей с α-токоферолом и фосфолипидами. Автореф. дис. … канд. хим. наук. Тюмень. - 2003. - 28 с.).
Соединение проявляет активность с пероксильными радикалами с константой скорости реакции k7=1,69×104 М-1×с-1 и обладает дополнительно способностью непосредственно взаимодействовать с гидропероксидами, разрушая их без образования свободных радикалов, что не наблюдается в присутствии α-токоферола. Разрушение гидропероксидов под влиянием N-(4′-гидрокси-3′,5′-ди-трет-бутилфенил)амида 2-гидрокси-3-трет-бутил-5-этилбензойной кислоты, в свою очередь, является причиной выигрыша в периодах индукции. Для предлагаемого синтетического антиоксиданта имеет место положительная корреляционная связь между концентрацией и величиной ингибирующего эффекта, что не наблюдается для α-токоферола, указанная зависимость имеет экстремальный характер и при высоких концентрациях антиоксидантное действие α-токоферола сменяется на проантиоксидантное. Дополнительно N-(4′-гидрокси-3′,5′-ди-трет-бутилфенил)амид 2-гидрокси-3-трет-бутил-5-этилбензойной кислоты обладает фотостабилизирующим действием, способен поглощать УФ-излучение в диапазоне 301-305 нм, опасным для развития рака кожи, что может использоваться в косметической промышленности / Поротов Л.Г., Сторожок Н.М., Перевозкина М.Г. Кинетические исследования антиоксидантного и фотостабилизирующего действия осалмида - нового амидного производного салициловой кислоты (Сб. докл. всерос. науч. конф. Молодых ученых и II школа им. Академика Н.М. Эмануэля «Окисление, окислительный стресс, антиоксиданты». Москва. (1-3 июня). 2006. С.131-133).
Задачей заявляемого изобретения является разработать состав для стабилизации липидов к окислению с помощью антиоксиданта, обладающего высокой эффективностью и низкой токсичностью.
Технический результат - простой состав, не требующий больших материальных затрат, основанный на способности низкотоксичного антиоксиданта N-(4′-гидрокси-3′,5′-ди-трет-бутилфенил)амида 2-гидрокси-3-трет-бутил-5-этилбензойной кислоты взаимодействовать с пероксильными радикалами и разрушать продукты окислительной деструкции липидов (гидропероксиды) нерадикальным путем, поглощать УФ-излучение в диапазоне 301-305 нм и обладать фотостабилизирующим действием.
Технический результат достигается тем, что к липидам добавляют в качестве антиоксиданта N-(4′-гидрокси-3′,5′-ди-трет-бутилфенил)амид 2-гидрокси-3-трет-бутил-5-этилбензойной кислоты в количестве 0,01-0,14% от массы липидов.
Сущность изобретения заключается в использовании N-(4′-гидрокси-3′,5′-ди-трет-бутилфенил)амида 2-гидрокси-3-трет-бутил-5-этилбензойной кислоты в качестве антиоксиданта, химическая структура соединения представлена ниже:
Эффективность стабилизаторов оценивалась несколькими независимыми методами (Сторожок Н.М. Межмолекулярные взаимодействия компонентов природных липидов в процессе окисления. Дис. … д-ра хим. наук. М.: Институт биохимической физики им. Н.М. Эмануэля РАН, 1996. 360 с.), (Цепалов В.Ф., Харитонова А.А., Гладышев Г.П. и др. Определение констант скорости и коэффициентов ингибирования фенолов-антиоксидантов с помощью модельной цепной реакции // Кинетика и катализ. - 1977. - Т.18. - вып.5. - С.1261-1267):
- изучалась кинетика поглощения кислорода при инициированном окислении липидных субстратов в присутствии предлагаемого состава и прототипа;
- тестировалась кинетика накопления первичных продуктов окисления - гидропероксидов методом йодометрического титрования (ПЧ) при аутоокислении липидов при повышенных температурах (60±0,2°C).
Антиоксидантную активность (АОА) тестировали волюмометрическим методом поглощения кислорода в модифицированной установке типа Варбурга при окислении метилолеата (МО) в среде инертного растворителя хлорбензола, процесс инициировали за счет термического разложения АИБН в концентрации 3×10-3 М. В качестве критериев оценки антиоксидантных свойств соединений использовали периоды индукции, начальные и максимальные скорости окисления. Графическим методом определяли величину периода индукции (τi), представляющей собой отрезок оси абсцисс, отсекаемый перпендикуляром, опущенным из точки пересечения касательных, проведенных к кинетической кривой. Эффективность торможения процесса окисления липидного субстрата определяется совокупностью реакций ингибитора и обозначает его антиоксидантную активность, количественно определяемую по формуле АОА=τi-τS/τS, где τS и τi - периоды индукции окисления субстрата в отсутствие и в присутствии исследуемого антиоксиданта (АО) соответственно. Критерием антиоксидантного действия служили начальная (Wo2 нач) и максимальная (Wo2 max) скорости процесса окисления в присутствии и в отсутствии антиоксиданта. Скорость инициирования определяли уравнением Wi=f[InH]/τi, где f - стехиометрический коэффициент ингибирования, [InH] - концентрация реперного ингибитора, τi - период индукции.
Кинетику накопления гидропероксидов в модельном субстрате исследовали в условиях аутоокисления методом обратного йодометрического титрования в среде хлорбензола при t=(60±0,2)°C. Навеску окисляемого модельного субстрата растворяли в смеси ледяной уксусной кислоты и хлороформа в соотношении 3:2, добавляли насыщенный на холоду иодид калия, смесь перемешивали и оставляли в темноте. Через равные промежутки времени отбирали пробы и определяли в них перекисное число: П Ч = 0,1269 × ( a − b ) d ; где a - объем Na2S2O3, пошедший на титрование пробы; b - объем Na2S2O3, пошедший на титрование контрольного опыта; d - масса навески субстрата окисления.
Сущность изобретения иллюстрируется следующими примерами.
Пример 1
1. Берут 1 г (точная навеска) метилолеата (МО) и помещают в манометрическую ячейку, добавляют N-(4′-гидрокси-3′,5′-ди-трет-бутилфенил)амид 2-гидрокси-3-трет-бутил-5-этилбензойной кислоты в количестве 0,03% от массы липидов, раствор 3×10-3 М инициатора окисления АИБН в хлорбензоле, доводят хлорбензолом до общего объема пробы 2 мл. Поглощение кислорода оценивают волюмометрическим методом в термостатированной установке типа Варбурга при температуре t=(60±0,2)°C при перемешивании на магнитной мешалке. Измеряют объем (мм3) поглощенного кислорода во времени, строят график в координатах dV/dt. Графическим методом из кинетических кривых определяют величину периода индукции (τi). Из наклона кинетических кривых определяют начальную (WO2 нач.) и максимальную (WO2 мах.) скорости окисления липидного субстрата в контрольном опыте и с добавками антиоксидантов. Показатели сравнивают с прототипом (Табл.1.).
Кинетические параметры окисления метилолеата в безводной среде в присутствии 3×10-3 М АИБН в зависимости от концентрации N-(4′-гидрокси-3′,5′-ди-трет-бутилфенил)амида 2-гидрокси-3-трет-бутил-5-этилбензойной кислоты и α-токоферола (прототип), Wi=4,2×10-8 М×с-1, t=60°C. Примечание * - АО-антиоксидант, «-» - отсутствие эффекта. Каждая цифра - результат 10 опытов, p<0,05.
| Таблица 1 | |||||
| № п/п | Содержание АО*, мас.% | τ, мин | WO2нач×10-7, М×с-1 | WO2max×10-7 M×с-1 | WO2max MO |
| WO2max AO | |||||
| Субстрат окисления - метилолеат (контроль) | |||||
| 1 | 0 | 0 | 1,90 | 8,00 | - |
| α-токоферол (прототип) | |||||
| 2 | 0,01 | 70 | 0,82 | 6,50 | 1,2 |
| 3 | 0,03 | 150 | 0,78 | 6,50 | 1,2 |
| 4 | 0,05 | 250 | 0,76 | 6,40 | 1,2 |
| 5 | 0,08 | 400 | 0,77 | 6,50 | 1,2 |
| 6 | 0,11 | 480 | 0,76 | 6,30 | 1,2 |
| 7 | 0,14 | 590 | 0,76 | 6,40 | 1,2 |
| N-(4′-гидрокси-3′,5′-ди-трет-бутилфенил)амид 2-гидрокси-3-трет-бутил-5-этилбензойной кислоты | |||||
| 8 | 0,01 | 150 | 1,06 | 7,14 | 1,1 |
| 9 | 0,03 | 200 | 0,62 | 4,60 | 1,7 |
| 10 | 0,05 | 280 | 0,47 | 3,40 | 2,4 |
| 11 | 0,08 | 420 | 0,32 | 3,39 | 2,4 |
| 12 | 0,11 | 500 | 0,29 | 3,26 | 2,5 |
| 13 | 0,14 | 620 | 0,27 | 2,38 | 3,4 |
Пример 2
2. Берут 10 г (точная навеска) линолевой кислоты (ЛК), добавляют N-(4′-гидрокси-3′,5′-ди-трет-бутилфенил)амид 2-гидрокси-3-трет-бутил-5-этилбензойной кислоты в количестве 0,03% от массы липидов, перемешивают магнитной мешалкой в светонепроницаемой термостатированной ячейке при температуре t=(60±0,2)°C. Через равные промежутки времени отбирают пробы и определяют в них перекисное число (ПЧ).
Величины начальной, максимальной скоростей поглощения кислорода при инициированном окислении метилолеата (МО), разрушения гидропероксидов при аутоокислении линолевой кислоты (ЛК) в присутствии N-(4′-гидрокси-3′,5′-ди-трет-бутилфенил)амида 2-гидрокси-3-трет-бутил-5-этилбензойной кислоты и α-токоферола (прототип), t=60°C.
Примечание * - липиды; «-» - отсутствие эффекта. Каждая цифра - результат 10 опытов, p<0,05.
| Таблица 2 | |||||
| Состав смеси | Инициированное окисление МО, Wi=4,2×10-8 М×c-1 | Аутоокисление ЛК | Процент разрушения ROOH за 7 часов | ||
| WO2 нач×10-7 М×с-1 | WO2 max×10-7 М×с-1 | Wнакопления ROOH×10-4; г I2/100 г лип.*×с-1 | Wразрушения ROOH×10-4, г I2/100 г лип.*×с-1 | ||
| ЛИПИДЫ (контроль) | 1,90 | 8,00 | 5,52 | - | - |
| ЛИПИДЫ + α-токоферол (0,03 мас.%) (прототип) | 0,78 | 6,50 | 5,52 | - | - |
| ЛИПИДЫ + N-(4′-гидрокси-3′,5′-ди-трет-бутилфенил)-амид 2-гидрокси-3-трет-бутил-5-этилбензойной кислоты (0,03 мас.%) | 0,62 | 4,60 | - | 3,33 | 71,7 |
Состав для стабилизации липидов, включающий антиоксидант, отличающийся тем, что в качестве антиоксиданта используют N-(4′-гидрокси-3′,5′-ди-трет-бутилфенил)амид 2-гидрокси-3-трет-бутил-5-этилбензойной кислоты, добавляемый в количестве 0,01-0,14% от массы липидов.