Нуклеиновые кислоты формулы (i) (nuglxmgnnv)a и их производные в качестве иммунностимулирующих агентов/адъювантов
Иллюстрации
Показать всеИзобретение относится к области молекулярной биологии и медицины. Предложены рибонуклеиновые кислоты общей формулы (NuGlXmGnNv)a и их производные в качестве иммуностимулирующего агента, композиции, их содержащие, применение для лечения раковых заболеваний, инфекционных заболеваний, аллергических и аутоиммунных заболеваний, и способ лечения указанных заболеваний. 4 н. и 17 з. п. ф-лы, 2 ил., 5 пр.
Реферат
Настоящее изобретение относится к нуклеиновым кислотам общей формулы (I) (NuGlXmGnNv) и их производным в качестве иммуностимулирующих агентов/адьювантов, а также к содержащим их композициям, необязательно включающим дополнительный адъювант. Кроме того, настоящее изобретение относится к фармацевтической композиции или вакцине, каждая из которых содержит нуклеиновые кислоты формулы (I) и/или их производные в качестве иммуностимулирующего агента и необязательно по крайней мере один дополнительный фармацевтически активный компонент, например, антигенный агент. Настоящее изобретение также относится к применению фармацевтической композиции или вакцины для лечения раковых заболеваний, инфекционных заболеваний, аллергических заболеваний, аутоиммунных заболеваний и т.п. Кроме того, в настоящем изобретении предлагается применение нуклеиновых кислот общей формулы (I) (NuGlXmGnNv) и/или их производных для получения фармацевтической композиции, предназначенной для лечения указанных заболеваний.
При проведении стандартной и генетической вакцинации часто возникает проблема незначительного и следовательно в большинстве случаев неадекватного иммунного ответа в организме, который требуется лечить или вакцинировать. Для решения указанной проблемы в вакцины или фармацевтически активные компоненты добавляют так называемые адъюванты, т.е. вещества или композиции, способные увеличивать и/или направленно влиять на иммунный ответ, например, в ответ на антиген. Например, установлено, что эффективность некоторых вводимых активных медикаментозных ингредиентов можно значительно улучшить при смешивании активного ингредиента с адъювантом, влияющим на высвобождение активного ингредиента в клеточную систему организма реципиента и необязательно на его захват клетками организма реципиента. С использованием указанного способа можно обеспечить эффект, сопоставимый с периодическим введением большого числа низких доз с регулярными интервалами. Термин «адъювант», использованный в данном контексте, обозначает соединение или композицию, которые служат в качестве носителя или вспомогательного агента для иммуногена и/или других фармацевтически активных соединений. Обычно термин «адъювант» рассматривают в широком смысле, и он обозначает целый ряд соединений или стратагермов, способных повышать иммуногенность антигенов, включенных в состав или вводимых одновременно с адъювантом. Адъюванты подразделяются, но, не ограничиваясь только ими, на иммунно-потенциирующие средства, системы доставки антигенов или их комбинации.
В предшествующем уровне техники описан ряд соединений и композиций, предназначенных для применения в качестве адьювантов, например, адьювант Фрейнда, оксиды металлов (гидроксид алюминия и т.п.), квасцы, неорганические хелатные соединения или их соли, различные парафиновые масла, синтетические смолы, альгинаты, мукоиды, соединения полисахаридов, казеинаты, а также соединения, выделенные из крови и/или сгустков крови, такие как, например, производные фибрина и т.п. Однако в большинстве случаев при применении указанных адьювантов наблюдаются нежелательные побочные эффекты, например, раздражение и воспаление кожи на участке введения. В некоторых случаях наблюдаются даже токсичные побочные эффекты, прежде всего некроз тканей. К сожалению, в большинстве случаев применение указанных адьювантов приводит к неадекватной стимуляции клеточного иммунного ответа только за счет активации В-клеток.
Соединения, которые выделяют из организмов животных, такие как, например, желатин, в основном являются не пригодными для применения в качестве адьювантов, предназначенных для иммуностимуляции. Не смотря на то, что указанные соединения обычно не вызывают отрицательного действия на организм хозяина или клетки организма хозяина, они в большинстве случаев слишком быстро мигрируют от участка введения в организм хозяина или в клетки организма хозяина, что значительно ухудшает их свойства, требующиеся для адъюванта, такие как, например, замедленное высвобождение активного ингредиента, необязательно вводимого в комбинации с адъювантом, и т.п. Указанное быстрое распространение можно, в некоторых случаях, замедлить с использованием таннинов или других (неорганических) соединений. Однако к настоящему времени метаболизм указанных дополнительных соединений и участки их накопления в организме полностью не изучены. Таким образом, в данном случае можно предположить, что указанные соединения накапливаются в виде инородных веществ, значительно влияя на механизмы фильтрации, например, клеток почки, печени и/или селезенки. Кроме того, способность желатина к набуханию при парентеральном введении может привести к нежелательным побочным эффектам в условиях in vivo, таким как, например, набухание, прежде всего, в участке введения и к болезненным ощущениям.
При введении соединений, выделенных из крови и/или сгустков крови, таких как, например, производные фибрина и т.п., обычно наблюдаются иммуностимулирующие эффекты. Однако, большинство указанных соединений при введении в качестве адьювантов оказываются непригодными для данной цели, т.к. наблюдается побочное действие на иммунную систему (которое проявляется одновременно с требуемыми иммуногенными свойствами). Например, многие из указанных соединений относятся к аллергенам и в некоторых случаях вызывают избыточный ответ иммунной системы, значительно превышающий требуемый уровень. Таким образом указанные соединения являются непригодными для применения в качестве адьювантов для иммуностимуляции по упомянутым выше причинам.
Соответственно, в первом объекте настоящего изобретения предлагаются иммуностимулирующие агенты, действующие в качестве адьювантов и стимулирующие врожденный иммунитет, предпочтительно при введении в комбинации с другими биологически активными соединениями, прежде всего при введении в комбинации с иммуномодулирующими соединениями, более предпочтительно в комбинации с соединениями, которые специфично стимулируют приобретенный иммунитет, такими как антигены.
В данном контексте известно, что (неспецифичные) иммуностимулирующие эффекты можно также получить при непосредственном применении нуклеиновых кислот для индукции неспецифичного (т.е. врожденного) иммунного ответа, например, с использованием последовательностей бактериальной CpG-ДНК, предназначенной не только для передачи генетической информации. Например, известно, что ДНК играет центральную роль в продуцировании неспецифичных иммунных ответов. Например, известно, что бактериальная ДНК выполняет роль сигнала «опасности» для предупреждения иммунных клеток, таких как макрофаги и дендритные клетки, и ускорения защитного иммунного ответа поляризованных Т клеток, ответа Тh1. Иммуностимулирующее действие предположительно возникает в результате присутствия неметилированных мотивов, CG (нуклеиновой кислоты), и в связи с этим можно предположить, что указанная CpG-ДНК является сама по себе иммуностимулирующим агентом (см., например, патент US № 5663153). CpG-ДНК напрямую вызывает активацию компонентов врожденной иммунной системы, что приводит к регуляции с повышением активности совместно стимулирующих молекул и провоспалительных цитокинов. Такое иммуностимулирующее свойство ДНК характерно также для олигонуклеотидов ДНК, стабилизированных за счет модификации фосфоротиоатом (см., например, патент US № 6239116). Указанную иммуностимулирующую ДНК можно также комбинировать с другими иммуностимулирующими соединениями. Например, в патенте US №6406705 описаны иммуностимулирующие композиции, содержащие синергетическую комбинацию олигодезоксирибонуклеотида CpG и другого соединения, в отличие от нуклеиновой кислоты, которые оказывают стимулирующий эффект на врожденную иммунную систему.
Однако, применение ДНК для индукции неспецифичного иммунного ответа характеризуется рядом недостатков. ДНК разрушается in vivo только относительно медленно, и таким образом при применении иммуностимулирующей (чужеродной) ДНК может вызвать образование антител против ДНК, что было подтверждено на модели мышей (Gilkeson и др., J. Clin. INvest., т. 95, сс.1398-1402 (1995)). Преобладающее присутствие (чужеродной) ДНК в организме, таким образом, может привести к избыточной активации иммунной системы, что, как показано на мышах, приводит к спленомегалии (Montheith и др., Anticancer Drug Res., т.12, № 5, сс.421-432 (1997)). Кроме того, (чужеродная) ДНК может взаимодействовать с геномом организма-хозяина и приводить к мутациям, прежде всего за счет встраивания в геном организма-хозяина. Например, может произойти встраивание введенной (чужеродной) ДНК в интактный ген, что представляет собой мутацию, которая может снизить или даже полностью подавлять функцию эндогенного гена. В результате указанной интеграции могут разрушиться ферментативные системы, жизненно важные для клеток. Кроме того, существует риск изменения клетки в такой степени, что клетка трансформируется в дегенеративное состояние. Указанная трансформация может произойти, например, при интеграции (чужеродной) ДНК в ген, который участвует в регуляции роста клеток. Таким образом, как описано ранее, при использовании (чужеродной) ДНК в качестве иммуностимулирующего агента нельзя исключить возможный риск развития ракового заболевания.
Таким образом, более предпочтительным является применение специфических РНК в качестве соединения для индукции (неспецифичного) ответа врожденной иммунной системы. Термин «врожденная иммунная система, являющаяся частью иммунной системы», использованный в данном контексте, обозначает основную систему защиты большинства организмов и включает защитные барьеры, такие как гуморальный и химический барьеры, включающие, например, воспаление, систему комплементов и клеточные барьеры. Кроме того, врожденная иммунная система включает небольшое число рецепторов, называемых образраспознающими рецепторами или рецепторами патоген-ассоциированных молекулярных образов (рецепторы ПАМО), таких как члены семейства Toll-подобных рецепторов (TLR, см., например, статью Trinchieri и Sher, Nature reviews, Immunology, т.7, (март 2007)). Такие рецепторы TLR представляют собой трансмембранные белки, которые распознают лиганды внеклеточной среды или эндосомальных просветов. После связывания с лигандами они передают сигнал через цитоплазматические адапторные белки, который индуцирует защитный ответ организма-хозяина и связанное с ним продуцирование противомикробных пептидов, провоспалительных хемокинов и цитокинов, противовирусных цитокинов и т.п. (см., например, статью Meylan E., J. Tschopp, и др., «Intracellular pattern recognition receptors in the host response», Nature, т.442, № 7098, сс.39-44 (2006)).
В настоящее время идентифицировано 10 рецепторов Toll (TLR) человека и 13 рецепторов мыши, для которых только частично изучен механизм их действия. Указанные Toll-подобные рецепторы человека (TLR) включают TLR1-TLR2 (известный лиганд: триациллипопептид), TLR1-TLR6 (известный лиганд: диациллипопептид), TLR2 (известный лиганд: пептидогликан), TLR3 (известный лиганд: дцРНК), TLR4 (известный лиганд: ЛПС (липополисахарид) грамотрицательных бактерий)), TLR5 (известный лиганд: бактериальный флагеллин(ы)), TLR7/8 (известные лиганды: имидазохинолины, аналоги гуанозина (гуанина) и оцДНК), TLR9 (известные лиганды: бактериальная ДНК CpG, вирусы, простейшие и малярийный пигмент гемозоин (продукт гидролиза гемоглобина) и TLR10. После распознавания микробных патогенов указанные TLR обычно индуцируют внеклеточные сигнальные пути, которые в свою очередь приводят к индуцированию воспалительных цитокинов (например, ФНО-α, ИЛ-6, ИЛ-1-β и ИЛ-12), интерферон типа I (ИФ-β и различные ИФ-α) и хемокины (Kawai Т. и S. Akira, «TLR signaling». Cell Death Differ, т.13, №5, сс.816-825 (2006)).
В данном контексте применение РНК является предпочтительным по нескольким причинам. Например, как известно в настоящее время и указано выше, оцРНК связывается с рецепторами TLR-7/-8, а дцРНК связывается с рецепторами TLR, и, таким образом, оказывает иммуностимулирующий эффект. Кроме того, РНК в качестве иммуностимулирующего агента обычно характеризуется значительно более коротким периодом полураспада in vivo по сравнению с ДНК, при этом исключаются недостатки, описанные выше для ДНК. Тем не менее, применение таких специфических РНК, известных в качестве иммуностимулирующих агентов, также в некоторой степени ограничено. Например, определенные последовательности РНК, описанные в предшествующем уровне техники, оказывают лишь ограниченное иммуностимулирующее действие in vivo. Для иммуностимуляции могут требоваться повышенные количества РНК, которые, без учета повышенной стоимости в связи с необходимостью введения большого количества РНК, приводят к риску развития нежелательных побочных эффектов, в основном описанных выше, например, раздражение и воспаление в участке введения, даже в случае введения в ограниченный период времени. Кроме того, токсичные побочные эффекты нельзя исключить при введении большого количества иммуностимулирующего агента.
Другим ограничением является низкий уровень индукции интерферонов типа I (например, ИФ-α и ИФ-β) известными иммуностимулирующими РНК, которые в основном являются индукторами противовирусной и противопролиферативной активности и цитолитической активности в лимфоцитах, природных клетках-киллерах и макрофагах.
Известные иммуностимулирующие дцРНК включают, например, поли A:U и поли I:С. Однако недостатком таких иммуностимулирующих молекул дцРНК является их неопределенная длина, что может привести к непредсказуемым молекулярным структурам и, как следствие, к агрегации. Указанные агрегаты могут, в свою очередь, привести к нежелательным побочным эффектам, таким как закупорка кровеносных сосудов или избыточная иммуностимуляция в участке инъекции. Кроме того, указанные непредсказуемые молекулярные структуры представляют проблему при проведении стандартных лабораторных исследований или на практике в промышленном производстве, т.к. проблема заключается в невозможности проведения соответствующего контроля качества вследствие переменных свойств продукта. Таким образом, в фармацевтике предпочтительно использовать нуклеиновую кислоту с определенной длиной и структурой, пригодную для применения в качестве адъюванта.
Несмотря на определенный успех применения РНК, существует постоянно возрастающая необходимость в улучшенных иммуностимулирующих агентах, которые сами по себе вызывают иммунный ответ врожденной иммунной системы пациента. Соответственно, во втором объекте настоящего изобретения предлагаются иммуностимулирующие агенты, вызывающие неспецифический иммунный ответ при активации врожденной иммунной системы пациента.
В обоих объектах настоящего изобретения предлагаются нуклеиновые кислоты общей формулы (I). Указанные нуклеиновые кислоты по настоящему изобретению активируют врожденную иммунную систему, вызывая, таким образом, неспецифический иммунный ответ. Используемые в качестве адьювантов (например, в качестве компонента вакцины), они могут дополнительно поддерживать иммуностимулирующую активность второго соединения, специфично активирующего приобретенную иммунную систему.
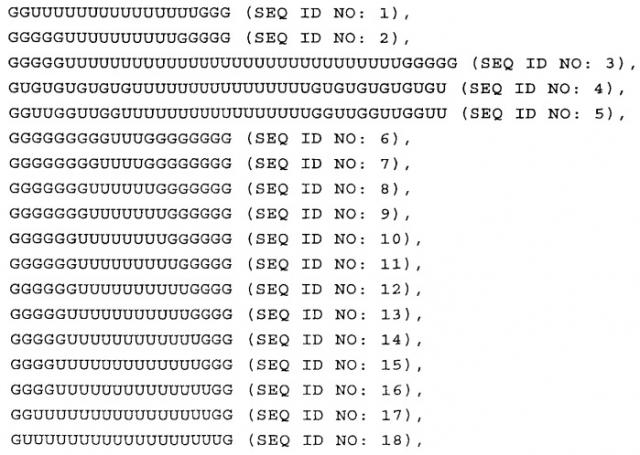
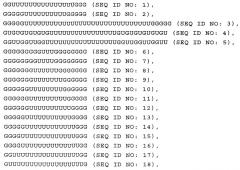
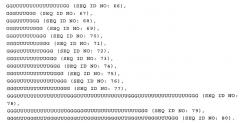
В настоящем изобретении предлагается нуклеиновая кислота формулы (I):
(NuGlXmGnNv)a
где
G обозначает гуанозин (гуанин), уридин (урацил) или аналог гуанозина (гуанина) или уридина (урацила), предпочтительно гуанозин (гуанин) или их аналоги,
Х обозначает гуанозин (гуанин), уридин (урацил), аденозин (аденин), тимидин (тимин), цитидин (цитозин) или аналоги указанных нуклеотидов (нуклеозидов), предпочтительно уридин (урацил) или его аналоги,
N обозначает последовательность нуклеиновой кислоты, длина которой составляет приблизительно от 4 до 50, предпочтительно приблизительно от 4 до 40, более предпочтительно приблизительно от 4 до 30 или от 4 до 20 нуклеотидов, при этом каждый N независимо выбирают из гуанозина (гуанина), уридина (урацила), аденозина (аденина), тимидина (тимина), цитидина (цитозина) или аналогов указанных нуклеотидов (нуклеозидов),
а равно целому числу от 1 до 20, предпочтительно от 1 до 15, наиболее предпочтительно от 1 до 10,
1 равно целому числу от 1 до 40,
где если l=1, то G обозначает гуанозин (гуанин) или его аналог,
если l>1, то по крайней мере 50% указанных нуклеотидов (нуклеозидов) обозначают гуанозин (гуанин) или его аналог,
m равно целому числу и по крайней мере равно 3,
где если m=3, то X обозначает уридин (урацил) или его аналог, и
если m>3, то присутствует по крайней мере 3 последовательных уридина (урацила) или его аналогов,
n равно целому числу от 1 до 40,
где если n=1, то G обозначает гуанозин (гуанин) или его аналог,
если n>1, то по крайней мере 50% указанных нуклеотидов (нуклеозидов) обозначают гуанозин (гуанин) или его аналог,
u, v могут независимо друг от друга обозначать целое число от 0 до 50,
предпочтительно если и равно 0, то v≥1, или
если v равно 0, то u≥1,
причем длина нуклеиновой кислоты формулы (I) по настоящему изобретению составляет по крайней мере 50 нуклеотидов, предпочтительно по крайней мере 100 нуклеотидов, более предпочтительно по крайней мере 150 нуклеотидов, еще более предпочтительно по крайней мере 200 нуклеотидов и наиболее предпочтительно по крайней мере 250 нуклеотидов.
Молекула (NuGlXmGnNv)a формулы (I) по настоящему изобретению представляет собой обычную нуклеиновую кислоту в форме любой ДНК или РНК, предпочтительно, но, не ограничиваясь только ими, циклической или линейной ДНК, одно- или двухцепочечной ДНК или РНК (которые также можно рассматривать как ДНК или РНК за счет нековалентной ассоциации двух одноцепочечных ДНК или РНК) или частично двухцепочечных ДНК или РНК (которые обычно состоят из более длиной и по крайней мере одной более короткой одноцепочечной ДНК или РНК, приблизительно одинаковых по длине, где одна или более одноцепочечных молекул ДНК или РНК являются частично комплементарными одной или более другим одноцепочечным молекулам ДНК или РНК, образуя, таким образом, двухцепочечную РНК на данном участке), например, (частично) одноцепочечная ДНК или РНК в комбинации с участками (частично) двухцепочечной ДНК или РНК. Предпочтительно, нуклеиновая кислота формулы (I) по настоящему изобретению является одно- или двухцепочечной ДНК или РНК, более предпочтительно частично двухцепочечной ДНК или РНК. Предпочтительной также является нуклеиновая кислота формулы (I) по настоящему изобретению в виде смеси одноцепочечной и двухцепочечной ДНК или РНК.
Прежде всего предпочтительно нуклеиновая кислота по настоящему изобретению (NuGlXmGnNv)a формулы (I) является частично двухцепочечной нуклеиновой кислотой, т.к. указанная (частично двухцепочечная) нуклеиновая кислота по настоящему изобретению формулы (I) (или формулы (Iа), (II) (IIа), (IIb), (IIIa) и/или (IIIb), как описано ниже, может положительно стимулировать врожденную иммунную систему пациента, который нуждается в курсе лечения и за счет направленного действия на рецепторы ПАМО для РНК (TLR-7 и TLR-8) или для двухцепочечной РНК (TLR-3, RIG-I и MDA-5). Рецепторы TLR-3, TLR-7 и TLR-8 расположены в эндосоме и активируются с помощью РНК, захваченной эндосомой. Напротив, RIG-I и MDA-5 являются цитоплазматическими рецепторами, которые активируются с помощью РНК, которая непосредственно захватывается в цитоплазме или которая высвобождается из эндосом (высвобождение или удаление из эндосом). Соответственно, любая частично двухцепочечная нуклеиновая кислота (NuGlXmGnNv)a по настоящему изобретению формулы (I) (или (частично двухцепочечная) нуклеиновая кислота по настоящему изобретению формулы (I) (и (Iа), (II) (IIа), (IIb), (IIIa) и (IIIb), как описано ниже) может активировать каскады различных сигналов иммуностимуляции, активируя таким образом ответ врожденной иммунной системы или значительно увеличивая его.
Структура (NuG1XmGnNv)a формулы (I) по настоящему изобретению включает элемент GlXmGn в качестве основного фрагмента и элементы Nu и/или Nv в качестве разграничивающих элементов, причем вся последовательность NuGlXmGnNv может повторяться, т.е. присутствует по крайней мере 1 раз, что определяется целым числом а. В настоящем изобретении было неожиданно установлено, что молекула формулы (I) по настоящему изобретению, т.е. характеризующаяся структурой (NuGlXmGnNv)a, как описано выше, приводит к значительному увеличению ответа врожденной иммунной системы пациента, на что прежде всего указывает увеличение высвобождения интерферона-α по сравнению во введением только основного фрагмента GlXmGn. Кроме того, молекула, включающая описанный выше основной фрагмент GlXmGn, может амплифицироваться в организме бактерий с более высоким выходом, если указанный фрагмент отделен повторяющимися элементами Nu и/или Nv, как указано в формуле (I). Указанная структура молекулы является прежде всего предпочтительной при получении структуры (NuGlXmGnNv)a формулы (I), как описано выше, с использованием методов транскрипции in vitro вместо стандартного твердофазного синтеза, который в значительной степени ограничен определенным размером нуклеиновых кислот.
Основной фрагмент GlXmGn формулы (I) по настоящему изобретению более подробно описан ниже.
G в составе нуклеиновой кислоты формулы (I) по настоящему изобретению обозначает нуклеотид или дезоксинуклеотид или включает нуклеозид, причем нуклеотидом (нуклеозидом) является гуанозин (гуанин) или уридин (урацил) или их аналог, более предпочтительно гуанозин (гуанин) или его аналог. Термин «аналоги нуклеотида (нуклеозида), гуанозина (гуанина) или уридина (урацила)», использованный в данном контексте, обозначает неприродные варианты природных нуклеотидов (нуклеозидов) гуанозина (гуанина) и уридина (урацила). Соответственно, аналогами гунозина (гуанина) или уридина (урацила) обычно являются нуклеотиды (нуклеозиды), химически модифицированные неприродными функциональными группами или компонентами, которые предпочтительно вводят в состав НК, т.е. осуществляют вставку, модификацию или делецию природного нуклеотида гуанозина (гуанина) или уридина (урацила) или на которые заменяют природные функциональные группы или компоненты природного нуклеотида гуанозина (гуанина) или уридина (урацила). Соответственно, каждую функциональную группу или компонент природного нуклеотида гуанозина (гуанина) или уридина (урацила) можно модифицировать или удалять из структуры, а именно основание, сахарид (рибозу), любую природную функциональную боковую группу и/или фосфатный остаток, образующие цепь олигонуклеотида. Фосфатные группы можно заменить, например, на фосфороамидаты, фосфоротиоаты, нуклеотиды пептидов, метилфосфонаты и т.п., однако в настоящем изобретении предпочтительными являются природные фосфодиэфирные цепи. Кроме того, сахаридный (рибозный) компонент выбирают из дезоксирибозы, прежде всего нуклеиновой кислоты, РНК, как описано выше, в которой сахаридный (рибозный) компонент выбирают из дезоксирибозы.
Соответственно, аналоги гуанозина (гуанина) или уридина (урацила), но, не ограничиваясь только ими, включают любой природный или неприродный гуанозин (гуанин) или уридин (урацил), модифицированный химическим способом, например, при ацетилированиия, метилировании, гидроксилировании и т.п., включая, например, 1-метилгуанозин (гуанин), 2-метилгуанозин (гуанин), 2,2-диметилгуанозин (гуанин), 7-метилгуанозин (гуанин), дигидроуридин (урацил), 4-тиоуридин (урацил), 5-карбоксиметиламинометил-2-тиоуридин (урацил), 5-(карбоксигидроксиметил)уридин (урацил), 5-фторуридин (урацил), 5-бромуридин (урацил), 5-карбоксиметиламинометилуридин (урацил), 5-метил-2-тиоуридин (урацил), метиловый эфир N-уридин(урацил)-5-оксиуксусной кислоты, 5-метиламинометилуридин (урацил), 5-метоксиаминометил-2-тиоуридин (урацил), 5'-метоксикарбонилметилуридин (урацил), 5-метоксиуридин (урацил), метиловый эфир уридин(урацил)-5-оксиуксусной кислоты, уридин(урацил)-5-оксиуксусная кислота (v). Получение указанных аналогов известно специалистам в данной области техники и описано, например, в патентах US №№4373071, 4401796, 4415732, 4458066, 4500707, 4668777, 4973679, 5047524, 5132418, 5153319, 5262530 и 5700642, содержание которых полностью включено в настоящее описание в качестве ссылки. Согласно настоящему изобретению предпочтительными являются те аналоги, которые увеличивают иммуногенность нуклеиновой кислоты формулы (I) по настоящему изобретению и/или не препятствует дополнительной модификации. По крайней мере один гуанозин (гуанин) или уридин (урацил) или их аналог может означать элементы основного фрагмента Cl и/или Gn, и не обязательно по крайней мере 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% 90% или даже 100% нуклеотидов-элементов основного фрагмента Cl и/или Gn являются природным гуанозином (гуанином), природным уридином (урацилом) и/или их аналогом и/или проявляют свойства их аналога, как описано выше. Предпочтительно элемент основного фрагмента Gl и/или Gn содержит по крайней мере всего один аналог природного гуанозина (гуанина) и/или природного уридина (урацила). Наиболее предпочтительно все нуклеотиды (нуклеозиды) в составе указанных элементов Gl и/или Gn являются аналогами, которые могут являться в наиболее предпочтительном варианте идентичными аналогами нуклеотидов (нуклеозидов) одного и того же типа (например, все гуанозиновые (гуаниновые) нуклеотиды являются 1-метилгуанозином (гуанином), или они могут различаться (например, по крайней мере два различных аналога гуанозина заменяют природный нуклеотид гуанозин).
Число нуклеотидов (нуклеозидов) элемента основного фрагмента G (Gl и/или Gn) в составе нуклеиновой кислоты формулы (I) по настоящему изобретению определяется индексами l и n. Индексы l и n независимо друг от друга равны целому числу от 1 до 100, 1 до 90, 1 до 80, 1 до 70, 1 до 60, предпочтительно от 1 до 50, еще более предпочтительно от 1 до 40, и наиболее предпочтительно от 1 до 30, где нижний предел равен 1, но в другом варианте равен 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30 или даже более. Предпочтительно для каждого целого числа если 1 и/или n=1, то G обозначает гуанозин (гуанин) или его аналог, а если 1 или n>1, то по крайней мере 50%, более предпочтительно по крайней мере 50%, 60%, 70%, 80%, 90% или даже 100% нуклеотидов (нуклеозидов) в составе элемента основного фрагмента G (Gl и/или Gn) обозначают гуанозин (гуанин) или его аналог. Например, но, не ограничиваясь только ими, если 1 или n=4, то Gl и/или Gn могут обозначать, например, GUGU, GGUU, UGUG, UUGG, GUUG, GGGU, GGUG, GUGG, UGGG или GGGG и т.п., если l или n=5, то Gl и/или Gn могут обозначать, например GGGUU, GGUGU, GUGGU, UGGGU, UGGUG, UGUGG, UUGGG, GUGUG, GGGGU, GGGUG, GGUGG, GUGGG, UGGGG или GGGGG и т.п., и т.п. Нуклеотид (нуклеозид) в составе элемента основного структурного фрагмента Gl и/или Gn, соседних с элементом Хm в составе нуклеиновой кислоты формулы (I) по настоящему изобретению, предпочтительно не обозначает уридин (урацил) или его аналог. Более предпочтительно нуклеотиды (нуклеозиды) в составе элемента основного структурного фрагмента Gl и/или Gn, соседних с элементом Хm в составе нуклеиновой кислоты формулы (I) по настоящему изобретению, обозначают по крайней мере один гуанозин (гуанин) или его аналог, более предпочтительно последовательность 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или даже 20 или более гуанозинов (гуанинов) или его аналогов. Кроме того, нуклеотид в составе элемента основного структурного фрагмента Gl и/или Gn, соседних с элементом N, например, Nu, и/или Nv (или Nw1 или Nw2, как описано ниже), в составе нуклеиновой кислоты формулы (I) по настоящему изобретению, предпочтительно не обозначает уридин (урацил) или его аналог. Более предпочтительно нуклеотиды (нуклеозиды) в составе элемента основного структурного фрагмента Gl и/или Gn, соседних с элементом N, например, Nu, и/или Nv (или Nw1 или Nw2, как описано ниже), в составе нуклеиновой кислоты формулы (I) по настоящему изобретению, обозначают по крайней мере один гуанозин (гуанин) или его аналог, более предпочтительно последовательность 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или даже 20 или более гуанозинов (гуанинов) или его аналогов.
Термин «гомология», использованный в данном контексте, обозначает, что последовательности сравнивают с контрольной последовательностью и определяют степень их гомологии (идентичности) в процентах. Например, для определения гомологии двух последовательностей нуклеиновых кислот в процентах сначала их совмещают относительно друг друга таким образом, чтобы последовательно сравнивать нуклеотидные последовательности. Для этого, например, в последовательность первой нуклеиновой кислоты можно вводить пробелы и нуклеотиды можно сравнивать с соответствующим положением второй последовательности нуклеиновой кислоты. Когда в одном положении первой последовательности нуклеиновой кислоты расположен нуклеотид, идентичный нуклеотиду во второй последовательности нуклеиновой кислоты, то в этом положении две последовательности являются идентичными (гомологичными). Гомология двух последовательностей в процентах является функцией числа идентичных положений в последовательностях. Если, например, определенная гомология последовательности определена для конкретной нуклеиновой кислоты по сравнению с контрольной нуклеиновой кислотой определенной длины, то такая гомология последовательности определена по сравнению с контрольной нуклеиновой кислотой. Следовательно, если, например, гомология последовательности нуклеиновой кислоты по сравнению с контрольной нуклеиновой кислотой длиной 100 нуклеотидов составляет 50%, то указанная нуклеиновая кислота может содержать 50 нуклеотидов, полностью идентичных фрагменту контрольной нуклеиновой кислоты длиной 50 нуклеотидов. Однако указанная нуклеиновая кислота может также представлять собой последовательность нуклеиновой кислоты длиной 100 нуклеотидов, гомология которой составляет 50%, другими словами, в данном случае 50% идентичных нуклеиновых кислот по сравнению с контрольной последовательностью нуклеиновой кислоты расположены во всей цепи нуклеиновой кислоты. В другом варианте, последовательностью нуклеиновой кислоты может являться последовательность нуклеиновой кислоты длиной 200 нуклеотидов, которая во фрагменте нуклеиновой кислоты длиной 100 нуклеотидов является полностью идентичной с контрольной последовательностью нуклеиновой кислоты длиной 100 нуклеотидов. Разумеется, другие последовательности нуклеиновых кислот полностью удовлетворяют указанному критерию.
Определение гомологии двух последовательностей в процентах можно осуществить с использованием математического алгоритма. Предпочтительным, но, не ограничиваясь только ими, примером математического алгоритма, который можно использовать для сравнения двух последовательностей, является алгоритм, описанный в статье Karlin и др., PNAS USA, т.90, cc.5873-5877 (1993). Указанный алгоритм включен в программу NBLAST, с помощью которой можно сравнивать последовательности с требуемой гомологией с последовательностями по настоящему изобретению. Для сравнения последовательностей, содержащих пробелы (гэпы), можно использовать программу Gapped BLAST, описанную в статье Altschul и др.. Nucleic Acids Res, т.25, cc.3389-3402 (1997). При использовании программ BLAST и Gapped BLAST можно использовать параметры по умолчанию одной из программ (например, NBLAST). Кроме того, последовательности можно сравнивать с использованием версии 9 программы GAP (основной программы сравнения) фирмы Genetic Computing Group с использованием матрицы по умолчанию (BLOSUM62, величины от -4 до +11), при этом величина штрафа за открытый гэп составляет -12 (для первого нуля гэпа), а величина штрафа за расширение гэпа составляет -4 (для каждого дополнительного удачного нуля в гэпе). После сравнения гомологию в процентах рассчитывают по числу совпадений в процентах контрольной последовательности с последовательностью по настоящему изобретению. Указанные способы определения гомологии последовательностей двух нуклеиновых кислот можно также использовать для сравнения соответствующих аминокислотных последовательностей с использованием соответствующих программ.
Аналогичным образом для формулы (I) предпочтительно, если 1 или n>1, то по крайней мере 60%, 70%, 80%, 90% или даже 100% нуклеотидов (нуклеозидов) элементов в основном структурном фрагменте Gl и/или Gn являются гуанозином (гуанином) или его аналогами, как описано выше. Остальные нуклеотиды (нуклеозиды) элементов основного структурного фрагмента Gl и/или Gn (если гуанозин (гуанин) составляет менее 100% указанных нуклеотидов (нуклеозидов)) могут являться уридином (урацилом) или его аналогами, как описано выше.
Элемент X, прежде всего Хm, в нуклеиновой кислоте формулы (I) по настоящему изобретению также является элементом основного структурного фрагмента и является нуклеотидом или дезоксинуклеотидом или включает нуклеозид, причем нуклеозид (нуклеотид) обычно выбирают из гуанозина (гуанина), уридина (урацила), аденозина (аденина), тимидина (тимина), цитидина (питозина) или их аналогов, предпочтительно уридина (урацила) или их аналогов. Термин «аналоги нуклеотида (нуклеозида)» обозначает неприродные варианты природных нуклеотидов (нуклеозидов). Соответственно, аналогами являются химические производные нуклеотидов (нуклеозидов), содержащие неприродные функциональные группы, которые предпочтительно включают в природные нуклеотиды (нуклеозиды), удаляют из них или которыми заменяют природные функциональные группы нуклеотида (нуклеозида). Таким образом, каждый компонент природного нуклеотида можно модифицировать, а именно, основание, сахаридный остаток (рибозу или дезоксирибозу) и/или фосфат, образующие нуклеотидную цепь. Фосфатные группы можно заменять, например, на фосфорамидаты, фосфоротиоаты, пептидные нуклеотиды, метилфосфонаты и т.п., однако предпочтительной является природная фосфодиэфирная цепь. Предпочтительно по крайней мере 10%, более предпочтительно по крайней мере 20%, более предпочтительно по крайней мере 50%, более предпочтительно по крайней мере 70% и даже еще более предпочтительно по крайней мере 90% всех нуклеотидов «X» проявляют свойства аналога, как определено выше, если нуклеиновая кислота по настоящему изобретению содержит по крайней мере всего один аналог. Аналоги, на которые заменен определенный нуклеотид в составе элемента основного структурного фрагмента «Хm», являются идентичными, например, все цитидиновые (цитозиновые) нуклеотиды (нуклеозиды) в составе элемента основного структурного фрагмента «Хm» представляют собой определенный цитидиновый (цитозиновый) аналог, например, 2-тиоцитидин (цитозин) или они могут отличаться от определенного нуклеотида (нуклеозида), например, элемент «Хm» включает по крайней мере два различных цитидиновых (цитозиновых) аналога.
Аналоги гуанозина (гуанина), уридина (урацила), аденозина (аденина), тимидина (тимина), цитидина (цитозина), включают, но, не ограничиваясь только ими, любые природные или неприродные гуанозин (гуанин), уридин (урацил), аденозин (аденин), тимидин (тимин), цитидин (цитозин, модифицированные химическими методами, например, при ацелировании, метилировании, гидроксилировании и т.п., и включают 1-метиладенозин (аденин), 2-метиладенозин (аденин), 2-метилтио-N6-изопентениладенозин (аденин), N6-метиладенозин (аденин), N6-изoпeнтeнилaдeнoзин (аденин), 2-тиоцитидин (цитозин), 3-метилцитидин (цитозин), 4-ацетилцитидин (цитозин), 2,6-диаминопурин, 1-метилгуанозин (гуанин), 2-метилгуанозин (гуанин), 2,2-диметилгуанозин (гуанин), 7-метилгуанозин (гуанин), инозин, 1-метилинозин, дигидроуридин (урацил), 4-тиоуридин (урацил), 5-карбоксиметиламинометил-2-тиоуридин (урацил), 5-(карбоксигидроксиметил)уридин (урацил), 5-фторуридин (урацил), 5-бромуридин (урацил), 5-карбоксиметиламинометилуридин (урацил), 5-метил-2-тиоуридин (урацил), метиловый эфир N-уридин(урацил)-5-оксиуксусной кислоты, 5-метиламинометилуридин (урацил), 5-метоксиаминометил-2-тиоуридин (урацил), 5'-метоксикарбонилметилуриди