Способ определения мембранной активности веществ на живых клетках
Иллюстрации
Показать всеИзобретение относится к биотехнологии, а именно к способам определения активности веществ, обладающих способностью встраиваться в биологические мембраны клеточных стенок с нарушением функционирования клеток. В измерительные ячейки прибора для автоматизированного подсчета числа живых инфузорий вносят суспензию клеток Tetrahymena pyriformis и испытуемое вещество с последующим определением числа живых клеток в каждую минуту, при этом совпадение динамики изменения числа живых клеток во времени для сравниваемых веществ делают заключение о равенстве их активностей. Методы расчета основаны либо на определении времени инкубации инфузорий с испытуемым веществом, необходимого для гибели половины инфузорий, либо на определении константы скорости гибели клеток, которую удобно рассчитывать по тангенсу угла наклона прямой, характеризующей зависимость логарифма числа подвижных клеток от времени в период наблюдаемого падения числа живых клеток. Обе величины, зависящие от мембранной активности, характеризуют мембранную активность изучаемых веществ и пригодны для сравнения активностей. Способ позволяет определять мембранную активность веществ, обеспечивая возможность стандартизации процесса. 3 з.п. ф-лы, 3 ил., 1 табл., 3 пр.
Реферат
Изобретение относится к биотехнологии, а именно к способам определения активности веществ, обладающих способностью встраиваться в биологические мембраны клеточных стенок с нарушением функционирования клеток, что является причиной токсического действия этих веществ [1]. Известны методы исследования способности веществ взаимодействовать с природными биологическими мембранами с использованием эритроцитов [2] или живых клеточных линий [3]. В этих методах проявляется способность тестируемых веществ нарушать целостность или нативность структуры биологических мембран, что приводит к лизису и гибели клеток. В количественном отношении мембранная активность цитотоксинов, определенная двумя методами, может не совпадать, что косвенно свидетельствует о возможных различиях в действии веществ на разные мембраны [4]. В связи с этим недостатком гемолитического метода можно считать то обстоятельство, что он чувствует только такие воздействия, которые грубо нарушают целостность мембраны или приводят к образованию в мембранах пор, ответственных за осмотический лизис. Недостатком метода, фиксирующего гибель клеток, является необходимость получения и ведения клеточных линий, а также проведение дополнительных реакций, обнаруживающих гибель клеток, например, по потере способности восстанавливать тетразолиевый краситель в формазан.
Преодолеть эти недостатки можно, используя другую клеточную мишень. Из литературы известно [5], что комплемент морской свинки способен обездвиживать инфузории Tetrahymena pyriformis в результате действия мембраноатакующего комплекса и при этом лизис наступает значительно позднее и под влиянием больших количеств сыворотки. Следить за числом оставшихся в живых инфузорий удобно с помощью специального прибора для биологических исследований [6]. Таким образом, такая клеточная модель, как живые инфузории, могла бы быть доступной и пригодной мишенью для изучения действия мембраноактивных соединений на стенку живой клетки. Ранее вопрос об использовании инфузорий в качестве мишени для определения мембранной активности веществ не изучался. Не исследовалось также действие мембраноактивных веществ на инфузории.
Инфузории использовались в качестве мишени «биотестирования», то есть живых клеток, гибнущих при воздействии на них токсических веществ [7], при этом полагалось, что изучается общая интегральная токсичность вещества для живой системы, представленной инфузориями, без рассмотрения механизмов токсичности.
Задачей заявленного изобретения является разработка универсального способа и метода расчета для определения мембранной активности веществ с использованием доступной мишени.
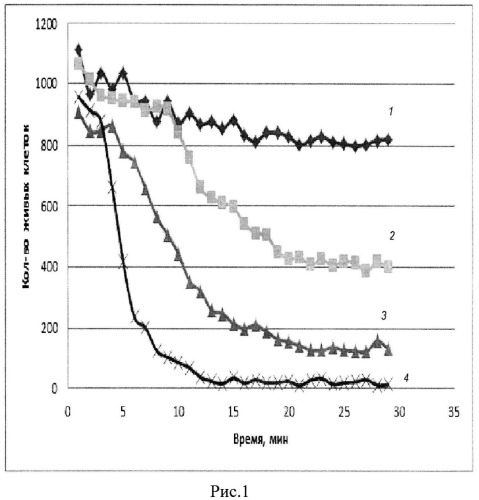
Поставленная задача достигается путем разработки способа определения и метода расчета функциональной активности мембраноактивных соединений по их воздействию на инфузории Tetrahymena pyriformis, с использованием прибора для биологических исследований [6]. Было обнаружено, что при действии мембраноактивного соединения на инфузории через определенный промежуток времени, зависящий от количества активного вещества, начинается процесс обездвиживания инфузорий, протекающий со скоростью, также зависящей от количества этого вещества (рис.1). При этом наблюдается изменение количества живых клеток во времени при добавлении разных количеств кардиотоксина кобры Naja sumatrana: 1 - 80 мкг, 2 - 120 мкг, 3 - 160 мкг, 4 - 240 мкг. Обе измеряемые величины: время инкубации, необходимое для достижения обездвиживания половины микроорганизмов, а также скорость перехода подвижных инфузорий в неподвижные могут быть использованы для расчета количества и активности мембраноактивного вещества.
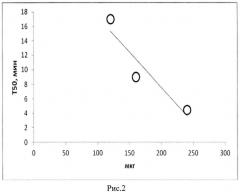
На рис.1 мы видим число движущихся клеток в данную минуту измерения, поскольку клетки, не изменившие свои координаты, программно не учитываются. Время половинной гибели клеток зависит от количества мембраноактивного вещества (рис. 2). На рис. представлена зависимость времени гибели половины клеток от добавления разных количеств кардиотоксина кобры Naja sumatrana). Наблюдаемая на графике рис.1 сигмоида характеризует переход между двумя состояниями: живое - неживое. Очевидно, что крутизна этого перехода (его скорость) может характеризовать активность испытуемого вещества. Мы предположили, что такой переход может характеризоваться уравнением первого порядка: n=n0e-kt , где n0 - число живых клеток в начале процесса, n - число живых клеток во время t. Логарифмируя это уравнение, получаем линейную зависимость логарифма числа живых клеток от времени, характеризующую константу скорости процесса k с размерностью 1/мин: ln n0 - ln n = kt.
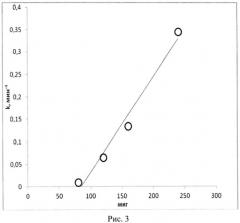
Действительно, на рис.3 представлен калибровочный график зависимости константы скорости обездвиживания инфузорий от количества мембраноактивного вещества - кардиотоксина кобры Naja sumatra , который имеет линейный характер.
Методы расчета основаны либо на определении времени инкубации инфузорий с тестируемым веществом, необходимого для гибели половины инфузорий, либо на определении константы скорости гибели клеток, которую удобно рассчитывать по тангенсу угла наклона прямой, характеризующей зависимость логарифма числа подвижных клеток от времени в период наблюдаемого падения числа живых клеток. Обе величины, зависящие от количества мембраноактивного вещества, могут быть использованы для сравнения с величинами, полученными для соединения, заведомо известного своей мембранной активностью и выбранного за стандарт. Тем самым достигается определение мембранной активности изучаемого вещества методом, пригодным для стандартизации.
Техническим результатом заявленного изобретения является разработка способа и метода расчета для определения мембранной активности веществ с использованием доступной и стандартизуемой мишени в виде инфузории Tetrahymena pyriformis, в результате чего не наблюдается грубого воздействия на целостность мембраны, приводящей к осмотическому лизису клеток.
Пример 1. Определение мембранной активности веществ на живых клетках.
В измерительные ячейки прибора вносят 200 мкл суспензии приблизительно 800 клеток инфузории Tetrahymena pyriformis в вероналовом буферном растворе, pH 7,4, содержащем 0,075 М NaCl, 0,075 мМ Ca2+ и 0,25 мМ Mg2+ и 100 мкл того же буфера, содержащего от 2 до 50 мкл раствора испытуемого вещества. Определяют число живых клеток в ячейках каждую минуту (рис.1). Динамика изменения числа живых клеток во времени для измеряемой активности комплемента сравнивается с аналогичной динамикой, полученной для контрольного образца, представляющего собой раствор вещества, заведомо обладающего мембранной активностью и выбранного за стандарт.
Для совпадающих динамик опытного и контрольного образцов полагают равенство активностей.
Пример 2. Аналогично примеру 1 только для расчета мембранной активности вещества измеряют время (T50) наступления обездвижения половины клеток для разных количеств образца и строят график зависимости времени от количества образца (рис.2).
Пример 3. Аналогично примеру 1 только для расчета мембранной активности определяют тангенс угла наклона прямой, характеризующей зависимость логарифма числа подвижных клеток от времени в период наблюдаемого падения числа живых клеток в качестве константы скорости (k) процесса для взятого количества образца (рис.3). На основании константы скорости в опыте по графику определяют, какому количеству стандартного образца соответствует мембранная активность вещества в эксперименте.
В качестве образца сравнения был выбран мелитин яда пчелы, обладающий высокой мембранной активностью [6]. В таблице 1 приведены константы скорости гибели инфузорий и времена гибели половины клеток под действием разных количеств мелитина яда пчелы и кардиотоксина кобры Naja sumatrana. Сравнение полученных данных показывает, что кардиотоксин кобры по сравнению с мелитином обладает примерно в 300 раз меньшей мембранной активностью.
| Таблица 1 | |||
| Константы скорости (k) гибели инфузорий и времена гибели половины клеток под действием разных количеств мелитина яда пчелы и кардиотоксина кобры Naja sumatrana. | |||
| Вещество | Кол-во, | k, мин-1 | T50, мин |
| МКГ | |||
| Мелитин | 0,51 | 0,16 | 11 |
| " | 0,85 | 0,21 | 5 |
| Кардиотоксин | 80 | 0,01 | >60 |
| " | 120 | 0,07 | 17 |
| " | 160 | 0,13 | 9 |
| " | 240 | 0,34 | 4,5 |
Литература
1. Куценко С.А. Основы токсикологии. Биомедицинский журнал Medline. ru. 2003. Т.4. Март.
(http://www.medline.ru/public/monografy/toxicology/p5-toxfactors/p3.phtml)
2. Zusman N., Miklas T.M., Graves Т., Dambach G.E., Hudson R.A. On the interaction of cobra venom protein cardiotoxins with erythrocytes. Biochem. Biophys. Res. Communs. 1984, V.124, №2, P.629-636.
3. Green L.M., Reade J.L., Ware C.F. Rapid colorimetric assay for cell viability: application to the quantitation of cytotoxic and growth inhibitory lymphokines. J. Immunol. Methods. 1984, V.70, №2, P.257-268.
4. Lin S.-R., Chang L.-S., Kee-Lung Chang K.-L. Separation and structure-function studies of Taiwan cobra cardiotoxins. J. Protein Chem. V.21, №2, P.81-86.
5. Sinclair I.J.B. The role of complement in the immune reactions of Paramecium aurelia and Tetrahymena pyriformis. Immunology. 1958, V.1, P.291-299.
6. Черемных Е.Г., Покатаев А.С., Гридунова В.Н. Прибор для биологических исследований. - Патент РФ 2361913, опубл. 20.07.09. Бюл. №20.
7. Виноходов Д.О. Научные основы биотестирования с использованием инфузорий. Автореферат диссертации на соискание ученой степени доктора биологических наук. Санкт-Петербург, 2007.
8. Lin S.Y., Huang M.C., Tseng W.C., Lee C.Y. Comparative studies on the biological activities of cardiotoxin, melittin and prymnesin. Naunyn Schmiedebergs Arch Pharmacol. 1975, V.287, P.349-358.
1. Способ определения мембранной активности веществ на живых клетках, отличающийся тем, что в измерительные ячейки прибора для автоматизированного подсчета числа живых инфузорий вносят суспензию клеток Tetrahymena pyriformis и испытуемое вещество с неизвестной мембранной активностью с последующим определением числа живых клеток в каждую минуту, при совпадении динамики изменения числа живых клеток во времени для испытуемого вещества и контрольного образца, представляющего собой мелитин яда пчелы, полагают равенство их активностей.
2. Способ по п.1, отличающийся тем, что для определения динамики изменения числа живых клеток во времени измеряют время инкубации инфузорий с испытуемым веществом, необходимое для гибели половины клеток, которое обратно пропорционально мембранной активности вещества, и сравнивают его со временем половинной гибели клеток для контрольного образца.
3. Способ по п.1, отличающийся тем, что для определения динамики изменения числа живых клеток во времени рассчитывают тангенс угла наклона зависимости логарифма числа живых клеток от времени в период наблюдаемого падения числа живых клеток, который является константой скорости процесса и прямо пропорционален мембранной активности испытуемого вещества, и сравнивают с константой скорости процесса для контрольного образца.
4. Способ по п.1, отличающийся тем, что в качестве испытуемого вещества используют кардиотоксин кобры Naja sumatrana.