Мутантная рекомбинантная l-аспарагиназа wolinella succinogenes (варианты)
Иллюстрации
Показать всеНастоящее изобретение относится к биотехнологии и представляет собой мутантные варианты рекомбинантной L-аспарагиназы, характеризующиеся аминокислотной последовательностью, соответствующей аминокислотной последовательности L-аспарагиназы бактерий Wolinella succinogenes, в которой аминокислотный остаток лизина в положении 24 заменен на остаток серина либо аминокислотный остаток валина в положении 23 заменен на остаток глутамина, а аминокислотный остаток лизина в положении 24 заменен на остаток треонина. Изобретение позволяет получить варианты L-аспарагиназы с улучшенной устойчивостью к протеолизу под действием трипсина по сравнению с немодифицированным рекомбинантным белком и различным уровнем глутаминазной активности при полном сохранении аспарагиназной активности, что делает их привлекательными объектами для разработки на их основе новых противоопухолевых терапевтических препаратов. 2 н.п. ф-лы, 1 ил., 1 табл., 11 пр.
Реферат
Изобретение относится к области биотехнологии и касается мутантных вариантов рекомбинантной L-аспарагиназы, обладающих повышенной протеолитической стабильностью.
L-аспарагиназы относятся к ферментам медицинского назначения, широко используемым во всем мире для лечения опасного онкологического заболевания, острого лимфобластного лейкоза (ОЛЛ).
ОЛЛ является самым распространенным злокачественным заболеванием у детей. В структуре педиатрической онкологии доля ОЛЛ составляет до 25% всех опухолей. Современный протокол лечения ОЛЛ с использованием L-аспарагиназ обладает чрезвычайно высокой эффективностью и позволяет достичь клинико-гематологической ремиссии у 97-98% пациентов [Масчан и Мякова, 2006; Горошкова с соавт., 2008].
Имеются данные об эффективности использования L-аспарагиназ при лечении миелобластной лейкемии [Duval et al., 2002], Ходжкинской и не-Ходжкинской лимфом, миелосаркомы и множественной миеломы [Perel et al., 2002]; NK/T-клеточной и кожной Т-клеточной лимфом [Obama et al., 1999; Yong et al., 2003; Jaccard et al., 2009]; метастазирующих опухолей, имеющих неблагоприятный прогноз [Jaccard et al., 2011]; саркомы мягких тканей [Tardito et al., 2007], гепатоклеточной саркомы и гастросаркомы [Cappelletti et al., 2008; Scotti et al., 2011]. Однако эти данные требуют клинического подтверждения [Covini et al., 2012].
Биологической мишенью L-аспарагиназ являются непосредственно злокачественные лимфоидные клетки (лимфоидные бласты), пролиферация которых в естественных условиях зависит от поступления извне аминокислоты L-аспарагина, источником которой являются клетки организма, синтезирующие аспарагин, а также пища. Введение L-аспарагиназ в системный кровоток пациентов обеспечивает расщепление свободно циркулирующего L-аспарагина с образованием аспарагиновой кислоты и аммония [Красоткина и Соколов, 20 II]. Считается, что основной механизм противоопухолевого действия L-аспарагиназ основан на индукции "голодания" лейкозных клеток, вызывающего их гибель в результате ограничения доступа к источнику L-аспарагина.
Эффективность в отношении подавления лейкозных клеток in vitro или in vivo обнаружена у природных L-аспарагиназ бактерий Wollinella succinogenes, Thermus thermophilus, Proteus vulgaris, Pseudomonas fluorescens, Serratia marcescens, Erwinia aroidea, Aspergillus terreus, Helicobacter pylori, Mycobacterium tuberculosis и Yersinia pseudotuberculosis и др. [Rowley & Wriston, 1967; Peterson & Ciegler, 1969; Reddy et al., 1969; De-Angeli et al., 1970; Pritsa et al., 2001; Абакумова с соавт., 2008; Гладилина с соавт., 2008; Cappelletti et al., 2008].
В России препараты на основе немодифицированной L-аспарагиназы ЕсА бактерий Escherichia coli входят в Перечень «Жизненно необходимых и важнейших лекарственных препаратов». В то же время во многих странах использование немодифицированной ЕсА снижается, в том числе вследствие наличия значительных побочных эффектов.
Альтернативами по отношения к ЕсА являются химически модифицированная, «пэгилированная» ЕсА (ONCASPAR) и лекарственный препарат «эрвиназа» на основе L-аспарагиназы ErA бактерий Erwinia chrysanthemi [Покровский с соавт., 2008].
L-аспарагиназа ErA по сравнению с ЕсА вызывает меньшее количество осложнений [Durden et al., 1983; Eden et al., 1990; Duval et al., 2002; Appel et al., 2006], однако в то же время имеет худшие показатели эффективности (частота ремиссий) и отдаленных результатов лечения (риск рецидива, бессобытийная и общая выживаемость) [Duval et al., 2002]. ErA не обеспечивает столь полного разрушения аспарагина, как ЕсА (что связывают с разным временем жизни этих ферментов в крови), и в этой связи использование ErA сопровождается заметно большим количеством рецидивов [van den Berg, 2011].
Иммунный ответ является распространенной реакцией организма на введение бактериальных L-аспарагиназ [van den Berg, 2011]. При этом у одной трети пациентов с чувствительностью к L-аспарагиназе ЕсА наблюдаются антитела, распознающие ErA [Billett et al., 1992; Vrooman et al., 2010], что затрудняет последовательное применение этих ферментов.
Таким образом, несмотря на достаточную эффективность, ни ЕсА, ни ErA не являются идеальными агентами для лечения ОЛЛ [Covini et al., 2012].
В этой связи интерес представляют направления качественного усовершенствования L-аспарагиназ, в первую очередь в части увеличения времени их действия и оптимизации соотношения специфической аспарагиназной и неспецифической глутаминазной активности [Patel et al., 2009].
Детальный механизм инактивации и последующей элиминации L-аспарагиназ из системного кровотока до сих пор остается неизвестным [Patel et al., 2009]. Считается, что L-аспарагиназы деградируют под действием различных протеолитических ферментов крови, включая ферменты трипсинового ряда [Newsted et al., 1995; Kotzia et al., 2007; Patel et al., 2009], уровень которых значительно возрастает через 10 и 20 дней после начала аспарагиназной терапии [Shimizu et al., 1998; Guo et al., 2000].
Известные способы повышения устойчивости к действию протеиназ включают внесение направленных мутаций в аминокислотные последовательности L-аспарагиназ, осуществляемых путем замены чувствительных остатков на альтернативные, не узнаваемые соответствующими протеиназами [Kotzia et al., 2007; Patel et al., 2009; Offman et al., 2011].
Инактивация фермента ЕсА трипсином осуществляется путем расщепления белка после остатка лизина в положении 29 [Ramjeesingh et al., 1992]. В то же время L-аспарагиназа Erwinia carotovora, гомологичная ЕсА, инактивируется трипсином путем первичного расщепления после остатка лизина в положении 53 и последующего расщепления после остатка аргинина в положении 206 [Kotzia et al., 2007]. Эти данные показывают, что сайты чувствительности к трипсину у L-аспарагиназ из различных микроорганизмов локализованы в не совпадающих между собой областях молекул и не могут быть идентифицированы путем сравнения их последовательностей.
Побочные эффекты применения L-аспарагиназ различны и характеризуются различной степенью тяжести [van den Berg, 2011]. Значительная часть этих эффектов вызвана наличием у L-аспарагиназ неспецифической глутаминазной активности, снижающей концентрацию глутамина в крови [Reinert et al., 2006]. Ферменты ЕсА и ErA характеризуются высоким уровнем глутаминазной активности, составляющим около 2% и 10% от их аспарагиназной активности, соответственно [van den Berg, 2011; Covini et al., 2012].
Неоднократно предпринимались попытки снизить уровень глутаминазной активности L-аспарагиназы ЕсА путем изменения ее аминокислотной последовательности [Derst et al., 2000; Offman et al., 2011]. В результате обнаружено, что мутации в положениях N24, R195, Y250 [Offman et al., 2011], а также N248 [Derst et al., 2000] приводят к многократному снижению соотношения глутаминазной и аспарагиназной активности фермента. Причем некоторые из обнаруженных мутаций аспарагиназную активность не меняли [Offman et al., 2011].
В то же время было установлено, что неспецифическая глутаминазная активность наряду с указанным выше негативным влиянием вносит свой положительный вклад в общую противоопухолевую активность L-аспарагиназы [Offman et al., 2011; Covini et al., 2012]. Так из двух вариантов L-аспарагиназ с «нулевой» и «50-процентной» глутаминазной активностью лучший противоопухолевый эффект выявлен у модифицированной L-аспарагиназы, глутаминазная активность которой составляла 50% от активности немодифицированного фермента [Offman et al., 2011].
Из числа природных ферментов особый интерес вызывает L-аспарагиназа WsA бактерий Wolinella succinogenes. WsA является хорошо изученным ферментом, обладающим доказанным противоопухолевым действием, пониженной токсичностью, протеолитической стабильностью и длительным временем циркулирования в кровотоке [Distasio & Niederman, 1976; Distasio et al., 1977; Distasio et al., 1982; Lubkowski et al., 1996; Reinert et al., 2006]. Чувствительность нативной немодифицированной WsA, выделенной из клеток W. succinogenes, к деградации под действием трипсина неизвестна.
Другие физико-химических свойства этого фермента, в частности уровень аспарагиназной активности, Км, зависимость активности от рН и др., схожи со свойствами ферментов ЕсА или ErA.
Главной особенностью нативной L-аспарагиназы WsA является исключительно низкая глутаминазная активность, составляющая 0.015% от аспарагиназной, что в 130-600 раз меньше, чем у ферментов ЕсА или ErA [Distasio & Niederman, 1976]. Как следствие, L-аспарагиназа WsA: (1) не вызывает иммуносупрессию гуморального или клеточного звеньев иммунитета даже в дозах, пятикратно превышающих дозы L-аспарагиназы ЕсА; (2) не нарушает морфологию селезенки и не изменяет состав субпопуляций спленоцитов; (3) не вызывает гепатотоксичность; (4) не повреждает тимус, почки и поджелудочную железу [Distasio et al., 1982; Reinert et al., 2006].
Кроме того, этот фермент:
- не ингибируется продуктами ферментативной реакции, в частности аммонием [Distasio & Niederman, 1976];
- обладает чрезвычайно низкой иммунологической перекрестной реактивностью с L-аспарагиназой E.coli, что делает возможным их последовательное применение в качестве препаратов первой и второй очереди [US 6251388, ЕР 1219706].
Вместе взятые эти свойства характеризуют нативную L-аспарагиназу WsA как перспективный фермент для использования в терапии ОЛЛ.
В то же время получение нативной L-аспарагиназы из биомассы W. succinogenes оказалось затруднительным в связи с низкой эффективностью культивирования [Albanese & Kafkewitz, 1978]. Биосинтез рекомбинантной формы этого белка в гетерологичной системе экспрессии также не был удачным, поскольку приводил к получению белка, обладавшего резко увеличенным уровнем глутаминазной активности [Derst et al., 2000], что обесценивало его основное преимущество.
Ближайшим аналогом заявляемых вариантов рекомбинантной L-аспарагиназы является рекомбинантная форма природной L-аспарагиназы Wolinella succinogenes [EP 1219706]. Однако описание таких свойств ближайшего аналога, как устойчивость к протеолитической деградации под действием трипсина и соотношение глутаминазной и аспарагиназной активности в этом документе отсутствует.
Для более подробной характеристики фермента-ближайшего аналога нами был осуществлен биосинтез соответствующей ближайшему аналогу рекомбинантной немодифицированной L-аспарагиназы Wolinella succinogenes и показано, что рекомбинантная немодифицированная L-аспарагиназа Wolinella succinogenes не проявляет устойчивости к протеолитической деградации под действием трипсина, а также, что характерное для нее соотношение глутаминазной и аспарагиназной активностей значительно уступает параметрам природного фермента.
Задача заявляемого изобретения - расширить арсенал рекомбинантных вариантов (форм) L-аспарагиназы Wolinella succinogenes. Задача решена путем получения:
- мутантного варианта Was71 рекомбинантной L-аспарагиназы, характеризующейся аминокислотной последовательностью, соответствующей аминокислотной последовательности L-аспарагиназы бактерий Wolmella succinogenes, в которой аминокислотный остаток лизина в положении 24 заменен на остаток серина, и
- мутантного варианта Was72 рекомбинантной L-аспарагиназы, характеризующейся аминокислотной последовательностью, соответствующей аминокислотной последовательности L-аспарагиназы бактерий Wolinella succinogenes, в которой аминокислотный остаток валина в положении 23 заменен на остаток глутамина, а аминокислотный остаток лизина в положении 24 заменен на остаток треонина.
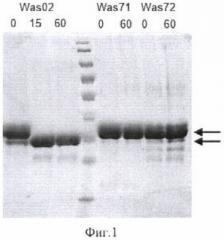
Фиг.1 Сравнительный анализ устойчивости рекомбинантных аспарагиназ, немодифицированной Was02 (контроль) и мутантных Was71 или Was72, к протеолитической деградации под действием трипсина. Показаны результаты электрофореза образцов аспарагиназ, инкубированных в реакционной смеси с трипсином в течение 0, 15 или 60 минут (продолжительность инкубации указана над дорожками). Стрелками показано расположение исходного белка (верхняя стрелка) и его деградированной формы (при наличии, нижняя стрелка). На средней дорожке показано расположение предокрашенных маркеров молекулярного веса (SM671, Fermentas).
Пример 1. Конструирование синтетического гена рекомбинантной немодифицированной L-аспарагиназы W. succinogenes Was02
Синтетический структурный ген L-аспарагиназы W. succinogenes получают с использованием традиционных методов химического синтеза в составе BamHI/XhoI фрагмента ДНК (SEQ ID NO 1). Синтетический структурный ген представляет собой нуклеотидную последовательность ДНК, кодирующую немодифицированную L-аспарагиназу W. succinogenes, имеющую аминокислотную последовательность [САА58658, GenBank], соответствующую продукту трансляции природного гена ansA [Х83689, GenBank]. В составе синтетического гена в области стартового ко дона ATG локализован сайт узнавания рестриктазы NcoI. BamHI/XhoI фрагмент ДНК, заключающий синтетический ген немодифицированной L-аспарагиназы W. succinogenes, клонируют в составе вектора pUC57, результирующую плазмиду называют pUC57-WAS.
Результирующая плазмида pUC57-WAS содержит в своем составе нуклеотидную последовательность NcoI/XhoI фрагмента ДНК, заключающего структурный ген немодифицированной аспарагиназы W. succinogenes.
Пример 2. Конструирование вектора pET28-Was02 и получение штамма BL21-Was02 -продуцента рекомбинантной немодифицированной L-аспарагиназы Was02 W. succinogenes
Рекомбинантная плазмида pET28-Was02 представляет собой совокупность XhoI/NcoI фрагмента ДНК векторной плазмиды pET28b(+) (Novagen) размером 5231 п.о. и NcoI/XhoI фрагмента ДНК плазмиды pUC57-WAS (пример 1) размером 995 п.о., заключающего структурный ген рекомбинантной немодифицированной L-аспарагиназы W. succinogenes.
Для получения плазмиды pET28-Was02 плазмиду pUC57-WAS расщепляют с помощью рестриктаз NcoI и XhoI, образовавшийся фрагмент ДНК размером 995 п.о. элюируют из геля с использованием кита Qiagen (Qiagen, cat. №28706) и лигируют с ДНК вектора pET28b(+), расщепленного с помощью рестриктаз NcoI и XhoI. Лигирование проводят с помощью ДНК-лигазы фага Т4. В результате получают плазмиду pET28-Was02 размером 6226 п.о.
Плазмида pET28-Was02 является экспрессионной, ее используют для биосинтеза немодифицированной L-аспарагиназы Was02 W. succinogenes в клетках E. coli. В составе плазмиды pET28-Was02 структурный ген немодифицированной L-аспарагиназы Was02 W.succinogenes находится под контролем промотора фага Т7.
Штамм-продуцент рекомбинантной немодифицированной L-аспарагиназы Was02 W. succinogenes получают путем трансформации реципиентного штамма E. coli BL21(DE3) (Novagen) - ВКПМ В-10189. Трансформацию осуществляют путем введения в клетки реципиентного штамма плазмиды pET28-Was02 с применением реактива CaCl2 [Маниатис с соавт., 1984]. Колонии трансформированного штамма отбирают на селективной среде, содержащей антибиотик канамицин.
В результате трансформации получают штамм BL21-Was02, который используют для биосинтеза рекомбинантной немодифицированной L-аспарагиназы W. succmogenes.
Клетки штамма E. coli BL21-Was02 содержат экспрессионную плазмиду pET28-Was02 и в ответ на внесение в среду культивирования индукторов ИПТГ или лактозы синтезируют рекомбинантную немодифицированную L-аспарагиназу W. succinogenes Was02, которую используют далее в качестве контроля.
Пример 3. Конструирование структурного гена мутантной L-аспарагиназы Was71, содержащей мутацию K24S, и получение плазмиды pET28-Was71
Фрагмент ДНК, заключающий структурный ген мутантной L-аспарагиназы Was71, получают в процессе ПЦР-амплификации с использованием в качестве матрицы ДНК плазмиды pET28-Was02. Амплификацию проводят в две стадии. Сначала амплифицируют два перекрывающихся фрагмента ДНК, для чего используют следующие пары праймеров:
Фрагмент 1 размером 171 п.о.:
N685 (5′-taatacgactcactataggg)
N895 (5′-agagtaagaagaactaacagaagattc)
Фрагмент 2 размером 945 п.о.:
N894 (5′-gaatcttctgttagttcttcttactct)
N898 (5′-tggctcgagttagtaggtagagaagattttctggatagctt)
Амплифицированные фрагменты ДНК элюируют из агарозного геля с использованием кита Qiagen (Qiagen, cat. №28706) и используют для ПЦР-лигирования. Для этого проводят ПЦР-амплификацию на смеси фрагментов 1 и 2 в качестве матрицы. Праймерами для амплификации служат N685 и N898. Полученный в результате ПЦР фрагмент ДНК размером 1089 п.о. элюируют из агарозного геля, обрабатывают рестриктазами NcoI и XhoI и клонируют в векторе pET28b(+), расщепленном с помощью рестриктаз NcoI и XhoI. В результате клонирования получают плазмиду pET28-Was71, в составе которой нуклеотидную последовательность клонированного фрагмента ДНК подтверждают с помощью секвенирования.
Плазмида pET28-Was71 содержит уникальный NcoI/XhoI фрагмент ДНК, заключающий структурный ген мутантной L-аспарагиназы W.succinogenes, в составе которой произведена замена K24S, в результате которой 24-й аминокислотный остаток L-аспарагиназы лизин заменен на остаток серина.
Плазмида pET28-Was71 является экспрессионной, ее используют для биосинтеза мутантной L-аспарагиназы Was71 в клетках E.coli. В составе плазмиды pET28-Was71 структурный ген L-аспарагиназы Was71, содержащей мутацию K24S, находится под контролем промотора фага Т7.
Пример 4. Конструирование структурного гена мутантной L-аспарагиназы Was72, содержащей мутации VK23.240T, и получение плазмиды pET28-Was72
Фрагмент ДНК, заключающий структурный ген мутантной L-аспарагиназы Was72, получают в процессе ПЦР-амплификации с использованием в качестве матрицы ДНК плазмиды pET28-Was02. Амплификацию проводят в две стадии. Сначала амплифицируют два перекрывающихся фрагмента ДНК, для чего используют следующие пары праймеров:
Фрагмент 1 размером 171 п.о.:
N685 (5′-taatacgactcactataggg)
N897 (5′-agagtaagaagaggtctgagaagattcacca)
Фрагмент 2 размером 949 п.о.:
N896 (5′-tggtgaatcttctcagacctcttcttactct)
N898 (5′-tggctcgagttagtaggtagagaagattttctggatagctt)
Амплифицированные фрагменты ДНК элюируют из агарозного геля с использованием кита Qiagen (Qiagen, cat. №28706) и используют для ПЦР-лигирования. Для этого проводят ПЦР-амплификацию на смеси фрагментов 1 и 2 в качестве матрицы. Праймерами для амплификации служат N685 и N898. Полученный в результате ПЦР фрагмент ДНК размером 1093 п.о. элюируют из агарозного геля, обрабатывают рестриктазами NcoI и XhoI и клонируют в векторе pET28b(+), расщепленном с помощью рестриктаз NcoI и XhoI. В результате клонирования получают плазмиду pET28-Was72, в составе которой нуклеотидную последовательность клонированного фрагмента ДНК подтверждают с помощью секвенирования.
Плазмида pET28-Was72 содержит уникальный NcoI/XhoI фрагмент ДНК, заключающий структурный ген мутантной L-аспарагиназы W. succmogenes, в составе которой произведена замена VK23,24QT, в результате которой 23-й и 24-й аминокислотные остатки аспарагиназы валин и лизин заменены на остатки глутамина и треонина, соответственно.
Плазмида pET28-Was72 является экспрессионной, ее используют для биосинтеза мутантной L-аспарагиназы Was72 в клетках E. coli. В составе плазмиды pET28-Was72 структурный ген мутантной L-аспарагиназы Was72, содержащей мутацию VK23, 24QT, находится под контролем промотора фага Т7.
Пример 6. Получение штамма BL21-Was71 - продуцента мутантной L-аспарагиназы Was71
Штамм-продуцент мутантной L-аспарагиназы Was71 получают путем трансформации реципиентного штамма E. coli BL21 (DE3) (Novagen) - ВКПМ В-10189. Трансформацию осуществляют путем введения в клетки реципиентного штамма плазмиды pET28-Was71 с применением реактива CaCl [Маниатис с соавт., 1984]. Колонии трансформированного штамма отбирают на селективной среде, содержащей антибиотик канамицин.
В результате трансформации получают штамм BL21-Was71, который используют для биосинтеза мутантного варианта Was71 рекомбинантной L-аспарагиназы.
Клетки штамма E. coli BL21-Was71 содержат экспрессионную плазмиду pET28-Was71 и в ответ на внесение в среду культивирования индукторов ИПТГ или лактозы синтезируют мутантную L-аспарагиназу Was71.
Пример 7. Получение штамма E. coli BL21-Was72 - продуцента мутантной L-аспарагиназы Was72
Штамм-продуцент мутантной L-аспарагиназы Was72 получают путем трансформации реципиентного штамма E. coli BL21 (DE3) (Novagen) - ВКПМ В-10189. Трансформацию осуществляют путем введения в клетки реципиентного штамма плазмиды pET28-Was72 с применением реактива CaCl2 [Маниатис с соавт., 1984, Москва, Мир]. Колонии трансформированного штамма отбирают на селективной среде, содержащей антибиотик канамицин.
В результате трансформации получают штамм BL21-Was72, который используют для биосинтеза мутантного варианта Was72 рекомбинантной L-аспарагиназы.
Клетки штамма E. coli BL21-Was72 содержат экспрессионную плазмиду pET28-Was72 и в ответ на внесение в среду культивирования индукторов ИПТГ или лактозы синтезируют мутантную L-аспарагиназу Was72.
Пример 8. Биосинтез рекомбинантной L-аспарагиназы Was02 или Was71 или Was72
Биосинтез рекомбинантной L-аспарагиназы Was02 (контроль) или Was71 или Was72 осуществляют следующим образом. Сначала получают посевную культуру. Для этого одну колонию трансформированного штамма BL21-Was02 или BL21-Was71 или BL21-Was72, соответственно, засевают в пробирку, содержащую 3 мл среды YTS следующего состава (мас.%): дрожжевой экстракт - 1, триптон бакто - 2, NaCl - 1, канамицин - 0,003, вода - остальное. Культуру выращивают на роторной качалке со скоростью 250 об/мин в течение 18 часов при температуре 37°С.
На втором этапе выросшую посевную культуру переносят в среду для индукции. С этой целью 0,5 мл посевной культуры переносят в колбу, содержащую 50 мл среды TRB следующего состава (мас.%): дрожжевой экстракт - 2,4; триптон бакто - 1,2; одномолярный фосфатный буфер (рН7) - 10; одномолярный раствор сульфата магния - 0,2; лактоза - 0,5; глицерин - 0,5; канамицин - 0,009; вода - остальное. Культивирование в среде для индукции продолжают в течение 20 часов в тех же условиях.
Полученную в результате культивирования биомассу осаждают центрифугированием в пластмассовых пробирках объемом 50 мл в течение 10 минут со скоростью 9000 об/мин с охлаждением (4°С). Надосадочную жидкость сливают. Клеточный осадок суспедируют в 30 мл буфера PBS следующего состава: 137 мМ NaCl, 2 мМ KCl, 10 мМ фосфатный буфер, рН 7,4, после чего вновь подвергают центрифугированию в течение 10 минут со скоростью 9000 об/мин с охлаждением (4°С). Надосадочную жидкость сливают и остатки жидкости тщательно удаляют с помощью вакуумного насоса.
Согласно данным анализа, выполненного методом электрофореза в полиакриламидном геле в денатурирующих условиях, содержание рекомбинантных L-аспарагиназ Was02 или Was71 или Was72 в биомассе соответствующего штамма составляет 25% относительно суммарного растворимого белка клеток.
Полученную биомассу замораживают при температуре минус 20°С.
Пример 9. Очистка рекомбинантной немодифицированной L-аспарагиназы Was02
Очистку рекомбинантной немодифицированной Was02 (контроль) аспарагиназы осуществляют следующим образом.
Биомассу штамма BL21-Was02 в количестве 2 г размораживают при комнатной температуре и суспендируют в 35 мл 5 мМ фосфатного буфера Na2HPO4-KH4PO4 рН 7,3, содержащего 1М NaCl, 5 мМ ЭДТА (этилендиаминтетрауксусной кислоты динатриевая соль), 1 мМ PMSF (фенилметилсульфонил фторид). Суспендированную биомассу помещают в ледяную баню. Дезинтеграцию биомассы проводят в ячейке Френч-пресса (French Press, Thermo Electron Corp., model FA 078A-E240) согласно инструкции к прибору.
Полученный клеточный лизат цетрифугируют при 9000g в течение 40 мин для осаждения неразрушенных клеток и клеточных мембран.
Полученный центрифугат подвергают хроматографии на колонке SP-сефароза (20 мл), элюируя связавшийся с сорбентом фермент раствором 10 мМ Na-фосфатного буфера рН 6,0, содержащего 1 М хлорида натрия. Полученный элюат разбавляют в 5 раз 20 мМ Tris-HCl буфером рН 9,0 (буфер А) и наносят на колонку с сорбентом Q-сефароза (6 мл). Связавшуюся с сорбентом аспарагиназу элюируют буфером А, содержащим 1 М хлорид натрия. Чистота полученного препарата L-аспарагиназы по данным электрофореза в полиакриламидном геле в денатурирующих условиях превышает 90%, выход при очистке достигает 30%.
Пример 10. Очистка рекомбинантной мутантной L-аспарагиназы Was71 или Was72
Очистку мутантного белка L-аспарагиназы Was71 или Was72 из биомассы штаммов BL21-Was71 или BL21-Was72, соответственно, осуществляют, как описано в Примере 9. В результате получают L-аспарагиназу Was71 или L-аспарагиназу Was72, имеющую чистоту и выход такие же, как для немодифицированного фермента (пример 9).
Пример 11. Оценка протеолитической стабильности рекомбинантной L-аспарагиназы
Образцы очищенных белков Was02 (контроль) или Was71 или Was72 инкубируют с препаратом трипсина, взятым в соотношении трипсин-аспарагиназа, равном 1:50, в буфере 50 мМ Трис-HCl, рН8.0 при температуре 37°С в течение 0, 15 и 60 минут.
Реакцию останавливают добавлением в реакционную смесь трихлоруксусной кислоты до конечной концентрации 7%. Белки из реакционных смесей осаждают цетрифугированием в течение 10 минут при 10000 g. Полученные осадки растворяют в буфере для нанесения на гель и анализируют в стандартных условиях путем электрофореза в денатурирующих редуцирующих условиях в 10% полиакриламидном геле (фиг.1).
Из результатов, представленных на фиг.1, видно, что оба мутантных варианта рекомбинантной L-аспарагиназы как Was71, так и Was72 оказываются устойчивы к действию трипсина и не обнаруживают признаков деградации даже после 60 минут инкубации в указанных условиях. В то же время немодифицированная рекомбинантная L-аспарагиназа Was02 (контроль) полностью гидролизуется по указанной выше схеме уже за 15 минут инкубации.
Пример 12. Оценка аспарагиназной и глутаминазной активности у рекомбинантных L-аспарагиназ
Специфическую аспарагиназную и неспецифическую глутаминазную активности очищенных рекомбинантных L-аспарагиназ Was02 (контроль) или Was71 или Was72 определяют путем проведении энзиматических реакций гидролиза аспарагина (специфическая активность) или глутамина (неспецифическая активность), протекающих с образованием аммиака, с последующим определением количества выделившегося аммиака по реакции с реактивом Несслера [Государственная фармакопея РФ, издание XII, часть 1, стр.471].
Измерение соответствующей энзиматической активности L-аспарагиназы осуществляют в две стадии: сначала проводят собственно энзиматическую реакцию L-аспарагиназы с L-аспарагином или L-глутамином, соответственно, а затем определяют количество аммиака, выделившегося в результате энзиматической реакции.
Проведение энзиматической реакции для определения специфической активности. В микропробирку на 1,7 мл (Eppendorf) помещают 80 мкл 0,1М раствора L-аспарагина (в качестве субстрата) и 300 мкл 0,1М K-фосфатного буфера, рН 8,0, смесь нагревают до температуры 37°С, после чего в пробирку вносят 20 мкл раствора L-аспарагиназы и содержимое перемешивают. Реакционную смесь инкубируют в течение 15 мин при температуре 37°С. Реакцию останавливают добавлением 100 мкл раствора, содержащего 24,5 г трихлоруксусной кислоты в 100 мл воды, содержимое перемешивают, охлаждают до 20°С и центрифугируют 5 мин на настольной центрифуге с ускорением 20700 g. Полученный раствор называют «испытуемым».
Энзиматическую реакцию для определения не специфической активности проводят, как описано выше, за исключением того, что в реакционную смесь вносят в 10-20 раз большее количество L-аспарагиназы, а в качестве субстрата используют 0,1М раствор L-глутамина.
Количественное определение выделившегося аммиака. К 80 мкл «испытуемого раствора» прибавляют по 80 мкл реактива Несслера, смесь инкубируют в течение 15 минут при комнатной температуре, после чего измеряют оптическую плотность результирующего раствора на спектрофотометре при длине волны 450 нм.
Для того чтобы установить удельную величину ферментативной активности L-аспарагиназы, величину активности, измеренную с использованием реактива Несслера, нормируют на концентрацию фермента в образце.
Определение концентрации L-аспарагиназы. Концентрацию очищенной L-аспарагиназы определяют по методу Брэдфорд с использованием реагента #R1271 (Fermentas) и прилагаемой к нему инструкции.
В результате измерения получают удельные значения специфической аспарагиназной и неспецифической глутаминазной активностей образцов очищенных рекомбинантных L-аспарагиназ Was02 (контроль), Was71 и Was72. Используя полученные данные, вычисляют относительные величины полученных активностей (табл.):
| Таблица | ||
| Относительные величины ферментативных активностей рекомбинантных L-аспарагиназ | ||
| Рекомбинантная L-аспарагиназа | Ферментативная активность, % | |
| Специфическая аспарагиназная | Неспецифическая глутаминазная | |
| Was02 (контроль) | 100 | 15±2 |
| Was71 (K24S) | 90±10 | 12±2 |
| Was72 (VK23, 24QT) | 95±5 | 1,7±0,2 |
Сравнение относительных величин специфической аспарагиназной и неспецифической глутаминазной активностей очищенных ферментов показывает, что рекомбинантные L-аспарагиназы Was02 (контроль) и Was71 обладают сходными ферментативными характеристиками, в то время как у рекомбинантной L-аспарагиназы Was72 по сравнению с Was02 уровень неспецифической глутаминазной активности снижен более чем в 8 раз при сохранении уровня специфической аспарагиназной активности.
Таким образом, получены мутантные варианты Was71 и Was72 рекомбинантной L-аспарагиназы Wolinella succinogenes, характеризующиеся устойчивостью к протеолизу под действием трипсина и различным уровнем глутаминазной активности, что делает их привлекательными для разработки терапевтических препаратов.
Список цитируемых источников научно-технической информации
Абакумова О.Ю., Подобед О.В., Борисова А.А., Сидорук К.В., Александрова С.С., Омельянюк Н.М., Покровская М.В., Кондакова Л.И., Соколов Н.Н. (2008). Противоопухолевая активность L-аспарагиназы из Yersinia pseudotuberculosis. Биомедицинская химия, 54(6): 712-719.
Гладилина Ю.А., Соколов Н.Н., Красоткина Ю.В. (2008). Клонирование, экспрессия и выделение L-аспарагиназы Helicobacter pylori. Биомедицинская химия: научно-практический журнал, 54(4): 482-486.
Горошкова М.Ю. с соавт.(2008). Оптимизация терапии нативной Е. coli-аспарагиназой в протоколе ALL-MB 2002 у детей с острым лимфобластным лейкозом стандартной группы риска. Онкогематология, 3: 25-33.
Красоткина Ю.В., Соколов Н.Н. (2011). О необходимости создания отечественного противоопухолевого препарата бактериальной L-аспарагиназы (обзор). Вопросы биологической, медицинской и фармацевтической химии, 7: 37-44.
Масчан М.А., Мякова Н.В. (2006). Острый лимфобластный лейкоз у детей.
Онкогематология, 1-2: 50-63.
Маниатис Т., Фрич Э., Сэмбрук Дж. Молекулярное клонирование. М.: Мир, 1984. 343 с. Покровский B.C., Лесная Н.А., Трещалина Е.М., Лукашева Е.В., Березов Т.Т. (2011).
Перспективы разработки новых ферментных противоопухолевых препаратов. Вопросы онкологии, 57(2): 155-164.
Albanese E. & Kafkewitz D. (1978). Effect of Medium Composition on the Growth and Asparaginase Production of Vibrio succinogenes. Applied and Environmental Microbiology, 36(1): 25-30.
Appel I.M., Hop W.C., Pieters R. (2006). Changes in hypercoagulability by asparaginase: a randomized study between two asparaginases. Blood Coagul Fibrinolysis, 17: 139-146.
Billett AL, Carls A, Gelber RD, Sallan SE. (1992). Allergic reactions to Erwinia asparaginase in children with acute lymphoblastic leukemia who had previous allergic reactions to Escherichia coli asparaginase. Cancer, 70:201-206.
Cappelletti D., Chiarelli L.R., Pasquetto M.V., Stivala S., Valentini G., Scotti C. (2008). Helicobacter pylori L-asparaginase: A promising chemotherapeutic agent. Biochem. Biophys. Res. Commun., 377: 1222-1226
Covini D., Tardito S., Bussolati O., Chiarelli L.R., Pasquetto M.V., Digilio R., Valentini G., Scotti C. (2012). Expanding Targets for a Metabolic Therapy of Cancer: L-Asparaginase. Recent Patents on Anti-Cancer Drug Discovery, 7: 4-13.
De-Angeli C.L., Pocchiari F. et al. (1970). Effect of L-asparaginase from Aspergillus terreus on ascites sarcoma in the rat. Nature (London), 225: 549-550.
Derst C., Henseling J., Rohm K.-H. (2000). Engineering the substrate specificity of Escherichia coli asparaginase II. Selective reduction of glutaminase activity by amino acid replacements at position 248. Protein Science, 9:2009-2017.
Distasio J.A., Niederman R.A. (1976). Purification And Characterization Of L-Asparaginase With Anti-Lymphoma Activity From Vibrio Succinogenes. J. Biol. Chem., 251: 6929-6933.
Distasio J.A., Niederman R.A., Kafkewitz D. (1977). Antilymphoma Activity of a Glutaminase-Free L-Asparaginase of Microbial Origin. Exp Biol Med, 155: 528-531.
Distasio J.A., Salazar A.M., Nadji М., Durden D.L. (1982). Glutaminase-Free Asparaginase From Vibrio Succinogenes: An Antilymphoma Enzyme Lacking Hepatotoxicity. Znt. J. Cancer, 30:343-347.
Durden D.L., Salazar A.M., Distasio J.A. (1983). Kinetic analisys of hepatotoxicity associated with antineoplastic asparaginases. Cancer Res., 43: 1602-1605.
Duval M, Suciu S, Ferster A, Rialland X, Nelken B, Lutz P, et al. (2002) Comparison of Escherichia coli-asparaginase with Erwinia asparaginase in the treatment of childhood lymphoid malignancies: results of a randomized European Organisation for Research and Treatment of Cancer Children′s Leukemia Group phase 3 trial. Blood, 99: 2734-2739.
Eden O.B., Shaw M.P., Lilleyman J.S., Richards S. (1990). Non-randomised study comparing toxicity of Escherichia coli and Erwinia asparaginase in children with leukaemia. Med. Pediatr. Oncol., 18(6): 497-502.
Guo L., Wang J., Qian S., Yan X., Chen R., Meng G. (2000) Construction and structural modeling of a single-chain Fv-asparaginase fusion protein resistant to proteolysis. Biotechnol. Bioeng., 70: 456-463.
Jaccard A., Petit В., Girault S. et al. (2009). L-asparaginase-based treatment of 15 western patients with extranodal NK/T-cell lymphoma and leukemia and a review of the literature. Ann Oncol., 20: 110-116.
Jaccard A, Gachard N, Marin B, Rogez S, Audrain M, Suarez F, et al. (2011). Efficacy of L-asparaginase with methotrexate and dexamethasone (AspaMetDex regimen) in patients with refractory or relapsing extranodal NK/T-cell lymphoma, a phase 2 study. Blood, 117: 1834-9.
Kotzia G.A., Lappa K., Labrou N.E. (2007). Tailoring structure-function properties of L-asparaginase: Engineering resistance to trypsin cleavage. Biochem J., 404: 337-343.
Lubkowski J., Palm G.J., Gilliland G.L., Derst C., Rohm K.-H., Wlodawer A. (1996). Crystal structure and amino acid sequence of Wolinella succinogenes L-asparaginase. Eur. J. Biochem., 241: 201-207.
Newsted W.J., Ramjeesingh M., Zywuiko M., Rothstein S.J., Shami E.Y. (1995). Engineering resistance to trypsin inactivation into L-asparaginase through the production of a chimeric protein between the enzyme and a protective single-chain antibody. Enzyme and Microbial Technology, 17:757-764.
Obama K., Tara M., Niina K. (1999). L-asparaginase induced complete remission in Epstein-Barr virus positive, multidrug resistant, cutaneous T-cell lymphoma. Int. J. Hematol., 69: 260-262.
Offman M.N., Krol M., Patel N., Krishnan S., Liu J.Z., Saha V., Bates P.A. (2011). Rational engineering of L-asparaginase reveals importance of dual activity for cancer cell toxicity. Blood, 117: 1614-1621.
Patel N., Krishnan S., Offman M.N., et al. (2009). A dyad of lymphoblastic lysosomal cysteine proteases degrades the antileukemic drug L-asparaginase. J. din. Invest. 119:1964-1973.
Perel Y, Auvrignon A, Leblanc T, Vannier J, Michel G, Nelken B, et al. (2002). Impact of addition of maintenance therapy to intensive induction and consolidation chemotherapy for childhood acute myeloblastic leukemia: results of a prospective randomized trial, LAME 89/91. Leucámie Aiqüe Myéloïde Enfant. J din Oncol, 20: 2774-2782.
Peterson L.E., Ciegler A. (1969). L-asparaginase production by Erwinia aroideae. Appl. Microbiol., 18:64-67.
Pritsa A.A., Papazisis K.T., Kortsaris A.H. et al. (2001). Antitumor activity of L-asparaginase from Thermus thermophilus. Anticancer Drugs, 12: 137-142.
Ramjeesingh M., Zywuiko M., Rothstein A., Shami E.Y. (1992). Monoclonal antibodies can protect L-asparaginase against inactivation by trypsin. Biotechnology, 10: 442-445.
Reddy V.V.S., Jayaram H.N., Sirsi M., Ramakrishnan T. (1969). Inhibitory activity of L-asparaginase from Mycobacterium tuberculosis on Yoshida ascites sarcoma in rats. Arch. Biochem. Biophys., 132: 262-267.
Reinert R.B., Oberle L.M., Wek S.A., Bunpo P., Wang X.P., Mileva I., Goodwin L.O., Aldrich C.J., Durden D.L., Mcnurlan M.A., Wek R.C., Anthony Т.О. (2006). Role Of Glutamine Depletion In Directing Tissue-Specific Nutrient Stress Responses To L-Asparaginase. J. Biol. Chem., 281: 31222-31233.
Rowley В., Wriston J.C. (1967). Partial purification and antilymphoma activity of Serratia marcescens L-asparaginase. Biochem. Biophys. Res. Commun., 28: 160-165.
Scotti С, Sommi P, Pasquetto MV, Cappelletti D, Stivala S, Mignosi P, et al. (2011). Cell-cycle inhibition by Helicobacter pylori Lasparaginase. PLoS One, 5: e13892.
Shimizu, Т., Yamashiro, Y., Igarashi, J., Fujita, H. and Ishimoto, K. (1998). Increased serum trypsin and elastase-1 levels in patients undergoing L-asparaginase therapy. Eur. J. Pediatr., 157:561-563.
Tardito S, Uggeri J, Bozzetti C, Bianchi MG, Rotoli BM, Franchi-Gazzola R, et al. (2007). The inhibition of glutamine synthetase sensitizes human sarcoma cells to L-asparaginase. Cancer Chemother Pharmacol, 60: 751-758.
van den Berg H. (2011). Asparaginase revisited. Leuk Lymphoma; 52: 168-178.
Vrooman LM, Supko JG, Neuberg DS, et al. (2010). Erwinia asparaginase after allergy to E. coli asparaginase in children with acute lymphoblastic leukemia. Pediatr Blood Cancer, 54:199-205.
Yong W., Zheng W., Zhang Y. et al. (2003). L-asparaginase-based regimen in the treatment of refractory midline nasal/nasal-type T/NK-cell lymphoma. Int. J. Hematol., 78: 163-167.
1. Мутантный вариант рекомбинантной L-аспарагиназы, характеризующийся аминокислотной последовательностью, соответствующей аминокислотной последовательности L-аспарагиназы бактерий Wolinella succinogenes, в которой аминокислотный остаток лизина в положении 24 заменен на остаток серина.
2. Мутантный вариант рекомбинантной L-аспарагиназы, характеризующийся аминокислотной последовательностью, соответствующей аминокислотной последовательности L-аспарагиназы бактерий Wolinella succinogenes, в которой аминокислотный остаток валина в положении 23 заменен на остаток глутамина, а аминокислотный остаток лизина в положении 24 заменен на остаток треонина.