Способ одновременного детектирования антител класса g к антигенам возбудителей torch-инфекций с использованием иммуночипа
Иллюстрации
Показать всеИзобретение относится к иммунологическим методам анализа и может быть использовано для массового скрининга инфекций TORCH-группы у новорожденных, беременных женщин и женщин, планирующих беременность. Целью настоящего изобретения является создание способа одновременного детектирования иммуноглобулинов класса G к отдельным антигенам возбудителей инфекций TORCH-комплекса. Техническим результатом, достигаемым при использовании изобретения, является повышение точности, чувствительности и специфичности детектирования IgG-антител как маркеров TORCH-инфекций. Технический результат достигается тем, что в качестве твердой фазы для иммуносорбента используется полистироловый микропланшет из низко люминесцирующего сорта пластика. Технический результат достигается тем, что дискретные микрообласти наносят на дно лунки микропланшета в виде по крайней мере двух микрозон. Технический результат достигается тем, что в качестве первого иммуноспецифического компонента используются смеси рекомбинантных антигенов. Технический результат достигается также тем, что в качестве исследуемого образца для проведения анализа может использоваться как сыворотка крови, так и сухие пятна цельной крови. Технический результат достигается также тем, что в качестве второго иммуноспецифического компонента используются моноклональные мышиные антитела. 7 з.п. ф-лы, 5 ил., 7 табл., 6 пр.
Реферат
Изобретение относится к иммунологическим методам анализа и может быть использовано для массового скрининга инфекций TORCH-группы у новорожденных, беременных женщин и женщин, планирующих беременность.
Предшествующий уровень техники
Вирусные и бактериальные инфекции играют важную роль в патологии беременных, плода и новорожденных. Актуальность проблемы инфекций в пре- и перинатальной диагностике в последние годы в значительной степени возросла в связи с неблагоприятными социально-экономическими изменениями в жизни общества, которые проявляются в повышении риска инфицирования женщин в период беременности. Из множества внутриутробных инфекций была выделена группа заболеваний, вызывающих у плода стойкие структурные дефекты многих органов и систем, особенно центральной нервной системы. Для обозначения этой группы используется аббревиатура TORCH-комплекс, объединяющая следующие внутриутробные инфекции: токсоплазмоз, краснуху, цитомегалию, а также инфекции, вызванные вирусом простого герпеса. Некоторые исследователи существенно расширяют этот список, в частности, заболеваниями, передающимися половым путем (сифилис, хламидиоз, мико- и уреаплазмоз, гепатиты В и С и др.).
Необходимость диагностики TORCH-инфекций у беременных сформулирована в приказе МЗ РФ №50 от 10.02.2003 г.«О совершенствовании акушерско-гинекологической помощи амбулаторно-поликлинических учреждениях». Несмотря на это, нерешенными остается еще ряд вопросов, актуальных для лабораторной диагностики TORCH-инфекций у беременных и новорожденных: отсутствие стандартов диагностики, сложность интерпретации полученных результатов.
Лабораторная диагностика осуществляется путем прямого выявления самих возбудителей TORCH-инфекций в биоматериале, либо с использованием серологических методов, предназначенных для определения антител класса A, G и М к антигенам возбудителей инфекций TORCH-комплекса. Наибольшее диагностическое значение имеет детекция иммуноглобулинов класса М как показателя активности процесса, что может свидетельствовать об остром заболевании или реинфекции. Однако во многих случаях, в том числе при иммунной недостаточности при реинфекции, инфекционном процессе у новорожденных и пр., специфические IgM-антитела выявляются редко. В данном случае решающее значение в диагностическом плане имеет выявление антител класса G. Определение титра и авидности IgG-антител целесообразно не только с целью диагностики, но и с целью прогнозирования течения заболевания, оценки эффективности терапии и мониторинга.
В связи с тем, что используемые сегодня методы диагностики имеют ряд недостатков и ограничений в применении, необходимо их комплексное использование, представляющее собой длительную и дорогостоящую процедуру.
Также известно, что причиной тяжелых форм поражения детей, как правило, являются не моноинфекции, а ассоциированные вирусно-вирусные и вирусно-бактериальные инфекции, так называемые микст-инфекции.
Основным методом серологической диагностики является иммуноферментный анализ. В качестве теста, подтверждающего результаты исследования и позволяющего оценить реактивность того или иного класса антител к отдельным антигенам возбудителя инфекции, используют тест-системы в формате линейного иммуноблоттинга (ИБ) различных коммерческих фирм (например, «EUROIMMUN" и "MIKROGEN»). Однако метод ИБ не предусматривает объективной приборной регистрации результатов исследования, используется лишь в отдельных случаях в качестве подтверждающего теста и вследствие дороговизны анализа не может применяться для проведения массовых обследований.
Разработка современных комплексов лабораторных средств диагностики инфекций TORCH-группы предусматривает применение методов и аппаратных решений, позволяющих при минимальных затратах времени и реагентов сохранить и повысить чувствительность и специфичность исследования. Это достигается комплексным использованием наряду с классическими методами анализа (ИФА - иммуноферментный анализ, ИБ - иммуноблоттинг и др.) скрининговых систем, позволяющих определять в исследуемом материале антитела одновременно к нескольким возбудителям. При этом способ детектирования должен быть адаптирован для проведения массовых обследований.
На сегодняшний день известны наборы реагентов для проведения иммуноферментного анализа с целью определения антител того или иного класса (патент РФ №134329, патент РФ №134328) к токсоплазме, цитомегаловирусу, вирусу краснухи и герпеса 1 и 2 типов в одном анализе. В наборах используют смесь антигенов, иммобилизованных на твердой подложке, выявляя одновременно антитела ко всем 4 инфекциям в одной лунке.
Недостатком этих наборов является невозможность дифференцированного выявления маркеров отдельных возбудителей.
Известен диагностический набор для многоаналитного Дот-иммуноанализа, включающий плоскую плотную подложку с нанесенными на ее поверхности антигенами, дополнительно блокированную неспецифическими природными или синтетическими полимерами; растворы для отмывок, разведения образца и конъюгата, конъюгат и систему проявления. При этом плотная подложка выполнена из непористого пластика, на поверхности которого нанесены антигены возбудителей TORCH-инфекций (Toxoplasma gondii, Chlamydia trachomatis, Rubella virus, Mycoplasma hominis, Ureaplasma urealyticum, Treponema pallidum, Cytomegalovirus, Herpes simplex virus-1), в качестве конъюгатов используют антитела к иммуноглобулинам G человека или стафилококковые белки А или G, связанные с каталитически активными солями золота или серебра (патент РФ 2298795, опубликован 10.05.2007).
Недостатками данного набора является:
1. Избыточность определения количества возбудителей восьми инфекций TORCH-группы (по нашим наблюдениям наиболее часто встречаемой комбинацией в клинике является токсоплазмоз, краснуха, цитомегаловирус, герпес первого и второго типа);
2. Невозможность применения теста для определения антител к вирусу простого герпеса второго типа;
3. Снижение точности анализа вследствие того, что результат анализа регистрируется лишь по одной точке на каждую инфекцию.
Известен способ одновременного детектирования антител класса G и М к возбудителям инфекций TORCH-комплекса (Чеканова Т.А., Маркелов М.Л., Пудова Е.А., Кирдяшкина Н.П., Судьина А.Е., Сажин А.И., Шипулин Г.А. "Иммуночипы - новый формат тест-систем для серологической диагностики инфекционных заболеваний", "Клиническая лабораторная диагностика", 2011, №10, с.3). Данный способ позволяет одновременно определять содержание антител класса G и М к 23 рекомбинантным аналогам антигенов 8 возбудителей TORCH-инфекций (вирусу краснухи, Эпштейн-Барра, цитомегаловирусу, парвовирусу B19, вирусу герпеса 1 и 2 типа, T. Gondii и Chlamydia trachomatis) в сыворотке крови. Все 23 рекомбинантных антигена сорбированы с помощью наноплоттеров для пьезоэлектрической микропечати в двух повторах на активированном предметном стекле (стеклянном слайде). Образующийся комплекс «антиген-антитело» выявляют взаимодействием конъюгата мультивидовых антител (анти-IgG и анти-IgM) с цианиновыми флуорофорами. Детекцию сигнала осуществляют с помощью многоканального флуоресцентного сканера.
Недостатком способа являются сложности в интерпретации результатов исследования из-за слишком большого числа антигенов, к которым определяются антитела. Кроме того, в данном анализе в качестве исследуемого образца может использоваться только сыворотка крови человека, что ограничивает возможности применения метода.
Известен способ раздельного детектирования IgM- и IgG-антител к возбудителям TORCH-инфекций (Yi Liu, Fengling Yu, Haiyan Huang, Jinxiang Han, «Development of Recombinant Antigen Array for Simultaneous Detection of Viral Antibodies», «PLoSONE», vol. 8, 2013). Способ предназначен для выявления антител класса G или М в образцах сыворотки крови или спинномозговой жидкости (СМЖ). На активированные стеклянные слайды наносят рекомбинантные и пептидные антигены цитомегаловируса (pp150), вируса герпеса 1 типа (gG-1) и 2 типа (gG-2) и краснухи (смесь антигенов Е1, Е2 и core), а также человеческие иммуноглобулины G или М в пяти концентрациях. Результат анализа определяют как эмиссию флуоресцентной метки, связанной с антивидовыми антителами, которые связываются с комплексом, образующимся между антигенами иммуносорбента и антителами в исследуемом образце. Интенсивность флуоресценции измеряют на флуориметре.
Недостатком способа является снижение чувствительности анализа вследствие использования одного антигена для определения одной инфекции, в то время как антителообразование происходит к нескольким иммунодоминантным антигенам и преимущественно зависит от стадии инфекционного процесса. Кроме того, данный способ не предусматривает определение маркеров токсоплазмоза, что существенно ограничивает применение теста.
Наиболее близким аналогом к настоящему изобретению является способ обнаружения антител класса G или М к иммунодоминантным антигенам возбудителей TORCH-инфекций (Т. Bacarese-Hamilton, L. Mezzasoma, A. Ardizzoni, F. Bistoni, A. Crisanti, «Serodiagnosis of infectious diseases with antigen microarrays», J Appl Microbiol. 2004; 96(1), pp.7-10). Способ позволяет выявлять антитела к пяти возбудителям (краснухе, токсоплазме, краснухе, герпесу 1 и 2 типа). Анализ осуществляют на активированных слайдах, на поверхности которых иммобилизовано пять антигенов в шести повторах, отрицательный контроль (миозин кролика) и человеческие иммуноглобулины М или G в четырех концентрациях, нанесенные в дублях. Для выявления антител G или М в качестве меток используют флуорофоры Alexa 546 и Alexa 594 соответственно, меченные антителами. Регистрацию результатов осуществляют с помощью флуоресцентного сканера.
Недостатком способа является использование в качестве твердой подложки стеклянных слайдов с нанесенными на их поверхности антигенами, позволяющих осуществить последовательное детектирование антител: исследование в режиме «один тест - один анализ», что не отвечает требованиям скрининговых обследований, а также обладает меньшей эффективностью и большей длительностью.
Цель и сущность изобретения
Целью настоящего изобретения является создание способа одновременного детектирования иммуноглобулинов класса G к отдельным антигенам возбудителей инфекций TORCH-комплекса.
Техническим результатом, достигаемым при использовании изобретения, является повышение точности, чувствительности и специфичности детектирования IgG-антител как маркеров TORCH-инфекций при их одновременном детектировании по сравнению с известными решениями.
Технический результат достигается тем, что в качестве твердой фазы для иммуносорбента используется полистироловый микропланшет из низко люминесцирующего сорта пластика.
Технический результат достигается тем, что дискретные микрообласти наносятся на дно лунки микропланшета в виде по крайней мере двух микрозон.
Технический результат достигается тем, что в качестве первого иммуноспецифического компонента используются смеси рекомбинантных антигенов.
Технический результат достигается также тем, что в качестве второго иммуноспецифического компонента используются моноклональные мышиные антитела.
Технический результат достигается также последовательным применением биотилированных антител и конъюгата стрептавидина с Pt-копропорфирином.
Технический результат достигается также тем, что в качестве исследуемого образца для проведения анализа может использоваться как сыворотка крови, так и сухие пятна цельной крови.
Технический результат достигается также тем, что в качестве антигенов применяют р30[SAG1], p29[GRA7], p35[GRA8] для выявления антител к Toxoplasmagondii, gB, Pp150 для выявления антител к ЦМВ, gG-1, gD-1 для выявления антител к ВПГ-1, gG-2, gD-2 для выявления антител кВПГ-2, E1, Е2 для выявления антител к вирусу краснухи.
Авторам не известны технические решения с заявляемой совокупностью признаков, следовательно, данное изобретение соответствует критерию новизны.
Известные технические решения, используемые для определения IgG-антител, основаны на образовании иммунных комплексов между антигеном или антигенами четырех, пяти или восьми возбудителей инфекций, иммобилизованными на активированных слайдах, антителами класса G исследуемого образца (сыворотки крови или СМЖ) и биоспецифическими компонентами, включающими конъюгаты антител с различными флуоресцентными метками, с последующим детектированием эмиссии метки тем или иным способом.
Предлагаемое техническое решение за счет использования микропланшетного формата исследования, применения нескольких биоспецифических реагентов в пределах одной микрозоны, а также последовательного введения биотин-стрептавидинового комплекса и высоко фосфоресцирующей метки, способа детектирования фосфоресцентного сигнала и оценки уровня искомых аналитов в совокупности с остальными признаками определяет возможность повышения точности и чувствительности анализа при минимальных временных затратах.
Следовательно, предлагаемое изобретение обладает эффективностью по отношению к известным техническим решениям, является новым и неочевидным из уровня техники.
Промышленная применимость
Изобретение может быть использовано в здравоохранении, в частности для скрининга беременных женщин, новорожденных и детей с целью предупреждения и снижения риска развития внутриутробных и врожденных аномалий развития. Следовательно, предлагаемое изобретение соответствует критерию промышленной применимости.
Описание иллюстраций
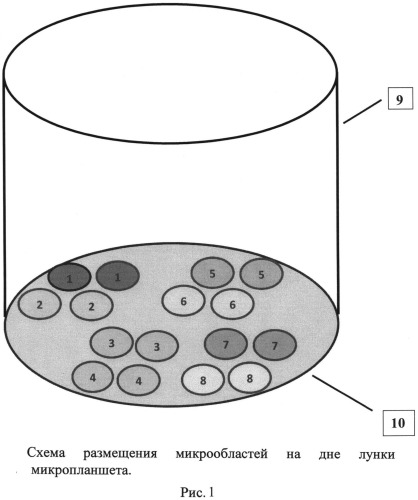
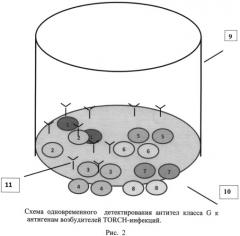
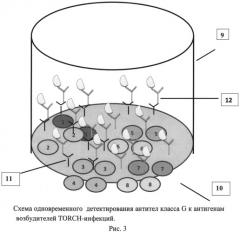
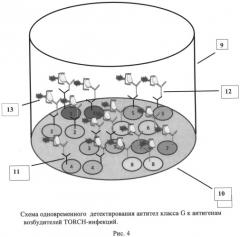
На рис.1 представлен иммуносорбент - лунка микропланшета, сенсибилизированная антигенами и антителами, нанесенными в виде микрообластей. На рис.2, 3 и 4 представлены схемы различных стадий анализа детектирования антител класса G к антигенам пяти возбудителей инфекций TORCH-группы, где 1 - микрообласти для детектирования IgG-антител к Т. gondii, 2 - микрообласти для детектирования IgG-антител к цитомегаловирусу, 3 - микрообласти для детектирования IgG-антител к ВПГ 1 типа, 4 - микрообласти для детектирования IgG-антител к ВПГ 2 типа, 5 - микрообласти для детектирования IgG-антител к вирусу краснухи, 6 - человеческие IgG (10 мг/мл), 7 - человеческие IgG (50 мг/мл), 8 - человеческие IgG (100 мг/мл), 9 - лунка 96-луночного микропланшета, 10 - дно лунки, 11 - исследуемые IgG-антитела, 12 - антивидовые антитела, меченные биотином, 13 - конъюгат - стрептавидин - Pt-копропорфирин. На рис.5 представлен график зависимости величины сигнала фосфоресценции от концентрации IgG-антителиммуносорбента.
Изобретение осуществляют следующим образом.
В образцах сыворотки крови одновременно детектируют наличие/отсутствие IgG-антител к антигенам возбудителей ToRCH-инфекций. Высокий титр антител свидетельствует об острой, подострой стадии инфекционного процесса или реинфекции. Низкий титр антител наблюдается при скрытом течении, начальной стадии инфекционного процесса, либо является показателем перенесенного заболевания.
Схема детектирования антител класса G показана на рис.2, 3 и 4.
На дне каждой лунки микропланшета формируют дискретные микрообласти, представляющие собой смеси рекомбинантных аналогов иммунодоминантных антигенов возбудителей инфекций TОRCH-группы:
Микрообласть 1 - смесь антигенов (p30[SAG1], p29[GRA7], p35[GRA8]) для выявления антител к Toxoplasmagondii;
Микрообласть 2 - смесь антигенов (gB, Pp150) для выявления антител кЦМВ;
Микрообласть 3 - смесь антигенов (gG-1, gD-1) для выявления антител к ВПГ-1;
Микрообласть 4 - смесь антигенов (gG-2, gD-2) для выявления антител кВПГ-2;
Микрообласть 5 - смесь антигенов (Е1, Е2)для выявления антител к вирусу краснухи;
Микрообласть 6 - человеческие иммуноглобулины класса G в концентрации 10 мг/мл;
Микрообласть 7 - человеческие иммуноглобулины класса G в концентрации 50 мг/мл;
Микрообласть 8 - человеческие иммуноглобулины класса G в концентрации 100 мг/мл для внутреннего контроля реакции и оценки работы компонентов анализа (внутренние калибраторы исследования).
Компоненты каждой микрообласти, содержащей смеси антигенов для отдельного возбудителя и IgG человека в трех концентрациях, иммобилизуют в двух повторах (дублях), что позволяет повысить точность анализа за счет снижения вариабельности и исключения возможности десорбции антигена. Таким образом, на дне каждой лунки микропланшета формируют 16 микрозон диаметром 0,5 мм (рис.1.).
В раствор для сенсибилизации добавляют глицерин с целью снижения скорости высыхания капель раствора в пределах микрообласти, что в свою очередь повышает равномерность и полноту адсорбции биоспецифических компонентов.
При анализе сыворотки крови исследуемый образец предварительно разводят 1:100 в растворе для разведения образцов и вносят в сенсибилизированную лунку в объеме 100 мкл. При анализе сухих пятен крови бумажный диск диаметром 3,2 мм помещают в лунку и добавляют 100 мкл раствора для разведения исследуемых образцов. Анализ проводят в три стадии: 1 и 2 стадии - иммуноспецифические, 3 - детектирующая. На первой стадии антитела (при их наличии в исследуемом образце) специфически связываются с антигенами, иммобилизованными в виде дискретных микрообластей 1-10 на дне лунки (рис.2). После инкубирования несвязавшиеся компоненты реакции удаляют отмыванием микропланшета.
Для проведения второй стадии анализа в лунку микропланшета вносят реакционный раствор вторых иммуноспецифических компонентов, содержащий биотинилированные моноклональные антитела, образуя комплексы «антиген-антитело-конъюгат» на микрообластях 1-10 и комплексы «IgG-антитело - анти-IgG-антитело» на микрообластях 11-16. Биотинилирование антивидовых антител применяют для усиления сигнала иммунных комплексов, образующихся на специфических микрозонах (рис.3).
Для проведения третьей стадии анализа в лунки микропланшета вносят детектирующий раствор, содержащий конъюгат стрептавидина с Pt-копропорфирином III (патент РФ №1707539), который образует фосфоресцирующие комплексы биотин-стрептавидин на специфических микрообластях на дне лунки (рис.4). Затем микропланшет отмывают и высушивают, после чего проводят детектирование эмиссии фосфоресценции с помощью фосфоресцентного сканера, осуществляющего последовательное сканирование сфокусированным лазерным лучом каждой микрообласти на дне лунки микропланшета.
По результатам анализа внутренних калибровочных проб строят кривую, представляющую собой линейную зависимость уровня сигнала фосфоресценции от концентрации IgG-антител, иммобилизованных в виде микрозон 11-16 (рис.5.)
При наличии в исследуемом образце антител к антигенам иммуносорбента они во время первой экспозиции образуют комплекс "антиген-антитело", который связывается затем с конъюгатом, а комплекс "антиген-антитело-конъюгат" выявляется фосфоресценцией при сканировании в биочип-анализаторе; интенсивность фосфоресценции при этом соответствует концентрации антител в исследуемой пробе.
Пример 1. Детектирование антител класса G к цитомегаловирусу.
На поверхности дна лунки полистиролового 96-луночного микропланшета (Thermo Labsystems, Финляндия) иммобилизуют смеси рекомбинантных аналогов антигенов токсоплазмы, краснухи, цитомегаловируса, вируса простого герпеса 1 и 2 типа в виде дискретных областей. Для детектирования IgG-антител к каждому из перечисленных возбудителей формируют по 2 идентичные микрозоны диаметром 0,5 мм. Таким же образом сенсибилизируют дно лунки микропланшета человеческими иммуноглобулинами G в трех концентрациях, по 2 микрозоны на каждую концентрацию. Таким образом, на дне каждой лунки микропланшета формируют 16 микрообластей. Для этого с помощью роботинизированного прибора для печатания чипов (наноплоттера) наносят в определенные зоны дна лунки микрокапли растворов соответствующих иммуноспецифических компонентов: IgG-антител человека (в концентрациях 10, 50 и 100 мг/мл) и антигенов (в концентрации 0,05 мг/мл) в растворе для сенсибилизации (0,01 М фосфатно-солевой раствор, pH - 7,2). Для снижения скорости высыхания капель в раствор для сорбции добавляют 5% глицерина (Sigma). Микропланшет инкубируют в течение 24 ч при 4°C, затем промывают и обрабатывают блокирующим раствором (0,05 М трис-HCl, pH 7,75, 1% БСА) в течение 1 часа при 37°С. После этого блокирующий раствор удаляют и высушивают микропланшет в течение 2 часов при комнатной температуре.
Для проведения анализа сыворотки крови предварительно разводят 1:100 в фосфатно-солевом буферном растворе (0,01 М, pH 7,4, 0,5% БСА, 0,05% азида натрия, 0,01% ТВИН-20) и по 100 мкл вносят в лунки иммуносорбента. При анализе сухого пятна крови бумажные диски диаметром 3,2 мм помещают в лунки и добавляют 100 мкл того же раствора, универсального для всех исследований содержания IgG-антител. Контрольные образцы, содержащие и не содержащие иммуноглобулины класса G к цитомегаловирусу (или к любому другому возбудителю), вносят в лунки микропланшета без предварительного разведения в объеме 100 мкл. Исследуемые пробы и контрольные образцы проверяют на наличие/отсутствие антител класса G к цитомегаловирусу, используя коммерческие монотесты («ИФА-ЦМВ-IgG», ЗАО «ЭКОлаб», и «CMV-IgG-ELISA», Medac).
Микропланшет выдерживают в течение 2 часов на шейкере при 25°C и 720 об/мин, после чего 3 раза отмывают промывочным буферным раствором (фосфатно-солевой буферный раствор, pH 6,4, 0,0023% натрия фосфорно-кислого 1-замещенного 2-водного, 0,03331% натрия 2-замещенного 12-водного, 0,2125% хлорида натрия, 0,0125% ТВИН-20; 25-кратный концентрат). Затем в лунки планшета вносят раствор биотинилированных антител (Biotin N-succinimidylester, Fluka, Швейцария) в концентрации 750 нг/мл в реакционном буфере (0,05 М трис-HCl, pH 7,75, 0,87% хлорида натрия, 0,5% БСА, 0,05 азида натрия, 0,01% ТВИН-20). Микропланшет выдерживают планшет 1 час при 25°C на шейкере (720 об/мин) и затем 3 раза отмывают промывочным буферным раствором. После чего в лунки вносят по 30 мкл раствора конъюгата стрептавидина с Pt-копропорфирином в концентрации 333 нг/мл в реакционном буфере (0,05 М трис-HCl, pH 7,75, 0,87% хлорида натрия, 0,5% БСА, 0,05 азида натрия, 0,01% ТВИН-20). Микропланшет 15 мин инкубируют на шейкере (720 об/мин) при 25°C, после чего лунки 3 раза промывают промывочным буферным раствором и 3 раза дистиллированной водой. Планшет подсушивают в течение 1 ч при комнатной температуре и регистрируют результаты анализа с помощью фосфоресцентного биочип-анализатора в режиме возбуждения на длине 532 нм с линейным разрешением 15-20 мкм и постоянной времени затухания сигнала 80 мкс непосредственно с твердой фазы дна лунок микропланшета. Детекцию сигнала осуществляют путем пошагового сканирования площадки диаметром около 1 мм. С помощью компьютерной программы для каждого исследуемого маркера автоматически рассчитывается среднее число фотоимпульсов по специфическим для маркера микрообластям.
Полученные значения интенсивностей сигнала от микрообластей, содержащих в качестве биоспецифических компонентов человеческие IgG-антитела, используют для построения калибровочной кривой (рис.5). Как видно из представленного графика, нарастание сигнала от данных микрообластей при увеличении концентрации IgG-антител в составе микрозон имеет линейный характер, что свидетельствует об адекватной работе компонентов и высокой чувствительности анализа при возможности измерения маркера в низких концентрациях. Вместе с тем, вариации значений интенсивности сигнала от микрообластей, содержащих антигены других возбудителей, не превышают значения порогового уровня, рассчитанного, исходя из формулы: Cutoff=ИФср+3д, где
Cutoff - интенсивность сигнала микрообластей, содержащих антигены;
ИФср - средняя величина фосфоресценции контрольного образца, не содержащего IgG-антитела, измеренная в импульсах;
д - среднее квадратичное отклонение.
Это показывает высокую специфичность способа, поскольку не наблюдается перекрестных взаимодействий исследуемого аналита с другими микрообластями (табл.1). Данные результаты коррелируют с результатами исследования с помощью коммерческих иммуноферментных монотестов (табл.2).
Пример 2. Детектирование антител класса G к смеси антигенов (gD-1 и gG-1) вируса простого герпеса 1 типа.
В лунки микропланшета, сенсибилизированного, как описано в примере 1, вносят предварительно подготовленные исследуемые образцы в виде сыворотки крови или пятен цельной крови на бумажных дисках, а также контрольные пробы, содержащие и не содержащие IgG-антитела к ВПГ 1 типа, в объеме 100 мкл. Исследуемые образцы и контрольные пробы проверяют на наличие/отсутствие антител класса G к вирусу простого герпеса 1 типа, используя коммерческие монотесты («ИФА-ВПГ-1-IgG», ЗАО «ЭКОлаб», и «HSV-1-IgG-ELISA», Medac).
Ход и детектирование результатов анализа осуществляют так, как описано в примере 1. Результаты исследования, приведенные в таблице 3, демонстрируют получение специфических сигналов от образцов, содержащих IgG-антитела к ВПГ 1 типа, причем уровень их фосфоресценции значительно отличается от отрицательных проб и сигналов от других микрообластей.
Пример 3. Детектирование антител класса G к смеси антигенов (gD-2 и gG-2) вируса простого герпеса 2 типа.
В лунки микропланшета, сенсибилизированного, как описано в примере 1, вносят предварительно подготовленные исследуемые образцы в виде сыворотки крови или пятен цельной крови на бумажных дисках, а также контрольные пробы, содержащие и не содержащие IgG-антитела к ВПГ 2 типа, в объеме 100 мкл. Исследуемые образцы и контрольные пробы проверяют на наличие/отсутствие антител класса G к вирусу простого герпеса 1 типа, используя коммерческие монотесты («ИФА-ВГГГ-2-IgG», ЗАО «ЭКОлаб», и «HSV-2-IgG-ELISA», Medac).
Стадии анализа, компоненты и детектирование результатов осуществляют так же, как описано в примере 1.
Из результатов исследования, приведенных в таблице 4, видно, что при анализе образцов, содержащих IgG-антитела к ВПГ 2 типа, способ позволяет регистрировать уровень сигнала от соответствующих микрообластей, отличающийся от результатов анализа отрицательных проб и превосходящий пороговый уровень, что демонстрирует высокую чувствительность способа. При этом наблюдается отсутствие значимых сигналов на микрообластях, специфичных к другим маркерам, что подтверждает специфичность исследования.
Пример 4. Детектирование антител класса G к смеси антигенов (p29, p30, p35) Toxoplasma gondii.
В лунки микропланшета, сенсибилизированного, как описано в примере 1, вносят предварительно подготовленные исследуемые образцы в виде сыворотки крови или пятен цельной крови на бумажных дисках, а также контрольные пробы, содержащие и не содержащие IgG-антитела к Т. gondii, в объеме 100 мкл. Исследуемые образцы и контрольные пробы проверяют на наличие/отсутствие антител класса G к токсоплазме, используя коммерческие монотесты («ИФА-Токсо-IgG», ЗАО «ЭКОлаб», и «Toxoplasma-IgG-ELISA», Medac).
Ход и детектирование результатов анализа осуществляют так, как описано в примере 1. Результаты исследования, приведенные в таблице 5, демонстрируют получение высоких сигналов от образцов, содержащих IgG-антитела к токсоплазме, при этом значения интенсивности сигнала от микрообластей, соответствующих другим возбудителям, не превышает порогового уровня, что подтверждает отсутствие перекрестных реакций и специфичность анализа.
Пример 5. Детектирование антител класса G к смеси антигенов (Е1 и Е2) краснухи.
В лунки микропланшета, сенсибилизированного, как описано в примере 1, вносят предварительно подготовленные исследуемые образцы в виде сыворотки крови или пятен цельной крови на бумажных дисках, а также контрольные пробы, содержащие и не содержащие IgG-антитела к вирусу краснухи, в объеме 100 мкл. Исследуемые образцы и контрольные пробы проверяют на наличие/отсутствие антител класса G к токсоплазме, используя коммерческие монотесты («ИФА-Краснуха-IgG», ЗАО «ЭКОлаб»).
Стадии анализа, компоненты и детектирование результатов осуществляют так же, как описано в примере 1.
Из результатов исследования, приведенных в таблице 6, видно, что при анализе образцов, содержащих IgG-антитела к вирусу краснухи, способ позволяет регистрировать уровень сигнала от соответствующих микрообластей, отличающийся от результатов анализа отрицательных проб и превосходящий пороговый уровень, что демонстрирует высокую чувствительность способа. При этом наблюдается отсутствие значимых сигналов на микрообластях, специфичных к другим маркерам, что подтверждает специфичность исследования.
Как видно из примеров 1-5, способ позволяет получить высокую чувствительность и специфичность при одновременном детектировании IgG-антител к каждому из пяти возбудителей TORCH-инфекций.
Пример 6. Одновременное определение антител класса G к пяти возбудителям инфекций TORCH-комплекса.
Способ осуществляют, как описано в примерах 1-5. В качестве исследуемых проб используют контрольные сыворотки и клиническиеобразцы, предварительно аттестованные с помощью иммуноферментных монотестов «ИФА-ЦМВ-IgG», «ИФА-ВПГ-1-IgG», «ИФА-ВПГ-2-IgG», «ИФА-Токсо-IgG», «ИФА-Краснуха-IgG» (ЗАО «ЭКОлаб»).
Результаты исследования контрольных проб и клинических образцов приведены в таблице 7. Коэффициент корреляции оценок образцов при исследовании в ИФА и представленным способом составил 98%. Исследование образцов №1-10 (сыворотки здоровых новорожденных) дало отрицательные результаты по IgG-антителам к возбудителям пяти TORCH-инфекций. В образцах №11-30 выявлено наличие антител класса G к антигенам того или иного возбудителя, или к антигенам нескольких возбудителей в различных титрах (табл.7).
Таким образом, проведенное предложенным способом исследование обеспечило получение адекватных результатов по выявлению IgG-антител. Способ позволяет на основании исследования одного образца охарактеризовать его по спектру антител класса G одновременно на пять TORCH-инфекций с высокой степенью специфичности и точности.
Применение предложенного способа может существенно повысить эффективность пренатального скрининга.
| Таблица 1 | ||||||
| Результаты анализа образцов, содержащих и не содержащих IgG-антитела к цитомегаловирусу, исследованных методом ИФА и иммуночипов | ||||||
| № контр. проб и образцов | Коэффициент позитивности в ИФА | Средняя интенсивность фосфоресценции микрообластей, имп. | ||||
| ЦМВ | ВПГ 1 типа | ВПГ 2 типа | Т. gondii | Краснуха | ||
| К+ | 3,49 | 2256 | 82 | 21 | 67 | 60 |
| К- | 0,12 | 46 | 35 | 47 | 71 | 13 |
| 1 | 0,38 | 71 | 69 | 34 | 25 | 27 |
| 2 | 0,65 | 88 | 22 | 18 | 66 | 45 |
| 3 | 0,81 | 102 | 43 | 22 | 70 | 16 |
| 4 | 1,24 | 569 | 61 | 17 | 46 | 10 |
| 5 | 1,43 | 593 | 57 | 53 | 39 | 34 |
| 6 | 1,52 | 923 | 72 | 24 | 21 | 62 |
| 7 | 1,35 | 1356 | 36 | 19 | 26 | 15 |
| 8 | 2,61 | 1702 | 29 | 9 | 54 | 58 |
| 9 | 3,2 | 1940 | 46 | 42 | 73 | 26 |
| 10 | 3,58 | 2174 | 72 | 12 | 52 | 21 |
| Таблица 2 | |||
| Результаты анализа образцов на IgG-антитела к цитомегаловирусу, исследованные методом ИФА и иммуночипов | |||
| Оценка образцов в иммуночипе | Число образцов, оцененных в ИФА как | ||
| отрицательный | сомнительный | положительный | |
| отрицательный | 7 | 2 | 3 |
| сомнительный | 0 | 0 | 3 |
| положительный | 0 | 1 | 157 |
| Таблица 3 | ||||||
| Результаты анализа образцов, содержащих и не содержащих IgG-антитела к вирусу простого герпеса 1 типа, исследованных методом ИФА и иммуночипов | ||||||
| № контр. проб и образцов | Коэффициент позитивности в ИФА | Средний сигнал интенсивности фосфоресценции микрообластей, имп. | ||||
| ЦМВ | ВПГ 1 типа | ВПГ 2 типа | Т. gondii | Краснуха | ||
| К+ | 3,56 | 42 | 1432 | 61 | 14 | 54 |
| К- | 0,09 | 8 | 35 | 29 | 11 | 12 |
| 1 | 0,11 | 16 | 26 | 44 | 25 | 24 |
| 2 | 0,34 | 23 | 48 | 51 | 16 | 45 |
| 3 | 0,42 | 31 | 55 | 12 | 10 | 26 |
| 4 | 1,23 | 22 | 245 | 17 | 22 | 19 |
| 5 | 1,54 | 14 | 573 | 63 | 19 | 46 |
| 6 | 1,92 | 30 | 724 | 62 | 21 | 31 |
| 7 | 2,08 | 17 | 916 | 59 | 14 | 16 |
| 8 | 2,71 | 24 | 1206 | 25 | 8 | 28 |
| 9 | 3,15 | 18 | 1297 | 32 | 23 | 32 |
| 10 | 3,29 | 26 | 1488 | 53 | 9 | 41 |
| Таблица 4 | ||||||
| Результаты анализа образцов, содержащих и не содержащих IgG-антитела к вирусу простого герпеса 2 типа, исследованных методом ИФА и иммуночипов. | ||||||
| № контр. проб и образцов | Коэффициент позитивности в ИФА | Средний сигнал интенсивности фосфоресценции микрообластей, имп. | ||||
| ЦМВ | ВПГ 1 типа | ВПГ 2 типа | Т. gondii | Краснуха | ||
| К+ | 2,84 | 54 | 71 | 1064 | 32 | 14 |
| К- | 0,1 | 12 | 21 | 9 | 29 | 11 |
| 1 | 0,13 | 36 | 27 | 14 | 21 | 29 |
| 2 | 0,28 | 23 | 18 | 34 | 36 | 42 |
| 3 | 0,62 | 40 | 25 | 32 | 39 | 34 |
| 4 | 1,2 | 13 | 42 | 174 | 46 | 19 |
| 5 | 1,34 | 24 | 38 | 453 | 17 | 55 |
| 6 | 1,55 | 36 | 72 | 627 | 11 | 27 |
| 7 | 1,64 | 17 | 67 | 771 | 53 | 19 |
| 8 | 1,69 | 27 | 69 | 862 | 34 | 63 |
| 9 | 1,77 | 19 | 17 | 935 | 23 | 32 |
| 10 | 1,92 | 27 | 58 | 1149 | 39 | 34 |
| Таблица 5 | ||||||
| Результаты анализа образцов, содержащих и не содержащих IgG-антитела к Toxoplasmagondii, исследованных методом ИФА и иммуночипов | ||||||
| № контр. проб и образцов | Коэффициент позитивности в ИФА | Средний сигнал интенсивности фосфоресценции микрообластей, имп. | ||||
| ЦМВ | ВПГ 1типа | ВПГ 2 типа | Т. gondii | Краснуха | ||
| К+ | 2,98 | 24 | 13 | 17 | 1750 | 24 |
| К- | 0,09 | 10 | 24 | 8 | 39 | 32 |
| 1 | 0,12 | 18 | 22 | 17 | 21 | 24 |
| 2 | 0,26 | 23 | 28 | 20 | 46 | 14 |
| 3 | 0,43 | 46 | 15 | 31 | 49 | 31 |
| 4 | 1,3 | 52 | 48 | 41 | 321 | 19 |
| 5 | 1,45 | 28 | 63 | 32 | 625 | 25 |
| 6 | 1,62 | 31 | 12 | 27 | 430 | 19 |
| 7 | 1,7 | 9 | 27 | 14 | 792 | 13 |
| 8 | 1,93 | 47 | 49 | 22 | 1348 | 43 |
| 9 | 2,04 | 18 | 34 | 35 | 1632 | 36 |
| 10 | 2,27 | 17 | 52 | 11 | 1824 | 22 |
| Таблица 6 | ||||||
| Результаты анализа образцов, содержащих и не содержащих IgG-антитела к вирусу краснухи, исследованных методом ИФА и иммуночипов. | ||||||
| № контр. проб и образцов | Коэффициент позитивности в ИФА | Средний сигнал интенсивности фосфоресценции микрообластей, имп. | ||||
| ЦМВ | ВПГ 1 типа | ВПГ 2 типа | Т. gondii | Краснуха | ||
| К+ | 4,14 | 8 | 62 | 21 | 37 | 2628 |
| К- | 0,13 | 13 | 56 | 13 | 39 | 62 |
| 1 | 0,14 | 11 | 27 | 9 | 18 | 64 |
| 2 | 0,29 | 23 | 8 | 27 | 44 | 77 |
| 3 | 0,7 | 37 | 15 | 30 | 29 | 91 |
| 4 | 1,32 | 12 | 58 | 15 | 21 | 265 |
| 5 | 1,5 | 28 | 23 | 18 | 25 | 512 |
| 6 | 1,67 | 39 | 45 | 28 | 43 | 903 |
| 7 | 1,89 | 43 | 34 | 42 | 12 | 877 |
| 8 | 2,16 | 47 | 29 | 29 | 13 | 1435 |
| 9 | 2,41 | 15 | 50 | 35 | 32 | 2100 |
| 10 | 2,83 | 24 | 52 | 31 | 24 | 2552 |
| Таблица 7 | ||||||||||
| Результаты одновременного детектирования антител класса G к ЦМВ, токсоплазме, ВПГ 1 и 2 типов и вирусу краснухи. | ||||||||||
| № образца | Коэффициент позитивности образца в ИФА | Средний сигнал интенсивности фосфоресценции микрообластей, имп. | ||||||||
| ЦМВ | ВПГ 1 типа | ВПГ 2 типа | Т. gondii | Краснуха | ЦМВ | ВПГ 1 типа | ВПГ 2 типа | Т. gondii | Краснуха | |
| 1 | 0,11 | 0,13 | 0,09 | ОД | 0,11 | 32 | 10 | 11 | 19 | 13 |
| 2 | 0,46 | 0,29 | 0,11 | 0,1 | 0,2 | 36 | 45 | 23 | 33 | 22 |
| 3 | 0,09 | 0,17 | 0,12 | 0,19 | 0,21 | 31 | 23 | 9 | 21 | 44 |
| 4 | 0,21 | 0,34 | 0,16 | 0,23 | 0,26 | 54 | 14 | 20 | 18 | 28 |
| 5 | 0,57 | 0,35 | 0,22 | 0,28 | 0,34 | 42 | 36 | 14 | 10 | 35 |
| 6 |