Фармацевтическая композиция с антиишемической и антиоксидантной активностью и способ ее получения
Иллюстрации
Показать всеИзобретения относятся к фармацевтической композиции с антиишемической и антиоксидантной активностью в виде таблеток или капсул и способу ее получения. Композиция содержит 4-((3-оксо-3-этоксипропаноил)амино)бензойную кислоту в количестве от 40 до 80 мас.%, аминосодержащее соединение и фармацевтически приемлемые наполнители. Аминосодержащее соединение выбрано из группы трометамол, меглумин и L-лизин, причем на 1 моль 4-((3-оксо-3-этоксипропаноил)амино)бензойной кислоты приходится от 0,05 до 0,25 моль указанного аминосодержащего соединения. Также композиция содержит лактозу, микрокристаллическую целлюлозу кальция стеарат и другие фармацевтически приемлемые наполнители. Согласно способу получения композиции 4-((3-оксо-3-этоксипропаноил)амино)бензойную кислоту и аминосодержащее соединение, взятые в мольном соотношении от 1:0,05 до 1:0,25, предварительно смешивают, смесь увлажняют водным или спиртовым раствором связующего агента, затем к увлажненной смеси прибавляют фармацевтически приемлемые наполнители в таком количестве, чтобы обеспечить содержание 4-((3-оксо-3-этоксипропаноил)амино)бензойной кислоты от 40 до 80 мас.%, затем смесь гранулируют, высушивают и получают таблетки или капсулы по известной технологии. Технический результат заключается в реализации указанного назначения. 2 н. и 4 з.п. ф-лы, 7 табл., 4 пр.
Реферат
Настоящая группа изобретений относится к медицине и фармацевтической промышленности, а именно к пероральным композициям, содержащим химические соединения с антиишемическими и/или антиоксидантными свойствами, и способу их получения.
Известны вещества из ряда производных малоновой кислоты, которые обладают кардиостимулирующими свойствами [см., например, а.с. 1780293 СССР, МКИ С07С 233/54, А61К 31/16]. Возможность и способ получения композиции, удовлетворяющей требованиям ГФ, не проверены.
Синтезированное в СПХФА соединение - 4-((3-оксо-3-этоксипропаноил)амино)бензойная кислота (далее ЭПАБК) - известно и относится к ряду производных малоновой кислоты [Заявка на патент №2012105369 РФ, патент 2167852 РФ].
Однако фармакологические свойства и токсичность этого соединения оставались неизученными, что не позволяло рассматривать его как возможную субстанцию лекарственного средства.
Проведенные исследования показали, что это соединение как индивидуально, так и в составе фармацевтической композиции проявляет в эксперименте антиишемическую и антиоксидантную активности (Примеры 4-6 в тексте описания).
Антиишемический эффект ЭПАБК и фармацевтической композиции на ее основе проявляется в виде положительного действия на систолический размер предсердия и левого желудочка, отсутствия гипертрофии миокарда, улучшения кровотока в легочной артерии. На фоне введения ЭПАБК не были обнаружены такие явления как аневризма, синергия, акинезия, отсутствовало тромбообразование.
На фоне введения ЭПАБК наблюдали ускорение процессов репарации миокарда и уменьшение зоны некроза, повышение времени работоспособности, улучшение сократительной активности миокарда.
Значения антиоксидантной активности тестируемой субстанции ЭПАБК и фармкомпозиции на ее основе позволяет отнести это соединение к веществам с умеренной антиоксидантной активностью.
В результате изучения острой токсичности при внутрибрюшинном и пероральном введении установлено, что тестируемая фармацевтическая субстанция может быть отнесена к малотоксичным и нетоксичным веществам.
Известно, что составы пероральных лекарственных препаратов включают, помимо действующего вещества, ряд широко применяемых в фармацевтической технологии вспомогательных веществ: сахара, крахмал, МКЦ, производные целлюлозы, стеараты, карбонаты и гидрокарбонаты металлов, различные полимеры и т.д., которые обеспечивают требуемые технологические свойства гранулятов и таблеток: прочность, сыпучесть, распадаемость, растворение и т.д. [см., например: Белоусов В.А. Влияние качества гранулята на технологические параметры таблетируемых материалов (Обзор) / В.А. Белоусов // Хим.-фарм. журнал. 1981. №12. С. 76-80; Воскобойникова И.В. Современные вспомогательные вещества в производстве таблеток. Использование высокомолекулярных соединений для совершенствования лекарственных форм и оптимизации технологического процесса / И. В. Воскобойникова [и др.] // Хим.-фарм. журнал. 2005. Т.39. №1. С.22-28].
Известны способы получения таблеток и гранул для капсул, которые включают процессы смешения, увлажнения, гранулирования, сушки, сухого гранулирования (калибровки), опудривания, прессования [См., например: Промышленная технология лекарств / Ред. проф. В.И. Чуешов. Харьков: Издательство НФаУ, 2013. Т.1. С.207-253; Меньшутина, Н.В. Инновационные технологии и оборудование фармацевтического производства / Н.В. Меньшутина, Ю.В. Мишина, С.В. Алвес. М.: Издательство БИНОМ, 2012. Т.1. С.81-171; Городничев, В.И. Оптимизация процесса гранулирования лекарственных порошков в псевдоожиженном слое / В.И. Городничев, Хани М. Эль-Банна, Б.В. Андреев // Хим.-фарм. журнал. 1980. №10. С.72-77].
Известна твердая лекарственная форма, включающая терапевтически эффективное количество алискирена [Пат. 2480210 РФ, МПК A61K 31/16, A61K 31/137, A61K 9/20, A61K 9/30, A61J 3/10, A61P 9/10, A61P 9/00 РФ. ТВЕРДАЯ ПЕРОРАЛЬНАЯ ЛЕКАРСТВЕННАЯ ФОРМА И СПОСОБ ЛЕЧЕНИЯ].
Алискирен-гемифумарат - частью своей химической структуры представляет собой моноамид этилен-1,2-дикарбоновой кислоты, классифицируется в том же классе лекарственных веществ, что и субстанция заявляемой композиции. Алискирен рекомендуется, в том числе, для лечения заболеваний сердечно-сосудистой системы. При создании пероральной формы, включающей традиционные вспомогательные вещества, для обоих действующих веществ (алискирена и заявляемого) возникали сходные трудности, связанные с созданием лекарственных средств, удовлетворяющих требованиям фармакопеи.
Пероральная форма по патенту 2480210 и способ ее получения выбраны в качестве прототипов для заявляемой группы изобретений.
В процессе разработки таблеток с 4-((3-оксо-3-этоксипропаноил)амино)бензойной кислотой оказалось, что введение в состав большинства известных наполнителей и применение традиционной технологии не обеспечивает соблюдения, по крайней мере, двух важнейших показателей таблеток, а именно достаточной прочности таблетки и высвобождения активного вещества, требуемого ГФ XI и XII, а также основными зарубежными Фармакопеями (USP, BP, ЕР).
В отношении прочности:
ЭПАБК представляет собой гидрофобные частицы, которые практически не обладают слипаемостью под давлением, т.е. прессуемостью. Поскольку доза активного вещества в таблетке должна быть довольно высока, порядка 300 мг/табл., т.е., в таблетной массе 50-70%, известные связующие не обеспечивают получения таблеток и гранул достаточной прочности; прочность таблеток, изготовленных с применением известных связующих (крахмал, желатин, ГПМЦ, ПВП и т.д.), не превышает 2 кг. Такие слабые таблетки разрушаются при попытке нанесения пленочной оболочки и при фасовке.
В отношении высвобождения:
ЭПАБК практически не растворима и не смачивается водой. Поэтому при определении высвобождения по тесту «Растворение» за 45 минут переходит из таблетки в раствор менее 65% активного вещества, что не соответствует требованиям Фармакопеи.
Задачей предлагаемой группы изобретений является разработка состава и способа получения фармацевтической композиции в виде таблеток, содержащих в качестве активной субстанции ЭПАБК, которые обеспечивали бы высвобождение не менее 75% активного вещества за 45 минут в соответствии с фармакопейными требованиями и обладали бы прочностью, достаточной для последующих технологических операций, т.е. не менее 6 кг на таблетку.
Задача решается тем, что фармацевтическая композиция с антиишемической и антиоксидантной активностью в виде таблеток или капсул содержит 4-((3-оксо-3-этоксипропаноил)амино)бензойную кислоту в качестве активного компонента, аминосодержащее соединение, выбранное из группы трометамол, меглумин или L-лизин, лактозу, микрокристаллическую целлюлозу, кальция стеарат и другие фармацевтически приемлемые наполнители, причем содержание 4-((3-оксо-3-этоксипропаноил)амино)бензойной кислоты в композиции составляет от 40 до 80 масс. %, а на 1 моль 4-((3-оксо-3-этоксипропаноил)амино)бензойной кислоты приходится от 0,05 до 0,25 моль указанного аминосодержащего соединения.
Задача решается также тем, что фармацевтическая композиция в качестве фармацевтически приемлемых наполнителей включает сахарозу, магния карбонат, крахмал, маннит, поливинилпирролидон, дезинтегранты, антифрикционные и скользящие вещества, принятые в фармацевтической технологии.
Задача решается также тем, что фармацевтическая композиция может быть выполнена в виде таблеток или капсул с терапевтически эффективной дозой 4-((3-оксо-3-этоксипропаноил)амино)бензойной кислоты.
Задача решается также тем, что способ получения фармацевтической композиции с антиишемической и антиоксидантной активностью включает просев и смешение компонентов, гранулирование, сушку, прессование таблеток или фасовку в твердые желатиновые капсулы, причем 4-((3-оксо-3-этоксипропаноил)амино)бензойную кислоту и указанное аминосодержащее соединение, взятые в мольном соотношении от 1:0,05 до 1:0,25, предварительно смешивают, смесь увлажняют водным или спиртовым раствором связующего агента, затем к увлажненной смеси прибавляют фармацевтически приемлемые наполнители, в таком количестве, чтобы обеспечить содержание 4-((3-оксо-3-этоксипропаноил)амино)бензойной кислоты в общей массе от 40 до 80 масс.%, затем смесь гранулируют, высушивают и получают таблетки или капсулы по известной технологии.
Задача решается также тем, что в качестве связующего агента используют крахмально-сахарный клейстер или спиртовой раствор поливинилпирролидона.
Сущность предлагаемых изобретений
В ходе исследований неожиданно было установлено (и этим решается задача), что при смешивании ЭПАБК с органическим соединением, содержащим аминогруппу, например трометамолом, N-метилглюкамином или L-лизином, и последующем увлажнении смеси водно-спиртовым раствором или водой, затем с последующим добавлением вспомогательных веществ - лактозы, МКЦ, маннита, гидрокарбоната натрия, карбоната магния или других фармацевтически приемлемых наполнителей - получается влажная масса. После сушки и гранулирования масса приобретает хорошую сыпучесть, из нее легко прессуются таблетки, или возможна фасовка гранулята в капсулы по известной технологии. При прессовании получаются прочные таблетки, пригодные для фасовки и нанесения покрытия. Таблетки могут быть покрыты защитной или декоративной оболочкой в коутере или в аппарате псевдоожиженного слоя известными методами.
Высвобождение активного вещества из таблеток, полученных по предлагаемому способу, составляет 80-90% за 45 минут, что соответствует фармакопейным требованиям.
Существенным оказалось относительное мольное соотношение ЭПАБК и аминосодержащего соединения.
Если в состав ввести меньше 5 мол.% аминосодержащего соединения на 1 моль ЭПАБК, то таблетки получаются недостаточно прочными, и высвобождение не превышает 65% за 45 минут.
Если же в состав ввести более 25 мол.% аминосодержащего соединения на 1 моль ЭПАБК, то масса получается вязкой, трудно поддается гранулированию и высушиванию, нетехнологична в переработке.
Не претендуя на теоретически обоснованное описание происходящего процесса, экспериментально было установлено, что сочетание 5÷25 мол.% ЭПАБК с аминосодержащим соединением оказывается необходимым и достаточным для придания грануляту и таблетной массе положительных технологических свойств, обеспечивающих хорошую прессуемость и высвобождение активного вещества.
Установлено также, что содержание ЭПАБК в таблетной массе должно быть не более 80%. В случае большего содержания ЭПАБК таблетная масса плохо прессуется, таблетки получаются непрочными. Кроме того, таблетки с содержанием ЭПАБК, превышающим 80%, распадаются в течение более 30 мин, что не соответствует требованиям Фармакопеи по распадаемости. Уменьшение содержания ЭПАБК в таблетной массе ниже 40% нецелесообразно из-за чрезмерного увеличения средней массы таблетки.
Техническими результатами заявляемых изобретений являются:
Создание композиции и способа ее получения.
Высвобождение активного вещества из таблетки в количестве не менее 75% за 45 мин, что соответствует фармакопейным требованиям;
Прочность таблеток не менее 6 кг на 1 таблетку, что обеспечивает возможность последующих технологических операций - нанесение пленочного покрытия, фасовку на автоматических линиях.
Достижение технического результата доказывается определением прочности, растворения и распадаемости таблеток в соответствии с фармакопейными методиками.
Изобретение характеризуется следующими примерами.
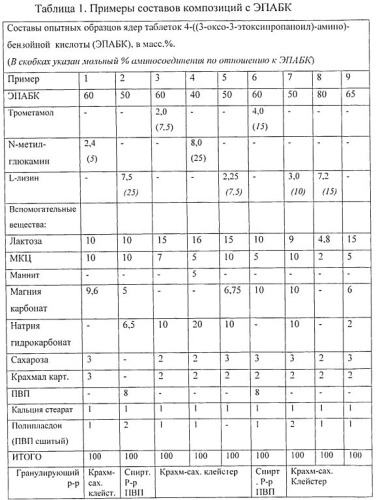
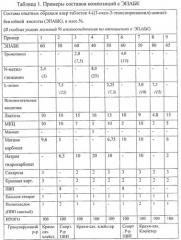
Как следует из данных, приведенных в таблицах, наиболее прочными и с высокими показателями высвобождения оказались образцы, содержащие от 40 до 80 массовых процентов ЭПАБК в композиции, а также 10-20 мольных процентов аминосодержащего соединения по отношению к ЭПАБК. В области нижнего предела содержания аминосоединения - 5% и менее, прочность таблетки начинает снижаться, и также снижается % высвобождения активного вещества. В случае отсутствия в составе аминосоединения (образец 9) таблетки получаются очень слабые, и степень высвобождения снижается до 60% и менее.
При введении в состав более 25 мол.% аминосоединения по отношению к ЭПАБК масса при смешении и увлажнении становится очень вязкой, трудно поддается гранулированию и сушке. Вследствие этого возрастают потери, процесс получения становится нетехнологичным и трудновоспроизводимым.
Примеры осуществления способа получения фармацевтической композиции с ЭПАБК в виде таблеток
Пример 1. Получение ядер таблеток ЭПАБК с гранулированием водным крахмальным клейстером.
В ступке порциями добавляют 60 г ЭПАБК к 2 г трометамола, тщательно перемешивая после добавления каждой порции. К сухой смеси прибавляют 20 г крахмально-сахарного клейстера, содержащего 2 г сахара свекловичного и 2 г крахмала картофельного. Массу тщательно перемешивают и для однородности протирают через сито с размером отверстий 3,5 мм.
Затем к влажной массе прибавляют 15 г лактозы, 7 г микрокристаллической целлюлозы и 10 г гидрокарбоната натрия. Полученную смесь протирают через сито с размером отверстий 2,5 мм, распределяют на поддоне и высушивают в вакуум-сушильном шкафу при (60-70)°C до остаточной влажности 2-4%.
Высушенный гранулят калибруют, протирая через сито с размером отверстий 1,0-1,5 мм. К полученному порошку прибавляют 1 г полипласдона XL, 1 г стеарата кальция и опудривают в смесителе для сухих порошков в течение 30 мин.
Из полученной смеси прессуют двояковыпуклые таблетки диаметром 11 мм и средней массой (0,500±0,025) г.
Выход составляет 96 г (192 таблетки). Свойства полученных таблеток указаны в табл.2, пример 3.
Пример 2. Получение ядер таблеток ЭПАБК с гранулированием спиртовым раствором ПВП.
В ступке порциями добавляют 50 г ЭПАБК к 7,5 г L-лизина, тщательно перемешивая после добавления каждой порции. К сухой смеси прибавляют 40 г 20% спиртового раствора ПВП, содержащего 8 г ПВП. Массу тщательно перемешивают и протирают через сито с размером отверстий 3,5 мм.
Затем к влажной массе прибавляют 10 г лактозы, 10 г микрокристаллической целлюлозы, 5 г карбоната магния и 6,5 г гидрокарбоната натрия.
Полученную смесь протирают через сито с размером отверстий 2,5 мм, распределяют на поддоне и высушивают в вакуум-сушильном шкафу при 50°C до остаточной влажности 2-3%.
Высушенный гранулят калибруют, протирая через сито с размером отверстий 1,0-1,5 мм. К полученному порошку прибавляют 2 г полипласдона XL, 1 г стеарата кальция и опудривают в смесителе для сухих порошков в течение 30 мин.
Из полученной смеси прессуют двояковыпуклые таблетки диаметром 12 мм и средней массой (0,600±0,030) г.
Выход составляет 91,2 г (152 таблетки). Свойства полученных таблеток указаны в табл.2, пример 2.
Пример 3. Получение ядер таблеток ЭПАБК с гранулированием водным крахмальным клейстером и сушкой в псевдоожиженном слое.
В ступке порциями добавляют 100 г ЭПАБК к 6,0 г L-лизина, тщательно перемешивая после добавления каждой порции. К сухой смеси прибавляют 40 г крахмально-сахарного клейстера, содержащего 6 г сахара свекловичного и 4 г крахмала картофельного. Массу тщательно перемешивают и протирают через сито с размером отверстий 3,5 мм.
Затем к влажной массе прибавляют 18 г лактозы, 20 г микрокристаллической целлюлозы, 20 г карбоната магния и 20 г гидрокарбоната натрия и перемешивают до однородности.
Полученную смесь протирают через сито с размером отверстий 2,5 мм. Влажный гранулят помещают в камеру сушилки псевдоожиженного слоя и высушивают до остаточной влажности 2-3%.
Высушенный гранулят калибруют, протирая через сито с размером отверстий 1,0-1,5 мм. К полученному порошку прибавляют 4 г полипласдона XL, 2 г стеарата кальция и опудривают в смесителе для сухих порошков в течение 30 мин.
Из полученной смеси прессуют двояковыпуклые таблетки диаметром 12 мм и средней массой (0,600±0,030) г.
Выход составляет 188 г (313 таблеток). Свойства полученных таблеток указаны в табл. 2, пример 7.
Пример 4. Антиишемическое действие
Антиишемическое действие 4-((3-оксо-3-этоксипропаноил)-амино)-бензойной кислоты (далее ЭПАБК) в сравнении с применяемыми антиишемическими препаратами изучали на модели инфаркта миокарда, выполненной путем перевязки левой коронарной артерии у крыс.
Наиболее достоверные различия по группам были получены по: 1) размеру левого предсердия, 2) конечному систолическому и диастолическому размерам левого желудочка, 3) размеру зоны некроза в миокарде.
Различия между группами интактных животных и негативного контроля оказались достоверными. Отсутствие растяжения левого предсердия при применении эффективных доз и режимов введения ЭПАБК говорит об уменьшении выраженности патологических изменений в миокарде вследствие острого и хронического инфарктов. Так, при внутрижелудочном введении триметазидина и ЭПАБК отмечалось улучшение показателя по сравнению с негативным контролем, причем налицо тенденция большей эффективности ЭПАБК, значение приближается к таковому у интактных крыс.
Конечный систолический размер левого желудочка (КСРлж), как и конечный диастолический размер (КДРлж), характеризует фактор сократимости левого желудочка миокарда, а значит его насосную функцию. Различия между группами интактных животных и негативного контроля оказались достоверными. На фоне внутрижелудочного введения ЭПАБК наблюдали достоверные различия по сравнению с данными, полученными от нелеченных крыс.
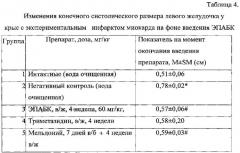
Как видно из данных таблицы 4, в контрольной серии экспериментов размеры зоны некроза у крыс составили 22,0±2,0% от общей массы миокарда. Размеры зоны ишемии в этот период времени были равны 34,0±2,6% от общей массы миокарда. Таким образом, размеры зоны некроза составили 68,0+4,3% от размеров зоны ишемии.
Последний показатель по современным представлениям является одной из важных характеристик ишемической альтерации миокарда, поскольку не зависит от уровня перевязки коронарной артерии и вследствие этого рассматривается как наиболее стабильная величина. ЭПАБК в дозе 60 мг/кг уменьшал размеры зоны некроза до 39+9,4% от зоны ишемии, что значимо больше данного показателя в группе препарата сравнения мельдония (гр. 5).
Пример 5. Антиоксидантное действие
Отравления CCl4 являются классической моделью перекисного повреждения печени. Об активации перекисного окисления липидов при введении CCl4 судят по накоплению продуктов пероксидации - диеновых конъюгатов (ДК), гидроперекисей липидов (ГП) и малонового диальдегида (МДА) в крови и печени крыс.
Как видно из приведенных данных (табл. 7), ЭПАБК обладает выраженным антиоксидантным действием, того же порядка, что и метилэтилпиридинол и классический антиоксидант - токоферола ацетат.
Таким образом, при изучении специфического действия ЭПАБК установлено:
1. Антиишемический эффект ЭПАБК и фармацевтической композиции на ее основе проявляется в виде положительного действия на систолический размер предсердия и левого желудочка, отсутствия гипертрофии миокарда, улучшения кровотока в легочной артерии. На фоне введения ЭПАБК не были обнаружены такие явления, как аневризма, синергия, акинезия, отсутствовало тромбообразование.
2. На фоне введения ЭПАБК наблюдали ускорение процессов репарации миокарда и уменьшение зоны некроза, повышение времени работоспособности, улучшение сократительной активности миокарда.
3. Значения антиоксидантной активности тестируемой субстанции ЭПАБК и фармкомпозиции на ее основе позволяет отнести это соединение к веществам с умеренной антиоксидантной активностью.
Пример 6. Определение острой токсичности 4-((3-оксо-3-этоксипропаноил)амино)бензойной кислоты (далее ЭПАБК)
Исследования проведены на беспородных мышах и крысах в соответствии с принятыми международными правилами и протоколами.
В результате эксперимента установлено:
- при внутрибрюшинном введении вещества белым беспородным мышам, самцам и самкам, величина ЛД50 составила 2440 мг/кг;
- при внутрижелудочном введении вещества белым беспородным мышам, самцам и самкам, величина ЛД50 превышала 5010 мг/кг;
- при внутрибрюшинном введении вещества белым беспородным крысам, самцам и самкам, величина ЛД50 составила 6050 мг/кг;
- при внутрижелудочном введении вещества белым беспородным крысам, самцам и самкам, величина ЛД50 составила 8900 мг/кг.
В соответствии с градацией Hodge и Sterner тестируемая фармацевтическая субстанция может быть отнесена к малотоксичным и нетоксичным веществам.
При введении фармацевтической композиции, содержащей ЭПАБК, расчет дозы производили в пересчете на субстанцию.
Изучены специфические антиишемическая и антиоксидантная активность готовой лекарственной формы (таблетки) производного малоновой кислоты (ЭПАБК) в эффективной для животных дозе (табл. 2). Порошок растертых таблеток для приготовления суспензии растворялся в воде очищенной и вводился перорально (внутрижелудочно).
Сформированы группы по 30 животных:
1Л - группа ложнооперированных животных (интактный контроль) - было произведено вскрытие грудной клетки животного с последующим ушиванием в аналогичных другим группам условиях, но без перевязки левой коронарной артерии;
2Л - негативный контроль (группа животных с моделированной патологией, но оставленная без лечения);
3Л - группа животных, которым вводили внутрижелудочно препарат сравнения триметазидин в терапевтической для крыс дозе 6 мг/кг в течение 60 дней;
4Л - группа животных, которым вводили тестируемое вещество внутрижелудочно в эффективной по результатам исследования субстанции дозе в течение 60 дней;
5Л - группа животных, которым вводили перорально препарат сравнения мельдоний в терапевтической для крыс дозе 85 мг/кг в течение 60 дней.
Антиишемический эффект проявляется в виде положительного действия на систолический размер предсердия и левого желудочка, отсутствия гипертрофии миокарда, улучшения кровотока в легочной артерии. На фоне введения таблеток не были обнаружены такие явления как аневризма, синергия, акинезия, отсутствовало тромбообразование. Исходя из данных, полученных на 29-й и 60-й день терапии, лечение в течение 28 дней можно считать достаточным, что согласуется со сроками основных этапов постинфарктного ремоделирования миокарда.
Антиишемическое и антиоксидантное действие ГЛФ соответствует таковым в пересчете на высвобождаемую субстанцию.
Изучена безопасность готовой лекарственной формы производного малоновой кислоты в остром и хроническом экспериментах. Полученные значения ЛД50 на мышах и крысах разного пола при пероральном введении позволяют отнести тестируемый препарат к препаратам с малой токсичностью. Величины ЛД50 превышают 2000 мг/кг.
Длительное (16 недель) введение готовой лекарственной формы (таблетки) не приводит к изменениям основных параметров подопытных животных разного пола - не происходит изменений состава периферической крови, биохимических параметров, показателей гемостаза, клинических параметров мочи. На фоне введения тестируемого препарата не изменяется динамика массы тела, показателей сердечно-сосудистой, мочевыделительной и центральной нервной систем. Патоморфологические и гистологические исследования не выявили повреждающего действия на органы и ткани экспериментальных животных. Отсроченные токсические эффекты отсутствовали.
1. Фармацевтическая композиция с антиишемической и антиоксидантной активностью в виде таблеток или капсул, отличающаяся тем, что она содержит 4-((3-оксо-3-этоксипропаноил)амино)бензойную кислоту в качестве активного компонента, аминосодержащее соединение, выбранное из группы трометамол, меглумин или L-лизин, лактозу, микрокристаллическую целлюлозу, кальция стеарат и другие фармацевтически приемлемые наполнители, причем содержание 4-((3-оксо-3-этоксипропаноил)амино)бензойной кислоты в композиции составляет от 40 до 80 мас.%, а на 1 моль 4-((3-оксо-3-этоксипропаноил)амино)бензойной кислоты приходится от 0,05 до 0,25 моль указанного аминосодержащего соединения.
2. Фармацевтическая композиция по п.1, отличающаяся тем, что в качестве фармацевтически приемлемых наполнителей включает сахарозу, магния карбонат, крахмал, маннит, поливинилпирролидон, дезинтегранты, антифрикционные и скользящие вещества, принятые в фармацевтической технологии.
3. Фармацевтическая композиция по любому из пп.1, 2, отличающаяся тем, что выполнена в виде таблеток с терапевтически эффективной дозой 4-((3-оксо-3-этоксипропаноил)амино)бензойной кислоты.
4. Фармацевтическая композиция по любому из пп.1, 2, отличающаяся тем, что выполнена в виде капсул с терапевтически эффективной дозой 4-((3-оксо-3-этоксипропаноил)амино)бензойной кислоты.
5. Способ получения фармацевтической композиции с антиишемической и антиоксидантной активностью по п.1 или 2, включающий просев и смешение компонентов, гранулирование, сушку, прессование таблеток или фасовку в твердые желатиновые капсулы, отличающийся тем, что 4-((3-оксо-3-этоксипропаноил)амино)бензойную кислоту и указанное аминосодержащее соединение, взятые в мольном соотношении от 1:0,05 до 1:0,25, предварительно смешивают, смесь увлажняют водным или спиртовым раствором связующего агента, затем к увлажненной смеси прибавляют фармацевтически приемлемые наполнители в таком количестве, чтобы обеспечить содержание 4-((3-оксо-3-этоксипропаноил)амино)бензойной кислоты в общей массе от 40 до 80 мас.%, затем смесь гранулируют, высушивают и получают таблетки или капсулы по известной технологии.
6. Способ по п.5, по которому в качестве связующего агента используют крахмально-сахарный клейстер или спиртовой раствор поливинилпирролидона.