Способ иммунохроматографического определения специфических антител
Иллюстрации
Показать всеИзобретение относится к иммунологии и медицинской диагностике и представляет собой способ иммунохроматографического определения специфических антител. В основе способа лежит контакт мембранной тест-полоски с анализируемой жидкой пробой и инициируемое этим контактом движение по мембранам тест-полоски реагентов, которые содержатся в пробе или нанесены на мембрану и в ходе взаимодействий в порах мембраны или на ее поверхности формируют иммунные комплексы. Интенсивность окраски метки, связавшейся в аналитической зоне, детектируется визуально. Отличительной особенностью предлагаемого способа определения антител является то, что в тесте используется конъюгат коллоидного золота с антигеном, а в аналитической зоне тест-полоски иммобилизуется реагент для связывания общих антител, в то время как в стандартной схеме иммунохроматографии для определения специфических антител с коллоидным золотом конъюгируется реагент для связывания антител, а в аналитической зоне тест-полоски иммобилизуется антиген. Использование предложенного способа анализа позволяет повысить чувствительность анализа и/или уменьшить расход антигена. 2 ил., 1 пр.
Реферат
Изобретение относится к иммунологии и медицинской диагностике и представляет собой метод иммунохроматографического определения специфических антител. Наличие в сыворотке крови антител, специфичных к возбудителю определенного заболевания, является эффективным критерием, позволяющим с высокой достоверностью диагностировать соответствующее инфекционное заболевание (Rose N.R. (ed.). Manual of Clinical Laboratory Immunology (4th ed.). Washington, D.C.: American Society for Microbiology, 1992.). В случае диагностики инфекционных заболеваний преимуществами данного подхода по сравнению с непосредственным выявлением и идентификацией возбудителя является определенность при выборе тестируемой пробы (сыворотка крови, тогда как возбудитель может на данной стадии инфекции преимущественно локализоваться в самых разных органах и тканях), а также возможность быстрой детекции достаточно высокого уровня антител, индуцированного контактом с антигеном, в то время как для выявления антигена могут потребоваться довольно продолжительные стадии доращивания до достижения им регистрируемой концентрации. Хотя в настоящее время активно используются как микробиологические, так и иммунологические способы диагностики инфекционных заболеваний, для проведения массового первичного скрининга оптимально иммунологическое определение наличия в сыворотке крови специфических антител (серодиагностика), которое может быть реализовано с высокой экспрессностью и производительностью. Особенный интерес вызывают серодиагностические подходы в тех случаях, когда в силу особенностей роста микроорганизмов получение результатов микробиологического тестирования может потребовать значительного времени.
Благодаря высокой чувствительности и специфичности серологические тесты незаменимы при массовых обследованиях. Кроме того, гуморальный иммунный ответ отражает активный инфекционный процесс, и поэтому результаты иммунохимического тестирования достоверно отражают именно случаи заболевания, дискриминируя их от бактерионосительства.
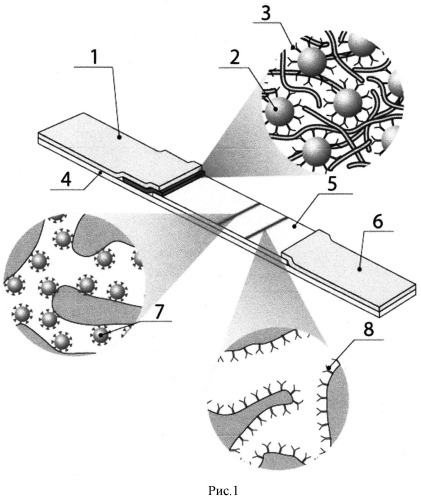
Иммунохимический анализ может быть реализован в различных форматах. Однако, поскольку для массовых обследований первоочередное значение имеют скорость и производительность тестирования, в данной ситуации несомненными преимуществами обладает иммунохроматографический анализ, для которого все необходимые реагенты предварительно нанесены на мембранные компоненты тест-полоски, и ее контакт с тестируемой пробой непосредственно инициирует движение фронта жидкости по мембранам, протекание специфических реакций и формирование иммунных комплексов, которые благодаря включению в их состав окрашенного маркера могут детектироваться визуально или с помощью оптического детектора (Рис.1).
Применительно к серодиагностике (определению антител, специфичных к определенному антигену или группе антигенов) общая схема иммунохроматографии заключается в следующем.
Проба, потенциально содержащая специфические антитела, под действием капиллярных сил перемещается вдоль тест-полоски. При этом она вначале взаимодействует с окрашенными частицами (коллоидное золото или иной маркер), на поверхности которых адсорбирован компонент, предназначенный для связывания с антителами. Обычно в качестве такового компонента выбирают антивидовые антитела (иммуноглобулины, выделенные из сыворотки животного, иммунизированного препаратом иммуноглобулинов человека или другого организма, для которого проводится серодиагностика), белок А из Staphylococcus aureus или белок G из Streptococcus spp. Затем фронт жидкости преодолевает аналитическую (тестовую) зону, которая представляет собой участок мембраны с иммобилизованным антигеном (нативным или специально модифицированным для эффективной сорбции). Степень связывания маркера с иммобилизованным антигеном и, соответственно, интенсивность окрашивания мембраны определяются концентрацией специфических антител в пробе. Для проверки качества реагентов и сохранения функциональности тест-системы используется расположенная далее контрольная зона, в которой компонент, сорбированный на окрашенной частице, связывается с соответствующим иммобилизованным на мембране реагентом.
Ниже представлена информация о методике, реализуемой в тест-системе «TB-Check-I» фирмы «Vedalab» (Франция) - см. http://www.sanitamedikal.com/Assets/MD_220002_m3_TB_1408_c.pdf. Данная методика определения антител к возбудителю туберкулеза рассматривается в настоящей заявке в качестве прототипной.
Метод основан на комбинации антител к иммуноглобулинам человека, конъюгированных с хромогеном, и высокоочищенного БЦЖ-белка… При прохождении исследуемого образца через адсорбционную зону тестового устройства конъюгат, содержащий меченые антитела, связывается с IgG, образуя комплекс «антиген-антитело». Этот комплекс взаимодействует с высокоочищенным БЦЖ-белком в тестовой зоне устройства, и если концентрация специфического IgG к возбудителю туберкулеза превышает 350 Е/мл, образует окрашенную полосу. При низкой концентрации антител окрашенная полоса в тестовой зоне не образуется. Несвязавшийся конъюгат взаимодействует с реагентом в контрольной зоне тестового устройства, образуя окрашенную полосу, что указывает на правильное проведение теста… Процедура исследования: …заполнить одноразовую пипетку сывороткой или плазмой и внести 1 каплю в окно для пробы тестового устройства. Добавить в окно для пробы 5-6 полных капель разбавляющего раствора (дилюента). Через 10-15 мин произвести учет результатов.
Одной из наиболее важных задач в иммунохроматографии является повышение чувствительности анализа. Для увеличения чувствительности анализа следует использовать как можно более высокие концентрации конъюгата и рецептора в аналитической зоне. Однако увеличение концентрации коллоидного конъюгата лимитировано тем фактом, что конъюгат должен полностью продиффундировать через иммунохроматографические мембраны за время проведения анализа (~10 мин), поэтому использование конъюгатов с оптической плотностью выше 10 проблематично. Увеличение концентрации центров связывания на поверхности коллоида лимитировано низкой сорбционной емкостью наночастиц золота - обычно концентрация белка около 10 мкг/мл является насыщающей (GHITESCU, L. and M. BENDAYAN. Immunolabeling efficiency of protein A-gold complexes. J. Histochem. Cytochem., 38, 1523-1530, 1990). Сорбционная емкость рабочей мембраны иммунохроматографического теста на несколько порядков выше, чем коллоидного золота - до 15 мг/мл (http://www.millipore.com/publications.nsf/a73664f9i981af8c852569b9005b4eee/348ee7096d9 3729b85256bf40066a40d/$FILE/tb500en00.pdf), но повышение концентрации рецептора в аналитической зоне в стандартном методе иммунохроматографического анализа для серодиагностики нецелесообразно по экономическим причинам, так как рецептором обычно являются самые дорогие компоненты тест-системы: рекомбинантные белки бактерий или вирусов. Поэтому нами был предложен способ иммунохроматографического анализа, в котором молекулы антигена или антигенов сорбируются на поверхности коллоидного золота (при этом расход антигена значительно снижается: с 300-600 нг до 100 нг на тест), а в аналитической зоне тест-полоски иммобилизуется компонент для связывания антител: антивидовые антитела, белок А из Staphylococcus uureus или белок G из Streptococcus spp. Перечисленные реагенты для связывания антител широко используются в иммунохимии (в иммуноанализе, для выделения очистки антител и т.д.), поэтому существует налаженное массовое производство данных реагентов и их стоимость более чем на порядок ниже стоимости рекомбинантных антигенов, поэтому 10-кратное повышение концентрации данных реагентов не приводит к существенному повышению стоимости теста и при этом позволяет значительно повысить чувствительность анализа.
Предложенный подход был реализован заявителями для серодиагностики туберкулеза с использованием антигена 38 кДа (Ag78, antigen 5, PhoS, Rv0934) M. tuberculosis. Ниже представлено описание способа получения тест-полосок и проведения иммунохроматографического анализа, а также полученные результаты.
Пример
Для формирования тест-системы использовали набор мембран «mdi Easypack» фирмы «Advanced Microdevices» (Индия), включающий рабочую мембрану CNPC-SN12 L2-P25 (размер пор 15 мкм), мембрану под конъюгат PT-R5, мембрану для нанесения образца GFB-R4, адсорбирующую мембрану АР 045, для нанесения БСА использовалась мембрана PT-R5.
На мембраны были нанесены следующие реагенты:
1. Белок А из Staphylococcus aureus, производства ООО «Имтек» (Россия).
2. Конъюгат коллоидного золота со средним диаметром частиц 30 нм и рекомбинантного антигена 38 кДа М. tuberculosis (Rv0934), фирмы «Arista Biologicals Inc.» (США), кат. № AGMTB-0220.
3. Моноклональные антитела НТМ81 против рекомбинантного антигена 38 кДа M. tuberculosis. Центр молекулярной диагностики и терапии, Москва (Россия).
Для формирования аналитической зоны использовали белок А, контрольной зоны - моноклональные антитела НТМ81 против рекомбинантного антигена 38 кДа M. tuberculosis. На 1 см полосы наносили 2 мкл раствора белка А (10,0 мг/мл в 50 мМ фосфатном буфере, pН 7,4) и 2 мкл раствора антител (0,5 мг/мл в том же буфере). Конъюгат коллоидного золота с антигеном наносили в разведении, соответствующем D520=6,5, в объеме 10 мкл на 1 см полосы. Для нанесения реагентов использовали диспенсер «IsoFlow» фирмы «Imagene Technology» (США). После нанесения реагентов мембраны высушивали не менее 24 ч в помещении с контролируемыми температурой и влажностью. Листы мембран с нанесенными иммунореагентами нарезали на индивидуальные тест-полоски шириной 3,5 мм.
Для сравнения изготавливали тест-полоски по стандартной схеме с использованием тех же реагентов и мембран, но с коллоидным золотом. Конъюгировали белок А (10 мкг/мл, конъюгат наносили на мембрану из оптической плотности 7), а в аналитической зоне иммобилизовали рекомбинантный белок 38 кДа М. tuberculosis.
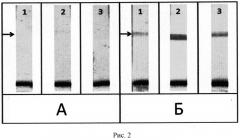
Иммунохроматографический анализ проводили при комнатной температуре. Тест-полоску погружали в пробу на 1 мин в вертикальном положении, а затем извлекали и помещали на горизонтальную поверхность. Детекцию связывания коллоидного золота осуществляли через 10 мин визуально (Рис.2).
Достигнутая при использовании предложенного способа анализа чувствительность на порядок превышает чувствительность, достигнутую при использовании стандартного способа анализа.
Рис.1. Принцип иммунохроматографического анализа для серодиагностики. 1 - мембрана, адсорбирующая образец; 2 - частицы коллоидного золота; 3 - реагент для связывания антител: антивидовые антитела, белок А, белок G или др.; 4 - пластиковая основа; 5 - рабочая мембрана; 6 - конечная адсорбирующая мембрана; 7 - антиген, иммобилизованный в аналитической зоне; 8 - антивидовые антитела, иммобилизованные в контрольной зоне.
Рис.2. Тестирование сывороток крови больных туберкулезом (3 пробы): А - стандартным методом и Б - альтернативным методом, предложенным заявителями (стрелкой указано положение аналитической зоны).
Способ иммунохроматографического определения специфических антител, отличающийся тем, что для анализа используется конъюгат коллоидного золота с антигеном, а в аналитической зоне тест-полоски иммобилизуется реагент для связывания общих антител, в качестве которого могут использоваться антивидовые антитела, белок А из Staphylococcus aureus или белок G из Streptococcus spp.