Способ оценки действия цитомегаловирусной инфекции на устойчивость мембран эритроцитов новорожденных от матерей, перенесших в третьем триместре беременности обострение цитомегаловирусной инфекции
Иллюстрации
Показать всеИзобретение касается способа оценки действия цитомегаловирусной инфекции на устойчивость мембран эритроцитов новорожденных от матерей, перенесших в третьем триместре беременности обострение цитомегаловирусной инфекции. Сущность способа: в периферической крови новорожденного определяют нарастание количественного содержания эритроцитов до 75,5%, содержащих в мембранах до 97,9±2,5 усл.ед. перекисей жирных кислот (ПОЛ), и определяют количество β-спектрина (в %) в мембранах эритроцитов новорожденного методом диск-электрофореза в полиакриламидном геле (10%) с додецилсульфатом натрия. Затем вычисляют значение дискриминантной функции по формуле: DФ=(+0.211×ПОЛ)+(-6.335×β-спектрин). При DФ более -21.16 оценивают неустойчивость мембран эритроцитов и развитие внутриутробной анемии. 2 ил.
Реферат
1. Цель изобретения - выявить, что обострение цитомегаловирусной инфекции вызывает снижение содержания стромального белка β-спектрина мембран эритроцитов новорожденного, вследствие нарастания в мембранах содержания перекисей жирных кислот и приводит к их неустойчивости.
2. Изобретение относится к медицине, а именно к оценке деструктивного действия цитомегаловирусной инфекции на белковый состав мембран эритроцитов, снижая содержание β-спектрина, от которого зависит устойчивость мембраны эритроцита.
3. Раскрытие изобретения
Возбудитель цитомегаловирусной инфекции, вступая в контакт с мембраной эритроцитов новорожденного через белки своей оболочки - PvTRAgS (9), способствует разрушению целостности белковой основы мембраны эритроцитов.
При этом в первую очередь это касается белков образующих цитоскелет эритроцита, которые обеспечивают эластичность эритроцита в целом (6). Белки стромы α-спектрин и β-спектрин, переплетаясь, образуют основу цитоскелета эритроцита (1, 7, 8). Изменение структуры молекулы спектрина или снижение его содержания нарушают устойчивость мембраны эритроцитов. Не исключено, что основным фактором, отрицательно влияющим на содержание спектрина, являются перекиси липидов, выработка которых стимулируется возбудителем цитомегаловирусной инфекции.
4. Прототипы работы
Прототипом были выбраны работы Иванова В.П., Лукашова А.Д., Полоникова А.В. (2) отмечавших, что при гипотонии нарушается содержание основных мембранных белков эритроцитов, а также работа Штехмана М.И., 2004 (10), в которой автор указывает, что при гипохромной анемии под влиянием нарушения электролитного баланса в эритроцитах происходит изменение структуры мембранного белка - спектрина. Однако в работах Иванова В.П., Лукашова А.Д. и Полоникова А.В. (2) нет указаний, какие именно факторы становятся причиной нарушения содержания белков цитоскелета мембран эритроцитов при гипотонии, а в работе Штехмана М.И. (10) основной причиной изменения цитоскелета эритроцитов считается нарушение баланса электролитического состава эритроцитов. В работах Луценко М.Т. и Андриевской И.А (4) описываются изменения спектрина под влиянием герпес-вирусной инфекции на базе изменений в мембранах МДА (5). В отличие от вышеуказанных работ в представленной заявке имеются следующие элементы отличия:
1) Авторы указывают, что на третьем триместре при обострении ЦМВИ возбудитель проникает в кровь плода и у новорожденного обнаруживаются антитела к цитомегаловирусу с титром 1:1600.
2) В мембранах эритроцитов определяется гистохимически высокое содержание перекисей жирных кислот. Под влиянием перекисей жирных кислот нарушается содержание в мембранах эритроцитов β-спектрина.
Таким образом, под влиянием инфекционного начала - цитомегаловирусной инфекции - в эритроцитах новорожденного, родившегося от матери, перенесшей в третьем триместре обострения цитомегаловирусной инфекции, происходит нарушение структуры мембран эритроцитов за счет снижения β-спектрина под влиянием появляющихся в большом количестве перекисей жирных кислот.
5. Новая техническая задача
Разработать способ оценки угрозы у новорожденных формирования анемии вследствие нарушения строения мембран эритроцитов, возникающей в результате снижения содержания β-спектрина, что приводит к изменению эластичности мембраны эритроцитов и затрудняет проникновение их через узкие капилляры к работающим органам.
6. Осуществление изобретения
6.1. Исследования проводились на базе акушерского отделения ФГБУ «Дальневосточный научный центр физиологии и патологии дыхания» СО РАМН. Обследовано 15 беременных на третьем триместре гестации с обострением цитомегаловирусной инфекции с титром 1:1600. У новорожденных забиралась кровь для определения гистохимическим методом перекисей жирных кислот, а также методом гель-электрофореза белков мембран эритроцитов. Контролем служили 15 беременных, не болевших цитомегаловирусной инфекцией в период гестации. У беременных симптоматически цитомегаловирусная инфекция проявлялась в виде острого респираторного заболевания, сопровождающегося ринофарингитом. Клинический диагноз - обострение цитомегаловирусной инфекции - устанавливался при комплексном исследовании периферической крови на наличие IgM или четырехкратного и более нарастания титра антител IgG в парных сыворотках в динамике через 10 дней, индекса авидности более 65%, а также ДНК цитомегаловируса. Исследования проводились с учетом требований Хельсинской декларации Всемирной медицинской ассоциации «Этические принципы проведения научных исследований с участием человека» с поправками 2000 г. и правилами клинической практики в Российской Федерации, утвержденными приказом Министерства РФ №266 от 19.06.2003 г.
6.2. Верификация цитомегаловируса, определение типоспецифических антител класса IgM и IgG, индекса авидности осуществлялись методами иммуноферментного анализа на микропланшетном ридере «Stat-Fax-2100» с использованием тест-систем ЗАО «Вектор-Бест» (Новосибирск), выявление ДНК цитомегаловируса методами ПЦР на аппарате ДТ-96 с использованием наборов НПО «ДНК-технология» (Москва).
6.3. Перекиси жирных кислот в мембранах эритроцитов определяли гистохимическим методом по Винклеру-Шульце (3). Суть метода заключалась в инкубации эритроцитов цельной крови в растворе, состоящем из 576 мг α-нафтола в 6 мл 1 N натриевой щелочи, доведенной до 50 мл дистиллированной водой. Вторым ингредиентом инкубационной среды является раствор, состоящий из 691 мг n-амино-N, N-диметиламина в 50 мл дистиллированной воды. Смешивают эти 2 раствора, фильтруют накануне реакции, отбирают в пробирку PUTH, КЗ ЭДТА 500 мкл этого раствора и вносят в него 200 мкл цельной крови с коагулянтом, взятой натощак из локтевой вены. Через 10 мин каплю крови наносят на предметное стекло и на центрифуге Diffe Spin-2 (USA) приготовляют монослойный мазок. Высушивают на открытом воздухе и изучают под цифровым микроскопом МТ (Япония), связанным с компьютерном через программу «Scion Corporation)) (USA), позволяющую проводить количественно цитофотометрический анализ: определять площадь клетки и автоматически плотность продукта реакции.
6.4. Белки в мембранах эритроцитов новорожденного с цитомегаловирусной инфекцией 1:1600 определяли методом диск-электрофореза в ступенчатом градиентном полиакриламидном геле (10%) с додецилсульфатом натрия. Выявляли белок β-спектрин с помощью денситометрии на аппарате Biometra (Германия).
6.5. Анализ полученных результатов проводился с помощью дискриминантного метода статистической обработки.
Исследования показали, что в случае обострения цитомегаловирусной инфекции у беременной в третьем триместре гестации высокий титр антител в периферической крови отмечается как у матери, так и в периферической крови новорожденного (1:1600). При этом в периферической крови новорожденного обнаруживается высокий процент (75,5%) эритроцитов, содержащих 97,9±2,5 усл.ед. перекисей жирных кислот (фигура 1), контроль - 22,0±0,85 усл.ед. на 15% эритроцитов (фигура 2). В мембранах эритроцитов количество β-спектрина у новорожденного снижается до 6,6±0,3% (контроль - 8,5±0,3%). Проведенный дискриминантный анализ показал, что дискриминантная функция (DФ) определяется следующим образом:
| Имя выборки | Объем выборки | Кол-во выборки | Расстояния Махалан | Критерий Фишера, различия выборок | Вероятность различия выборок | Граничное значение дискриминант ной функции | Вероятность ошибочности классиф., % |
| 49300R | 1515 | 22 | 4.84 | 65.22 | 100.000 | -41.88 | 1.5611.058 |
| DФ=(+.211×ПОЛ)+(-6.335×β-спектрин) | |||||||
| где DФ - дискриминантная функцияПОЛ - перекиси жирных кислот+.211 - коэффициент, автоматически выставленный компьютером в дискриминантном уравнении при значении ПОЛβ-спектрин - белок стромы эритроцитов, содержащийся в мембранах эритроцитов-6.335 - коэффициент, автоматически выставленный компьютером в дискриминантном уравнении при значении β-спектринаВ результате анализа DФ=(+.211·97.9)+(-6.335·6.6)=(-21-16) |
Следовательно, при DФ(-21.16)> граничного значения (-41.81) отмечается снижение β-спектрина и создается угроза нарастания неустойчивости мембран эритроцитов новорожденного, что может привести к внутриутробной анемии.
ЛИТЕРАТУРА
1. Воробьев А.И. Руководство по гематологии. М.:. Ньюдиамед. 2007. 1275.
2. Иванов В.П., Лукашов А.Д., Полоников А.В. Содержание основных белков мембран эритроцитов у больных первичной артериальной гипотонией и ее связь с наследственностью, предрасположенной к сердечно-сосудистой патологии // Тер. Архив. 2000. №9. С.69-73.
3. Лилли Р. Патологическая техника и практическая гистохимия. М.:. Мир. 1969. 645.
4. Луценко М.Т., Андриевская И.А. Дифференциальная диагностика устойчивости мембран эритроцитов периферической крови у беременных с герпес-вирусной инфекцией // Бюллетень физиологии и патологии дыхания РАМН. 2009. Вып.4. С.71-74.
5. Луценко М.Т., Андриевская И.А. Способ оценки действия герпес-вирусной инфекции на устойчивость мембран эритроцитов новорожденных от матерей, перенесших в третьем триместре беременности обострение герпес-вирусной инфекции // Бюллетень «Изобретения, полезные модели». 2013. №20.
6. Marchesi V.T. The red cell membrane skeleton recent progress // Blood. 1983. P.1-11.
7. Palek J. Hereditary elliptocytosis and related disordes // Clin. Hematol. 1985. 14(1). P.45-47.
8. Telen M.J., Kaufman R.E. The mature erythrocyte. Wintrobs Clinical Hematology. Ed. J.P. Greer. J. Forster. J.N. Lukens // Chapter 8.11th edition Lippincott William and Wilkins. 2004. P.217-247.
9. Tyagi R.K., Sharma V.D. Erythrocyte bilding activity displayed by a selective group of Plasmodium vivax tryptophan rich antigens is inhibited by patients antibodie // Plos One. 2012. 7(12). S.50754.
10. Штехман М.И. Железодефицитная анемия и беременность // Гинекология. 2004. Т.6, №4. С.11.
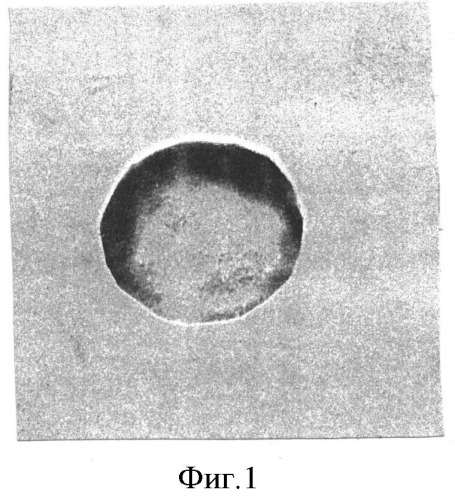
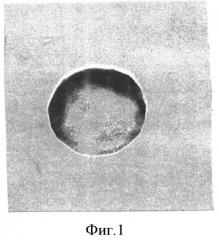
На фигуре 1 изображена гистохимическая реакция на перекиси жирных кислот в эритроците периферической крови новорожденного от матери, перенесшей обострение цитомегаловирусной инфекции в третьем триместре гестации, с титром антител 1:1600. В крови новорожденного определяется титр антител к цитомегаловирусу 1:1600. В эритроците интенсивность реакции на перекиси жирных кислот составляла при цитофотометрическом исследовании по программе «Scion Corporation)) 97,9 усл. ед. Создается угроза неустойчивости мембраны эритроцита, поскольку количество скелетного белка β-спектрина снижалось до 6,6±0,3% (контроль - 8,5±0,3%).
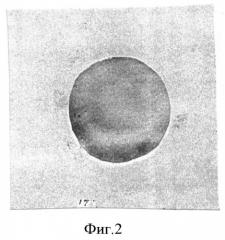
На фигуре 2 изображена гистохимическая реакция на перекиси жирных кислот в эритроците новорожденного от матери, которая не болела на всем протяжении гестации. В эритроците реакция на перекиси жирных кислот у новорожденного составила 22,0±0,85 усл. ед. по программе «Scion Corporation)). В мембранах эритроцитов количество β-спектрина - 8,5β±0,3%. Угрозы неустойчивости мембран не предусматривается.
Способ оценки действия цитомегаловирусной инфекции на устойчивость мембран эритроцитов новорожденных от матерей, перенесших в третьем триместре беременности обострение цитомегаловирусной инфекции, характеризующийся тем, что в периферической крови новорожденного определяют нарастание количественного содержания эритроцитов до 75,5%, содержащих в мембранах до 97,9±2,5 усл.ед. перекисей жирных кислот (ПОЛ) и определяют количество β-спектрина (в %) в мембранах эритроцитов новорожденного методом диск-электрофореза в полиакриламидном геле (10%) с додецилсульфатом натрия, вычисляют значение дискриминантной функции по формуле: DФ=(+0.211×ПОЛ)+(-6.335×β-спектрин),и при DФ более -21.16 оценивают неустойчивость мембран эритроцитов и развитие внутриутробной анемии.