Антифунгальное средство на основе метилового эфира 2-бензимидазолилкарбаминовой кислоты или его производных
Иллюстрации
Показать всеИзобретение относится к антифунгальному средству, содержащему эффективное количество метилового эфира 2-бензимидазолилкарбаминовой кислоты, или его солей с неорганическими и органическими кислотами, или их гидратов, или его комплексных соединений с металлорганическими и неорганическими солями, содержащими переходный металл. Заявленное средство проявляет антифунгальную активность в отношении возбудителей микозов из группы, включающей Trichophyton mentagrophytes var. Interdigitale, Trichophyton rubrum, Microsporum canis, Trichophyton mentagrophytes var. granulosum, Candida albicans. Антифунгальная активность выявлена в отношении патогенных и условно-патогенных грибов, вызывающих микозы слизистых оболочек и кожи у человека и животных. 8 з.п. ф-лы, 4 табл., 28 пр.
Реферат
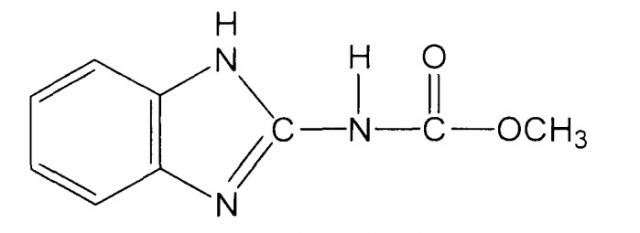
Настоящее изобретение относится к новому антифунгальному средству на основе известных соединений, а именно метилового эфира 2-бензимидазолилкарбаминовой кислоты и его производных, которое может быть использовано для предупреждения и лечения заболеваний человека и животных, вызываемых патогенными и условно-патогенными грибами.
Метиловый эфир 2-бензимидазолилкарбаминовой кислоты (далее - карбендазим, медамин, БМК) - простейшее производное бензимидазола, нашедший широкое практическое применение в качестве системного фунгицида в сельском хозяйстве. ЛД50 для крыс 6400, для кроликов 8000, для собак 8000 мг/кг. Препарат используется в концентрации 0,03-0,06% по действующему веществу. В применяемых концентрациях БМК не фитоциден для большинства растений [Мельников Н.Н. Химия и технология пестицидов. М.: Химия, 1974, с.635].
Карбендазим - один из первых фунгицидов системного действия, который используют и в настоящее время. Он эффективен в отношении ряда заболеваний растений и, в первую очередь, в отношении мучнистой росы.
Недостатком этого препарата является сравнительно быстрое приобретение устойчивости к нему ряда фитопатогенных грибов. Кроме того, несмотря на низкую острую токсичность в больших дозах они могут вызвать тератогенный эффект [Мельников Н.Н. Пестициды. Химия, технология и применение. М.: Химия, 1987, с.565].
Разрешен к применению на территории Российской Федерации в виде концентрата суспензии 200 г/л, 500 г/л на пшенице, ячмене, озимой ржи, сахарной свекле от корневой и прикорневой гнили, церкоспореллезе, снежной плесени, мучнистой росы, каменной и пыльной головни, бурой ржавчины, на яблонях от парши и мучнистой росы, на картофеле от фузариозной гнили и ризоктониоза (Список пестицидов и агрохимикатов, разрешенных к применению на территории Российской Федерации. Приложение к журналу «Защита и карантин растений», №4, 2012, с.162-164).
Карбендазим (медамин) используют также в качестве антигельминтного препарата, который обладает активностью против кишечных нематод [Демидов Н.В. Антигельминтики в ветеринарии. М.: Колос, 1982].
Карбендазим - широко известный как фунгицид и лекарство против лечения паразитических инфекций, вызываемых гельминтами, предложен нами для лечения микозов кожи.
Задачей настоящего изобретения является использование метилового эфира 2-бензимидазолилкарбаминовой кислоты, некоторых его производных и композиций на их основе в качестве противомикотических средств, проявляющих антифунгальную активность в отношении возбудителей таких заболеваний, как эпидермофитии, трихофитии, микроспории и кандидозы.
Объектом изобретения является новое антифунгальное средство, содержащее в эффективном количестве метиловый эфир 2-бензимидазолилкарбаминовой кислоты
или его соли с органическими и неорганическими кислотами, или их гидраты, или его комплексные соединения с металлорганическими и неорганическими солями, содержащими переходный металл, и возможно один или более приемлемые вспомогательные компоненты.
Антифунгальная активность выявлена в отношении патогенных и условно-патогенных грибов, вызывающих микозы слизистых оболочек, кожи и ее придатков у человека и животных.
Соли, образующие комплексные соединения с метиловым эфиром 2-бенз-имидазолилкарбаминовой кислоты, выбраны из группы, включающей хлориды, бромиды, сульфаты, нитраты, фосфаты, сульфонаты, формиаты, тартраты, малеаты, малаты, цитраты, бензоаты, салицилаты, аскорбаты, ацетаты, пропионаты и т.п. и смеси из них.
Указанные комплексные соединения могут иметь одну или две молекулы метилового эфира 2-бензимидазолилкарбаминовой кислоты и одну молекулы соли.
Неорганические кислоты, образующие соли с метиловым эфиром 2-бензимидазолилкарбаминовой кислоты, выбраны из группы, включающей хлористую, серную, азотную, фосфорную, бромоводородную, фтороводородную, йодоводородную и др. кислоты.
Органические кислоты, образующие соли с метиловым эфиром 2-бензимидазолилкарбаминовой кислоты, выбраны из группы, включающей бензойную, сульфоновую, алкилсульфоновую, уксусную, пропионовую, алкилбензолсульфоновую, салициловую, муравьиную, янтарную и др. кислоты.
Соли метилового эфира 2-бензимидазолилкарбаминовой кислоты с неорганическими и органическими кислотами могут быть представлены в форме гидратов.
Переходные металлы включают цинк, медь, никель, марганец, кобальт, кадмий, железо, молибден, вольфрам и хром.
Антифунгальная активность выявлена в отношении следующих возбудителей микозов: Trichophyton mentagrophytes var. Interdigitale, Trichophyton rubrum, Microsporum canis, Trichophyton mentagrophytes var. granulosum, Aspergillus niger, Penicillium notatum, Candida albicans, Alternaria alternate, Fusarium graminearum.
Заявленные соединения для профилактики и лечения микозов применимы при минимальной подавляющей концентрации в интервале значений 0,1-7 мг/мл.
В качестве приемлемых вспомогательных компонентов соединение содержит, в частности, вещества, способствующие проникновению.
Предлагаемые соединения применимы для предупреждения и лечения микозов слизистых оболочек, кожи и ее придатков у человека и животных.
Микозы, для которых эффективно заявленное средство, включают: вызываемые условно-патогенными грибами - кандидозные и плесневые дерматозы, онихомикозы (поражения ногтей), отомикозы (поражения кожи и слизистых оболочек слухового прохода), заболевания кожи и ее придатков (волосы, ногти), вызываемых дерматофитами (дерматофитии): зооантропонозную и антропонозную трихофитии гладкой кожи, волосистой части головы, бороды и усов (паразитарный сикоз), поверхностные, инфильтративные и нагноительные формы, онихомикозы, фавус (парша) волосистой части головы, гладкой кожи, бороды и усов, поверхностные, инфильтративные и нагноительные формы, онихомикозы, зооантропонозную и антропонозную микроспории гладкой кожи, волосистой части головы, поверхностные, инфильтративные и нагноительные формы, онихомиозы, микозы стоп и кистей, рубромикоз гладкой кожи и онихомикозы, эпидерматофитию паховую в виде поражения крупных складок гладкой кожи, эпидерматофитии стоп.
Синтез комплексных соединений метилового эфира 2-бензимидазолилкарбаминовой кислоты с неорганическими и органическими солями, содержащими переходный металл, известен и подробно освещен в литературе [US 3595870, опубл. 29.01.1974, US 3789122, опубл. 27.07.1971, JPS 4948433, опубл. 21.12.1974, JPS 54145216, опубл. 13.11.1979, AU 477616, опубл. 07.10.1971, Новикова Г.А., Молодкин А.К., Кукаленко С.С. Координационые соединения металлов с имидазолами и бензимидазолами. Журнал неорганической химии. Том 33, вып.12, 1988, с.3111-3122 и др.].
Была изучена сравнительная антифунгальная активность метилового эфира 2-бензимидазолилкарбаминовой кислоты и его некоторых производных в отношении фито-, антропо-, зоопатогенных грибов. Результаты приведены в таблице 1.
Как видно из материалов таблицы 1, как фитопатогенные грибы (которые могут являться также возбудителями микозов человека и животных), так условно-патогенные плесневые возбудители «оппортунистических» микозов человека и животных характеризуются примерно сходной резистентностью к действию БМК и исследованных его производных. Минимальная подавляющая концентрация (далее - МПК) для БМК в отношении исследованных фито-, и зоопатогенных грибов составляла сходные концентрации (1-5 мг/мл). Полученные данные о фунгицидной активности БМК соответствуют ранее известным данным по подавлению роста БМК и сходными его производными (в концентрациях 3-5 мг/мл) фитопатогенных грибов других видов Fusarium culmorum и Helminthosporium sativum [Пилюгин B.C. Азотсодержащие гетероциклические соединения. Синтез и биологическая активность производных 2-аминобензимидазола и 1,3,5-сим-триазина. Уфа: Гилем, 2008]. По нашим материалам биологическая активность гидрохлорида БМК и комплекса БМК с сульфатом меди в отношении использованных и фитопатогенных, и условно-патогенных плесневых грибов превосходила таковую собственно БМК в 1,5-2 раза.
Дрожжеподобные грибы, в частности, один из ведущих возбудителей «оппортунистических» микозов человека, возбудитель кандидоза (Candida albicans) проявлял значительно меньшую резистентность (до 10 раз) в сравнении с плесневыми зооантропопатогенными грибами к действию как БМК, так и его производных. Однако при этом изученные производные БМК превосходили по антифунгальной активности в отношении Candida albicans исходный препарат БМК в 1,5-1,8 раза.
Возбудители дерматофитий в отношении БМК и его изученных производных в сравнении с мицелиальными грибами проявляли значительно меньшую резистентность. МПК для БМК при действии на все дерматофиты была сходна для таковой в отношении дрожжеподобных грибов и значительно ниже (в 10 и более раз), чем для плесневых условно-патогенных возбудителей «оппортунистических» микозов людей и животных, у исследованных нами производных БМК в сравнении с исходным препаратом была ниже в 3-5 раз.
Таким образом, БМК и исследованные нами его производные способны проявлять антифунгальные свойства в отношении зооантропопатогенных грибов - возбудителей микозов. Как известно, «оппортунистические» микозы вызываются разнообразными видами грибов, возникновению которых предшествует наличие предрасполагающих факторов со стороны организма хозяина (разнообразные нарушения тех или иных механизмов его защиты от грибов-возбудителей). Возбудителями таких «плесневых» микозов (аспергиллез, пенициллиоз и др.) являются в основном свободно живущие обитатели объектов внешней среды (почва, воздух, вода, растения и другие). При этом возбудителями «оппортунистических» микозов могут выступать и некоторые фитопатогенные грибы. В целом сходство биологических свойств свободноживущих почвообитающих, фитопатогенных грибов и возбудителей «оппортунистических» плесневых микозов, по-видимому, и определяет их сходную чувствительность к антифунгальному действию разработанного в качестве системного фунгицида БМК и его производных.
Дрожжеподобным грибам, вызывающим «оппортунистические» микозы, особенно основным возбудителям кандидоза, свойственна иная экология. Грибы рода Candida, в том числе наиболее частый возбудитель кандидоза Candida albicans, являются естественными обитателями покровных тканей (кожа, слизистые оболочки) людей и животных. Ввиду этого по своим физиологическим свойствам эти грибы значительно ближе к зоопаразитарным грибам. Чувствительность этих грибов к антифунгальному действию БМК и его производных значительно выше, а МПК для них сходны с таковыми для дерматофитов.
Дерматофиты - мицелиальные грибы родов Trichophyton, Microsporum и Epidermophyton. Дерматофиты вызывают дерматофитии - контагиозные инфекции с поражением кожи разной глубины (эпидермис, дерма) и ее придатков (волосы, ногти). В зависимости от вида возбудителя заболевания - микозы стоп и кистей, антропонозная и зооантропонозная трихофития и микроспория; фавус («парша»), эпидермофития - могут протекать остро и/или хронически, с разной степенью выраженности воспалительных явлений и передаваться или только от человека к человеку, или от животных к человеку. Возбудители дерматофитии являются несовершенными формами почвообитающих кератинофильных грибов родов Arthroderma и Nannizzia, патогенность которых дискутабельна. Считается, что в ходе паразитарной адаптации дерматофиты утратили способность к сапрофитическому существованию. Ввиду вышеприведенного антифунгальная активность БМК и его производных в отношении дерматофитов, как и других антропопатогенных грибов, может представлять интерес в плане перспектив их возможного применения для терапии микозов. В этом плане следует отметить, что концентрации БМК и особенно его изученных производных, оказывающие угнетающее действие на антропопатогенные грибы (0,1-7 мг/мл), несколько больше, но сопоставимы по фунгицидной активности с лечебными дозами препаратов, применяемыми для наружного лечения людей, например мирамистина (бензилдиметил [3-(миристоиламино)пропил]аммоний хлорида моногидрат) - (0,015-0,5 мг/мл) [Pat. №3789122 USA, US C1. 260-299, 424-245, (A01n 9/22). Fungicidal cjmpositions of transition metal complexes of substituted 2-benzimidazoltcarbamftic aside, alkyl esters].
Пример 1.
Фунгицидная активность проверялась путем учета полной задержки роста - минимальной подавляющей концентрации (МПК) в отношении тест-культур грибов на плотной среде Сабуро, содержащей исследуемые препараты. При проведении исследования порошкообразные препараты предварительно растворялись в диметилсульфоксиде (далее - ДМСО) и вносились в расплавленную среду Сабуро (селективная), вносили растворы БМК и его производных в 1 мл ДМСО на 100 мл среды (до конечных концентраций веществ 0,1-10,0 мг/мл), разливали по 20 мл в чашки Петри и равномерно перемешивали вплоть до полимеризации среды. После полимеризации («застывания») на среды с препаратами и контрольные среды (среды без добавления веществ, среды с растворителем - 1% ДМСО) высевали тест-культуры грибов и инкубировали при 28°С в течение 40 дней. Результаты регистрировали ежедневно визуально по наличию роста типичных колоний грибов [Кашкин П.П., Лисин В.В. Практическое руководство по медицинской микологии. Л.: Медицина, 1983. - 190 с.].
Для определения фунгицидной активности соединения в отношении фитопатогенных почвообитающих грибов, вызывающих заболевания растений, использованы тест-культуры фитопатогенных грибов Fusarium graminearum и Alternaria altemata.
В качестве тест-объектов для оценки антифунгального действия в отношении антропо- и зоопатогенных грибов использовали культуры клинических (выделенных из патологического материала больных и лабораторно идентифицированных) штаммов грибов: возбудителей «оппортунистических инфекций» - условно-патогенных плесневых грибов - Penicillium notatum и Aspergillus ninger, дрожжеподобных грибов - Candida albicans, и «первично-патогенных» грибов - возбудителей дерматофитий: дерматофитов антропофильных - возбудителей микозов стоп и кистей Trichophyton mentagrophytes var. interdigitale и Trichophyton rubrum, возбудители зооантропонозных трихофитии и микроспории - Trichophyton mentagrophytes var. gypseum (seu granulosum) и Microsporum canis.
Определение МПК изученных соединений в отношении всех тест-культур грибов проводилось не менее чем трехкратно.
Пример 2.
Получение соли карбендазима с соляной кислотой в гидратной форме БМК·HCl·2H2O - гидрохлорида карбендазима дигидрата (далее - ГХБМК). Суспензию БМК 15 г (0,0785 молей) в 80 мл Н2О при перемешивании нагревают до 60°С, в течение 15 минут дозируют 13,13 мл 11,96 Н водного раствора HCl (0,157 молей), выдерживают при этой же температуре 15 минут. Реакционную массу охлаждают при комнатной температуре в течение 3-х часов. Образовавшийся осадок фильтруют и сушат под ИК-лампой. Вес полученного осадка - 18,451 г. Выход в расчете на гидрохлорид карбендазима дигидрата - 89,17%. Исходя из меркурометрического анализа на содержание Cl-ионов доля ГХБМК в полученном препарате составляет 86,88%, анализ осадка по данным УФ-спектроскопии - 86%, что свидетельствует об образовании ГХБМК·2Н2О. Аналогично получают соль карбендазима с другими неорганическими кислотами.
Пример 3.
Синтез комплекса БМК с сульфатом меди БМК2·CuSO4. К БМК 3,82 г (0,02 моля) приливают 2,5 г (0,01 моль) CuSO4·5H2O, растворенных при нагревании в 6 мл Н2О, и 2 мл ацетона. Суспензию перемешивают в течение 2-х часов при 50°С. Происходит изменение цвета реакционной массы от голубого к серо-фиолетовому. Постепенно повышают температуру до 90-100°С и при этой температуре продолжают синтез еще 1 час. При отгонке ацетона происходит изменение цвета суспензии от серо-фиолетового к светло-зеленому. Затем охлаждают реакционную массу до комнатной температуры, осадок отфильтровывают, промывают на фильтре водой и сушат. После сушки получают 4,9 г (выход 90,4%) осадка с содержанием Cu2+ 9,7%, расчетное содержание меди - 11,72%. Содержание комплекса в осадке 83%.
Пример 4.
Получение соли БМК с салициловой кислотой (БМК·СК). К 0,04 моля кислоты приливают 30-35 мл ацетона, засыпают 7,64 г (0,04 моля) БМК, полученную суспензию перемешивают в течение 15 минут при 50°С, затем ацетон выпаривают. Образовавшийся кристаллический осадок досушивают под инфракрасной лампой.
При образовании соли меняется характер ИК-спектров валентных колебаний. Для БМК 3319(N-H); 1711(С=O); 1643(С=С+C-N); 1599(C-N+С-O); 1286, 1267(С-O-С асим.); 1096(С-O-С сим.) см-1. Для соли БМК с салициловой кислотой 3328, 3319(N-H); 1653, 1617(С-0); 1634(С=С+C=N); 1591(C-N+С-O); 1267(С-O-С асим.); 1096(С-O-С сим.) см-1.
Пример 5.
Синтез комплекса БМК с хлоридом меди (БМК2·CuCl2): 1,91 г (0,01 моль) БМК заливают раствором 0,8526 г (0,005 молей) CuCl2·2Н2О в 6 мл Н2О и добавляют 2 мл ацетона. Образовавшуюся суспензию нагревают при перемешивании при температуре 55°С в течение 20 минут и сушат под инфракрасной лампой. Для анализа полученное соединение отмывают водой от не вступившего в реакцию хлорида меди, затем ацетоном и сушат над CaCl2. В полученном соединении содержание меди составляет 12,29%, расчетное - 12,3%.
Пример 6.
Получение комплекса БМК с хлоридом меди (БМК·CuCl2): в 10 мл метанола растворяют 1,91 г (0,01 моль БМК) и 1,71 г (0,01 моль) CuCl2·2Н2О, после удаления растворителя получают примерно 3 г БМК·CuCl2. Синтез проведен, как описано в патентном документе JP 49-48433 (1974).
Пример 7.
Получение комплекса БМК с сульфатом меди (БМК·CuSO4): к 2,5 г (0,01 моль) CuSO4·5H2O приливают 60 мл метанола, засыпают 1,91 г (0,01 моль) БМК. При интенсивном перемешивании синтез идет в течение 4-х часов при 50°С. Образовавшийся осадок отфильтровывают и промывают на фильтре метанолом. После сушки получают 3,11 г осадка. Выход 86,2%. Содержание комплекса в осадке 94-96%.
Пример 8.
Получение комплекса БМК с хлоридом марганца четырехводным (БМК2·MnCl2): синтез осуществляют по аналогии с примером получения БМК2·CuCl2.
Пример 9.
Получение комплекса БМК с бромидом цинка (БМК2·ZnBr2): синтез осуществляют по аналогии с примером получения БМК2·CuCl2.
Пример 10.
Получение комплекса БМК с хлоридом железа шестиводным (БМК2·FeCl3): синтез осуществляют по аналогии с примером получения БМК2·CuCl2.
Пример 11.
Получение комплекса БМК с нитратом кобальта шестиводным (БМК2·CoNO3): синтез осуществляют по аналогии с примером получения БМК2·CuCl2.
Пример 12.
Соль БМК с алкилбензолсульфокислотой (далее - АБСК) (C8-18H17-37C6H5SO3H) получают согласно патенту РФ №2497361.
Пример 13.
Соль БМК с муравьиной кислотой (далее - HCO2H) и бензойной кислотой (далее - НОС6Н4СООН) получают аналогично примеру 4.
Пример 14.
К БМК 3,82 г (0,02 моля) добавляют 2,5 г (0,01 моль) CuSO4·5H2O, приливают 6 мл воды и 2 мл ацетона, суспензию перемешивают в течение 2-х часов при 50°C, затем поднимают температуру до 90°C и продолжают синтез еще 1 час. Растворитель отгоняют. Осадок досушивают под инфракрасной лампой. Для анализа часть осадка отмывают водой от не прореагировавшего сульфата меди. В отмытом осадке содержание Cu2+ составляет 9,6%, расчетное содержание меди - 11,72%. Содержание комплекса в осадке 82%.
Пример 15.
Получение комплекса БМК с ацетатом меди (БМК·Сu(С2Н3О2)2 - далее БМК·СuАс): к раствору гидрата ацетата меди 2,4 г (0,012 молей) в 80 мл этанола добавляют 1,91 г (0,01 моль) БМК. Реакцию проводят при интенсивном перемешивании при температуре примерно 50°С в течение 3-х часов. Полученную суспензию охлаждают до комнатной температуры и отфильтровывают. Осадок на фильтре промывают водой, спиртом и сушат. Получают 3,1 г комплекса зеленого цвета с выходом 83,42%. Содержание меди в осадке составляет 17,02%, теоретическое значение 17,05%, теоретическое значение 17,05%. Фильтрат этанола можно использовать для последующих синтезов.
Пригодными веществами, способствующими проникновению, являются диметилсульфоксид, диметилформамид, салициловая кислота (спиртовой или водно-спиртовой раствор), диметилацетомид, пропиленгликоль, изопропиловый спирт, поверхностно-активные вещества (например, лаурилсульфат натрия). Также в качестве вспомогательных веществ используют инертные мазевые основы - вазелин, вазелиновое масло и т.д.
Предлагаемые композиции получают смешиванием компонентов при комнатной или повышенной температуре.
Пример 16.
Берут 1 г комплекса БМК с сульфатом меди, смешивают его с 99 г вазелина в качестве мазевой основы при комнатной температуре до образования однородной массы.
Пример 17.
Берут 1,6 г соль БМК с салициловой кислотой, добавляют 98,4 г диметилсульфоксида, перемешивают при комнатной температуре в течение 0,5 ч.
Пример 18.
Аналогично примеру 17, только вместо диметилсульфоксида берут диметилформамид.
Пример 19.
Берут 0,5 г соли БМК с соляной кислотой в гидратной форме, добавляют 99,5 г изопропилового спирта, перемешивают при комнатной температуре в течение 1,0 ч.
Пример 20.
Аналогично примеру 19, только вместо изопропилового спирта добавляют пропиленгликоль в количестве 98 г, а соль БМК с соляной кислотой в гидратной форме берут в количестве 2,0 г.
Пример 21.
Берут 1 г комплекса БМК с ацетатом меди, добавляют 99 г диметилацетомида, перемешивают при комнатной температуре в течение 1,5 ч.
Пример 22.
Аналогично примеру 21, только в качестве действующего вещества берут комплекс БМК с бромидом цинка.
Пример 23.
Аналогично примеру 17, только при этом диметилсульфоксид берут в количестве 95,3 г и дополнительно добавляют 3 г воды и 0,1 мл 36% соляной кислоты для стабилизации композиции.
Пример 24.
Берут 5 г соли БМК с алкилбензолсульфокислотой, добавляют 95 г пропиленгликоля и перемешивают в течение 1 ч при комнатной температуре.
Пример 25.
Берут 37 г ПЭГ 400, смешивают с 17 г ПЭГ 15000, добавляют диметилсульфоксид в количестве 19 г, БМК в количестве 1,7 г и воду 25,3 г. Смесь нагревают до 50-60°С и перемешивают до образования однородной массы.
Проверка антифунгальных свойств in vivo при лечебном применении проводилась в отношении возбудителей дерматофитий на модели зооантропонозной трихофитии с контролируемым течением. Экспериментальная зоонозная трихофития моделировалась на мышах линии BALB/C, генетически высокочувствительных к данной дерматофитии [Calderon R., Hay R. Cell-mediated immunity in experimental murine dermatohyytosis // Immunology. - 1984. - Vol. 53, №3. - P. 457-464. Calderon R., Hay R. Fungicidal activity of human neutrophyls and monocytes on dermatophyte fungi Trichophyton quinckeanum and Trichophyton rubrum // Immunology. - 1987. - Vol. 61, №3. - P. 289-295]. Контролируемая интенсивность микотических поражений кожи обеспечивалась, помимо использования линейных животных, дозированным инфицированием, для чего в качестве инфицирующего материала применялись выделенные одноклеточные элементы культур гриба - микроконидии трихофитона. В процессе выделения микроконидий после получения 7-дневной культуры Trichophyton mentagrophytes variant granulosum штамм 182 на жидкой среде Сабуро проводилось освобождение культуральной жидкости от мицелиальных образований гриба (центрифугирование при 3000 об/мин). Осаждение микроконидий проводилось центрифугированием при 8000 об/мин с последующим 3-кратным отмыванием стерильным изотоническим раствором с добавлением гентамицина сульфата (5 мг/мл). Полученная суспензия микроконидий после расфасовки сохранялась в замороженном виде. Определение концентрации микроконидий для инфицирования проводили микроскопически (микроскопия нативной суспензии в темном поле) и определением их жизнеспособности путем мерного высева на плотную среду Сабуро с последующим (через 7 дней) вычислением количества колониеобразующих единиц [Медведев Ю.А. Молекулярно-клеточные механизмы иммуногенеза при зоонозной трихофитии: Дис. …д-ра мед. наук. - М., 1988. - 240 с.]. Для моделирования инфекции мышам линии BALB/C на предварительно выбритую поверхность кожи спины площадью 4×2 см наносили суспензию микроконидий гриба (1-3×10×9 микроконидий в 0,05% растворе Твин-80 на физиологическом растворе) при объеме 0,05 мл/мышь. Эффективность заражения контролировалась на 5 день после заражения по результатам высева кожных чешуек на плотную среду Сабуро с последующей идентификацией культур по культуральным и морфологическим свойствам [Кашкин П.Н., Лисин В.В. Практическое руководство по медицинской микологии. - Л.: Медицина, 1983. - 190 с.]. Клинически степень поражения кожи в динамике заболевания оценивали в баллах по формуле: диаметр поражения × выраженность гипереми × выраженность отека × выраженность суппурации (последние три признака по интенсивности от 1 до 3) [Calderon R., Hay R. Cell-mediated immunity in experimental murine dermatohyytosis // Immunology. - 1984. - Vol. 53, №3. - P. 457-464].
Наружная терапия зараженных животных проводилась нанесением на инициированные участки кожи растворов (взвесей, суспензий) испытуемых веществ. Антифунгальный эффект производных БМК при лечебном использовании может быть проиллюстрирован следующими примерами.
Пример 26. Лечение зооантропонозной трихофитии салицилатом БМК (БМК·СК).
В экспериментах зоонозную трихофитию моделировали на 20 инбредных мышах линии BALB/C по вышеописанной методике. У всех мышей уже на 3 день после заражения отмечены воспалительные явления, сходные по интенсивности во всех группах животных (Табл. 2). Также у всех мышей на 5 день после заражения в результате высева на среду Сабуро из чешуек кожи были выделены ретрокультуры Trichophyton mentagrophytes variant granulosum. Лечение проводили наружным нанесением на участки поражения раствора БМК·СК в 5% водно-спиртовом растворе салициловой кислоты (далее - СК) в концентрации 2 мг/мл. Лечение начинали с третьего дня после заражения. В качестве контроля терапии использовали наружно наносимый 5% водно-спиртовой раствор БМК·СК и крем «Низорал» (далее - МК), содержащий в качестве активного ингредиента кетоконазол. Лечение проводили, начиная с третьего дня после заражения вплоть до полного излечения.
Эффективность антифунгальной терапии контролировалась микологически: по негативации результатов микроскопического исследования и высева кожных чешуек из очагов заражения на плотную среду Сабуро [Кашкин П.Н., Лисин В.В. Практическое руководство по медицинской микологии. - Л.: Медицина, 1983. - 190 с.] и исчезновению клинических признаков поражения кожи в динамике заболевания в баллах по формуле: диаметр поражения × выраженность гиперемии × выраженность отека × выраженность суппурации (последние три признака по интенсивности от 1 до 3) [Calderon R., Hay R. Cell-mediated immunity in experimental murine dermatohyytosis // Immunology. - 1984. - Vol. 53, №3. - P. 457-464]. Негативация результатов микологического обследования очагов поражения отмечалась в группах мышей: мазь кетоконазоловая (МК) - к 14 дню после заражения, БМК·СК - к 21 дню после заражения, в группах «без лечения» и СК возбудители трихофитии микологически определялись до 30 дня после заражения (окончание наблюдения). Изменения в очагах заражения приведены в табл. 2.
Таким образом, наблюдалось полное излечение при наружном применении соли БМК·СК в водно-спиртовом растворе салициловой кислоты.
Пример 27. Лечение зооантропонозной трихофитии комплексом БМК с хлоридом меди БМК2·CuCl2.
В экспериментах зоонозную трихофитию моделировали на 20 инбредных мышах линии BALB/C по вышеописанной методике. У всех мышей уже на 3 день после заражения отмечены воспалительные явления, сходные по интенсивности во всех группах животных (Табл. 3). Также у всех мышей на 5 день после заражения в результате высева на среду Сабуро из чешуек кожи были выделены ретрокультуры Trichophyton mentagrophytes variant granulosum. Лечение проводили наружным нанесением на участки поражения взвеси комплекса БМК с хлоридом меди (БМК2·CuCl2) в концентрации 5 мг/мл в вазелиновом масле (далее - ВМ). Лечение начинали с третьего дня после заражения. В качестве контроля терапии использовали наружно наносимое вазелиновое масло (ВМ). Лечение проводили, начиная с третьего дня после заражения вплоть до полного излечения.
Эффективность антифунгальной терапии контролировалась микологически: по негативации результатов микроскопического исследования и высева кожных чешуек из очагов заражения на плотную среду Сабуро [Кашкин П.Н., Лисин В.В. Практическое руководство по медицинской микологии. Л.: Медицина, 1983. - 190 с.] и исчезновению клинических признаков поражения кожи в динамике заболевания в баллах по формуле: диаметр поражения × выраженность гипереми × выраженность отека × выраженность суппурации (последние три признака по интенсивности от 1 до 3) [Calderon R., Hay R. Cell-mediated immunity in experimental murine dermatohyytosis // Immunology. - 1984. - Vol. 53, №3. - P. 457-464]. Негативация результатов микологического обследования очагов поражения отмечалась в группах мышей: мазь кетоконазоловая (МК) - к 14 дню после заражения, ВМ-БМК2·CuCl2 - к 21 дню после заражения, в группах «без лечения» и ВМ возбудители трихофитии микологически определялись до 30 дня после заражения (окончание наблюдения). Изменения в очагах заражения приведены в табл. 3.
Таким образом, наблюдалось полное излечение при наружном применении комплекса БМК2·CuCl2, который смешивали с вазелиновым маслом в качестве мазевой основы.
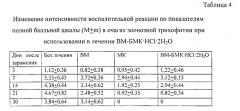
Пример 28. Лечение зооантропонозной трихофитии солью карбендазима (БМК) с соляной кислотой в гидратной форме БМК·HCl·2H2O - гидрохлоридом карбендазима дигидрата.
В экспериментах зоонозную трихофитию моделировали на 20 инбредных мышах линии BALB/C по вышеописанной методике. У всех мышей уже на 3 день после заражения отмечены воспалительные явления, сходные по интенсивности во всех группах животных (Табл. 4). Также у всех мышей на 5 день после заражения в результате высева на среду Сабуро из чешуек кожи были выделены ретрокультуры Trichophyton mentagrophytes variant granulosum. Лечение проводили наружным нанесением на участки поражения взвеси соли карбендазима (БМК) с соляной кислотой в гидратной форме БМК·HCl·2H2O, в концентрации 5 мг/мл в вазелиновом масле (далее - ВМ). Лечение начинали с третьего дня после заражения. В качестве контроля терапии использовали наружно наносимое вазелиновое масло (ВМ). Лечение проводили, начиная с третьего дня после заражения вплоть до полного излечения.
Эффективность антифунгальной терапии контролировалась микологически: по негативации результатов микроскопического исследования и высева кожных чешуек из очагов заражения на плотную среду Сабуро [Кашкин П.Н., Лисин В.В. Практическое руководство по медицинской микологии. Л.: Медицина, 1983. - 190 с.] и исчезновению клинических признаков поражения кожи в динамике заболевания в баллах по формуле: диаметр поражения × выраженность гипереми × выраженность отека × выраженность суппурации (последние три признака по интенсивности от 1 до 3) [Calderon R., Hay R. Cell-mediated immunity in experimental murine dermatohyytosis // Immunology. - 1984. - Vol. 53, №3. - P. 457-464]. Негативация результатов микологического обследования очагов поражения отмечалась в группах мышей: мазь кетоконазоловая (МК) - к 14 дню после заражения, ВМ-ГХБМК - к 21 дню после заражения, в группах «без лечения» и ВМ возбудители трихофитии микологически определялись до 30 дня после заражения (окончание наблюдения). Изменения в очагах заражения приведены в таблице 4.
Таким образом, наблюдалось полное излечение при наружном применении БМК·HCl·2H2O в вазелиновом масле.
1. Антифунгальное средство, содержащее эффективное количество метилового эфира 2-бензимидазолилкарбаминовой кислоты, или его солей с неорганическими и органическими кислотами, или их гидратов, или его комплексных соединений с металлорганическими и неорганическими солями, содержащими переходный металл, и возможно один или более приемлемые вспомогательные компоненты, проявляющее антифунгальную активность в отношении возбудителей микозов из группы, включающей Trichophyton mentagrophytes var. Interdigitale, Trichophyton rubrum, Microsporum canis, Trichophyton mentagrophytes var. granulosum, Candida albicans.
2. Средство по п.1, в котором соли, образующие комплексные соединения с метиловым эфиром 2-бензимидазолилкарбаминовой кислоты, выбраны из группы, включающей хлориды, бромиды, сульфаты, нитраты, фосфаты, сульфонаты, бензолсульфонаты, формиаты, тартраты, малеаты, малаты, цитраты, бензоаты, салицилаты, аскорбаты, ацетаты, пропионаты и смеси из них.
3. Средство по п.1, в котором комплексные соединения с метиловым эфиром 2-бензимидазолилкарбаминовой кислоты могут иметь одну или две молекулы метилового эфира 2-бензимидазолилкарбаминовой кислоты и одну молекулу соли.
4. Средство по п.1, в котором неорганические кислоты, образующие соли с карбендазимом, выбраны из группы, включающей хлористую, серную, азотную, фосфорную, бромоводородную, фтороводородную, йодоводородную кислоты.
5. Средство по п.1, в котором органические кислоты, образующие соли с карбендазимом, выбраны из группы, включающей бензойную, сульфоновую, алкилсульфоновую, уксусную, пропионовую, алкилбензолсульфоновую, салициловую, муравьиную кислоты.
6. Средство по п.1, в котором переходные металлы включают цинк, медь, никель, марганец, кобальт, кадмий, железо и хром.
7. Средство по п.1, в котором в качестве приемлемых вспомогательных компонентов оно содержит, в частности, вещества, способствующие проникновению.
8. Средство по п.1, в котором минимальная подавляющая концентрация указанных в пп. 1-6 соединений составляет 0,1-7 мг/мл.
9. Средство по п.1, в котором указанные в пп.1-7 соединения применимы для предупреждения и лечения микозов слизистых оболочек, кожи и ее придатков у человека и животных.