Ферментный препарат на основе иммобилизованной бутирилхолинэстеразы и способ его приготовления
Иллюстрации
Показать всеИзобретения относятся к биотехнологии. Предложены способ приготовления ферментного препарата на основе иммобилизованной бутирилхолинэстеразы и ферментный препарат для определения карбаматов и фосфорорганических соединений. Готовят крахмальный или желатиновый гель в фосфатном буфере pH 7,9-8,0. Охлаждают гель до 31-35ºC. Затем его смешивают с буферным раствором бутирилхолинэстеразы и буферным раствором индикатора тиоловых групп 5,5'-дитио-бис(2-нитробензойной кислотой) с концентрацией 0,56 Μ. Дозируют полученную смесь на гидрофобную подложку и высушивают при температуре 8ºC. Изобретения позволяют упростить процедуру иммобилизации фермента, увеличить время хранения ферментного препарата без потери его активности в течение более одного года. Полученный препарат обладает высокой чувствительностью к действию фосфорорганических соединений и карбаматов и может использоваться для контроля степени загрязнения объектов окружающей среды ингибиторами холинэстераз. 2. н.п. ф-лы, 7 ил., 7 пр.
Реферат
Изобретение относится к биотехнологии, биохимии и инженерной энзимологии, в частности к способам получения иммобилизованных ферментов, и может быть использовано в химии, биохимии, медицине, микробиологии, экологии и сельском хозяйстве для аналитического определения токсичности отдельных веществ и интегральной токсичности смесей различных веществ, в том числе обладающих антихолинэстеразным действием.
Данное изобретение предназначено для получения высокоактивных препаратов иммобилизованной холинэстеразы, которые могут использоваться в качестве биологического модуля в устройствах типа «биосенсор» для контроля степени загрязнения объектов окружающей среды ингибиторами холинэстераз, в том числе применяемыми в сельском хозяйстве пестицидами, представляющими собой производные карбаминовой кислоты, а также фосфорорганические соединения.
Холинэстераза обладает высокой чувствительностью к карбаматам и фосфорорганическим соединениям: применяемым в быту фосфорорганическим инсектицидам (хлорофос, дихлофос), пестицидам, использующимся в сельском хозяйстве для защиты растений, лекарственным препаратам. Органофосфаты фосфорилируют, а карбаматы ацетилируют остаток серина в активном центре фермента, в результате такого необратимого ингибирования фермента длительное время сохраняется низкая активность холинэстеразы.
В настоящее время для анализа ингибиторов холинэстераз применяют препараты фермента, представляющие собой холинэстеразу, иммобилизованную на различных носителях физическими и химическими способами.
Известен способ получения иммобилизованной холинэстеразы [авторское свидетельство SU 1409656, МПК C12N 11/14, опубл. 15.07.1988 г.], заключающийся в ковалентном связывании фермента с хлорангидридным производным силохрома C-80, который в свою очередь получают из карбоксильного производного силохрома C-80 путем его нагревания с хлористым тионилом в смеси с диметилфорамидом и абсолютированным хлороформом. Иммобилизацию проводят в фосфатном буфере в течение 1 часа, путем смешивания препарата холинэстеразы с носителем при охлаждении, затем препарат промывают охлажденным раствором NaCl и водой. Полученный иммобилизованный препарат сохраняет активность в течение 80 дней при комнатной температуре.
Недостатками известного препарата и способа его приготовления являются сложность процедуры получения носителя, использование для этой цели токсичного хлороформа, а также относительно короткое время сохранения активности фермента.
Наиболее близким техническим решением, выбранным в качестве прототипа, является препарат, включающий холинэстеразу из сыворотки лошадей, краситель FDC Blue No. 1 и одну из специализированных добавок (глицерин, карбоксиметилцеллюлозу, Carbowax-400 (полиэтиленгликоль 400), Kraystay K (CAS No. 8038-11-7), хлорид натрия, сорбитол, сахарозу, Тритон X-100, диметилсульфоксид), иммобилизованные в крахмальный гель, и способ его приготовления [Batjman E.K., Goodson L.H., Thomson J.R. Stabilization of serum cholinesterase in dried starch gel. // Analytical Biochemistry, 1967. V.19, N 3. P.587-492.]. Специализированную добавку вносят в препарат для обеспечения высушивания крахмала и удержания крахмальных пленок прикрепленными к подложке. В качестве подложки используют пенополиуретан. Способ иммобилизации состоит в проведении следующей последовательности процедур. Листы пенополиуретана нарезают на части размером 4×6 дюймов (10,6×15,24 см). Готовят смесь, содержащую теплый 8% крахмальный гель (47°C), холинэстеразу и какую-либо из добавок. Набирают 10 мл смеси в шприц (без использования иглы) и помещают содержимое шприца в центр подготовленной полиуретановой подложки, которую затем располагают на теплой стеклянной пластине. Затем с помощью бытовой скалки очень быстро распределяют крахмальную смесь тонким слоем по всей поверхности полиуретановой подложки таким образом, чтобы голубой цвет смеси был равномерным, а на скалке и стеклянной пластине крахмальной смеси осталось как можно меньше. Подготовленные стеклянные пластины помещают в холодильник для застывания геля, а затем высушивают в вакуумном испарителе при пониженном давлении в течение ночи. Полученный высушенный ферментный слой имеет круглую форму, его нарезают на более мелкие части диаметром 0,95 см, складывают во флакон с закручивающейся крышкой, содержащий слой перхлората магния в качестве влагопоглотителя. Для определения ингибиторов холинэстераз в воздухе или воде оценивают активность иммобилизованной таким способом холинэстеразы по методу Эллмана. Для этого первоначально полученный ферментный препарат помещают в 5 мл 0,1 М трис буфера pH 7,4, содержащего 10 единиц активности α-амилазы, и инкубируют в течение 30-60 минут при комнатной температуре. Затем аликвоту полученного супернатанта добавляют в кювету, содержащую 2,5 мл следующей смеси: 2 мл раствора 5,5′ дитио-бис (2-нитробензойной кислоты) концентрации 396 мг/100 мл; 0,4 мл свежеприготовленного раствора йодистого бутирилхолина (21,6 мг/мл) и 47,5 мл 0,1 М буфера трис pH 7,4. По скорости изменения оптической плотности при длине волны 412 нм, измеренной с помощью спектрофотометра, определяют активность холинэстеразы.
Недостатками препарата и способа его приготовления являются сложность и многостадийность процедуры его получения, длительное время анализа, так как необходима предварительная инкубация препарата в течение 30-60 минут, внесение дополнительного реагента α-амилазы, а также необходимость включения в препарат дополнительного компонента - красителя FDC Blue No.1, с помощью которого авторы пытаются обеспечить более равномерное распределение крахмальной смеси по поверхности подложки. Однако использование подобной технологии распределения вязкого раствора приводит к увеличению различий между партиями ферментных препаратов, поскольку степень равномерности определяется «на глаз».
Технический результат изобретения заключается в упрощении процедуры иммобилизации фермента, увеличении времени хранения ферментного препарата без потери активности более одного года, повышении точности измерений активности холинэстеразы, в частности при проведении длительных анализов, а также существенном упрощении анализа, сокращении времени его проведения и уменьшении его стоимости.
Технический результат достигается тем, что в ферментном препарате на основе иммобилизованной бутирилхолинэстеразы, содержащем бутирилхолинэстеразу, иммобилизованную в гель, новым является то, что содержит индикатор тиоловых групп 5,5′ дитио-бис (2-нитробензойную кислоту).
Технический результат достигается также и способом приготовления ферментного препарата на основе иммобилизованной бутирилхолинэстеразы, включающем приготовление геля в фосфатном буфере pH 7,9-8,0, охлаждение геля до 31-35°C, смешивание буферного раствора бутирилхолинэстеразы и раствора индикатора тиоловых групп 5,5′ дитио-бис (2-нитробензойной кислоты) с гелем, дозирование на гидрофобную подложку, высушивание при температуре 8°C.
Сравнение заявляемых технических решений с прототипом и другими техническими решениями из данной области техники позволило установить их соответствие критериям «новизна» и «изобретательский уровень».
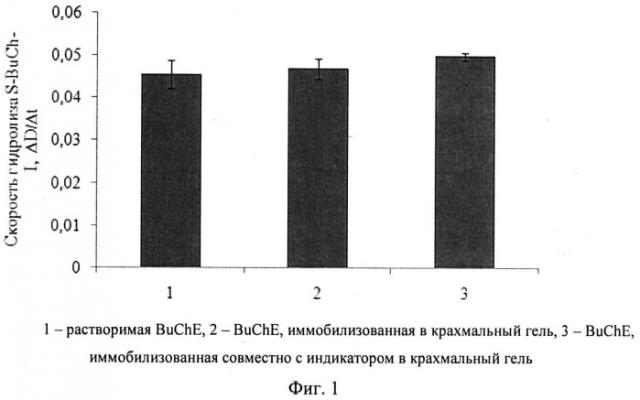
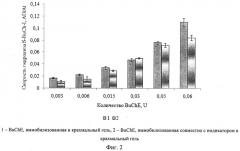
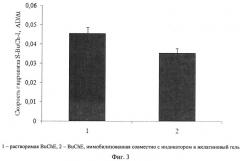
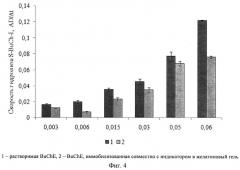
Изобретение поясняется чертежами. На фиг.1 представлено сравнение активностей препаратов растворимой и иммобилизованной в крахмальный гель холинэстеразы, а также холинэстеразы, иммобилизованной в крахмальный гель совместно с индикатором тиоловых групп, определяемых по скорости гидролиза бутирилтиохолина йодистого холинэстеразой. На фиг.2 представлена зависимость скорости гидролиза бутирилтиохолина йодистого от количества бутирилхолинэстеразы в иммобилизованном препарате на основе крахмального геля. На фиг.3 представлено сравнение активностей препаратов растворимой холинэстеразы и холинэстеразы, иммобилизованной совместно с индикатором в желатиновый гель, определяемых по скорости гидролиза бутирилтиохолина йодистого холинэстеразой. На фиг.4 представлена зависимость скорости гидролиза бутирилтиохолина йодистого от количества бутирилхолинэстеразы в иммобилизованном препарате на основе желатинового геля. На фиг.5 представлена активность бутирилхолинэстеразы, иммобилизованной совместно с индикатором тиоловых групп в крахмальный гель, в зависимости от времени хранения препарата. На фиг.6 представлена активность бутирилхолинэстеразы, иммобилизованной совместно с индикатором тиоловых групп в желатиновый гель, в зависимости от времени хранения препарата. На фиг.7 представлена зависимость скорости ферментативного гидролиза S-BuCh-I препаратом, на основе крахмального геля, от концентрации пиримифосметила.
Ферментный препарат на основе иммобилизованной бутирилхолинэстеразы представляет собой ферментативно-активную субстанцию, состоящую из бутирилхолинэстеразы, индикатора тиоловых групп 5,5′ дитио-бис (2-нитробензойной кислоты) и буфера, совместно иммобилизованных в гель.
Полученный препарат обладает высокой чувствительностью к действию фосфорорганических соединений. Например, концентрация пиримифосметила, при которой наблюдается снижение скорости ферментативного гидролиза на 50%, составляет 50 мкМ.
В процессе приготовления осуществляют автоматическое дозирование крахмальной смеси, что позволяет получить препараты, не различающиеся по активности фермента от партии к партии. Кроме того, дозирование проводят на подложку, обладающую гидрофобными свойствами. В результате после высушивания ферментный препарат отделяют от подложки и, таким образом, получают препараты, свободные от подложки и предназначенные для проведения одного измерения. Высушивание иммобилизованного препарата проводят без использования вакуумного испарителя.
Пример 1.
Иммобилизацию бутирилхолинэстеразы в крахмальный гель проводят следующим образом: раствор бутирилхолинэстеразы (BuChE) готовят на 0,05 М калий-фосфатном буфере pH 7,9-8,0. Раствор серосодержащего бутирилтиохолина йодистого (S-BuC-I) готовят на дистиллированной воде. Раствор 5,5′-дитио-бис (2-нитробензойной кислоты) готовят на 0,05 М калий-фосфатном буфере pH 7,9-8,0. Навеску 0,312 г крахмала помещают в 12 мл 0,05 М калий-фосфатного буфера pH 7,9-8,0, интенсивно перемешивают и кипятят в течение 2 мин. Полученную смесь охлаждают до 31-35°C, затем вносят 100 мкл раствора BuChE, содержащего 12,25 ед. активности фермента, и 300 мкл 0,56 М раствора 5,5′-дитио-бис (2-нитробензойной кислоты). Дозируют полученную смесь по 25 мкл на гидрофобную подложку с помощью автоматической станции epMotion 5075 («Eppendorf», Германия), высушивают при температуре 8°C в течение 24 часов. Полученный препарат активируют добавлением 100 мкл 0,12 мМ раствора S-BuCh-I. Изменение оптической плотности регистрируют при 412 нм в течение 5 минут на спектрофотометре UVIKON 943 A (Contron Instruments, Италия). Предварительно препарат инкубируют в течение 5 минут в фосфатном буфере.
Концентрация 5,5′-дитио-бис (2-нитробензойной кислоты) в одном препарате составляет 0,16 М, BuChE - 0,03 U.
Активность препарата прямо пропорциональна скорости ферментативного гидролиза S-BuCh-I. Скорость ферментативного гидролиза S-BuCh-I определяют по методу Эллмана.
Внесение в состав препарата 5,5′-дитио-бис (2-нитробензойной кислоты) не изменяет активности иммобилизованной BuChE (фиг.1). Активность препарата, содержащего совместно иммобилизованные в крахмальный гель бутирилхолинэстеразу и 5,5′-дитио-бис (2-нитробензойную кислоту), соответствует активности растворимого фермента. Таким образом, в процессе иммобилизации с индикатором в крахмальный гель фермент сохраняет 100% активности.
Пример 2.
Иммобилизацию BuChE и индикатора на тиоловую группу в крахмальный гель проводят способом, аналогичным примеру 1. К 10 мл охлажденного до 31-35°C геля вносят растворы с различным содержанием BuChE и 0,56 M раствор 5,5′-дитио-бис (2-нитробензойной кислоты). Дозируют полученную смесь по 25 мкл на гидрофобную поверхность с помощью автоматической станции epMotion 5075, высушивают при температуре 8°C в течение 24 часов.
Получают препараты, содержащие 0,003 U, 0,006 U, 0,015 U, 0,03 U, 0,05 U, 0,06 U активности BuChE, и препараты, содержащие помимо BuChE также индикатор на тиоловую группу. Концентрация 5,5'-дитио-бис (2-нитробензойной кислоты) в одном препарате составляет 0,16 М. Активность полученных препаратов определяют способом, аналогичным примеру 1.
Активность многокомпонентного иммобилизованного ферментного препарата, полученного на основе крахмального геля, зависит от количества фермента в препарате (фиг.2). Активности полученных препаратов находятся в интервале от 0,012 до 0,085 усл.ед. и составляют не менее 80% от активности бутирилхолинэстеразы, иммобилизованной без индикатора.
Пример 3.
Иммобилизованный ферментный препарат, на основе желатинового геля, готовят следующим образом: раствор бутирилхолинэстеразы (BuChE) готовят на 0,05 М фосфатном буфере pH 7,9-8,0. Раствор серосодержащего бутирилтиохолина йодистого (S-BuC-I) готовят на дистиллированной воде. Раствор 5,5′-дитио-бис (2-нитробензойной кислоты) готовят на 0,05 М фосфатном буфере pH 7,9-8,0. Навеску 0,187 г желатина помещают в 10 мл 0,05 М фосфатный буфер pH 7,9-8,0, интенсивно перемешивают и оставляют на 30 мин. Затем полученную смесь нагревают до 80°C. Полученную смесь охлаждают до 31-35°C, затем вносят 100 мкл раствора BuChE, содержащего 12,25 ед. активности фермента, и 300 мкл 0,56 М раствора 5,5′-дитио-бис (2-нитробензойной кислоты). Дозируют полученную смесь по 25 мкл на гидрофобную подложку с помощью автоматической станции epMotion 5075, высушивают при температуре 8°C в течение 24 часов. Ферментный препарат активируют добавлением 100 мкл 0,12 мМ раствора S-BuCh-I. Изменение оптической плотности регистрируют при 412 им в течение 5 минут на спектрофотометре UVIKON 943 A (Contron Instruments, Италия). Предварительно препарат инкубируют в течение 5 минут в фосфатном буфере.
Концентрация 5,5′-дитио-бис (2-нитробензойной кислоты) в одном препарате составляет 0,16 М, BuChE - 0,03 U. Активность ферментного препарата прямо пропорциональна скорости ферментативного гидролиза S-BuCh-I. Скорость ферментативного гидролиза S-BuCh-I определяют по методу Эллмана.
Внесение в состав препарата 5,5'-дитио-бис (2-нитробензойной кислоты) не приводит к значительному изменению активности BuChE (фиг.3). Активность полученного препарата составляет не менее 80% от активности растворимой бутирилхолинэстеразы.
Пример 4.
Иммобилизацию BuChE и индикатора тиоловых групп в желатиновый гель проводят способом, аналогичным примеру 3. К 10 мл охлажденного до 31-35°C желатинового геля вносят растворы с различным содержанием BuChE и 0,56 М раствор 5,5′-дитио-бис (2-нитробензойной кислоты). Дозируют полученную смесь по 25 мкл на гидрофобную поверхность с помощью автоматической станции epMotion 5075, высушивают при температуре 8°C в течение 24 часов.
Получают препараты, содержащие индикатор тиоловых групп и 0,003 U, 0,006 U, 0,015 U, 0,03 U, 0,05 U, 0,06 U. Концентрация 5,5'-дитио-бис (2-нитробензойной кислоты) в одном препарате составляет 0,16 M. Активность полученных препаратов определяют способом, аналогичным примеру 1.
На основе желатинового геля получают препараты активного фермента (фиг.4). Активность иммобилизованных препаратов на основе желатинового геля зависит от количества включенного в их состав фермента.
Пример 5.
Иммобилизацию BuChE и индикатора тиоловых групп в крахмальный гель проводят способом, аналогичным примеру 1. К 10 мл охлажденного до 31-35°C геля вносят раствор BuChE, содержащий 44 U и 0,56 М раствор 5,5′-дитио-бис (2-нитробензойной кислоты). Дозируют полученную смесь по 25 мкл на гидрофобную поверхность, высушивают при температуре 8°C в течение 24 часов.
Концентрация 5,5′-дитио-бис (2-нитробензойной кислоты) в одном препарате составляет 0,16 М, BuChE - 0,11 U.
Ферментный препарат активируют добавлением 100 мкл 120·10-3 М раствора S-BuCh-I. Изменение оптической плотности регистрируют при 412 нм в течение 5 минут на спектрофотометре UVIKON 943 A (Contron Instruments, Италия) при температуре 25°C. Предварительно препарат инкубируют в течение 5 минут в фосфатном буфере.
Введение в состав индикатора тиоловых групп не влияет на активность фермента и обеспечивает сохранение активности в течение года (фиг.5).
Пример 6.
Иммобилизацию BuChE и индикатора тиоловых групп в желатиновый гель проводят способом, аналогичным примеру 3. К 10 мл охлажденного до 31-35°C геля вносят раствор BuChE, содержащий 44 U и 0,56 М раствор 5,5′-дитио-бис (2-нитробензойной кислоты). Дозируют полученную смесь по 25 мкл на гидрофобную поверхность, высушивают при температуре 8°C в течение 24 часов.
Концентрация 5,5′-дитио-бис (2-нитробензойной кислоты) в одном препарате составляет 0,16 М, BuChE - 0,11 U.
Ферментный препарат активируют добавлением 100 мкл 0,12 мМ раствора S-BuCh-I. Изменение оптической плотности регистрируют при 412 нм в течение 5 минут на спектрофотометре UVIKON 943 A (Contron Instruments, Италия) при температуре 25°C. Предварительно препарат инкубируют в течение 5 минут в фосфатном буфере.
Введение в состав индикатора тиоловых групп не влияет на активность фермента и обеспечивает сохранение активности в течение года (фиг.6).
Пример 7
Иммобилизацию BuChE и индикатора тиоловых групп в крахмальный гель проводят способом, аналогичным примеру 1. К 10 мл охлажденного до 31-35°C геля вносят раствор BuChE, содержащий 44 U и 0,56 М раствор 5,5′-дитио-бис (2-нитробензойной кислоты). Дозируют полученную смесь по 25 мкл на гидрофобную поверхность, высушивают при температуре 8°C в течение 24 часов.
Концентрация 5,5′-дитио-бис (2-нитробензойной кислоты) в одном препарате составляет 0,16 М, BuChE - 0,11 U.
Определяют чувствительность препарата к действию пиримифосметила. Для измерения скорости изменения оптической плотности в кювету спектрофотометра UVIKON 943 A (Contron Instruments, Италия) вносят один диск препарата, 1,8 мл дистиллированной воды и 100 мкл раствора пиримифосметила и инкубируют в течение 5 минут. Ферментный препарат активируют добавлением 100 мкл 120·10-3 М раствора S-BuCh-I. Изменение оптической плотности регистрируют при 412 нм в течение 10 минут при температуре 25°C.
Зависимость скорости гидролиза S-BuCh-I препарата от концентрации пиримифосметила представлена на фиг.7.
Заявляемое изобретение является дозированным препаратом, предназначенным для проведения одного анализа, и может использоваться в лабораторных и полевых условиях. Препарат предназначен для анализа токсичности различных сред, в том числе определения качества природных, сточных вод и водных растворов; определения токсичности промышленных и бытовых отходов, водных вытяжек из почвы и донных осадков; оценки токсичности воздушной среды; определения наличия вредных веществ в продукции пищевой промышленности и сельского хозяйства.
Дополнительное внесение в состав препарата индикатора тиоловых групп 5,5′-дитио-бис (2-нитробензойной кислоты) позволяет улучшить характеристики препарата путем повышения точности измерений активности холинэстеразы, существенно упростить проведение анализа и сократить время его проведения.
Таким образом, использование заявляемого изобретения позволяет упростить процедуры иммобилизации фермента, увеличить время хранения ферментного препарата без потери активности более одного года, повысить точность измерений активности холинэстеразы, в частности при проведении длительных анализов, а также существенно упростить анализ, сократить время его проведения и уменьшить его стоимость.
1. Способ приготовления ферментного препарата на основе иммобилизованной бутирилхолинэстеразы, включающий приготовление крахмального или желатинового геля в фосфатном буфере pH 7,9-8,0, охлаждение геля до 31-35ºC, смешивание буферного раствора бутирилхолинэстеразы и буферного раствора индикатора тиоловых групп 5,5'-дитио-бис(2-нитробензойной кислоты) с концентрацией 0,56 Μ с гелем, дозирование на гидрофобную подложку, высушивание при температуре 8ºC.
2. Ферментный препарат для определения карбаматов и фосфорорганических соединений, полученный способом по п. 1.