Пробиотический штамм бифидобактерий
Иллюстрации
Показать всеГруппа изобретений относится к биотехнологии. Предложен штамм Bifidobacterium longum NCIMB 41676, обладающий иммуномодулирующим действием. Указанный штамм применяют в качестве противоинфекционного пробиотического штамма. Предложен также пробиотический состав, содержащий указанный штамм и носитель для орального приема. Предложено также применение состава в качестве усилителя когнитивных функций для профилактики расстройств центральной нервной системы, таких, как болезнь Альцгеймера, шизофрения и/или незначительные когнитивные расстройства. Как вариант, применяют состав для профилактики воспаления, связанного с ожирением, для профилактики нарушений метаболизма, связанных с ожирением. Группа изобретений обеспечивает повышение уровня противовоспалительного цитокина IL-10 и понижение уровня провоспалительных цитокинов, уменьшение индуцируемой липополисахаридами активности NfkB. 6 н. и 31 з.п. ф-лы, 16 ил., 6 табл., 8 пр.
Реферат
Область техники, к которой относится изобретение
Пробиотический штамм АН 1714 бифидобактерий обладает значительными иммуномодулирующими свойствами при оральном потреблении. Штамм может быть полезен в качестве иммуномодулирующего биотерапевтического средства.
Уровень техники
Изобретение относится к штамму бифидобактерий (Bifidobacterium) и его использованию в качестве пробиотических бактерий, в частности в качестве иммуномодулирующего биотерапевтического вещества.
Механизмы защиты желудочно-кишечного тракта человека от его колонизации кишечными бактериями исключительно сложны и включают иммунные и неиммунные взаимодействия (1). Врожденные защитные механизмы включают низкий рН желудка, желчные соли, перистальтику, муциновые слои и антимикробные вещества и составы, такие, как лизоцим (2). Иммунные механизмы включают специализированные лимфоидные образования, подстилающие М-клетки (называемые также комплексами Пейера), распределенные по всей тонкой и прямой кишке (3). Люминальные антигены, присутствующие в данных местах, стимулируют развитие субпопуляций Т- и В-клеток с образованием цитокиновых сетей и секрецию антител в желудочно-кишечный тракт (4). Кроме того, антигены могут попадать через эпителиальные клетки к интраэпителиальным лимфоцитам и к иммуноцитам находящейся под ними собственной пластины слизистой оболочки (5). Таким образом, человек тратит значительные силы на иммунную защиту желудочно-кишечного тракта. Поскольку слизистая оболочка кишечника является самой большой поверхностью, посредством которой человек контактирует с окружающей средой, ему необходимы специальные механизмы, посредством которых регулируется иммунный ответ на 100 тонн пищи, которая проходит через желудочно-кишечный тракт в течение среднего времени жизни человека. Кроме того, кишечник населяют более 500 видов бактерий, концентрация которых в прямой кишке составляет 1011-1012/г. В связи с этим регулирующие механизмы должны быть способны различать непатогенные бактерии, нормально живущие в кишечнике, от нашествий патогенов, которые могут вызвать серьезные проблемы у хозяина. Кишечная флора активно участвует в защите хозяина, борясь с попадающими через пищеварительную систему потенциально патогенными микроорганизмами.
Бактерии, присутствующие в желудочно-кишечном тракте человека, могут вызывать воспалительные процессы. Некоторые болезненные состояния, связанные с воспалением кишечника, могут быть вызваны аберрантными иммунными реакциями на собственную микрофлору. Антигены, ассоциированные с нормальной микрофлорой, как правило, не должны вызывать иммунного ответа, и нарушение такой толерантности является основным механизмом воспаления слизистой оболочки кишечника (6). О нарушении нормальной толерантности свидетельствуют, в частности, повышенные уровни антител, направленных против собственной флоры кишечника, у пациентов с болезнью воспаленного кишечника (IBD).
Настоящее изобретение относится к штамму бифидобактерий, который, как было нами показано, обладает иммуномодулирующим эффектом за счет регулирования уровней цитокинов или за счет антагонистической активности, исключающей вызывающие воспалительные процессы микроорганизмы из желудочно-кишечного тракта.
Сущность изобретения
В настоящем изобретении предлагается выделенный штамм бифидобактерий NCIMB 41676.
Штамм бифидобактерий может быть в форме живых клеток. Штамм бифидобактерий может быть в форме не живых клеток. Бифидобактерии могут быть получены из ткани толстой кишки здорового человека путем биопсии. Штамм бифидобактерий может обладать значительным иммуномодулирущим действием при его оральном потреблении человеком.
В настоящем изобретении предлагается также состав, содержащий упомянутый штамм бифидобактерий. Состав может дополнительно содержать пробиотический материал. Состав может дополнительно содержать пребиотический материал. Состав может дополнительно содержать носитель для орального приема. Носитель для орального приема может быть одним из фармацевтически приемлемых носителей, таким, как, например, капсула, таблетка, порошок. Носителем для орального приема может быть также пищевой продукт, такой, как, например, сквашенное молоко, йогурт, замороженный йогурт, сухое молоко, концентрированное молоко, сырная паста, заправки или напитки. Состав может дополнительно содержать белок и/или пептид, в частности, белки или пептиды, богатые на глютамин/глутамат, липид, углеводород, витамин, минерал и/или микроэлемент. Штамм бифидобактерий может содержаться в количестве более 106 КОЕ на грамм состава. Состав может дополнительно содержать адъювант. Состав может дополнительно содержать бактериальный компонент. Состав может дополнительно содержать лекарственное средство. Состав может дополнительно содержать смесь биологических компонентов. Состав может быть использован для протоколов иммунизации и вакцинации.
В настоящем изобретении предлагаются также штамм бифидобактерий или содержащий его состав, которые могут использоваться в продуктах питания.
В настоящем изобретении предлагаются также штамм бифидобактерий или содержащий его состав, которые могут использоваться в качестве лекарственного средства.
В настоящем изобретении предлагаются также штамм бифидобактерий или содержащий его состав, которые могут использоваться для профилактики и/или лечения нежелательных воспалительных процессов.
В настоящем изобретении предлагаются также штамм бифидобактерий или содержащий его состав, которые могут использоваться для профилактики и/или лечения нежелательных воспалительных процессов желудочно-кишечного тракта, такие, как, например, воспалительные заболевания кишечника, включая болезнь Крона, язвенный колит, синдром раздраженного кишечника; паучит; или постинфекционный колит.
В настоящем изобретении предлагаются также штамм бифидобактерий или содержащий его состав, которые могут использоваться для профилактики и/или лечения новообразований желудочно-кишечного тракта.
В настоящем изобретении предлагаются также штамм бифидобактерий или содержащий его состав, которые могут использоваться для профилактики и/или лечения системных заболеваний, таких, как ревматоидный артрит.
В настоящем изобретении предлагаются также штамм бифидобактерий или содержащий его состав, которые могут использоваться для профилактики и/или лечения аутоиммунных нарушений, вызванных нежелательными воспалительными процессами.
В настоящем изобретении предлагаются также штамм бифидобактерий или содержащий его состав, которые могут использоваться для профилактики и/или лечения раковых заболеваний, вызванных нежелательными воспалительными процессами.
В настоящем изобретении предлагаются также штамм бифидобактерий или содержащий его состав, которые могут использоваться для профилактики раковых заболеваний.
В настоящем изобретении предлагаются также штамм бифидобактерий или содержащий его состав, которые могут использоваться для профилактики и/или лечения диарейных состояний, вызванных нежелательными воспалительными процессами, таких, как, например, диарея, вызванная Clostridium difficile, ротавирусная диарея, постинфекционная диарея или диарея, вызванная возбудителями инфекций, такими, как E.coli.
В настоящем изобретении предлагаются также штамм бифидобактерий или содержащий его состав для приготовления противовоспалительных биотерапевтических средств, используемых для профилактики и/или лечения нежелательных воспалительных процессов.
В настоящем изобретении предлагаются также штамм бифидобактерий или содержащий его состав для приготовления ряда биотерапевтических средств, используемых для коррекции уровня IL-10.
В настоящем изобретении предлагаются также штамм бифидобактерий или содержащий его состав, которые могут использоваться для профилактики и/или лечения воспалительных расстройств, иммунодефицита, болезни воспаленного кишечника, синдрома раздраженного кишечника, раковых заболеваний (в особенности желудочно-кишечного тракта и иммунной системы), диарейных состояний, диареи, вызванной антибиотиками, детской диареи, аппендицита, аутоиммунных нарушений, рассеянного склероза, болезни Альцгеймера, ревматоидного артрита, целиакии, сахарного диабета, состояний при трансплантации органов, бактериальных инфекций, вирусных инфекций, грибковых болезней, пародонтоза, болезней мочеполовой системы, болезней, передающихся половым путем, ВИЧ-инфекции, повторной ВИЧ-инфекции, диареи, связанной с ВИЧ-инфекцией, травм, вызванных хирургическим вмешательством, метастатической болезни, вызванной хирургическим вмешательством, сепсиса, потери веса, анорексии, лихорадочных состояний, кахексии, для заживления ран, при язвах, нарушениях барьерной функции кишечника, аллергии, астме, респираторных заболеваниях, нарушениях кровообращения, ишемической болезни сердца, анемии, нарушениях аппарата свертываемости крови, болезнях почек, расстройствах центральной нервной системы, гепатитах, расстройствах питания, остеопорозе, эндокринных нарушениях, болезнях кожного покрова, псориазе, угрях обыкновенных, панических расстройствах, расстройствах поведения и/или расстройствах, вызванных посттравматическим стрессом.
Штамм бифидобактерий в соответствии с настоящим изобретением может использоваться как антагонистическое средство, исключающее провоспалительные микроорганизмы из желудочно-кишечного тракта.
В настоящем изобретении предлагаются также штамм бифидобактерий или содержащий его состав, которые могут использоваться для приготовления противовоспалительных биотерапевтических средств, предназначенных для снижения уровня провоспалительных цитокинов.
Штамм бифидобактерий в соответствии с настоящим изобретением может использоваться в качестве противоинфекционного пробиотического штамма.
В настоящем изобретении предлагаются также штамм бифидобактерий или содержащий его состав, которые могут использоваться для профилактики и/или лечения биполярной болезни, депрессии, расстройств настроения и/или тревожности.
В настоящем изобретении предлагаются также штамм бифидобактерий или содержащий его состав, которые могут использоваться в качестве селективного усиливающего средства для профилактики и/или лечения расстройств центральной нервной системы, таких, как болезнь Альцгеймера, шизофрения и/или незначительные когнитивные расстройства.
В настоящем изобретении предлагаются также штамм бифидобактерий или содержащий его состав, которые могут использоваться для профилактики и/или лечения воспалительных процессов, вызванных ожирением.
В настоящем изобретении предлагаются также штамм бифидобактерий или содержащий его состав, которые могут использоваться для профилактики и/или лечения нарушений метаболизма, вызванных ожирением.
Предметом настоящего изобретения являются штамм бифидобактерий АН 1714 (NCIMB 41676), а также его мутанты и варианты. Мутант может быть генетически модифицированным мутантом. Вариант может быть естественно встречающимся вариантом бифидобактерий. Предлагается также устойчивый к рифампицину вариант штамма АН1714. Штамм может быть пробиотиком. Штамм может быть в форме биологически чистой культуры.
В настоящем изобретении предлагается также выделенный штамм бифидобактерий NCIMB 41676. Штаммы бифидобактерий могут быть в форме живых клеток. В качестве альтернативы, штаммы бифидобактерий могут быть в форме неживых клеток. Как правило, пробиотические бактерии используются в форме живых клеток. Однако возможно их использование и в форме не живых клеток, например, в виде умерщвленных культуры или составов, содержащих полезные факторы, экспрессируемые пробиотическими бактериями. Умерщвленные культуры могут включать микроорганизмы, убитые под воздействием высокой температуры, экстремальных значений рН, давления или гамма-излучения. При использовании не живых клеток изготовление конечного продукта из них упрощается, они могут быть включены в широкое разнообразие фармацевтических форм, и условия хранения препаратов из них значительно менее жесткие, чем для препаратов, содержащих живые клетки. Так, например, в патенте США 4347240 описано успешное использование убитых высокой температурой клеток штамма Lactobacillus casei YIT 9018 для лечения и/или профилактики роста опухолей.
Штаммы бифидобактерий могут быть выделены из образцов ткани толстой кишки здорового человека, полученных с помощью биопсии. Штаммы бифидобактерий могут обладать значительным иммуномодулирущим действием при их оральном потреблении человеком.
В настоящем изобретении предлагается также состав, содержащий упомянутый штамм бифидобактерий. Состав может включать еще один пробиотический материал. Состав может включать пребиотический материал. Состав предпочтительно включает носитель для орального приема. Носитель для орального приема предпочтительно является одним из фармацевтически приемлемых, таким, как, например, капсула, таблетка, порошок. Носителем для орального приема может быть также пищевой продукт, такой, как, например, кисломолочный продукт, йогурт, замороженный йогурт, сухое молоко, концентрированное молоко, сырные пасты, заправки или напитки. Состав может дополнительно содержать белок и/или пептид, в частности, белки или пептиды, богатые на глютамин/глутамат, липид, углеводород, витамин, минерал и/или микроэлемент. Штамм бифидобактерий может содержаться в составе в количестве более 106 КОЕ на грамм потребляемого состава. Состав предпочтительно включает один или более из следующих компонентов: адъювант, бактериальный компонент, лекарственное средство, смесь биологических компонентов.
В настоящем изобретении предлагается также штамм бифидобактерий или состав для использования в продуктах питания или в качестве лекарственного средства для профилактики и/или лечения нежелательных воспалительных процессов, профилактики и/или лечения нежелательных воспалительных процессов в органах дыхания, таких как, например, астма, профилактики и/или лечения нежелательных воспалительных процессов желудочно-кишечного тракта, таких как, например, воспалительные заболевания кишечника, включая болезнь Крона, язвенный колит, паучит или пост-инфекционный колит, профилактики и/или лечения новообразований желудочно-кишечного тракта, профилактики и/или лечения системных заболеваний, таких, как ревматоидный артрит, профилактики и/или лечения автоиммунных нарушений, вызванных нежелательными воспалительными процессами, профилактики и/или лечения раковых заболеваний, вызванных нежелательными воспалительными процессами, профилактики и/или лечения диарейных состояний, вызванных нежелательными воспалительными процессами, таких, как, например, диарея, вызванная Clostridium difficile, ротавирусная диарея, постинфекционная диарея или диарея, вызванная возбудителями инфекций, такими, как E.coli.
В настоящем изобретении предлагаются также штамм бифидобактерий или состав для приготовления противовоспалительных биотерапевтических средств, используемых для профилактики и/или лечения нежелательных воспалительных процессов. Состав может работать как антагонист, исключающий вызывающие воспаление микроорганизмы из желудочно-кишечного тракта.
В настоящем изобретении предлагаются также штамм бифидобактерий или состав для приготовления противовоспалительных биотерапевтических средств, предназначенных для снижения уровня провоспалительных цитокинов.
В настоящем изобретении предлагаются также штамм бифидобактерий или состав для приготовления противовоспалительных биотерапевтических средств, предназначенных для коррекции уровня IL-10.
Штамм бифидобактерий может использоваться в качестве противоинфекционного пробиотика благодаря его способности противодействовать росту патогенных организмов.
Нами было найдено, что определенные штаммы бифидобактерий обеспечивают иммуномодулирующий эффект in vitro.
Поэтому изобретение имеет большой терапевтический потенциал для профилактики и лечения нарушенных иммунных реакций, в частности, нежелательных воспалительных процессов, таких как астма.
Бифидобактерии являются симбиотическими микроорганизмами. Они были выделены из микрофлоры желудочно-кишечного тракта человека. Иммунная система желудочно-кишечного тракта не дает выраженной реакции на представителей данной микрофлоры, так как иначе возникшая воспалительная реакция разрушила бы также клетки-хозяева и нарушила бы функционирование тканей. Поэтому существуют определенные механизмы, благодаря которым иммунная система может распознавать не патогенных членов семейства желудочно-кишечной микрофлоры и отличать их от патогенных организмов. Это обеспечивает сохранность клеток-хозяев с одной стороны, и поддержание требуемого защитного барьера от патогенной флоры, с другой стороны.
Штамм Bifidobacterium longum АН 1714 был внесен в Национальную коллекцию промышленных и морских бактерий NCIMB (Абердин, Великобритания) 5 ноября 2009 с присвоением ему номера NCIMB 41676.
Bifidobacterium longum может быть генетически модифицированным мутантом или встречающимся в природе вариантом.
Bifidobacterium longum предпочтительно используется в форме жизнеспособных клеток.
В качестве альтернативы, Bifidobacterium longum может использоваться в форме не жизнеспособных клеток.
Предвидится, что штамм бифидобактерий в соответствии с настоящим изобретением может быть назначен животным (включая человека) в подходящей стандартной форме для орального приема, такой как капсулы, микрокапсулы, таблетки, гранулы, порошок, пастилки, пилюли, суппозитории, суспензии и сиропы. Подходящие составы, содержащие штамм бифидобактерий, могут быть изготовлены традиционно применяемыми способами с использованием органических и неорганических добавок. Количество активного ингредиента в составе может быть на уровне, обеспечивающем требуемый терапевтический эффект.
Состав может также включать бактериальный компонент, лекарственное средство или смесь биологических компонентов.
Кроме того, может быть приготовлена вакцина, содержащая штаммы в соответствии с настоящим изобретением, с использованием любого известного подходящего способа, и которая может содержать любой приемлемый по фармацевтическим требованиям носитель или адъювант.
В контексте настоящего описания термины «мутант», «вариант» и «генетически модифицированный мутант» включают штамм бифидобактерий, генетические и фенотипические свойства которого отличаются от соответствующих свойств родительского штамма. Термин «встречающийся в природе вариант штамма Bifidobacterium longum» подразумевает организмы, отобранные в результате селекции из организмов, в которых произошли спонтанные изменения целевых свойств. Намеренные изменения свойств родительского штамма осуществляются обычными генно-инженерными методами (in vitro), такими как разрыв генов, конъюгационный перенос и прочие. Термин «генетическое модифицирование» включает введение экзогенных и/или эндогенных последовательностей ДНК в геном штамма бифидобактерий, например, путем их вставки в геном бактериального штамма посредством векторов на основе плазмидной ДНК или бактериофагов.
Термины «естественные мутации» и «индуцированные мутации» включают изменения по меньшей мере одного основания путем делеции, вставки, обращения или иных изменений ДНК, которые могут приводить к изменению аминокислотной последовательности, кодируемой последовательностью ДНК.
Термины «мутант», «вариант» и «генетически модифицированный мутант» включают также штамм бифидобактерий, который был подвергнут генетическим изменениям, которые накапливаются в геноме в степени, в сущности и по своей природе одинаковой для всех микроорганизмов, и/или генетическим изменениям, которые происходят в результате спонтанных мутаций, приобретений и/или потерь, которые не могут быть получены путем намеренных (in vitro) преобразований генома, но которые могут быть получены путем естественного отбора вариантов и/или мутантов, и которые обеспечивают требуемые преимущества, повышающие жизнеспособность бактерий при воздействии на них агрессивных факторов среды, таких как, например, антибиотики. Мутант может быть создан путем намеренной (in vitro) вставки тех или иных генов в геном, которые принципиально не меняют биохимической функциональности организма, но продукты экспрессии которых могут быть использованы для идентификации или селекции бактерий, например, которые придают устойчивость к антибиотикам.
Сведущим в данной области техники будет понятно, что мутантные или вариантные штаммы бифидобактерий могут быть идентифицированы посредством анализа последовательности их ДНК на гомологию с родительским штаммом. Штаммы бифидобактерий, имеющие высокую степень идентичности последовательности ДНК с родительским штаммом, могут считаться мутантными или вариантными штаммами. Штамм бифидобактерий, имеющий степень идентичности (гомологии) последовательности ДНК соответствующей последовательности родительского штамма, составляющую 96% или более, 97% или более, 98% или более, или 99% или более, может считаться мутантным или вариантным штаммом. Гомологичность последовательностей может быть определена с помощью программы BLAST, общедоступной на сайте http://www.ncbi.nlm.nih,gov/BLAST/.
Мутанты родительского штамма включают также производные штаммы бифидобактерий, имеющие гомологию межгенной спейсерной полинуклеотидной последовательности 16s-23s, составляющую по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% по отношению к соответствующей последовательности родительского штамма. Такие мутанты могут дополнительно содержать мутации ДНК в других последовательностях ДНК бактериального генома.
Краткое описание чертежей
Настоящее изобретение будет более понятным из нижеследующего подробного описания его воплощений, приводимых только в качестве примеров, сопровождаемого прилагаемыми чертежами.
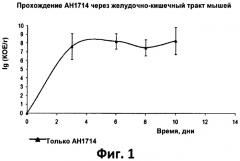
Фиг.1. График, отображающий прохождение В. longum АН 1714 через желудочно-кишечный тракт.
Фиг.2. Фотография В. longum АН 1714, выращенных на агаре с красителем конго красный.
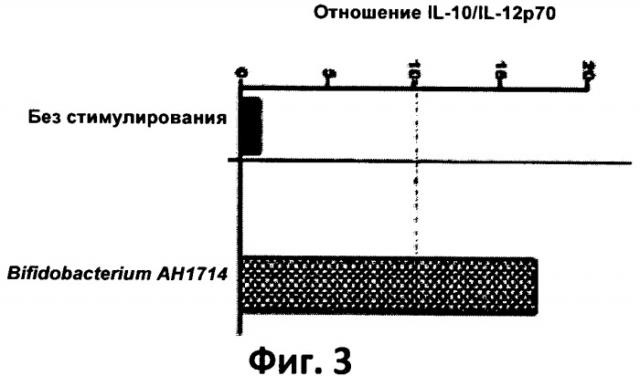
Фиг.3. Столбчатая диаграмма, отображающая отношение экспрессии IL-10:IL-12р70 в мононуклеарах периферической крови, не стимулируемых и стимулируемых штаммом Bifidobacterium longum 1714;
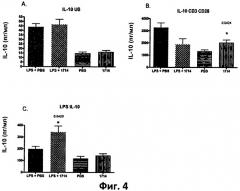
Фиг.4. Столбчатая диаграмма, отображающая уровень IL-10 в спленоцитах, выделенных из мышей, которых кормили штаммом 1714 и его носителем (PBS), при стимуляции липополисахаридами (LPS) in vivo в количестве 1 мг/кг, и без нее. (А) клетки, не стимулированные in vitro, (В) клетки, стимулированные LPS in vitro; (С) клетки, стимулированные antiCD3/CD28 in vitro. Данные представлены в виде среднего значения и среднеквадратичного отклонения.
Фиг.5. Столбчатая диаграмма, отображающая уровень TNF-α в спленоцитах, выделенных из мышей, которых кормили штаммом 1714 и его носителем (PBS), при стимуляции липополисахаридами (LPS) in vivo в количестве 1 мг/кг, и без нее. (А) клетки, не стимулированные in vitro; (В) клетки, стимулированные antiCD3/CD28 in vitro. Данные представлены в виде среднего значения и среднеквадратичного отклонения.
Фиг.6. Столбчатая диаграмма, отображающая уровень IFN-γ в спленоцитах, выделенных из мышей, которых кормили штаммом 1714 и его носителем (PBS), при стимуляции липополисахаридами (LPS) in vivo в количестве 1 мг/кг, и без нее. (А) клетки, не стимулированные in vitro; (В) клетки, стимулированные antiCD3/CD28 in vitro. Данные представлены в виде среднего значения и среднеквадратичного отклонения.
Фиг.7. Столбчатая диаграмма, отображающая уровень IL-12p70 в спленоцитах, выделенных из мышей, которых кормили штаммом 1714 и его носителем (PBS), при стимуляции липополисахаридами (LPS) in vivo в количестве 1 мг/кг, и без нее. (А) клетки, не стимулированные in vitro; (В) клетки, стимулированные antiCD3/CD28 in vitro. Данные представлены в виде среднего значения и среднеквадратичного отклонения.
Фиг.8. Столбчатая диаграмма, отображающая уровни TNF-α (А) и IL-10 (В) в сыворотке, взятой у мышей, которых кормили штаммом 1714 и его носителем (PBS), через 2 часа после стимуляции липополисахаридами (LPS) in vivo в количестве 1 мг/кг. Данные представлены в виде среднего значения и среднеквадратичного отклонения.
Фиг.9. Столбчатая диаграмма, отображающая активность NFkB (в фотонах/с) для селезенки, выделенной из животных, которых кормили плацебо и штаммом 1714, через 3 часа после стимуляции одной дозой липополисахаридов (LPS) в количестве 0,5 мг/мг (** означает р<0.01).
Фиг.10. (А) Столбчатая диаграмма, отображающая активность NFkB (фотонов/с) для целых животных, которых кормили плацебо и штаммом 1714, через 1,5 часа после обработки одной дозой липополисахаридов (LPS) в количестве 0,5 мг/мг; (В) и (С) - представительные изображения целых животных (черно-белое и цветное).
Фиг.11. Столбчатая диаграмма, отображающая время неподвижности мышей после 6-минутного теста на испуг.
Фиг.12. График, отображающий процент времени оцепенения в ответ на контекстные стимулы (Ctx), ассоциирующиеся с испугом, в первый день (приобретение страха), второго дня (память/забывание) и третьего дня (забывание).
Фиг.13. График, отображающий процент времени оцепенения в ответ на информативные стимулы (Cue), ассоциирующиеся с испугом, в первый день (приобретение страха), второго дня (память/забывание) и третьего дня (забывание).
Фиг.14. Столбчатая диаграмма, отображающая количество стеклянных шариков, закопанных мышами в течение 30 минут.
Фиг.15. Столбчатая диаграмма, отображающая изменение температуры тела мышей (ΔТ) после обработки.
Фиг 16. Столбчатая диаграмма, отображающая изменения уровней цитокинов в стимулированных спленоцитах мышей при различном рационе питания.
Подробное описание изобретения
Штамм Bifidobacterium longum АН 1714 был внесен в Национальную коллекцию промышленных и морских бактерий (NCIMB - Абердин, Великобритания) 5 ноября 2009 года с присвоением ему номера NCIMB 41676.
Штамм Bifidobacterium longum UCC35624 был внесен в Национальную коллекцию промышленных и морских бактерий (NCIMB - Абердин, Великобритания) 13 января 1999 года с присвоением ему номера NCIMB 41003.
Примеры
В приведенных ниже примерах содержится подробное описание воплощений настоящего изобретения. Примеры приведены только в иллюстративных целях и не должны рассматриваться как ограничения настоящего изобретения, так как возможно множество их вариаций без отхода от идей и масштабов настоящего изобретения.
Пример 1 - Выделение Bifidobacterium longum АН 1714
Штамм Bifidobacterium longum АН 1714 был выделен из образцов ткани толстой кишки здоровых людей, полученных способом биопсии.
Проводили скрининг различных отделов желудочно-кишечного тракта человека, предварительно намеченных во время колоректального зондирования, на наличие пробиотических бактериальных штаммов. Образцы ткани слизистой оболочки желудочно-кишечного тракта человека собирали в пробирку с солевым раствором и фосфатным буфером (PBS), с добавлением 0,05% цистеина-HCl). Для выделения микроорганизмов, живущих в ткани, использовали тритон Х-100 (0,05%). После этого образцы тканей инкубировали в течение 10 мин. Образцы энергично встряхивали, после чего бактерии видов Lactobacilli и Bifidobacteria, живущие в ткани, разделяли друг от друга путем посева на селективную агарозную среду (агар De Man, Rogosa and Sharpe (MRS) + ванкомицин и агар Wilkins-Chalgren + мупироцин соответственно). Отдельные колонии снимали с агара и для обеспечения их чистоты проводили трехкратный повторный посев штрихом. Для выявления потенциальных бифидобактерий использовали микроскопию, окрашивание по Грамму, каталазный тест и анализ на фруктозу-6 фосфат фосфокетолазу. Выделенные штаммы растворяли в 40%-ном глицерине и хранили при температуре от -20°С до -80°С. Для дополнительной идентификации выделенных штаммов использовали секвенирование межгенной спейсерной области 16S.
После выделения чистого штамма бифидобактерий, обозначенного АН 1714, оценивали его микробиологические характеристики, которые приведены в Таблице 1 ниже.
Бактерии штамма АН 1714 являются грамположительными, каталаза отрицательными, фруктоза-6-фосфат фосфокетолазаположительными бактериями плеоморфной формы, что подтверждает, что они являются бифидобактериями.
| Таблица 1 | |
| Физиохимические характеристики штамма B.longum AH1714 | |
| Характеристики | Штамм B.longum AH1714 |
| Окрашивание по Граму | + |
| Тест на каталазу | - |
| Клеточная подвижность | - |
| F6PPK* | + |
Для дополнительной идентификации выделенных бифидобактерий проводили секвенирование межгенной спейсерной области 16s-23s (далее обозначается так же как IGS) по следующей методике. Из бактерий штамма АН 1714 выделяли ДНК с помощью 100 мкл экстракционного раствора и 25 мкл препарационного раствора для ткани (набор реактивов XNAT2 производства Sigma). Образцы инкубировали в течение 5 мин при комнатной температуре, затем 2 часа при температуре 95°С, после чего добавляли 100 мкл нейтрализующего раствора из того же набора Sigma XNAT2. Определяли количество геномной ДНК в растворе с помощью спектрофотометра Nanodrop. Полученные образцы хранили при 4°С. Проводили полимеразную цепную реакцию с IGS-специфичными праймерами: IGS R 5'-CTGGTGCCAAGGCATCCA-3' (идентификационный №4) и IGS L 5'-GCTGGATCACCTCCTTTCT-3' (идентификационный №3). Реакцию проводили при следующих параметрах циклов: 94°С в течение 4 минут (1 цикл), 94°С в течение 45 секунд, 53°С в течение 45 секунд, 72°С в течение 45 секунд (28 циклов). Реакционная смесь для ПЦР содержала 2 мкл (100 нг) ДНК, набор для ПЦР Red Taq производства Sigma, 0.025 нМ праймеров IGS L и IGS R (MWG Biotech, Германия). Реакции проводили на амплификаторе Biotherma. Для анализа экспрессии IGS продукты ПЦР (в количестве 10 мкл) разделяли в 2% агарозном геле с буфером ТАЕ, окрашенном бромидом этидия, с маркером молекулярного веса (с шагом 100 пар нуклеотидов, производства Roche). Отдельные продукты амплификации, соответствующие отдельным полосам после разделения в геле, очищали с помощью набора реактивов Wizard PCR производства Promeg. Очищенные продукты ПЦР секвенировали с использованием IGS-специфичных праймеров, последовательности которых приведены выше. Расшифрованные последовательности проверяли по базе данных нуклеотидных последовательностей NCBI на гомологию с известными последовательностями с использованием стандартной программы поиска BLAST (http://www.ncbi.nlm.nih.gov/BLAST/). После нахождения наиболее близких последовательностей производили их выравнивание с исследуемыми с помощью программы DNASTAR MegAlign. Полученные последовательности (прямая последовательность IGS, идентификационный номер 1 и обратная последовательность IGS, идентификационный номер 2, - приводятся в списке последовательностей). Поиск по базе данных NCIMB показал, что штамм АН 1714 характеризуется уникальными последовательностями IGS (прямая и обратная), имеющими достаточно высокую степень гомологии с соответствующими последовательностями бактерий Bifidobacterium longum.
Для определения «штрихкода» ПЦР для штамма АН 1714 проводили ПЦР с использованием праймеров BOX (8). Реакции проводили при следующих параметров циклов 94°С в течение 7 минут (1 цикл); 94°С в течение 1 минуты, 53°С в течение 45 секунд, 65°С в течение 8 минут (30 циклов) и 65°С в течение 16 минут. Реакционная смесь содержала 50 нг ДНК, набор для ПЦР Sigma Red Taq и 0,03 нМ праймера BOXA1R (5'- CTACGGCAAGGCGACGCTGACG-3') (идентификационный номер 5) (MWG Biotech, Германия). Реакции проводили на амплификаторе Biotherma. Продукты ПЦР (в количестве 10 мкл) разделяли в 3% агарозном геле с маркером молекулярного веса (с шагом 100 пар нуклеотидов, производства Roche) и фотографировали.
Чувствительность к антибиотикам
Характеристики чувствительности к антибиотикам штамма В. longum АН 1714 определяли методом дисков. Культуру выращивали в подходящей бульонной питательной среде в течение 48 часов, и 100 мкл среды с выросшими бактериями наносили на агар-содержащую среду. Поверх на агар укладывали диски, содержащие антибиотики в известных концентрациях. После инкубации в течение 1-2 дней при температуре 37°С в анаэробных условиях осматривали образцы и определяли чувствительность штамма к антибиотикам.
| Таблица 2 | ||
| Чувствительность к антибиотикам | ||
| Антибиотик | Группа | Чувствительность штамма АН1714 |
| Пенициллин G | β-лактамовый антибиотик | Ч |
| Ампициллин | β-лактамовый антибиотик | Ч |
| Метициллин | β-лактамовый антибиотик | С |
| Стрептомицин | Аминогликозидный антибиотик | У |
| Гентамицин | Аминогликозидный антибиотик | С |
| Ванкомицин | Гликопептидный антибиотик | Ч |
| Налидиксовая кислота | Синтетический хинолоновый антибиотик | У |
| Новобиоцин | Аминокумариновый антибиотик | Ч |
| Тетрациклин | Поликетидный антибиотик | Ч |
| Триметоприм/ сульфаметоксазол | Сульфонамидный антибиотик | У |
| Триметоприм | У | |
| Рифампицин | Рифамициновый антибиотик | Ч |
| Хлорамфеникол | Ч | |
| Метронидазол | Нитроимидазоловый антибиотик | С |
| Мупироцин | У | |
| У = устойчивый (размер зон не более 14 мм) | ||
| С = средне-чувствительный (размер зон 15-19 мм) | ||
| Ч = чувствительный (размер зон не менее 20 мм) |
Прохождение через желудочно-кишечный тракт
Чтобы определить, могут ли бактерии штамма Bifidobacterium longum АН 1714 выживать при низких значениях рН, соответствующих значениям рН в желудке, собирали бактериальные клетки свежевыращенной в течение ночи культуры, дважды промывали в фосфатном буфере (рН 6,5) и ресуспендировали в бульоне TPY, рН которого был доведен до 2,5 (с помощью 1М раствора НСl). Клетки инкубировали при температуре 37°С и определяли их выживание через 5, 30, 60 и 120 минут методом чашечного подсчета. АН1714 хорошо выживали в течение 5 мин при рН 2,5, но спустя 30 минут жизнеспособных клеток не обнаруживалось.
После выхода из желудка клетки возможного пробиотика подвергаются воздействию солей желчной кислоты в тонком кишечнике. Для определения способности штамма В. longum АН1714 выживать под воздействием солей желчной кислоты культуры высевали штрихом на чашках с агаром TPY с добавлением 0,3%, 0,5%, 1%, 2%, 5%, 7,5% и 10% свиной желчи (вес/объем). Рост В. longum АН1714 наблюдали на чашках, содержавших вплоть до 0,5% желчи.
| Таблица 3 | ||||||||
| Рост АН1714 в присутствии свиной желчи (эксперимент проводился дважды) | ||||||||
| % свиной желчи (вес/объем) | 0,0 | 0,3 | 0,5 | 1,0 | 2,0 | 5,0 | 7,5 | 10,0 |
| Выживание штамма АН 1714 | +++ | ++ | + | - | - | - | - | - |
| +++ = очень хороший рост (100%) | ||||||||
| ++ = хороший рост (66%) | ||||||||
| + = плохой рост (33%) | ||||||||
| - = отсутствие роста (0%) |
Способность В. longum АН 1714 проходить через желудочно-кишечный тракт изучали на мышах, не содержавших бактерий. Мыши потребляли 1×10 бактерий АН1714 в день и в их фекалиях определяли количество скормленных им бактерий. Обнаружение бактерий АН1714 облегчалось тем, что для кормления использовались спонтанно-вариантные бифидобактерии, устойчивые к рифампицину. Только они давали рост культур на среде RCA+цистеин с добавлением рифампицина. Образцы фекалий собирали ежедневно и определяли в них содержание В. longum АН 1714, в результате чего был получен график прохождения бактерий через желудочно-кишечный тракт (см. фиг.1).
Антимикробное действие
Для оценки антимикробной активности штамма В. longum АН 1714 против показательных культур и выявления, вызвана ли антимикробная активность выработкой кислоты, бактерии АН 1714 выращивали в среде MRS (с добавлением 0,05% цистеин-HCl). 2 мкл культуры АН 1714 точечно наносили на агар и инкубировали в течение 24 часов. Показательные микроорганизмы выращивали в средах: TSB (E.coli и Salmonella typhimurium), бруцелловый бульон (Campylobacter jejuni) и RCM (улучшенная среда для клостридий - Clostridium difficile). Расплавленную среду, содержащую 2% (объем/объем) ночной культуры показательных микроорганизмов выливали в виде второго слоя поверх слоя агара с точечно нанесенными пробиотическими культурами, после чего проводили выращивание культур в течение ночи. Чашки инкубировали при 37°С и прочих условиях, подходящих для роста показательной культуры, и записывали показатели