Способ профилактики у детей старше 5 лет формирования частично контролируемой бронхиальной астмы, обусловленной воздействием марганца и ванадия
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к педиатрии, и может быть использовано для профилактики формирования частично контролируемой бронхиальной астмы, обусловленной воздействием марганца и ванадия, у детей старше 5 лет, проживающих на индустриально развитых территориях. Для этого на фоне базисной терапии дополнительно вводят «Энтеросгель» за 1,5-2 часа до или через 2 часа после еды или после приема лекарственных средств детям в возрасте от 5 до 10 лет - 15 г 2 раза в сутки, от 11 до 15 лет - 15 г 3 раза в сутки курсом 7 дней; «Кудесан» перорально во время приема пищи в первой половине дня в возрастной дозировке: от 5 до 7 лет - 10-16 капель (15-24 мг), от 8 до 15 лет - 16-20 капель (24-30 мг), предварительно растворив в небольшом количестве кипяченой воды или ином напитке комнатной температуры, один раз в сутки курсом 30 дней; «Пантогам» перорально через 15-20 минут после еды, в возрастной дозировке: от 5 до 7 лет - по 500 мг 2 раза в день, от 8 до 15 лет - по 500 мг 3 раза в день курсом 30 дней, причем курс сочетанного применения указанных лекарственных средств осуществляют 2 раза в год. Способ позволяет значительно снизить риск возникновения частично контролируемых форм бронхиальной астмы за счет выраженного положительного синергизма лекарственных средств. 4 табл.
Реферат
Изобретение относится к области медицины и может быть использовано для предупреждения развития у детей частично контролируемых форм бронхиальной астмы, обусловленных контаминацией биосред тяжелыми металлами: марганцем и ванадием.
В последнее время дополнительно к классификации бронхиальной астмы (далее - БА) по степени тяжести врачи начали широко использовать критерии степени контроля над заболеванием. При этом выделяют: контролируемую, частично контролируемую и неконтролируемую бронхиальную астму (http://www.astmatest.ru/what_is_asthma.html).
При формировании частично контролируемой бронхиальной астмы наблюдается зона недостаточного контроля над заболеванием, и при этом лечение недостаточно эффективно, так как наблюдаются отдельные симптомы астмы, либо ночные, либо дневные (более двух эпизодов в неделю), возможно, с ограничением повседневной активности, может быть снижена пиковая скорость выдоха. В этой ситуации необходимо выяснить причины и длительность появления симптомов астмы и рассмотреть возможность увеличения объема терапии для достижения лучшего контроля.
Актуальность предлагаемого способа определяется широкой распространенностью бронхиальной астмы в детском возрасте на территориях с повышенной нагрузкой химическими веществами промышленного происхождения. Бронхиальная астма у детей по своей распространенности, тяжести и особенностям течения, несмотря на огромные успехи в ее диагностике и лечении, продолжает оставаться одной из самых актуальных проблем педиатрии. Указанное заболевание за последние полвека продолжает расти и показатель ее распространенности у детей на территории России достигает в настоящее время 8-10%. В связи с этим на современном этапе проблема совершенствования профилактики частично контролируемых форм бронхиальной астмы у детей особенно актуальна, так как клинически такую астму вылечить, даже высокотехнологичными методами, значительно сложнее, чем предупредить.
Важны вопросы разработки и внедрения эффективной профилактики частично контролируемой бронхиальной астмы у детей, проживающих в условиях повышенной химической техногенной нагрузки. Научно доказано, что промышленные токсиканты, особенно тяжелые металлы - марганец, ванадий, вносят существенный негативный вклад в трансформацию инфекционно-аллергических заболеваний органов дыхания.
Химические вещества I-II классов опасности неорганической природы оказывают прямое системное токсическое и ферментопатологическое воздействие на детей с респираторными аллергозами. Длительное ирритативное действие на барьерные ткани поддерживает неспецифическое воспаление в бронхо-легочной системе, вызывая формирование иммунопатологических реакций - основы развития бронхиальной астмы. После соединения с белками крови тяжелые металлы сами становятся истинными аллергенами, и вызывают дополнительную специфическую сенсибилизацию у детей, потенцируют развитие аутоиммунных процессов в слизистой оболочке бронхов с последующим формированием резистентности к стандартному лечению. Кроме того, промышленные токсиканты повышают иммунологическую агрессивность природных аллергенов.
В настоящее время, в соответствии с рекомендациями GINA (GINA - Global Initiative for Asthma, пересмотр 2011 г.) «Глобальная стратегия лечения и профилактики бронхиальной астмы», выбор базисной медикаментозной терапии зависит от текущего уровня контроля БА и терапии пациента. С точки зрения экспертов GINA, БА считается контролируемой при соблюдении следующих критериев: количество дневных симптомов менее 2 эпизодов в неделю, отсутствие ночных симптомов и пробуждений, ограничений активности, обострений, потребности в препаратах неотложной помощи, наличие не более двух эпизодов БА в неделю, при этом показатели объема форсированного выдоха за первую секунду (ОФВ1) или пиковой скорости выдоха (ПСВ) находятся в пределах нормальных величин.
Для частично контролируемого течения заболевания достаточно наличия любого из вышеперечисленных проявлений БА в течение недели при снижении значений ОФВ 1 и ПСВ на 20% и более от должных для данного пациента.
Наличие трех и более признаков частично контролируемой БА в течение недели характерно для неконтролируемой формы болезни [Чучалин А.Г. (ред.) Глобальная стратегия лечения и профилактики бронхиальной астмы, с.16. М.: Атмосфера; 2006].
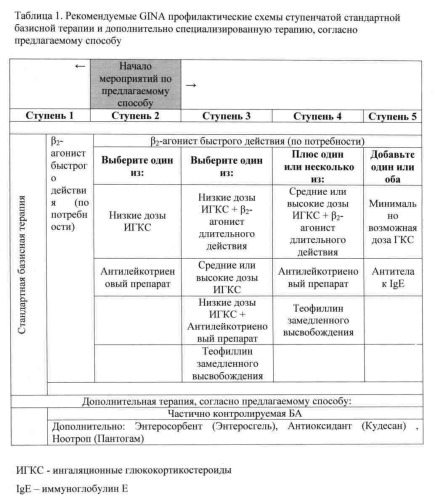
В качестве базисной стандартной терапии при частично неконтролируемой БА рекомендуется назначать комбинацию низких доз ингаляционных глюкокортикостероидов (ИГКС) и β2-агониста длительного действия, альтернативой является монотерапия высокими дозами ИГКС. Кроме того, еще одним вариантом терапии является комбинация низких доз ИГКС с антилейкотриеновым препаратом [Чучалин А.Г. (ред.) Глобальная стратегия лечения и профилактики бронхиальной астмы, с.32. М.: Атмосфера; 2006].
Однако рекомендуемая и проводимая стандартная базовая терапия не всегда является достаточной, и не у всех больных удается добиться контроля над симптомами заболевания, применяя общепринятые схемы лечения глюкокортикостероидами. Существуют фенотипические варианты заболевания, обуславливающие введение концепции «астмы, плохо поддающейся лечению». В свою очередь возраст - один из наиболее значимых критериев, определяющих фенотип бронхиальной астмы у детей. Выбор базовой терапии, зачастую, основывается только на мнении врача, которое достаточно субъективно, его предпочтениях, наличии опыта работы с определенной группой лекарственных средств. Поэтому в ряде случаев не обеспечивается полный контроль над БА, что чревато переходом ее в частично контролируемую БА или даже в неконтролируемую форму БА, особенно под воздействием химических токсикантов среды обитания.
Из патента РФ №2445082 известен способ лечения и профилактики формирования частично контролируемой бронхиальной астмы, согласно которому пациенту проводят курс базисной терапии GINA сочетанным приемом лекарственных средств: Сальметерола и Флутиказона в соответствии с возрастными дозировками.
Из заявки на патент РФ 95111608 также известен способ профилактики бронхиальной астмы, включающий базисную терапию и дополнительно к ней в качестве профилактического средства назначают, как добавку к пище, напиток янтарной кислоты или ее соли, в частности монокалиевую и кальциевую, по 100 мг 1-3 раза в день. При этом предупреждается или уменьшается частота и тяжесть астматических приступов, облегчается их купируемость.
Данный известный способ эффективен только в отношении неосложненной БА на ранних стадиях ее развития. Основным недостатком данного способа является также и то, что у больных БА всегда присутствует аутосенсибилизация, которая может привести к появлению аллергической реакции на янтарную кислоту или ее соль и вызвать обострение основного заболевания.
Также из патента РФ №2459622 известен способ профилактики бронхиальной астмы у детей с рецидивирующим обструктивным бронхитом в условиях повышенной контаминации биосред тяжелыми металлами и альдегидами, путем назначения в период ремиссии сочетанного приема следующих лекарственных средств: Сингуляр+Энтеросгель+Полиоксидоний, причем курс сочетанного применения указанных лекарственных средств осуществляют не менее 2 раз в год. Однако этот известный способ предназначен для профилактики обострения первичной БА и не предназначен для профилактики формирования частично контролируемой БА.
При этом из уровня техники не были выявлены известные способы профилактики у детей развития частично контролируемых форм БА, ассоциированных с внешнесредовым воздействием марганца и ванадия, поэтому сделать выбор ближайшего аналога к заявляемому объекту не представляется возможным.
Технический результат, достигаемый предлагаемым изобретением, заключается в обеспечении эффективности предупреждения развития у детей старше 5 лет частично контролируемых форм бронхиальной астмы, связанных с воздействием химических токсикантов - марганца и ванадия, поступающих из атмосферного воздуха, и повышения резистентности организма к указанным токсикантам.
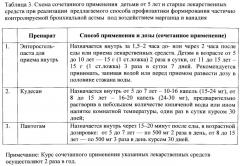
Указанный технический результат достигается предлагаемым способом профилактики у детей старше 5 лет формирования частично контролируемой бронхиальной астмы, обусловленной воздействием марганца и ванадия, путем назначения лекарственных средств, согласно базисной ступенчатой терапии, при этом осуществляют дополнительное сочетанное применение детьми следующих лекарственных средств: «Энтеросгель» за 1,5-2 часа до или через 2 часа после еды или после приема лекарственных средств детям в возрасте от 5 до 10 лет - 15 г 2 раза в сутки, от 11 до 15 лет - 15 г 3 раза в сутки курсом 7 дней; «Кудесан» перорально во время приема пищи в первой половине дня в возрастной дозировке: от 5 до 7 лет - 10-16 капель (15-24 мг), от 8 до 15 лет - 16-20 капель (24-30 мг), предварительно растворив в небольшом количестве кипяченой воды или ином напитке комнатной температуры, один раз в сутки курсом 30 дней; «Пантогам» перорально через 15-20 минут после еды, в возрастной дозировке: от 5 до 7 лет - по 500 мг 2 раза в день, от 8 до 15 лет - по 500 мг 3 раза в день курсом 30 дней, причем курс сочетанного применения указанных лекарственных средств осуществляют 2 раза в год.
Поставленный технический результат достигается за счет следующего.
Для понимания существа вопроса, следует пояснить. По результатам идентификации опасности установлено, что на территориях с превышением гигиенических нормативов (предельно-допустимая концентрация - ПДКс.с содержания марганца и ванадия в атмосферном воздухе) риск развития заболеваний органов дыхания, в том числе бронхиальной астмы, превышает приемлемый уровень (индекс опасности развития заболеваний органов дыхания - от 1,34 до 17,22). Вклад ванадия в хронический индекс опасности развития патологии органов дыхания, в том числе БА, достигает 21-51%, марганца - 29-59%. Установлено наличие достоверной причинно-следственной связи между повышенным содержанием марганца и ванадия в атмосферном воздухе и возникновением у детей аллергических заболеваний органов дыхания (показатель отношения шансов OR=22,04; его доверительный интервал DI=2,25-177,19), при этом риск возникновения данной патологии в 2,6 раза выше, чем у детского населения, находящегося вне зоны влияния исследуемых факторов.
Повышенная частота регистрации БА у детей в условиях несоответствия качества атмосферного воздуха гигиеническим нормативам обусловлена особенностями воздействия марганца и ванадия на функционирование иммунной системы и органов дыхания. После соединения с белками крови марганец и ванадий приобретают свойства аллергенов, вызывают дополнительную специфическую сенсибилизацию, повышают иммунологическую агрессивность причинно-значимых аллергенов (бытовых, пыльцевых, пищевых).
Содержание марганца и ванадия в крови, в концентрациях в 1,5 раза и более превышающие референтные, активирует экспрессию эпителиоцитами бронхиального дерева M-холинорецепторов, повышает функциональной активности лейкотриеновых, H1-гистаминовых и адренергических рецепторов, что усиливает проявления бронхиальной обструкции у детей.
Развитие специфического иммунного воспалительного процесса и бронхиальной констрикции поддерживается индуцированными марганцем нарушениями гомеостаза окислительно-антиоксидантных процессов и энергетического баланса бронхиального эпителия. Активируемые марганцем процессы окислительной деградации клеточных и субклеточных мембран эпителиоцитов в сочетании с торможением фосфорилирования и синтеза АТФ, а также продукции коферментов А и Q на уровне митохондрий, сопровождаются повреждением рецепторного аппарата клеток, способствуют нарушению их биокоммуникационной и функциональной активности, снижением регенерационных возможностей респираторного тракта.
У детей, проживающих в условиях хронического аэрогенного воздействия концентраций марганца и ванадия, установлены выраженные нарушения функции внешнего дыхания (ФВД). При риноманометрическом исследовании величина суммарного обструктивного показателя в 1,7 раза ниже, суммарного сопротивления - в 1,3 раза выше группы сравнения; рестриктивные и обструктивные нарушения ФВД при спирографическом исследовании выявляются до 1,6 раза чаще и в 27% случаях имеют выраженный характер.
Помимо прямого иммунотропного, сенсибилизирующего и прооксидантного действия указанных металлов реализуются и опосредованные эффекты, связанные с расстройствами вегетативной (автономной) регуляции. Для хронического ингаляционного воздействия марганца и ванадия характерны симптомы вегетативной дисфункции с активацией преимущественно парасимпатического звена нервной системы и развитием исходной ваготонии (повышенная саливация и секреция слизи, особенно в ночное время, сужение просвета бронхов, снижение объема дыхательной экскурсии). Кроме того, хроническое воздействие повышенных концентраций марганца и ванадия в крови приводит к развитию морфофункциональных изменений подкорковых ганглиев прежде всего, стриопалидарной системы, активации двигательного центра и «ассинопсии», что в совокупности реализуется в виде гипертонуса гладкой мускулатуры бронхо-альвеолярного отдела. В двигательном анализаторе возбуждение распространяется не только на корковые зоны синергистов, но и антагонистов, что приводит к ригидности мускулатуры.
При наличии данных, указывающих на частичный контроль над течением БА (формирование частично контролируемой бронхиальной астмы), тактика проведения лечебных мероприятий по предлагаемому способу в условиях негативного влияния тяжелых металлов (марганец, ванадий), начинается всегда со ступени 2 GINA и заключается по предлагаемому способу в дополнительном назначении к базисным препаратам, рекомендуемым на этой ступени, медикаментов, обладающих энтеросорбционными, антиоксидантными, сосудистыми и ноотропными свойствами. Своевременное назначение патогенетически обоснованных компонентов позволяет добиться контроля над течением БА на более нижних ступенях базисной терапии GINA (т.е. не переходить на более высокие ступени, а наоборот, добившись контроля над БА при реализации заявляемого способа, можно снизить базисную терапию до 1-й ступени), т.е. избежать назначения противоастматических средств, обладающих рядом побочных и нежелательных эффектов. В таблице 1 приведены рекомендуемые GINA профилактические схемы ступенчатой базисной терапии и дополнительно приведена специализированная терапия, согласно предлагаемому способу.
Благодаря сочетанному применению лекарственных средств, рекомендуемых предлагаемым способом, одновременно с использованием базисной терапии, обеспечивается высокая эффективность профилактики частично контролируемой бронхиальной астмы у детей, проживающих в условиях экологического неблагополучия.
ЭНТЕРОСГЕЛЬ® (Enterosgelum dulcis). Международное название - Полиметилсилоксана полигидрат. Фармакотерапевтическая группа: Энтеросорбенты. Регистрационный номер Р N003719/02-28/03/2012. Химический состав: гидрогель метилкремниевой кислоты. Код АТС A07B10C. Энтеросорбирующее, обволакивающее, дезинтоксикационное средство. Обладает выраженными сорбционным и детоксикационным свойствами. В просвете желудочно-кишечного тракта препарат связывает и выводит из организма эндогенные и экзогенные токсические вещества различной природы, включая токсины, антигены, пищевые аллергены, соли тяжелых металлов. Энтеросгель не уменьшает всасывания витаминов и микроэлементов, способствует восстановлению нарушенной микрофлоры кишечника и не влияет на его двигательную функцию.
«КУДЕСАН®» (QUDESAN) - убидекаренон (коэнзим Q10, убихинон) - антигипоксант, природное вещество, являющееся витаминоподобным коферментом с антиоксидантными свойствами. Убидекаренон является эндогенным субстратом, принимает участие в переносе электронов в транспортной цепочке окислительно-восстановительных процессов, в процессе обмена энергии, в реакции окислительного фосфорилирования в дыхательной цепи митохондрий клеток. Участвует в процессах клеточного дыхания, увеличивая синтез АТФ. Препарат, нормализующий метаболизм миокарда, уменьшающий гипоксию тканей. Оказывает клинически значимое антиоксидантное действие. Предохраняет липиды клеточных мембран от перекисного окисления. Код АТХ: С01ЕВ09.
«ПАНТОГАМ®» (PANTOGAM, кальциевая соль гопантеновой кислоты) - нейропротектор, обладает нейрометаболическими, нейротрофическими и ноотропными свойствами. Содержит гамма-аминобутировую кислоту (GABA), что повышает устойчивость мозга к гипоксии и воздействию токсичных веществ, стимулирует анаболические процессы в нейронах, сочетает умеренное седативное действие с мягким стимулирующим эффектом, обладает противосудорожным действием, уменьшает моторную возбудимость с одновременным упорядочением поведения, повышает умственную и физическую работоспособность. Механизм действия обусловлен прямым влиянием Пантогама на GABAB-рецептор-канальный комплекс. Код АТХ: N06BX.
Опытным путем было установлено, что только использование комплексной схемы применения вышеуказанных лекарственных препаратов обеспечивает синергизм в достижении поставленного технического результата. Использованием их по отдельности или при схеме из двух средств не достигается увеличение сроков ремиссии, не обеспечивается максимально возможное воздействие на все звенья патогенеза перехода бронхиальной астмы только в частично контролируемую форму.
Кроме того, следует пояснить, что в рамках стандарта GINA оказания медицинской помощи больным с частично контролируемой БА предусматривает своевременный переход на более высокие ступени с целью установления контроля над БА, с отменой препаратов лишь при положительных эффектах от назначения противоастматических средств.
При реализации предлагаемого способа осуществляют следующие операции в нижеуказанной последовательности:
1. производят выбор территории по риску формирования у детей частично контролируемой бронхиальной астмой: промышленно развитые территории с высокой антропогенной нагрузкой, в частности, с высоким содержанием в атмосферном воздухе марганца и ванадия;
2. производят отбор больных с этой территории для проведения у них профилактических мероприятий. Модель пациента. Например, дети в возрасте от 5 до 15 лет с наличием бронхиальной астмы, устойчивой к проведению стандартной базисной терапии; с превышением референтных концентраций марганца (0,011±0,004 мг/дм3) и ванадия (0,24±0,21 мг/дм3) в крови более чем в 1,5 раза, обусловленных внешнесредовым загрязнением; с наличием специфических антител класса иммуноглобулина Е (IgE) и иммуноглобулина G (IgG) к марганцу и ванадию, выше физиологически допустимого уровня; с наличием сопутствующего патологического процесса со стороны вегетативной нервной системы. О том, что у отобранных детей бронхиальная астма имеет форму частично контролируемой, используют следующие медико-биологические критерии, приведенные в таблице 2.
3. осуществляют клинико-лабораторное обследование указанных детей: наличие специфических антител класса IgE и IgG к марганцу и ванадию, выше физиологически допустимого уровня; антиоксидантную активность (АОА) крови; уровень малонового диальдегида (МДА) плазмы; активность глутатионпероксидазы и/или глюкозо-6-фосфатдегидрогеназы; активность глутатион-S-трансферазы; уровень Т-лимфоцитов, CD25+ и CD95+-лимфоцитов.
Объем исследований включает показатели, выполненные унифицированными общеклиническими, биохимическими и иммуноферментными методами, позволяющими оценить состояние и функции органов и систем с использованием диагностического оборудования:
- микроскоп лабораторный «Micros MC-200» с диапазоном увеличения до 1600х (Австрия) регистрационный номер МЗ РФ N 2002/801 (фагоцитарная активность лимфоцитов);
- спектрофотометр ПЭ-5300в (Россия, г. С-Петербург) (ОАО Экохим) (антиоксидантная активность крови, малоновый диальдегид);
- анализатор иммуноферментный микропланшетный автоматический «Infinite F50», (Тесап, Австрия) №1008007750 (гидроперекиси липидов, глутатионпероксидаза, глюкозо-6-фосфатдегидрогеназа, глутатион-S-трансфераза);
- анализатор лабораторный иммунологический «ELx808IU», (США) (Biotek) (IgE общий и специфический к марганцу и ванадию);
- атомно-абсорбционный спектрометр компании Perkin Elmer «Analyst-400», регистрационный номер в Государственном реестре №38267-08 (исследование марганца в крови);
- масс-спектрометр с индуктивно-связанной аргоновой плазмой фирмы «Agilent 0077 сх» (определение ванадия в крови);
- показатели состояния иммунитета (иммуноглобулины A, M, G) оцениваются методом радиальной иммунодиффузии по Манчини;
- исследование фагоцитоза выполнено методом микроскопии с использованием в качестве объектов фагоцитоза формалинизированных эритроцитов барана (определение процента фагоцитоза, фагоцитарного числа, фагоцитарного индекса, абсолютного количества фагоцитов),
- изучение маркеров клеточной дифференцировки проведено методом проточной цитометрии с определением популяций и субпопуляций лимфоцитов (CD25+, CD95+) на проточном цитометре FACSCalibur фирмы «Becton Dickinson» с использованием универсальной программы CellQuestPrO.
В качестве критериев оценки отклонений лабораторных показателей используются возрастные физиологические уровни, а для содержания марганца и ванадия - референтные уровни (Н. Тиц, 2003).
При выполнении функциональной диагностики для оценки проходимости верхних дыхательных путей используется неинвазивный метод - передняя активная риноманометрия с автоматическим анализом объемно-скоростных показателей носового дыхания.
Исследование функции внешнего дыхания выполняется спирографическим тестом с форсированным выдохом. Для расчета должных величин показателей кривой ″поток-объем″ используются уравнения регрессии по Knudson (М.П. Анохин, 2003).
Состояние различных звеньев вегетативной нервной системы (ВНС) оценивается на компьютерном кардиокомплексе с помощью программы ″Поли-Спектр″, основанной на математическом анализе сердечного ритма (P.M. Баевский, 1979; Д. Жемайтите, 1989). Для анализа используются параметры, рекомендуемые кардиоритмографическими стандартами (HRV/Standards of measurements, 1996).
Далее осуществляют математическую обработку доказательной базы оценки эффективности рекомендуемого способа с помощью непараметрических методов статистики с построением и анализом двумерных таблиц сопряженности, метода однофакторного дисперсионного анализа, методов линейного и нелинейного регрессионного анализа. Для оценки достоверности полученных результатов используют критерий Фишера (оценка адекватности моделей), критерий Стьюдента (сравнение групп по количественным признакам), критерий χ2-квадрат (сравнение структуры признаков). Сравнительную оценку вероятностной взаимосвязи между признаками в группах оценивают по показателю отношения шансов (odd ratio - OR) с анализом доверительного интервала (ДI). Различия полученных результатов считают статистически значимыми при p<0,05.
4. проводят профилактику отобранным в результате вышеприведенного обследования детям с целью снижения риска формирования у них частично контролируемой БА на территории экологического неблагополучия путем комплексного назначения помимо стандартной базисной терапии трех лекарственных средств по схеме, приведенной в таблице 3.
Пример конкретного осуществления
1. Выбор территории проживания. Наиболее значимыми компонентами по вероятности трансформации БА в частично контролируемую БА являются химические вещества, присутствующие в атмосферном воздухе в концентрациях выше одного ПДК: марганец и его соединения (II класс) в 1,3 раза; ванадий - в 1,2 раза.
2. Исследовано 86 детей с частично контролируемой БА в возрасте от 5 до 15 лет (из них девочки - 37 чел., мальчики - 49 чел.), находившиеся в течение трех недель на стационарном обследовании и лечении в педиатрическом отделении клиники.
Клинические и анамнестические критерии при отборе детей приведены выше, а также в таблице 2.
У детей с частично контролируемой БА, обусловленной воздействием аэрозолей соединений марганца и ванадия, доказаны достоверные причинно-следственные связи нарушений иммунного ответа (повышение/снижение относительного фагоцитоза и фагоцитарного числа при увеличении концентрации ванадия и марганца в крови, при этом доля дисперсии зависимой переменной составила: R2=0,17-0,42, p<0,05); снижение концентрации IgM при увеличении концентрации марганца в крови (R2=0,64, p<0,05); снижение содержания IgG и IgА в сыворотке крови при увеличении концентрации в крови марганца и ванадия (R2=0,21-0,35, p<0,05); увеличение IgE общего при повышении концентрации марганца (R2=0,25 при p<0,05); снижение пула CD4+, CD25+ и CD95+-лимфoцитoв при увеличении концентрации ванадия), повышение продукции специфических IgG и IgE к ванадию и марганцу (R2=0,24 при p<0,05); увеличение абсолютного количества эозинофилов в крови, эозинофильно-лимфоцитарного индекса (R2=0,28 при p<0,05), дисбаланс окислительных и антиоксидантных процессов (повышение/снижение антиоксидантной активности сыворотки крови, повышение уровня малонового диальдегида плазмы, гидроперекиси липидов, ферментативной активности клеток (активности глутатионпероксидазы и глюкозо-6-фосфатдегидрогеназы, глутатион-8-трансферазы) при увеличении концентрации марганца и ванадия (R2=0,35-0,46, p<0,05).
Установлены достоверные причинно-следственные связи нарушений функциональных показателей: при риноманометрии - обратная корреляционная связь суммарного обструктивного показателя и содержания в крови ванадия (R2=-0,47, p=0,04) и прямые корреляционные отношения суммарного сопротивления и содержания в крови марганца (R2=0,32, p=0,01); при спирографии - снижение PEF при повышении в крови марганца и ванадия (R2=-0,12-0,27, p=0,001); при проведении КИГ - исходная ваготония, наличие асимпатикотонической реактивности у более чем 1/3 обследованных детей, срыв (AMo1, ИН2) и напряжение (LF2) адаптационно-компенсаторных механизмов, в причинно-следственной связи с уровнем содержания марганца в крови (R2=-0,35-0,42, p=0,05-0,001).
Потенцированное аллергическое воспаление, опосредованное воздействием марганца и ванадия, с развитием общетоксических и прооксидантных эффектов, на фоне вегетативных нарушений являются причинами формирования резистентности к стандартной базисной терапии: снижают эффективность использования нестероидных противовоспалительных средств и ингаляционных глюкокортикоидов, ведут к нарушению контроля над течением бронхиальной астмы, требуют проведения специализированных медико-профилактических мероприятий.
Указанные данные показывают, что отобранные в соответствии с критериями по таблице 2 дети с частично контролируемой БА характеризуются формированием именно частично контролируемой формой БА, ассоциированной именно с воздействием марганца и ванадия. Поэтому в дальнейшем они и проходили курс профилактики согласно предлагаемому способу, схема реализации которого приведена в таблице 3.
Данные по эффективности профилактики предлагаемым способом детей с частично контролируемой БА, ассоциированной с марганцем и ванадием, приведены ниже (по данным катамнеза через 12 месяцев):
- наблюдалась положительная динамика клинической симптоматики (обострения протекают преимущественно в легкой форме у 83% детей, дневные и ночные симптомы БА находятся в пределах контроля у 95%, потребность в бетаз-агонистах короткого действия, который требуются в соответствии со стандартной базисной терапией, менее 4 доз в неделю у 93%);
- величина ОФВ1 (объемный форсированный выдох) по данным спирографии более 85% от индивидуального лучшего показателя отмечается у 92% детей, величина суммарного обструктивного показателя и суммарного сопротивления при риноманометрии в пределах возрастной нормы у 96%;
- купирование синдрома вегетативных дисфункций (в т.ч. синдромов дефицита внимания с гиперактивностью и астено-невротического синдромов) у 78% детей;
- наблюдается иммуномодулирующий эффект у 84% обследованных (повышение у 83% детей сниженного уровня Т-лимфоцитов, восстановление фагоцитарной активности лейкоцитов, активация пула CD4+, CD25+ и CD95+-лимфоцитов, повышение содержания IgG и IgA, снижение продукции IgE общего и специфических IgG и IgE к ванадию и марганцу у 72% детей);
- произошла нормализация баланса окислительных и антиоксидантных процессов (антиоксидантной активности сыворотки крови, малонового диальдегида плазмы, гидроперекиси липидов) у 88% детей и восстановление ферментативной активности клеток (повышение активности глутатионпероксидазы и глюкозо-6-фосфатдегидрогеназы, нормализация глутатион-3-трансферазы) у 62% детей.
Для доказательства синергизма воздействия в заявляемом способе именно сочетанного применения трех предлагаемых лекарственных средств, ниже приводим таблицу 4, отражающую клиническую эффективность в катамнезе (через год) при различных схемах приема лекарств для профилактики формирования частично контролируемой БА.
Как показали исследования и данные, приведенные в таблице 4, эффект предлагаемого способа не является следствием простого действия используемых препаратов, а имеет место выраженный положительный синергизм лекарственных средств по профилактике развития частично контролируемой БА у детей старше 5 лет (сумма эффектов отдельных препаратов в тех же дозах дает эффект существенно менее выраженный, чем при сочетанием применении рекомендуемых в заявляемом способе трех лекарственных средств).
Повысилась резистентность организма к накоплению марганца и ванадия (снижение содержания марганца через 12 мес.на 42-53%, ванадия - на 34-65%, несмотря на то, что дети, прошедшие лечение, продолжали проживать в условиях внешнесредового воздействия марганца и ванадия).
Таким образом, предложенный способ сочетанного применения Энтеросгеля, Кудесана и Пантогама у детей с частично контролируемой БА и контаминацией биосред промышленными токсикантами - марганцем и ванадием, не только органично дополняет стандартную базисную схему GINA профилактики развития частично контролируемых форм БА у детей старше 5 лет, но и способствует значительному снижению риска возникновения таких форм.
Предлагаемый способ может быть рекомендован для профилактики формирования частично контролируемой БА у детей старше 5 лет, проживающих на индустриально развитых территориях и имеющих повышенный уровень в биосредах токсикантов - марганца и ванадия.
Способ профилактики у детей старше 5 лет формирования частично контролируемой бронхиальной астмы, обусловленной воздействием марганца и ванадия, путем назначения лекарственных средств, согласно базисной ступенчатой терапии, характеризующийся тем, что осуществляют дополнительное сочетанное применение детьми следующих лекарственных средств: «Энтеросгель» за 1,5-2 часа до или через 2 часа после еды или после приема лекарственных средств детям в возрасте от 5 до 10 лет - 15 г 2 раза в сутки, от 11 до 15 лет - 15 г 3 раза в сутки курсом 7 дней; «Кудесан» перорально во время приема пищи в первой половине дня в возрастной дозировке: от 5 до 7 лет - 10-16 капель (15-24 мг), от 8 до 15 лет - 16-20 капель (24-30 мг), предварительно растворив в небольшом количестве кипяченой воды или ином напитке комнатной температуры, один раз в сутки курсом 30 дней; «Пантогам» перорально через 15-20 минут после еды, в возрастной дозировке: от 5 до 7 лет - по 500 мг 2 раза в день, от 8 до 15 лет - по 500 мг 3 раза в день курсом 30 дней, причем курс сочетанного применения указанных лекарственных средств осуществляют 2 раза в год.