Способ определения пиридоксальфосфата в эритроцитах периферической крови
Иллюстрации
Показать всеИзобретение относится к области медицины, а именно к методу медицинской диагностики, и может быть использовано в лабораторно-диагностической практике для определения пиридоксальфосфата в эритроцитах периферической крови, как в норме, так и при патологических состояниях организма, в том числе анемии. Приводят функциональную и количественную оценку продуктов реакции на пиридоксальфосфат в нативных эритроцитах путем обработки взвеси эритроцитов в инкубационном растворе при 37°C, в состав которого входят: 0,1 М фосфатный буфер pH 7,4-7,6; нитросиний тетразолий - 1 мг; НАДФ+ - 1 мг; пиридоксаль-5-фосфат - 26,5 мг. В 500 мкл инкубационного раствора помещают 200 мкл цельной крови с коагулянтом в пробирки PUTH КЗ ЭДТА. Инкубация проводится в течение 30 мин при 37°C. Готовят монослойный мазок и подсушивают при комнатной температуре, после чего изучают под цифровым микроскопом по компьютерной программе «Scion Corporation» цитофотометрическим методом плотность продуктов реакции, приходящуюся на 1 эритроцит. Изобретение позволяет решать диагностические и научно-исследовательские задачи. 2 ил.
Реферат
1. Цель изобретения - разработать способ выявления в эритроцитах периферической крови беременных на фоне обострения цитомегаловирусной инфекции гистохимическим методом содержание пиридоксальфосфата.
2. Изобретение относится к медицине, а именно к разработке метода, выявляющего гистохимическим способом содержание в эритроцитах пиридоксальфосфата, подавляющего оксигенацию гемоглобина.
3. Раскрытие изобретения
С помощью радиоактивной метки доказано, что пиридоксальфосфат, который является конкурентом 2,3-дифосфоглицерата (2,3ДФГ) в образовании комплекса с гемоглобином, образует связь с деоксигемоглобином посредством N-конечных α-аминных групп β-цепей (3). Блокирование N-концевых групп приводит к потере влияния 2,3ДФГ на сродство гемоглобина к кислороду [4]. Предполагают, что одной из этих групп, с которой 2,3ДФГ образует солевую связь, является α-аминная группа валина [2]. Однако до настоящего времени нет представлений, может ли меняться содержание пиридоксальфосфата в эритроцитах и под влиянием каких факторов, действующих на них в периферической крови. Для решения этого вопроса необходим метод, позволяющий выявлять содержание пиридоксальфосфата в эритроцитах и определять его количественное содержание.
4. Новая техническая задача
Разрабатывается новый метод, позволяющий гистохимическим способом выявлять пиридоксальфосфат в эритроцитах и цитофотометрически определять его содержание в отдельно взятом эритроците.
5. Предложенный метод принципиально отличается от ранее применявшихся, направленных на определение радиоактивной меткой только в присутствии пиридоксальфосфата в эритроцитах. Предложенный метод позволяет выявлять гистохимической реакцией не только наличие пиридоксальфосфата в отдельно взятом эритроците, но и регистрировать его содержание цитофотометрическим методом в зависимости от меняющихся условий воздействия на эритроциты периферической крови.
6. Осуществление изобретения
6.1. Обследовано 20 рожениц в возрасте 18-25 лет с хронической цитомегаловирусной инфекцией (ХЦМВИ) в стадии обострения на третьем триместре гестации (основная группа) и 15 беременных без таковой патологии (контрольная группа). Диагноз обострения ХЦМВИ устанавливался при комплексном исследовании периферической крови на наличие IgM к ЦМВ или четырехкратного и более нарастания титра антител IgG в парных сыворотках в динамике через 10 дней, индекса авидности более 65%, а также наличия ДНК ЦМВ. Исследования проводились с учетом требований Хельсинской декларации Всемирной медицинской ассоциации «Этические принципы проведения научных исследований с участием человека» с поправками 2008 г. и правилами клинической практики в Российской Федерации, утвержденными приказом Министерства РФ №266 от 19.06.2003 г.
Верификация ЦМВ, определение типоспецифических антител, индекс авидности осуществлялись методами ИФА на спектрофотометре «Stat-Fax-2100» (USA) с использованием тест-систем ЗАО «Вектор-Бест» (Новосибирск), методами ПЦР на аппарате ДТ-96 с использованием наборов НПО «ДНК-технология» (Москва).
6.2. Пиридоксальфосфат в эритроцитах периферической крови определяли следующим методом. Субстратом служил 0,1 М раствор пиридоксаль-5-фосфата (Reanal, Венгрия). Инкубационный раствор готовился на основе 0,1М фосфатного буфера pH 7,4-7,6 с добавлением нитросинего тетразолия фирмы «ICN Biomedicals)) (USA) в конечной концентрации 5 ммоль, НАДФ+ фирмы «Applichem» (Германия) - 1 ммоль. Состав инкубационной среды: 0,1 М фосфатный буфер рН 7,4-7,6; нитросиний тетразолий - 1 мг; НАДФ+ - 1 мг; пиридоксаль-5-фосфат - 26,5 мг. В 500 мкл раствора вносили 200 мкл цельной крови с коагулятом, взятой из локтевой вены утром натощак. Инкубационный раствор помещали в вакуумные пробирки PUTH, КЗ ЭДТА. Инкубация длилась 30 мин при 37°C. Каплю инкубационного раствора наносили на предметное стекло и готовили монослойный мазок на центрифуге «Diffe Spin-2» (USA). Полученные мазки высушивали при комнатной температуре и изучали с помощью цифрового микроскопа МТ (Япония), связанного с компьютерной программой «Scion Corporation», позволяющей на изображении мазка выделять отдельно взятый эритроцит , определять его площадь и автоматически получать количество продукта реакции.
6.3. Для контроля брали адекватное количество буфера.
6.4. Эффективность предложенного метода проверяли на эритроцитах, взятых от беременных после обострения цитомегаловирусной инфекции при титре 1:1600.
7. Содержание оксигемоглобина определяли по методу Эвелина и Мэллой (1).
8. Статистическую обработку данных осуществляли по критерию Манна-Уитни, гипотезу о статистической значимости различий двух выборок - с помощью t-критерия Стьюдента. Значения считали достоверными при p<0,01.
9. Полученные данные
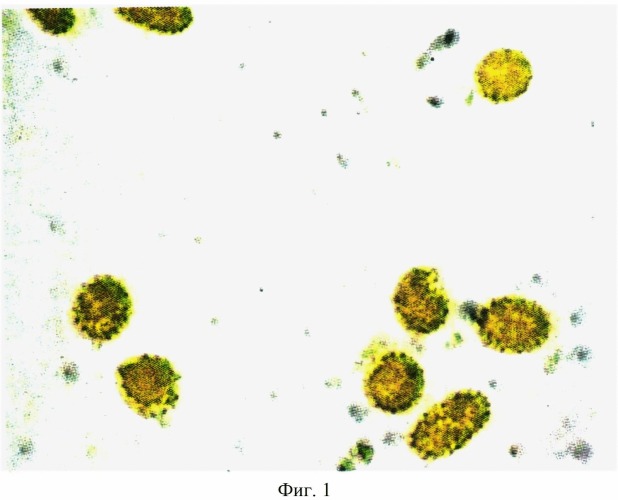
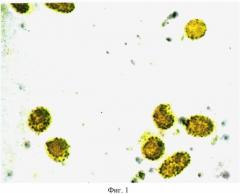
Исследования показали, что при обострении цитомегаловирусной инфекции на третьем триместре гестации в периферической крови увеличивается число эритроцитов, содержащих высокую реакцию на пиридоксальфосфат до 65,0±1,2% (контроль - 7,90±0,09%). Интенсивность реакции при титре к цитомегаловирусу 1:1600 в одном эритроците резко возрастает и составляет 58,00±0,95 усл. ед. (контроль - 15,00±0,20 усл. ед.) Нарастание пиридоксальфосфата в эритроцитах резко снижает содержание в крови оксигемоглобина - до 94,5±1,2%, что становится угрозой формирования у беременной анемии.
Литература
1. Покровский А.А. Справочник. Биохимические методы и исследования. М.: Медицина. 1969. 337 с.
2. Федоров Н.А. Нормальное кроветворения и его регуляция. М.: Медицина. 1976. 543 с.
3. Benesch R.E., Benesch R. Interaction of red cell organic phosphates with hemoglobin // Forsvar med. 1969. V. 5. P. 154-159.
4. Bunn H., Briehl R. The interaction of 2,3-diphosphoglucerate with various human hemoglobins // J. Clin, invest. 1970. V. 49. P. 1088.
На фигуре 1 изображена гистохимическая реакция в эритроцитах на пиридоксальфосфат у беременной на третьем триместре гестации при титре 1:1600. Интенсивность реакции - высокая и составляет 58,00±0,95 усл. ед. при цитофотометрическом анализе. Увеличение - 10×100.
На фигуре 2 изображена гистохимическая реакция в эритроцитах на пиридоксальфосфат у беременной, не болевшей на протяжении всего периода гестации. Интенсивность реакции в эритроцитах - 15,00±0,20 усл. ед. Увеличение - 10×100.
Способ определения пиридоксальфосфата в эритроцитах периферической крови, включающий выполнение гистохимической реакции в инкубационном растворе, состоящем из 500 мкл 0,1 М фосфатного буфера pH 7,4-7,6; нитросинего тетразолия 5 ммоль - 1 мг, НАДФ+ 1 ммоль - 1 мг, в который вносят 200 мкл цельной крови с коагулянтом, проводят реакцию при 37°C в течение 30 мин, после чего из капли инкубационной смеси готовят монослойный мазок, подсушивают и определяют продукты реакции на пиридоксальфосфат методом компьютерной цитофотометрии по относительной плотности продуктов реакции в условных единицах, приходящихся на 1 эритроцит, с учетом плотности окрашенных продуктов реакции.