Пористые кристаллические материалы, их синтез и применение
Иллюстрации
Показать всеИзобретение относится к пористому кристаллическому материалу. Материал имеет тетраэдрический каркас, включающий общую структуру М1-IM-М2, где М1 является металлом, имеющим первую валентность, М2 является металлом, имеющим другую валентность, отличную от указанной первой валентности, и IM является имидазолатным или замещенным имидазолатным связывающим фрагментом. При этом выполняется одно или более из следующих условий: М1 является одновалентным металлом и М2 является трехвалентным элементом; М1 является Li+; и М2 является В3+. Также предложены способы поглощения газа, способы отделения газа от потока содержащей газ текучей среды. Изобретение позволяет улучшить поглощение газа на весовой основе. 6 н.п. и 22 з.п. ф-лы, 3 ил, 8 табл., 3 пр.
Реферат
Область техники
Данное изобретение относится к пористым кристаллическим материалам, их синтезу и применению.
Уровень техники
Одним известным семейством пористых кристаллических материалов являются цеолитовые материалы, которые основаны на трехмерной каркасной структуре с четырьмя связями, определенной с помощью тетраэдров [TO4] с общим углом, где Т является любым тетраэдрически координированным катионом. Среди известных материалов в этом семействе присутствуют алюмосиликаты, которые содержат трехмерную микропористую кристаллическую каркасную структуру [SiO4] и [AlO4] тетраэдрических элементов с общим углом, алюмофосфаты, которые содержат трехмерную микропористую кристаллическую каркасную структуру [AlO4] и [PO4] тетраэдрических элементов с общим углом, и силикоалюмофосфаты (SAPO), в которых каркасная структура составлена из [SiO4], [AlO4] и [PO4] тетраэдрических элементов с общим углом. Включенные в цеолитовое семейство материалы представляют собой свыше 180 различных пористых каркасных систем, многие из которых имеют большое промышленное значение в качестве катализаторов и абсорбентов.
В настоящее время было синтезировано новое семейство пористых материалов, которое основано на [М(IM)4] тетраэдрах, в которых IM является связывающим фрагментом имидазолатного типа и М является переходным металлом. Эти новые материалы вообще называют цеолитовыми имидазолатными каркасами, или ZIF (zeolitic imidazolate frameworks), так как угол, образованный имидазолатами (IM), когда они связаны мостиковой связью с переходными металлами, аналогичен углу 145° Si-O-Si связи в цеолите. В результате, несмотря на то что эта область исследования находится на ранней стадии развития, уже возможно синтезировать ZIF аналоги большого числа известных цеолитовых структур, а также получать пористые каркасные системы, ранее неизвестные для цеолитов. Обсуждение этого исследования можно найти, например, в следующих публикациях профессора Yaghi и его соавторов: "Exceptional Chemical and Thermal Stability of Zeolitic Imadazolate Frameworks", Proceedings of the National Academy of Sciences of USA, vol. 103, 2006, pp.10186-10191, "Zeolite A Imidazolate Frameworks", Nature Materials, vol. 6, 2007, pp.501-506, "High-Throughput Synthesis of Zeolitic Imidazolate Frameworks and Application to CO2 Capture", Science, vol. 319, 2008, pp.939-943, "Colossal Cages in Zeolitic Imidazolate Frameworks as Selective Carbon Dioxide Reservoirs", Nature, vol. 453, 2008, pp.207-212 и "Crystals as Molecules: Postsynthesis Covalent Functionalization of Zeolitic Imidazolate Frameworks", Journal of the American Chemical Society, vol. 130, 2008, pp.12626-12627.
Большая часть этих работ по ZIF структурам суммирована в заявке на патент US 2007/0202038, все содержание которой включено в данный документ путем ссылки. В частности, в ней описывают цеолитовый каркас, имеющий общую структуру: M-L-M, где М является переходным металлом и L является связывающим фрагментом, представляющим собой структуру, выбранную из группы, состоящей из I, II, III или любого их сочетания:
где А1, А2, А3, А4, А5, А6 и А7 могут быть либо С, либо N; R5-R8 присутствуют, когда А1 и А4 являются С; R1, R4 или R9 являются стерически незатрудненной группой, которая не влияет на М; R2, R3, R5, R6, R7, R8, R10, R11 и R12 каждый независимо является алкильной группой, галогеном, цианогруппой, нитрогруппой; М1, М2, М3, М4, М5 и М6 каждый является переходным металлом; когда связывающий фрагмент представляет собой структуру III, R10, R11 и R12 каждый независимо являются электроноакцепторными группами. В US 2007/0202038 также описывают, что цеолитовые каркасы подходят в качестве носителей катализаторов и в качестве адсорбентов для газов, в особенности диоксида углерода.
В цеолитовых каркасах, заявленных в заявке на патент US 2007/0202038, металлы все являются переходными металлами, обычно тетраэдрически координированными двухвалентными переходными металлами, в основном Zn2+ и Со2+. Единственным примером, описанным в заявке на патент US 2007/0202038, который содержит металлы с переменной валентностью, является ZIF-5, который имеет непористый каркас, включающий октаэдрически координированный In3+ помимо тетраэдрически координированного Zn2+.
Помимо этого, в литературе известно множество материалов, имеющих каркасные структуры, включающие катион и анион металла, которые представляют собой либо [В(IM)4]-, либо[Al(IM)4]-. Однако большинство этих материалов не имеют тетраэдрического каркаса и/или оказываются непористыми структурами.
Например, о катионной слоистой структуре [PbB(IM)4](NO3) и ее нейтральной изоструктуре TIB(IM)4 сообщали Ziegler et al. в 2002 и 2004 годах, соответственно. См. Ziegler et al. "Construction of a Functional Layered Solid Using Tetrakis(imidazolyl)borate Coordinating Anion", Inorganic Chemistry, vol. 41, 2002, pp.4984-4986 и Ziegler et al. "Lead and Thallium Tetrakis(imidazolyl)borates:
Modifying Structure by Varying Metal and Anion", Inorganic Chemistry, vol. 43, 2004, pp.4272-4277. Однако, хотя Pb2+ и TI+ в упомянутых выше структурах принимают координационное число, равное четырем, их координационные геометрии сильно отклоняются от тетраэдрической. В результате продукты, о которых сообщали Ziegler et al., оказываются вообще двумерными слоистыми структурами, отличающимися от цеолитовых и цеолито-подобных открытых каркасов.
О соединении с формулой AgB(IM)4 сообщали Pettinari et al. в 2000 году и о соединении с формулой CuB(IM)4 сообщали Pike et al. в 2005 году. См. Pettinari et al. "Synthesis, Characterization and X-ray Structural Studies of Novel Dinuclear Silver(l) Complexes of Poly(azolyl)borate Ligands", Inorganic Chimica Acta, vol. 308, 2000, pp.65-72 и Pike et al., "Convenient Synthesis of Copper (I) Thiolates and Related Compounds", Inorganic Chimica Acta, vol. 358, 2005, pp.1331-1336. Соединения серебра и меди синтезировали в метаноле и воде, соответственно. Хотя упомянутые выше соединения согласуются с тетраэдрическими каркасами, не сообщали никакой информации о кристаллической структуре или кристалличности этих двух материалов. Более важно то, что упомянутые выше соединения относили к только что синтезированным материалам, основываясь на элементном анализе. То, что эти два материала в их только что синтезированной форме не содержат в каркасах молекул-гостей, например, молекул растворителя, является убедительным доказательством того, что материалы не являются пористыми.
В заявке на патент JP 2007087737 "Lithium Ion Conduction Material and Secondary Lithium Ion Battery Using It" описывают группы солей лития с формулами Li+[M(Azo)4-n(Q)n]-, в которых М является либо В, либо Al, Azo является азольным остатком или замещенным азольным остатком, Q является остатком соединения, отличного от азолов, и n равно 0, 1, 2, 3. Способ приготовления для солей лития с n=0 иллюстрируют на примере синтеза LiAl(IM)4, где IM является имидазолатом, и способ включает реагирование LiAlH4 с имидазолом. Был представлен элементный анализ только что синтезированного материала, соответствующий формуле LiAl(IM)4. To, что этот материал в только что синтезированной форме не содержит в каркасе молекул-гостей, например, молекул растворителя, является убедительным доказательством того, что он не является пористым.
Согласно настоящему изобретению были синтезированы новые группы пористых кристаллических материалов, которые имеют тетраэдрический каркас, имеющий общую структуру M1-IM-M2, где М1 является металлом, имеющим первую валентность и, в особенности, одновалентным металлом, выбранным из Li+, Cu+ и Ag+, М2 является металлом, имеющим другую валентность, отличную от указанной первой валентности, и, в особенности, трехвалентным элементом, выбранным из В3+, Al3+ и Ga3+, и IM является имидазолатным или замещенным имидазолатным связывающим фрагментом. Такие материалы предоставляют новые возможности для применений в качестве катализаторов, так как, например, Cu+, Ag+, Al3+ и Ga3+ показывают химическое поведение, отличное от двухвалентных переходных металлов, обычно используемых для синтеза ZIF. Более того, применяя элементы Li и В с низкой атомной массой вместо переходных металлов, возможно получить адсорбенты с улучшенным поглощением газа на весовой основе.
Краткое описание изобретения
В одном аспекте изобретение относится к пористому кристаллическому материалу, имеющему тетраэдрический каркас, имеющий общую структуру М1-IM-M2, где М1 является металлом, имеющим первую валентность, М2 является металлом, имеющим другую валентность, отличную от указанной первой валентности, и IM является имидазолатным или замещенным имидазолатным связывающим фрагментом.
В одном воплощении М1 является одновалентным металлом и М2 является трехвалентным элементом.
Обычно М1 является катионом одновалентного металла, выбранным из Li+, Cu+ и Ag+, особенно Li+.
Обычно, М2 является катионом трехвалентного элемента, выбранным из В3+, Al3+ и Ga3+, особенно В3+.
Обычно тетраэдрический каркас имеет тип каркаса, выбранный из группы, состоящей из crb, dft, саg, sod, mer, rho, ana, Ita, dia, zni, gme, Ics, fri, gis, poz и moz.
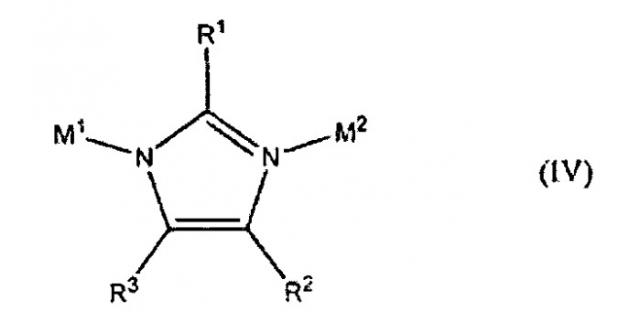
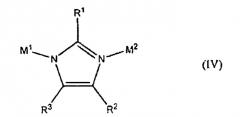
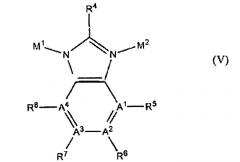
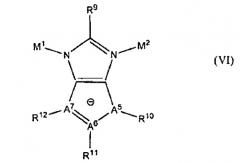
В дополнительном аспекте изобретение относится к пористому кристаллическому материалу, имеющему тетраэдрический каркас, включающий структуру, выбранную из группы, состоящей из IV, V, VI или любого их сочетания:
где А1, А2, А3, А4, А5, А6 и А7 могут быть либо С, либо N; R5-R8 присутствуют, когда от А1 до А4 являются С; R1, R4 или R9 являются стерически незатрудненной группой, которая не влияет на смежные М1 или М2; R2, R3, R5, R6, R7 и R8 каждый независимо является водородом, алкильной группой, галогеном, цианогруппой или нитрогруппой; М1 является катионом одновалентного металла; М2 является катионом трехвалентного элемента; и R10, R11 и R12 каждый независимо являются электроноакцепторными группами.
В одном воплощении М1 является Li+, М2 является В3+, IM является IV, каждый из R1, R2 и R3 являются водородом, тетраэдрический каркас имеет тип каркаса саg и только что синтезированный материал содержит молекулы-гости в тетраэдрическом каркасе.
В еще одном дополнительном аспекте изобретение относится к способу поглощения газа, включающему приведение газа в контакт с описанным здесь пористым кристаллическим материалом.
Краткое описание чертежей
Фиг.1 является изображением соединения 1 примера 1, выполненным с помощью Oak Ridge Thermal Ellipsoid Plot (ORTEP).
На Фиг.2 показана структура каркаса ZIF-4, имеющего тип каркаса сад. На Фиг.3 показаны картина порошковой рентгеновской дифракции игольчатого микрокристаллического соединения 2 примера 2, изображенная в виде непрерывной записи самописца, и картина, вычисленной на основе структуры соединения 2 примера 2, состоящего из крупных кристаллов, показанная в виде черточек.
Подробное описание воплощений
В данном документе описывают новое семейство пористых кристаллических материалов, имеющих тетраэдрический каркас, имеющий общую структуру M1-IM-M2, где М1 является металлом, имеющим первую валентность, М2 является металлом, имеющим другую валентность, отличную от указанной первой валентности, и IM является имидазолатным или замещенным имидазолатным связывающим фрагментом. Также здесь описывают способ синтеза нового семейства материалов и способ применения данных материалов для поглощения газов, таких как диоксид углерода.
Обычно М1 является катионом одновалентного металла, таким как Li+, Na+, К+, Cs+, Rb+, Cu+, Ag+ и Au+. Более конкретно, М1 является катионом одновалентного металла, выбранным из Li+, Cu+ и Ag+, особенно Li+.
Обычно, М2 является катионом трехвалентного элемента, такого как В3+, Al3+, Ga3+, In3+, Fe3+, Cr3+, Sc3+, Y3+ и La3+, где La представляет собой любой лантанидный металл. Более конкретно, М2 является катионом трехвалентного элемента, выбранным из В3+, Al3+ или Ga3+, особенно В3+.
Вообще, описанные здесь пористые кристаллические материалы имеют тетраэдрический каркас, включающий структуру, выбранную из группы, состоящей из IV, V, VI или любого их сочетания:
где А1, А2, А3, А4, А5, А6 и А7 могут быть либо С, либо N; R5-R8 присутствуют, когда соответствующие им от А1 до А4 являются С; R1, R4 или R9 являются стерически незатрудненной группой, которая не влияет на смежные М1 или М2; R2, R3, R5, R6, R7 и R8 каждый независимо является водородом, алкильной группой, галогеном, цианогруппой или нитрогруппой; М1 является катионом одновалентного металла; М2 является катионом трехвалентного элемента; и, если они присутствуют, R10, R11 и R12 каждый независимо являются электроноакцепторными группами.
В одном воплощении R1, R4 и R9 независимо выбирают из водорода, метильной, этильной, нитро-, формильной, гало- и цианогрупп и галогена.
Подходящие электроноакцепторные группы для каждого R10, R11 и R12 включают нитрогруппу, цианогруппу, фтор и хлор.
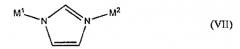
Примеры членов семейства описанных здесь новых пористых кристаллических материалов включают структуры, выбранные из группы, состоящей из VII, VIII, IX, X, XI, XII, XIII, XIV, XV, XVI, XVII и XVIII:
Эти имидазолатные связующие фрагменты также успешно применяли при синтезе ZIF, как сообщали профессор Yaghi и его соавторы в следующих публикациях: "Exceptional Chemical and Thermal Stability of Zeolitic Imadazolate Frameworks", Proceedings of the National Academy of Sciences of USA, vol. 103, 2006, pp.10186-10191, "Zeolite A Imidazolate Frameworks", Nature Materials, vol. 6, 2007, pp.501-506, "High-Throughput Synthesis of Zeolitic Imidazolate Frameworks and Application to CO2 Capture", Science, vol. 319, 2008, pp.939-943, "Colossal Cages in Zeolitic Imidazolate Frameworks as Selective Carbon Dioxide Reservoirs", Nature, vol. 453, 2008, pp.207-212 и "Crystals as Molecules: Postsynthesis Covalent Functionalization of Zeolitic Imidazolate Frameworks", Journal of the American Chemical Society, vol. 130, 2008, pp.12626-12627.
Описанное здесь новое семейство пористых кристаллических материалов может иметь тетраэдрические каркасные структуры любого типа. Тип каркаса пористого кристаллического материала обозначают здесь с помощью мнемонического кода, состоящего из трех полужирных строчных букв. Эта система символов была введена профессорами O'Keeffe и Yaghi и принята в исследованиях ZIF. Общую информацию о данной символической системе можно найти, например, в публикации O'Keeffe and Yaghi et al. "Reticular Chemistry: Occurrence and Taxonomy of Nets and Grammar for the Design of Frameworks", Accounts of Chemical Research, vol. 38, 2005, pp.176-182 и на сайте Reticular Chemistry Structure Resource (RCSR) http://rcsr.anu.edu.au/home. Мы отмечаем, что в химической литературе понятия «тип каркаса», «топология» и «сеть» используют по существу взаимозаменяемо. Эти мнемонические коды не следует путать с действительными материалами или приравнивать к ним.
Обычно пористый кристаллический материал по настоящему изобретению является изоструктурой известного ZIF и принимает тип тетраэдрического каркаса, выбранный из группы, состоящей из crb, dft, саg, sod, mer, rho, ana, Ita, dia, zni, gme, Ics, fri, gis, poz и moz. Все эти типы каркасов были получены при синтезе ZIF.
В одном воплощении одновалентный металл М1 является Li+, трехвалентный элемент М2 является В3+, 1М является имидазолатным связующим фрагментом, то есть структурой VII, и тетраэдрический каркас имеет тип каркаса саg. Только что синтезированный материал содержит молекулы-гости в каркасе.
Синтез настоящего пористого кристаллического материала основан на реакции [М1(L)n]Xx и Aa[M2(IM)4],
где М1, М2 и IM такие же, как описано выше,
L является нейтральным лигандом, обычно аммиаком, амином, фосфином, нитрилом или простым эфиром,
n является неотрицательным целым числом от 0 до 12,
Х является анионом, обычно галогенидом, нитратом, перхлоратом, ацетатом, трифторметансульфонатом или ацетилацетонатом,
А является катионом, обычно Na+, K+, тетраалкиламмонием [NR4]+ или тетраалкилфосфонием [PR4]+, и
x и а каждое являются неотрицательным целым числом.
Реакция протекает в полярном апротонном растворителе и, в некоторых случаях, в присутствии темплата. Полярный апротонный органический растворитель обычно представляет собой амид (например, N,N-диметилформамид, N,N-диметилацетамид, 1,3-диметилпропиленмочевину), сульфоксид (например, диметилсульфоксид) или фосфорамид (например, гексаметилфосфорамид). Темплат, если он присутствует, обычно является нейтральным органическим соединением, таким как простой эфир, кетон, сложный эфир, амин, нитрил, нитросоединение, фосфин, углеводород или галогенид.
Обычно процедура синтеза включает смешивание раствора [M1(L)n]Xx и раствора Аа[М2(IM)4], оба в полярном апротонном органическом растворителе, при температуре от примерно -78°С (температуры ванны с сухим льдом) до примерно 153°С (нормальная температура кипения N,N-диметилформамида) и предоставление материалам возможности реагировать при этой температуре в течение от примерно 0,5 часа до примерно 72 часов. Молярное отношение [M1(L)n]Xx к Aa[M2(IM)4] составляет от примерно 0,1 до примерно 10. Если осаждается побочный продукт АХ, твердое вещество отделяется от раствора. При необходимости в этой точке в раствор добавляют темплат. Количество темплата находится в таком диапазоне, что на нижнем пределе он является эквимолярным тому из двух регентов, который находится в меньшем молярном количестве, и на верхнем пределе он является эквимолярным растворителю. Раствор поддерживают при температуре от -78°С до примерно 153°С для того, чтобы дать возможность продукту кристаллизоваться. После завершения стадии кристаллизации, обычно занимающей от примерно 0,5 часа до примерно 168 часов, извлекают получающийся пористый кристаллический материал.
Li+, Cu+, Ag+ особенно эффективны в замене катиона A (Na+, K+, NR4 +, PR44 +) реагента Aa[M2(IM)4], так как они все образуют значительно более сильные связи со связывающим фрагментом 1М, чем A. Li+, Cu+, Ag+ - все являются эффективными в кристаллизации настоящего пористого кристаллического материала, так как для них всех предпочтительной является тетраэдрическая координация.
Реагенты Aa[M2(IM)4], используемые в синтезе настоящих пористых кристаллических материалов, приготавливают заранее. Приготовление особенно удобно, когда М2=В3+, Al3+, Ga3+. Процедуры приготовления соединений бора можно найти, например, в Moore et al. “Studies In The Tetraarylborates, Part VII. The Preparation and Reagent Properties of Some New Nitrogen Heterocyclic Tetraarylborates - Especially Sodium Tetrakis(1-lmidazolyl)borate, A Novel Gravimetric Reagent for Hydrogen Ion”, Analytica Chimica Acta, vol. 100, 1978, pp.457-467 и Ziegler et al. “Lead and Thallium Tetrakis(imidazolyl)borates: Modifying Structure by Varying Metal and Anion”, Inorganic Chemistry, vol. 43, 2004, pp.4272-4277. Все эти приготовления включают реакцию ВН4 - и H-IM, где H-IM является имидазолом или замещенным имидазолом. Эта химия применима для Al3+ Ga3+, так как Al и Ga показывают химические характеристики, аналогичные В, и так как соединения AlH4 - и GaH4 - являются легко доступными.
Настоящие пористые кристаллические материалы в только что синтезированной форме содержат в тетраэдрических каркасах молекулы-гости, обычно молекулы растворителя и/или темплата. Молекулы-гости можно удалить либо путем откачки при давлении менее 6,7 Па (50 мТорр) при температуре от примерно 70°С до примерно 300°С, либо путем обмена с органическим растворителем с небольшим размером молекул, например, ацетонитрилом, за которым следует описанный выше способ откачки. Удаление молекул-гостей приводит к внутреннему объему пор, который можно использовать для адсорбции различных газов, таких как диоксид углерода, моноксид углерода, углеводороды, водород, азот, кислород, благородные газы и амины.
Размер и форму пор в настоящих кристаллических материалах можно регулировать с помощью выбора имидазолатного связывающего фрагмента, растворителя и темплата. В результате настоящие пористые кристаллические материалы показывают значительный потенциал для применения в качестве катализаторов и при хранении и разделении газов.
С точки зрения катализа внедрение Cu+, Ag+, Al+ и Ga+ делает возможной уникальную каталитическую химию, которая недоступна для металлов, используемых до сих пор для ZIF, обычно двухвалентных переходных металлов, таких как Zn2+, Co2+.
В области хранения и разделения газов, которая в настоящее время является наиболее важным применением ZIF, использование очень легких металлов, таких как Li и В, является крайне желательным для улучшения поглощения газа на весовой основе. Например, предполагается, что пористый материал с химической композицией LiB(IM)4 показывает на 39% более высокое поглощение газа в единицах ммоль/г, чем изоструктурный материал Zn(IM)2 (массы составов Li0,5B0,5(IM)2 и Zn(IM)2 составляют 143 и 199, соответственно; здесь IM является имидазолатом).
Ниже изобретение описано более конкретно со ссылкой на примеры и приложенные чертежи.
Пример 1
Раствор 14 мг хлорида лития (LiCl, 0,33 ммоля) в 5 мл N,N-диметилформамида (ДМФ) добавляли в раствор 100 мг тетракис(1-имидазолил)бората натрия (NaB(IM)4, 0,33 ммоля) в 5 мл ДМФ в 20 мл стеклянном пузырьке. Когда завершалось осаждение хлорида натрия (обычно примерно за 2 часа), чистый раствор перемещали в другой 20 мл стеклянный пузырек и смешивали с 5 мл тетрагидрофурана (ТГФ). Вскоре на стеклянной стенке появлялись кристаллы в форме многогранника и им давали расти в течение примерно 8 часов. Маточный раствор затем удаляли и кристаллы полностью промывали ТГФ и сушили в вакууме. Получали 35 мг продукта с высокой степенью кристалличности LiB(IM)4 Гость (соединение 1) (выход 30%, Гость представляет собой смесь ТГФ и ДМФ).
Бесцветные кристаллы соединения 1 в форме многогранника с приблизительными размерами 0,08×0,19×0,21 мм использовали для рентгеновского кристаллографического анализа. Данные по интенсивности рентгеновского излучения измеряли при 133(2) К, охлаждения достигали с помощью Rigaku-MSC X-Stream 2000, на системе ПЗС двумерного индикатора Bruker SMART APEX, оборудованной графитовым монохроматором и МоКа запаянной лампой с острым фокусом (α=0,71073 Å), функционирующей с мощностью 1600 Ватт (50 кВ, 32 А). Детектор помещали на расстоянии 5,8 см от кристалла.
Все 1515 кадров собирали с шириной развертки 0,3° в ω и при времени экспозиции 20 секунд/кадр. Полное время сбора данных составляло примерно 11 часов. Кадры объединяли с помощью пакета программ Bruker SAINT, используя алгоритм интегрирования с сужением кадра. Интегрирование данных с использованием орторомбического элемента ячейки давало полное число отражений, равное 27071 для максимума угла 9, равного 28,40° (разрешение 0,90 Å), из которых 4692 были независимыми, завершенность=98,3%, Rint=0,0759, Rsig=0,0611 и 3273 были больше 2σ(I). Конечные постоянные ячейки: а=14,382(5) Å, b=14,809(5) Å, с=17,869(6) Å, α=90°, β=90°, γ=90°, объем=3806(2) Å3 основывали на оптимизации XYZ-центроидов 2336 отражений выше 2σ(I) с 2,278°<θ<23,570°. Анализ данных показывает пренебрежимо малый распад в течение сбора данных. Данные корректировали на влияние поглощения, используя метод многократного сканирования (SADABS). Отношение минимума к максимуму наблюдаемого перехода составляло 0,5697.
Структуру определяли и детализировали, используя пакет программ Bruker SHELXTL (Version 6.1), используя пространственную группу Pbca с Z=8 для формульного элемента Li В С16 Н20 N8 О, то есть, LiB(IM)4·ТГФ. Пять неводородных атомов молекулы ТГФ ясно выявлялись в разностных картах синтеза Фурье. Однако, детализация этих атомов не достигла успеха из-за небольшой неупорядоченности молекулы ТГФ, что делало нелегким точное моделирование. Неупорядоченность была вызвана наложением ТГФ и ДМФ, которые были, соответственно, большим и меньшим компонентами гостевой смеси. Для того, чтобы улучшить детализацию легких атомов на каркасе, использовали программу PLATON/SQUEEZE для устранения электронной плотности неупорядоченных молекул-гостей. Конечная анизотропная детализация по методу наименьших квадратов с полной матрицей на F2 с 199 переменными сходилась при R1=7,24% для измеренных данных и wR2=17,77% для всех данных. Степень согласия составляла 1,041. Наибольший пик конечной разностной карты составлял 0,289 е-/Å3, и наибольшая дырка составляла -0,267 е-/Å3. На основе конечной модели вычисленная плотность кристалла составляет 0,998 г/см3 и F(000) составляет 1184 электронов.
Обоснованность этой структуры подтверждается с помощью описанных выше R факторов, степени согласия и остаточных электронных плотностей и с помощью очень правдоподобных параметров расположения атомов каркаса, приведенных в таблице 1. Помимо этого, трактовка гостевой части структуры подтверждается с помощью результатов PLATON/SQUEEZE, показанных в таблице 2. Программа идентифицировала восемь полостей на элементарную ячейку. Каждая имела объем от 146 до 148 Å3 и содержала 38 электронов. Как объем, так и количество электронов подтверждают распределение одной молекулы-гостя на одну полость (как ТГФ, так и ДМФ имеют 5 не-водородных атомов и 40 электронов на молекулу), и поэтому формулой кристалла является Li(IM)4·Гость.
| Таблица 1 | ||||
| Атомные координаты и эквивалентные параметры изотропного атомного смещения (Å2) для соединения 1U(eq) определяют как одну третью следа ортогонализированного тензора Uij. | ||||
| x | y | z | U(eq) | |
| N1 | 0,91688(12) | 0,16097(12) | 0,62417(9) | 0,0176(4) |
| N4 | 1,14471(13) | -0,01735(13) | 0,64484(11) | 0,0277(5) |
| N7 | 0,95613(12) | 0,19942(12) | 0,75802(9) | 0,0182(4) |
| N5 | 1,05049(11) | 0,26554(12) | 0,64962(9) | 0,0172(4) |
| N2 | 0,84096(13) | 0,13435(14) | 0,51725(10) | 0,0256(4) |
| N3 | 1,06254(12) | 0,10166(12) | 0,68310(9) | 0,0173(4) |
| N6 | 1,17178(13) | 0,35073(13) | 0,61547(11) | 0,0239(4) |
| N8 | 0,88028(13) | 0,26633(14) | 0,85190(10) | 0,0259(4) |
| C9 | 1,14427(14) | 0,27288(15) | 0,64364(12) | 0,0208(5) |
| C6 | 1,07483(15) | 0,03737(15) | 0,63057(12) | 0,0218(5) |
| C12 | 0,92037(15) | 0,27681(15) | 0,78558(12) | 0,0223(5) |
| B1 | 0,99664(16) | 0,18318(16) | 0,67886(13) | 0,0173(5) |
| C7 | 1,01622(16) | 0,34659(15) | 0,62324(13) | 0,0234(5) |
| С3 | 0,91335(15) | 0,17280(15) | 0,54931(12) | 0,0217(5) |
| C10 | 0,93655(17) | 0,13448(16) | 0,81107(13) | 0,0282(5) |
| С8 | 1,09050(16) | 0,39694(16) | 0,60277(13) | 0,0256(5) |
| С1 | 0,83986(17) | 0,10941(18) | 0,64045(14) | 0,0335(6) |
| С2 | 0,79516(18) | 0,0938(2) | 0,57474(14) | 0,0368(6) |
| С5 | 1,18061(16) | 0,01327(16) | 0,71150(14) | 0,0287(5) |
| С11 | 0,89095(17) | 0,17620(16) | 0,86780(13) | 0,0299(6) |
| С4 | 1,13132(16) | 0,08573(15) | 0,73551(13) | 0,0247(5) |
| Li1 | 0,8107(3) | 0,1311(2) | 0,4063(2) | 0,0207(8) |
| Таблица 2 | |||||
| Расположение и объем полостей и количество электронов в них в элементарной ячейке соединения 1 | |||||
| Полость | Координаты центроида | Объем (Å3) | Электроны (е-) | ||
| X | Y | Z | |||
| 1 | 0,341 | 0,305 | 0,401 | 147 | 38 |
| 2 | 0,841 | 0,305 | 0,099 | 147 | 38 |
| 3 | 0,341 | 0,194 | 0,901 | 148 | 38 |
| 4 | 0,841 | 0,194 | 0,599 | 148 | 38 |
| 5 | 0,159 | 0,805 | 0,401 | 146 | 38 |
| 6 | 0,659 | 0,805 | 0,099 | 146 | 38 |
| 7 | 0,159 | 0,694 | 0,901 | 146 | 38 |
| 8 | 0,659 | 0,694 | 0,599 | 146 | 38 |
Соединение 1 имеет тетраэдрический каркас имидазолата металла с переменной валентностью M1M2(IM)4, где М1 и М2 являются катионами одновалентного и трехвалентного элемента, соответственно. Это ясно показано на Oak Ridge Thermal Ellipsoid Plot (ORTEP) соединения 1, показывающем два смежных металлических катиона, Li+ и В3+, оба тетраэдрически координированные четырьмя имидазолатными связующими (Фиг.1). Длины связей Li-N и B-N - все лежат в диапазонах, общепринятых в литературе (таблица 3), подтверждая правильность определения отличительных черт металлов. Тетраэдрическая координационная геометрия каждого металлического катиона близка к совершенной, что подтверждается с помощью углов связей N-Li-N и N-B-N, которые все очень близки к идеальному тетраэдрическому углу 109,5° (таблица 3). Для сравнения, в таблице 3 также приведены углы связей N-TI-N и N-B-N, измеренные в монокристаллической структуре двумерного слоистого соединения TIB(IM)4, описанного Ziegler et al. в "Lead and Thallium Tetrakis(imidazolyl)borates: Modifying Structure by Varying Metal and Anion", Inorganic Chemistry, vol. 43, 2004, pp.4272-4277. Нететраэдрическая координация TI+ препятствует образованию цеолитовых или подобных цеолитовым открытых каркасов, в то время как тетраэдрическая координация Li+ облегчает его.
| Таблица 3 | |||||
| Длины и углы связей, включающих Li+ или В3+, измеренные в кристаллической структуре соединения 1, и углы связей, включающих TI+ или В3+, измеренные в кристаллической структуре слоистого соединения TIB(IM)4 | |||||
| Длины связей соединения 1 (Å) | Углы связей соединения 1 (°) | Углы связей TIB(IM)4 (°) | |||
| Li-N | B-N | N-Li-N | N-B-N | N-TI-N | N-B-N |
| 2,021 | 1,536 | 104,289 | 108,000 | 77,093 | 107,774 |
| 2,030 | 1,537 | 106,639 | 108,808 | 78,757 | 107,824 |
| 2,053 | 1,542 | 109,412 | 109,191 | 78,899 | 109,180 |
| 2,062 | 1,549 | 109,802 | 109,240 | 89,721 | 110,183 |
| 112,985 | 109,393 | 92,251 | 110,381 | ||
| 113,159 | 112,148 | 155,030 | 111,501 |
Тип каркаса соединения 1 такой же, как у ZIF-4, который, в свою очередь, такой же, как у минерала галлата кальция (Calcium Gallate) (обозначаемый в дальнейшем как сад). Хотя тип каркаса сад не является цеолитовым типом каркаса, он представляет собой трехмерный тетраэдрический каркас, и когда он принят ZIF, он наделяет материал полостями и каналами из 6 колец, которые могут быть доступными (Фиг.2). В таблице 4 сравнивают параметры элементарной ячейки соединения 1 с параметрами элементарной ячейки ZIF-4, о котором сообщали Yaghi et al. в "Exceptional Chemical and Thermal Stability of Zeolitic Imadazolate Frameworks", Proceedings of the National Academy of Sciences of USA, vol. 103, 2006, pp.10186 - 10191. Они идентичны, за исключением небольшого сжатия соединения 1 на ребрах ячейки, которое, полагают, основано на обычных длинах связей Li-N, B-N и Zn-N. Поэтому в синтезе соединения 1 демонстрируют концепцию замещения двухвалентного металла в нейтральном тетраэдрическом каркасе ZIF чередующимися одновалентными и трехвалентными элементами, при этом сохраняя тип каркаса.
| Таблица 4 | |||||
| Сравнение композиций и параметров элементарной ячейки соединения 1 и ZIF-4 | |||||
| Материал | Композиция каркаса | Параметры элементарной ячейки | |||
| Пространственная группа | а (Å) | b(Å) | с (Å) | ||
| ZIF-4 | Zn(IM)2 | Pbca, орторомбическая | 15,395(2) | 15,307(2) | 18,426(2) |
| Соединение 1 | LiB(IM)4 | Pbca, орторомбическая | 14,382(5) | 14,809(5) | 17,869(6) |
Пример 2
Для демонстрации темплатного действия ТГФ в синтезе соединения 1, пример 1 повторяли без добавления ТГФ и получали игольчатый микрокристаллический продукт LiB(IM)4 (соединение 2). Крупные кристаллы соединения 2, подходящие для монокристаллической рентгеновской дифракции, получали альтернативным путем, который представляет собой очень медленную трансформацию соединения 1 в соединение 2 в ТГФ при условиях окружающей среды. Способ трансформации кристалла вероятно включает следовое количество воды, присутствующей в ТГФ, и обычно протекает в основном примерно за один месяц. Игольчатый микрокристаллический продукт и крупные кристаллы являются одинаковой кристаллической фазой, что доказывается превосходным согласием картины порошковой рентгеновской дифракции первого и картины, вычисленной из кристаллической структуры последнего (Фиг.3).
Кристаллическая структура соединения 2 была успешно определена и детализирована (таблицы 5 и 6). LiB(IM)4 тетраэдрический каркас соединения 2 является непористым и, следовательно, не содержит молекул-гостей. Это доказывается очень низкими остаточными электронными плотностями конечной сходящейся детализации структурной модели без каких-либо гостевых молекул (таблица 5). Измеренные длины связей соответствуют обычным значениям связей Li-N и B-N, и измеренные углы связей подтверждают тетраэдрическую координационную геометрию каждого атома Т (таблица 7). Что касается описываемого типа каркаса, соединение 2 представляет собой аналог ZIF-61 с переменной валентностью с типом каркаса zni, о котором сообщали Yaghi et al. в "High-Throughput Synthesis of Zeolitic Imidazolate Frameworks and Application to CO2 Capture", Science, vol. 319, 2008, pp.939-943 (таблица 8). По сравнению с ZIF-61 соединение 2 показывает небольшое сжатие на ребрах ячейки из-за разницы длины связей (Zn-N против Li-N и B-N) и небольшое понижение симметрии пространственной группы, обусловленное заменой единственного Т центра (Zn2+) двумя чередующимися Т центрами (Li+ и В3+).
| Таблица 5 | |
| Данные о кристаллическом строении и детализация структуры соединения | |
| Эмпирическая формула | С12 H12 В Li N8 [то есть, LiB(IM)4] |
| Масса | 286,05 |
| Температура | 100(2) K (-173°С) |
| Длина волны | 0,71073 Å |
| Кристаллическая система, | Тетрагональная, I41cd |
| пространственная группа |
| Размеры элементарной ячейки | а=22,4981 (7) Å α=90° |
| b=22,4981 (7) Å β=90° | |
| с=11,5015(6) Å γ=90° | |
| Объем | 5821,7(4) Å3 |
| Z, Вычисленная площадь | 16, 1,305 г/см3 |
| Коэффициент поглощения | 0,086 мм-1 |
| F(000) | 2368 |
| Размер кристалла | 0,13×0,02×0,02 мм |
| Диапазон угла тэта для сбора данных | от 1,81° до 28,28° |
| Границы показателей | -29≤h≤29, -29≤k≤29, -14≤/≤14 |
| Собранные отражения/единственные | 80347/3505 [Rint=0,1380] |
| Завершенность для тэта=28,28 | 98,3% |
| Способ детализации | Метод наименьших квадратов с полной матрицей на F2 |
| Данные/ограничения/параметры | 3505/1/199 |
| Степень согласия на F2 | 0,969 |
| Конечные показатели R [I>2σ(1)] | R1=0,0345, wR2=0,0766 |
| Показатели R (все данные) | R1=0,0493, wR2=0,0827 |
| Наибольшие разностный пик и дырка | 0,204 и -0,200 e-/Å3 |
| Таблица 6 | ||||
| Атомные координаты (x 104) и эквивалентные параметры изотропного смещения (Å2×103) для соединения 2U(eq) определяют как одну третью следа ортогонализированного тензора Uij | ||||
| x | y | z | U(eq) | |
| В(1) | 1485(1) | 993(1) | 3244(1) | 12(1) |
| С(1) | 2494(1) | 918(1) | 4386(1) | 15(1) |
| С(2) | 1958(1) | 1701(1) | 4775(1) | 16(1) |
| С(3) | 2471(1) | 1719(1) | 5396(1) | 16(1) |
| С(4) | 1396(1) | 1130(1) | 999(1) | 15(1) |
| С(5) | 1606(1) | 1940(1) | 1959(2) | 18(1) |
| С(6) | 1510(1) | 2068(1) | 817(1) | 20(1) |
| С(7) | 374(1) | 1311(1) | 3253(1) | 16(1) |
| С(8) | 694(1) | 973(1) | 4918(1) | 19(1) |
| С(9) | 100(1) | 1091(1) | 4981(1) | 22(1) |