Способ получения хинолоновых соединений
Иллюстрации
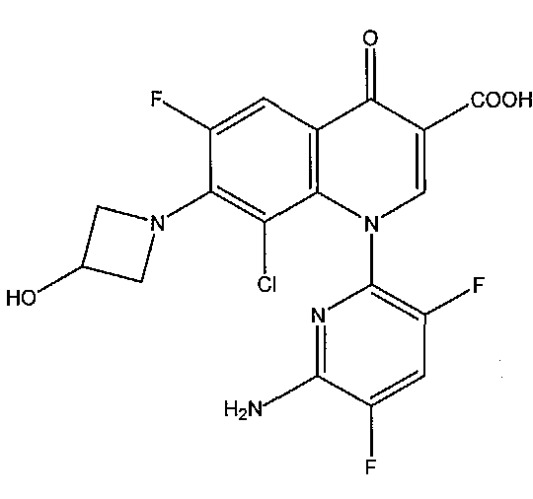
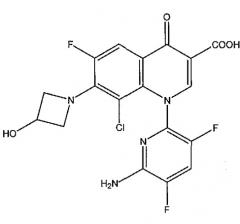
Показать всеИзобретение относится к области органической химии, а именно к способу получения хинолонового соединения, включающему стадию взаимодействия дехлорхинолонового соединения, или его фармацевтически приемлемой соли, или эфира с хлорирующим агентом и кислотой, в котором молярное отношение кислоты к дехлорхинолоновому соединению составляет от 0,008 до 0,012 и в котором получают менее чем 0,40% димерной примеси в процентах площади в расчете на полученное хинолоновое соединение, и где хинолоновое соединение представляет собой 1-(6-амино-3,5-дифторпиридин-2-ил)-8-хлор-6-фтор-7-(3-гидроксиазетидин-1-ил)-4-оксо-1,4-дигидрохинолин-3-карбоновую кислоту, или ее фармацевтически приемлемую соль, или эфир, дехлорхинолоновое соединение представляет собой 1-(6-амино-3,5-дифторпиридин-2-ил)-6-фтор-7-(3-гидроксиазетидин-1-ил)-4-оксо-1,4-дигидрохинолин-3-карбоновую кислоту, или ее фармацевтически приемлемую соль, или эфир и димерная примесь представляет собой 1-амино-3-(азетидин-3-илиокси)пропан-2-олбис(Ν,Ν′-хинолонкарбоновую кислоту), или ее фармацевтически приемлемую соль, или эфир. Технический результат: разработан улучшенный способ получения производного хинолона, полезного в качестве противоинфекционного средства. 14 з.п. ф-лы, 21 ил., 2 пр., 2 табл.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ НАСТОЯЩЕЕ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к области получения противоинфекционных соединений. Более конкретно, настоящее изобретение относится к получению семейства хинолоновых соединений, пригодных в качестве противоинфекционных средств. Настоящее изобретение относится к способу получения хинолонового соединения, согласно которому получают менее чем приблизительно 0,40% димерной примеси хинолона.
Предшествующий уровень техники
С момента открытия пенициллина в 1920-ых и стрептомицина в 1940-ых получено или специально сконструировано много новых соединений для применения в качестве антибактериальных средств. Когда-то считали, что применяя данные терапевтические средства можно бороться или полностью искоренить инфекционные заболевания. Появились устойчивые штаммы грамположительных бактерий, такие как устойчивые к метициллину стафилококки, устойчивые к пенициллину стрептококки и устойчивые к ванкомицину энтерококки, которые могут вызывать серьезные и даже смертельные случаи у пациентов, инфицированных данными устойчивыми бактериями. Появились бактерии, которые являются устойчивыми к макролидным антибиотикам, т.е. антибиотикам на основе 14-16-членного лактонового кольца. Кроме того, обнаружены устойчивые штаммы грамотрицательных бактерий, такие как H. influenzae и M. catarrhalis. См., например, F. D. Lowry, "Antimicrobial Resistance: The Examples of Staphylococcus aureus," J. Clin. Invest., 2003, 7/7(9), 1265-1273 и Gold, H.S. and Moellering, R.C., Jr., "Antimicrobial-Drug Resistance," N. Engl. J. Med, 1996, 335, 1445-53.
Несмотря на данную проблему повышения устойчивости к антибиотикам новые основные классы антибиотиков для клинического применения не разрабатывались с момента санкционирования в Соединенных Штатах в 2000 году антибиотика, содержащего оксазолидиноновое кольцо, N-[[(5S)-3-[3-фтор-4-(4-морфолинил)фенил]-2-оксо-5-оксазолидинил]метилацетамида, который известен как линезолид и продается под торговым названием Zyvox® (см. соединение A). См. R.C. Moellering, Jr., "Linezolid: The First Oxazolidinone Antimicrobial," Annals of Internal Medicine, 2003, 735(2), 135-142.
Линезолид является одобренным для применения в качестве антибактериального средства, активного против грамположительных организмов. К несчастью, уже сообщалось об устойчивых к линезолиду организмах. См. Tsiodras et al., Lancet, 2001, 358, 207; Gonzales et al., Lancet, 2001, 357, 1 179; Zurenko et al., Proceedings Of The 39th Annual lnterscience Conference On Antibacterial Agents and Chemotherapy (ICAAC); San Francisco, CA, USA, (September 26-29, 1999).
Несмотря на вышеизложенное существует постоянная необходимость в новых противоинфекционных средствах и в способах их получения.
Краткое описание фигур
На Фиг.1 показаны предсказанные профили для количества димерной примеси 4, когда этилацетат (EtOAc) является растворителем. Это основано на первоначальном дизайне экспериментов. Центральная линия каждого графика показывает прогнозируемые значения и две линии, фланкирующие центральную линию, представляют приблизительно +95 процентов степень достоверности. Горизонтальная пунктирная линия показывает концентрацию димера 4 0,235094 процентов. Вертикальные пунктирные линии показывают переменные для 1,05 эквивалентов N-хлорсукцинимида (NCS), 3,5 мольных процентов серной кислоты, 17°C, 0,05 процентов содержания воды в растворителе и скорости добавления NCS 0,1 объема в минуту. 95-процентный предел достоверности представляет собой ±0,040991 для величин, показанных в предыдущем предложении.
На Фиг.2 показано влияние H2SO4 и времени на концентрацию димерной примеси 4.
На Фиг.3 показан худший вариант для предсказанного профиля для количества димерной примеси 4 для устойчивости DoE, т.е. для второго дизайна экспериментов. Центральная линия каждого графика показывает прогнозируемые значения и две линии, фланкирующие центральную линию, представляют приблизительно ±95 процентов степень достоверности. Горизонтальная пунктирная линия показывает концентрацию димера 4 0,1045 процентов. Вертикальные пунктирные линии показывают переменные для 1,04 эквивалентов N-хлорсукцинимида (NCS), 21°C, скорости добавления NCS 30 минут и 0,8 мольных процентов серной кислоты. 95-процентный предел достоверности представляет собой +0,009339 для величин, показанных в предыдущем предложении.
На Фиг.4 показан первоначальный дизайн экспериментальной таблицы экспериментов.
На Фиг.5a показаны истинные значения с помощью предсказанного графика для первоначального дизайна экспериментов фиг.4.
На Фиг.5b показан итог аппроксимации для первоначального дизайна экспериментов фиг.4.
На Фиг.5c показан анализ дисперсии для первоначального дизайна фиг.4.
На Фиг.5d показаны оценки значения параметров для первоначального дизайна экспериментов фиг.4.
На Фиг.5e показан остаток с помощью предсказанного графика для первоначального дизайна экспериментов фиг.4.
На Фиг.5f показаны отсортированные оценки значения параметров для первоначального дизайна экспериментов фиг.4.
На Фиг.6a показаны предсказанные профили для первоначального дизайна экспериментов фиг.4.
На Фиг.6b показаны профили взаимодействия для первоначального дизайна экспериментов фиг.4.
На Фиг.7 показан устойчивый дизайн экспериментальной таблицы экспериментов для второго дизайна экспериментов.
На Фиг.8a показаны истинные значения с помощью предсказанного графика для второго дизайна экспериментов фиг.7.
На Фиг.8b показан итог аппроксимации для второго дизайна экспериментов фиг.7.
На Фиг.8c показан анализ дисперсии для второго дизайна экспериментов фиг.7.
На Фиг.8d показана рассогласованность для второго дизайна экспериментов фиг.7.
На Фиг.8e показаны оценки значения параметров для второго дизайна экспериментов фиг.7.
На Фиг.8f показан остаток с помощью предсказанного графика для второго дизайна экспериментов фиг.7.
На Фиг.8g показаны предсказанные профили для второго дизайна экспериментов фиг.7.
Сущность настоящего изобретения
Настоящее изобретение относится к области получения противоинфекционных соединений. Более конкретно, настоящее изобретение относится к получению семейства хинолоновых соединений, пригодных в качестве противоинфекционных средств.
Настоящее изобретение относится к способу получения хинолонового соединения, включающему стадию взаимодействия дехлорхинолонового соединения, или его фармацевтически приемлемой соли, или эфира с хлорирующим агентом и кислотой, в котором получают, менее чем приблизительно 0,40% в расчете на проценты площади, как определено количественно аналитической ВЭЖХ, димерной примеси хинолона.
В других вариантах осуществления настоящее изобретение относится к способу, в котором дэхлорхинолоновое соединение представляет собой 1-(6-амино-3,5-дифторпиридин-2-ил)-6-фтор-7-(3-гидрокси-азетидин-1-ил)-4-оксо-l,4-дигидрохинолин-3-карбоновую кислоту, или ее фармацевтически приемлемую соль, или эфир, хинолоновое соединение представляет собой 1-(6-амино-3,5-дифторпиридин-2-ил)-8-хлор-6-фтор-7-(3-гидроксиазетидин-1-ил)-4-оксо-1,4-дигидрохинолин-3-карбоновую кислоту, или ее фармацевтически приемлемую соль, или эфир.
В других вариантах осуществления настоящее изобретение относится к способу, в котором димерная примесь представляет собой соединение 1-амино-3-(азетидин-3-илокси)пропан-2-олбис(N,N'-хинолонкарбоновую кислоту), или ее фармацевтически приемлемую соль, или эфир. В других вариантах осуществления настоящее изобретение относится к способу, в котором димерная примесь представляет собой моноэфир. В других вариантах осуществления настоящее изобретение относится к способу, в котором димерная примесь представляет собой диэфир.
В других вариантах осуществления настоящее изобретение относится к способу, в котором хлорирующий агент представляет собой N-хлорсукцинимид.
В других вариантах осуществления настоящее изобретение относится к способу, в котором кислоту выбирают из группы, состоящей из серной кислоты, хлористоводородной кислоты, бромистоводородной кислоты, фосфорной кислоты, трифторуксусной кислоты, трифторметансульфокислоты, метансульфокислоты, п-толуолсульфокислоты или перхлорной кислоты и их смесей.
В других вариантах осуществления настоящее изобретение относится к способу, в котором кислота представляет собой серную кислоту.
В других вариантах осуществления настоящее изобретение относится к способу, в котором взаимодействие проводят при температуре от приблизительно 0°C до приблизительно 30°C.
В других вариантах осуществления настоящее изобретение относится к способу, в котором взаимодействие проводят при температуре от приблизительно 15°C до приблизительно 25°C.
В других вариантах осуществления настоящее изобретение относится к способу, в котором взаимодействие проводят при температуре от приблизительно 13°C до приблизительно 21°C.
В других вариантах осуществления настоящее изобретение относится к способу, в котором молярное отношение N-хлорсукцинимида к дэхлорхинолону составляет более чем приблизительно 1.
В других вариантах осуществления настоящее изобретение относится к способу, в котором молярное отношение N-хлорсукцинимида к дэхлорхинолону составляет от приблизительно 1,05 до 1,2.
В других вариантах осуществления настоящее изобретение относится к способу, в котором молярное отношение N-хлорсукцинимида к дэхлорхинолону составляет от приблизительно 1,04 до 1,07.
В других вариантах осуществления настоящее изобретение относится к способу, в котором молярное отношение серной кислоты к дэхлорхинолону составляет от приблизительно 0,005 до приблизительно 0,05.
В других вариантах осуществления настоящее изобретение относится к способу, в котором молярное отношение серной кислоты к дэхлорхинолону составляет от приблизительно 0,007 до приблизительно 0,02.
В других вариантах осуществления настоящее изобретение относится к способу, в котором молярное отношение серной кислоты к дэхлорхинолону составляет от приблизительно 0,008 до приблизительно 0,012.
В других вариантах осуществления настоящее изобретение относится к способу, в котором применяют эфир ацетата в качестве растворителя.
В других вариантах осуществления настоящее изобретение относится к способу, в котором эфир ацетата выбирают из группы, состоящей из метилацетата, этилацетата и их смесей.
В других вариантах осуществления настоящее изобретение относится к способу, в котором упомянутый эфир ацетата представляет собой метилацетат.
В других вариантах осуществления настоящее изобретение относится к способу, включающему дополнительную стадию взаимодействия хинолонового соединения с основанием.
В других вариантах осуществления настоящее изобретение относится к способу, в котором основание представляет собой гидроксид.
В других вариантах осуществления настоящее изобретение относится к способу, в котором гидроксид выбирают из группы, состоящей из гидроксида натрия, гидроксида калия, гидроксида лития, гидроксида бария и их смесей.
В других вариантах осуществления настоящее изобретение относится к способу, в котором гидроксид представляет собой гидроксид калия.
В других вариантах осуществления настоящее изобретение относится к способу, в котором применяют смесь C1-C6 спирта и воды в качестве растворителя.
В других вариантах осуществления настоящее изобретение относится к способу, в котором C1-C6 спирт представляет собой изопропанол.
В других вариантах осуществления настоящее изобретение относится к способу, в котором способ представляет собой способ в коммерческом масштабе.
В других вариантах осуществления настоящее изобретение относится к композиции, содержащей хинолоновое соединение или его соль или эфир, содержащий менее чем приблизительно 0,40% димерной примеси хинолонового соединения.
В других вариантах осуществления настоящее изобретение относится к композиции, в которой хинолоновое соединение представляет собой 1-(6-амино-3,5-дифторпиридин-2-ил)-8-хлор-6-фтор-7-(3-гидрокси-азетидин-1-ил)-4-оксо-l,4-дигидрохинолин-3-карбоновую кислоту, или ее фармацевтически приемлемую соль, или эфир.
В других вариантах осуществления настоящее изобретение относится к композиции, в которой димерная примесь представляет собой 1-амино-3-(азетидин-3-илокси)пропан-2-олбис(N,N'-хинолонкарбоновую кислоту), или ее фармацевтически приемлемую соль, или эфир.
В других вариантах осуществления настоящее изобретение относится к композиции, в которой композиция представляет собой композицию в коммерческом масштабе.
В других вариантах осуществления настоящее изобретение относится к способу или композиции, в которой димерная примесь составляет менее чем приблизительно 0,35%.
В других вариантах осуществления настоящее изобретение относится к способу или композиции, в которой димерная примесь составляет менее чем приблизительно 0,30%.
В других вариантах осуществления настоящее изобретение относится к способу или композиции, в которой димерная примесь составляет менее чем приблизительно 0,25%.
В других вариантах осуществления настоящее изобретение относится к способу или композиции, в которой димерная примесь составляет менее чем приблизительно 0,20%.
В других вариантах осуществления настоящее изобретение относится к способу или композиции, в которой димерная примесь составляет менее чем приблизительно 0,15%.
В других вариантах осуществления настоящее изобретение относится к способу или композиции, в которой димерная примесь составляет менее чем приблизительно 0,10%.
В других вариантах осуществления настоящее изобретение относится к способу или композиции, в которой димерная примесь составляет менее чем приблизительно 0,05%.
В других вариантах осуществления настоящее изобретение относится к способу или композиции, в которой димерная примесь составляет менее чем приблизительно 0,04%.
В других вариантах осуществления настоящее изобретение относится к способу или композиции, в которой димерная примесь составляет менее чем приблизительно 0,03%.
В других вариантах осуществления настоящее изобретение относится к способу или композиции, в которой димерная примесь составляет менее чем приблизительно 0,02%.
В других вариантах осуществления настоящее изобретение относится к способу или композиции, в которой упомянутая димерная примесь составляет менее чем приблизительно 0,01%.
Подробное описание настоящего изобретения
Хинолоны
Способы и композиции настоящего изобретения включают хинолоновое соединение.
Хинолоновые соединения, такие как производные пиридонкарбоновой кислоты, пригодные в настоящем изобретении, описывают, включая их получение, формулирование и применение, в патенте США № 6156903, Yazaki et al., опубликованном 5 декабря 2000 и его список замеченных опечаток 13 ноября 2001 и 11 декабря 2001; в патенте США № 6133284, Yazaki et al., опубликованном 17 октября 2000; в патенте США № 5998436, Yazaki et al., опубликованном 7 декабря 1999 и его список замеченных опечаток 23 января 2001, 30 октября 2001 и 17 декабря 2002; в PCT заявке № WO 2006/1 10815, Abbott Laboratories, опубликованной 1 октября 2006; в PCT заявке № WO 2006/042034, Abbott Laboratories, опубликованной 20 апреля 2006, в PCT заявке № WO 2006/015194, Abbott Laboratories, опубликованной 9 февраля 2006; в PCT заявке № WO 01/34595, Wakunaga Pharmaceutical Co., Ltd., опубликованной 17 мая 2001, и в PCT заявке № WO 97/1 1068, Wakunaga Pharmaceutical Co., Ltd., опубликованной 27 марта 1997.
Производные пиридонкарбоновой кислоты настоящего изобретения включают соединения, соответствующие следующей структуре. (Производное 1 пиридонкарбоновой кислоты)
Производное 1 пиридонкарбоновой кислоты, в которой R1 представляет собой атом водорода или защитную группу карбоксильной функции; R2 представляет собой гидроксильную группу, низшую алкоксигруппу, или замещенную, или незамещенную аминогруппу; R3 представляет собой атом водорода или атом галогена; R4 представляет собой атом водорода или атом галогена; R5 представляет собой атом галогена или необязательно замещенную насыщенную циклическую аминогруппу; R6 представляет собой атом водорода, атом галогена, нитрогруппу или необязательно защищенную аминогруппу; X, Y и Z могут быть одинаковыми или различными и соответственно представлять собой атом азота, CH или CR7 (в которой R7 представляет собой низшую алкильную группу, атом галогена или цианогруппу), при условии, что по меньшей мере один из X, Y и Z представляет собой атом азота, и W представляет собой атом азота или CR8 (в которой R8 представляет собой атом водорода, атом галогена или низшую алкильную группу), и при условии, что когда R1 представляет собой атом водорода, R2 представляет собой аминогруппу, R3 и R4 представляют собой атом фтора, R6 представляет собой атом водорода, X представляет собой атом азота, Y представляет собой CR7 (в которой R7 представляет собой атом фтора), Z представляет собой CH, и W представляет собой CR8 (в которой R8 представляет собой атом хлора), тогда R5 не представляет собой 3-гидроксиазетидин-1-ильную группу или их фармацевтически приемлемую соль, эфир или пролекарство.
Как описано выше, когда R1 представляет собой защитную группу карбоксильной функции, она может представлять собой любой остаток эфира карбоновой кислоты, который относительно легко расщепляется, давая соответствующую свободную карбоксильную группу. Примеры защитных групп карбоксильной функции включают защитные группы, которые отщепляются гидролизом, каталитическим восстановлением и другими обработками в мягких условиях, такие как низшие алкильные группы, такие как метильная группа, этильная группа, н-пропильная группа, изопропильная группа, н-бутильная группа, изобутильная группа, трет-бутильная группа, пентильная группа, гексильная группа и гептильная группа; низшие алкенильные группы, такие как винильная группа, аллильная группа, 1-пропенильная группа, бутенильная группа, пентенильная группа, гексенильная группа и гептенильная группа; аралкильные группы, такие как бензильная группа; и арильные группы, такие как фенильная группа и нафтильная группа; и группы, которые можно легко удалить в несколько этапов, такие как низшие алканоилокси низшие алкильные группы, такие как ацетоксиметильная группа и пивалоилоксиметильная группа; низшие алкоксикарбонилокси низшие алкильные группы, такие как метоксикарбонилоксиметильная группа и 1-этоксикарбонилоксиэтильная группа; низшая алкоксиметильная группа, такая как метоксиметильная группа; лактонильная группа, такая как фталидил; ди- низшие алкиламино низший алкильная группа, такая как 1-диметиламиноэтильная группа; и (5-метил-2- оксо-1,3-диоксол-4-ил)метильная группа.
Следует отметить, что заместители R1, R2, R3, R4, R5, R6, R7, R8, R9, A, J1, J2, J3, W, X, Y, Z, e, f и g определяют в настоящем изобретении для удобства относительно химической структуры производных пиридонкарбоновой кислоты.
В других вариантах осуществления настоящее изобретение относится к способу получения производного пиридонкарбоновой кислоты, имеющего структуру производного 1 пиридонкарбоновой кислоты, в котором W представляет собой CR8, в которой R8 представляет собой атом водорода, атом галогена или низшую алкильную группу.
В других вариантах осуществления настоящее изобретение относится к способу получения производного пиридинкарбоновой кислоты, имеющего структуру производного 1 пиридинкарбоновой кислоты, в котором R5 представляет собой группу, представленную следующими формулами (a) или (b):
(a)
(b)
в которых A представляет собой атом кислорода, атом серы или NR9 (в которой R9 представляет собой атом водорода или низшую алкильную группу), e представляет собой число от 3 до 5, f представляет собой число от 1 до 3, g представляет собой число от 0 до 2, J1, J2 и J3, которые могут быть одинаковыми или отличными друг от друга, представляют собой атом водорода, гидроксильную группу, низшую алкильную группу, амино низшую алкильную группу, аминогруппу, низшую алкиламиногруппу, низшую алкоксигруппу или атом галогена.
В других вариантах осуществления настоящее изобретение относится к способу получения производного пиридинкарбоновой кислоты, имеющего структуру производного 1 пиридинкарбоновой кислоты, в котором R5 представляет собой группу, представленную формулой (a).
(a)
В других вариантах осуществления настоящее изобретение относится к способу получения производного пиридинкарбоновой кислоты, имеющего структуру производного 1 пиридинкарбоновой кислоты, в котором e в формуле (a) равно 3 или 4.
(a)
В других вариантах осуществления настоящее изобретение относится к способу получения производного пиридинкарбоновой кислоты, имеющего структуру производного 1 пиридинкарбоновой кислоты, в котором R1 представляет собой атом водорода; R2 представляет собой аминогруппу, низшую алкиламиногруппу или ди- низшую алкиламиногруппу; R3 представляет собой атом галогена; R4 представляет собой атом галогена; R представляет собой атом водорода; X представляет собой атом азота; Y и Z представляют собой CH или CR7 (в которой R7 представляет собой низшую алкильную группу или атом галогена); и W представляет собой CR8 (в которой R8 представляет собой атом галогена или низшую алкильную группу).
В других вариантах осуществления настоящее изобретение относится к способу получения производного пиридинкарбоновой кислоты, имеющего структуру производного 1 пиридинкарбоновой кислоты, в котором R2 представляет собой аминогруппу; R3 представляет собой атом фтора; R4 представляет собой атом фтора; Y представляет собой CF; Z представляет собой CH; W представляет собой CR8 (в которой R8 представляет собой атом хлора, атом брома или метильную группу), и e в формуле (a) равно 3.
(a)
В других вариантах осуществления настоящее изобретение относится к способу получения пиридонкарбоновой кислоты, где упомянутая пиридонкарбоновая кислота соответствует следующей структуре:
или ее фармацевтически приемлемой соли, эфира или пролекарства. Данная вышеуказанная пиридонкарбоновая кислота также известна под общедоступным кодовыми наименованиями Abbott Laboratories ABT-492, Wakunaga Pharmaceutical Co., Ltd. WQ 3034, Rib-X Pharmaceuticals, Inc., RX-3341, USAN делафлоксацин и также под химическими названиями 1-(6-амино-3,5-дифтор-2-пиридинил)-8-хлор-6-фтор-1,4-дигидро-7-(3-гидрокси-1-азетидинил)-4-оксо-3-хинолинкарбоновая кислота, 1-(6-амино-3,5-дифтор-2-пиридинил)-8-хлор-6-фтор-1,4-дигидро-7-(3-гидроксиазетидин-1-ил)-4-оксо-3-хинолинкарбоновая кислота, 3-хинолинкарбоновая кислота, 1-(6-амино-3,5-дифтор-2-пиридинил)-8-хлор-6-фтор-1,4-дигидро-7-(3-гидрокси-1-азетидинил)-4-оксо и 1-(6-амино-3,5-дифторпиридин-2-ил)-8-хлор-6-фтор-7-(3-гидроксиазетидин-1-ил)-4-оксо-1,4-дигидрохинолин-3-карбоновая кислота. Данная форма соединения карбоновой кислоты соответствует CAS регистрационному номеру 189279-58-1. Кроме того, WO 2006/042034, цитируемая выше, описывает D-глюцитольную соль данного соединения [D-глюцитол 1-(6-амино-3,5-дифтор-2-пиридинил)-8-хлор-6-фтор-1,4-дигидро-7-(3-гидрокси-1-азетидинил)-4-оксо-3-хинолинкарбоксилат (соль)] и тригидрат D-глюцитольной соли данного соединения [D-глюцитол 1-(6-амино-3,5-дифтор-2-пиридинил)-8-хлор-6-фтор-1,4-дигидро-7-(3-гидрокси-1-азетидинил)-4-оксо-3-хинолинкарбоксилат тригидрат (соль)]. D-глюцитольная соль и тригидрат D-глюцитольной соли соответствуют CAS регистрационным номерам 352458-37-8 и 883105-02-0 соответственно. D-глюцитол соответствует CAS регистрационному номеру 6284-40-8. WO 2006/042034 также описывает кристаллическую форму D-глюцитольной соли, охарактеризованную при измерении при приблизительно 25°C с Cu-Ka облучением, порошковой рентгенограммой, показанной на фиг.1 (см. WO 2006/042034), и кристаллическую форму тригидрата D-глюцитольной соли при измерении при приблизительно 25°C с Cu-Ka облучением, порошковой рентгенограммой, показанной на фиг.2 (см. WO 2006/042034). Данные D-глюцитольные соли являются пригодными в настоящем изобретении. Кроме того, см. A. R. Haight et al., "Synthesis of Quinolona ABT-492: Crystallizations for Optimal Processing", Organic Process Research & Development (2006), 10(4), 751-756.
Термины "способ в коммерческом масштабе" и "композиция в коммерческом масштабе" относится к способу и композиции, соответственно, который осуществляют или которую получают за один цикл в количестве по меньшей мере приблизительно 100 грамм.
Обнаружение и подавление образования димерной примеси при получении делафлоксацина
См. Hanselmann, R., et al., "Identification and Suppression of a Dimer Impurity in the Development of Delafloxacin", Organic Process Research & Development, vol. 13, pages 54-59 (2009).
Делафлоксацин представляет собой 6-фторхинолоновый антибиотик, который разрабатывается в Rib-X Pharmaceuticals, Inc. В процессе первоначальных попыток масштабирования по получению делафлоксацина образовывалось вплоть до 0,43% новой примеси на предпоследней стадии хлорирования. Она была идентифицирована как димерный аддукт делафлоксацина. Последующее применение дизайна экспериментов (DoE) привело к обнаружению факторов, ответственных за образование данной примеси. Использование знаний, полученных у DoE, позволило воспроизводимо подавлять данную примесь до приемлемого уровня.
Противомикробная устойчивость в привычной социальной среде и в больничных условиях вызывает возрастающую озабоченность в здравоохранении в результате непрерывного появления бактериальных штаммов, устойчивых ко многим лекарственным средствам. См. (a) Cosgrove, S. E.; Carmeli, Y. Clin. Infect. Dis. 2003, 36, 1433. (b) Seybold, U.; Kourbatova, E. V.; Johnson, J. G.; Halvosa, S. J.; Wang, Y. F.; King, M. D.; Ray, S. M.; Blumberg, H. M. Clin. Infect. Dis. 2006, 42, 647 и (c) Tenover, F. C; McDougal, L. K.; Goering, R. V.; Killgore, G.; Projan, S. J.; Patel, J. B.; Dunman, P. M. J. Clin. Microbiol. 2006, 44, 108.
Метициллин-устойчивый золотистый стафилококк (MRSA) занимает первое место как наиболее часто выделяемый патогенный организм в больничных блоках интенсивной терапии в Соединенных Штатах и частота MRSA случаев увеличилась с 35,9% в 1992 до 64,4% в 2003. См. Klevens, R.M.; Edwards, J. R.; Tenover, F. C; McDonald, L. C; Horan, T.; Gaynes, R. Clin. Infect. Dis. 2006, 42, 389.
С момента введения налидиксовой кислоты приблизительно 40 лет назад, хинолоновые антибиотики занимают главное место в списке антибиотиков. 6-Фторхинолоны, такие как ципрофлоксацин, приобрел особенно возросшую роль при лечении инфекций благодаря его широкому спектру применения. См. (a) Bush, K. Clin. Microbiol. Infect. 2004, 10 (Suppl. 4), 10. и (b) Emmerson, A. M.; Jones, A. M. J. Antimicrob. Chemother. 2003, 51 (Suppl. Sl), 13.
Делафлоксацин представляет собой 6-фторхинолоновый антибиотик с превосходной антибактериальной активностью против грамположительных организмов, включая и метициллин-чувствительные S aureus и MRSA. В настоящее время он проходит вторую фазу клинических испытаний. Делафлоксацин первоначально получен Wakunaga Pharmaceuticals и Abbott Laboratories и был впоследствии запатентован Rib-X Pharmaceuticals, Inc.
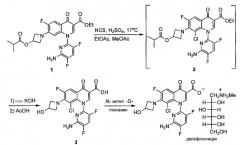
Получение делафлоксацина первоначально было разработано Abbott Laboratories (Схема 1) и ключевой стадией в данной схеме является селективное хлорирование 8-положения функционализированного хинолона 1 (дэхлорхинолон). См. (a) Haight, A. R.; Ariman, S. Z.; Barnes, D. M.; Benz, N. J.; Gueffier, F. X.; Henry, R. F.; Hsu, M. C; Lee, E. C; Morin, L.; Pearl, K. B.; Peterson, M. J. ; Plata, D. J.; Willcox, D. R. Org. Process Res. Dev. 2006, 4, 751. и (b) Barnes, D. M.; Christesen, A. C; Engstrom, K. M.; Haight, A. R.; Hsu, M. C; Lee, E. C; Peterson, M. J.; Plata, D. J.; Raje, P. S.; Stoner, E. J.; Tedrow, J. S.; Wagaw, S. Org. Process Res. Dev. 2006, 4, 803.
В данном способе раствор 1 в смеси метилацетата (MeOAc) и этилацетата хлорировали, применяя NCS в присутствии 3,5 моль % H2SO4, получая 2. За этим следовала замена растворителя и омыление KOH для того, чтобы получить 3. Делафлоксацин получали после образования соли с N-метил-D-глюкамином.
Схема 1: Получение делафлоксацина
Несмотря на первоначальный успех при внедрении данного способа авторы изобретения столкнулись с трудностями при масштабировании данной стадии, заключающимися в том, что вплоть до 0,43 % по площади новой примеси обнаружили с помощью ВЭЖХ и RRT 1.60 после выделения 3. Кроме того, оказалось, что данную новую примесь трудно удалить в процессе конечного образования соли. Таким образом, авторы изобретения решили начать исследования по установлению данной примеси, понять, как она образуется, и подавить ее образование.
Результаты и обсуждение
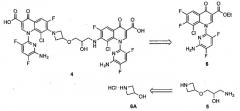
Несмотря на многочисленные попытки выделить данную новую примесь препаративной ВЭЖХ авторам изобретения не удалось сделать это и был установлен только молекулярный вес с помощью HPLC-MS 880 Да. Измеренный молекулярный вес данной примеси точно в два раза больше молекулярного веса кислоты 3, что предполагает димерное производное данного соединения. Тщательное исследование профиля чистоты субстрата реакции хлорирования не привели к обнаружению какой-либо примеси, которой можно было бы аналогично приписать димерную структуру и ее образование, следовательно, было отнесено к последовательности хлорирование-гидролиз. Был рассмотрен ряд потенциальных димерных аддуктов, которые могли бы образовываться на данной стадии, включая 4, который мог быть результатом расщепления азетидиновой группировки в одной молекуле 3 и реакции гидроксильной группы второй молекулы. Для того чтобы дополнительно исследовать данную возможность, авторы изобретения приступили к получению 4.
Схема 2: Ретросинтез предполагаемой примеси 4
Ретросинтетически (Схема 2) молекула 4 легко размыкается на подходящим образом защищенный аминоспирт 5 и хинолон 6; последний является известным соединением. Фрагмент 5 можно получить из имеющегося в продаже гидрохлорида азетидин-3-ола 7. См. (a) Yazaki, A.; Niino, Y.; Ohshita, Y.; Hirao, Y.; Amano, H.; Hayashi, N.; Kuramoto, Y. PCT международная заявка WO 9711068, 1997. CAN: 126, 305587 и (b) Yazaki, A.; Aoki, S. PCT международная заявка WO 2001034595, 2001. CAN: 134, 366811.
Таким образом, синтез начинали с 7, в котором атом азота защищали в виде бензилкарбамата для того, чтобы получить 8 с количественным выходом. Данный аддукт алкилировали рацемическим эпихлоргидрином для того, чтобы получить 9 с выходом 84%. Раскрытие эпоксида 9 аммиаком давало 10, которое конденсировали без очистки с 6 для того, чтобы получить 11 c суммарным выходом 83%. Удаление Cbz группы в условиях гидрирования давало 12 с выходом 93%. Вторая конденсация с 6 приводила к образованию димерного соединения 13 с выходом 71%. После омыления предполагаемую примесь 4 получали с выходом 98%.
Схема 3: Синтез примеси 4
С синтезированным 4 в наличии неизвестную примесь в загрязненной порции делафлоксацина сравнивали с полученным 4 с помощью приведенных экспериментов и сравнивали с помощью HPLC-MS и HPLC-UV. Оказалось, что синтетическое 4 однозначно соответствовало неизвестной примеси, наблюдаемой в ранее полученных порциях делафлоксацина.
Для того чтобы понять динамику образования примеси 4, авторы изобретения решили дополнительно исследовать реакцию в исследованиях дизайна экспериментов (DoE). Следующие факторы выбирали для изучения в DoE исследовании разрушения IV, в диапазонах, как показано: температура (15-25°C), количество NCS (1,05-1,2 экв.), количество H2SO4 (2-5 моль %), содержание воды в растворителе (0-0,5%), объем растворителя (2-3 об.), растворитель (метилацетат/этилацетат) и скорость добавления NCS (0,05-0,3 об/мин). См. фиг.4, фиг.5a, 5b, 5c, 5d, 5e и 5f, фиг.6a и 6b, фиг.7 и фиг.8a, 8b, 8c, 8d, 8e, 8f и 8g. Проводили всего 19 реакций хлорирования в MultiMaxTM реакторе, полученном у Mettler-Toledo, Inc., 1900 Polaris Parkway, Columbus, OH, 43240.
В каждом случае образцы из реакций гасили через 5 ч, омыляли KOH и неочищенные реакционные смеси анализировали ВЭЖХ. Для того чтобы определить количество 4, хлорированные образцы 2 омыляли до 3. Величину площади в процентах для примеси 4, которая была получена в каждом случае, обрабатывали и анализировали, применяя DoE программное обеспечение. Дизайн эксперимента и анализ проводили, применяя JMP, Design of Experiments, Version 7, SAS Institute Inc., Cary, NC, 1989-2007, применяя пошаговое приближение, с последующим стандартным способом наименьших квадратов.
Превосходную корреляцию R2 0,997 получали, следуя обработке данных. Основные эффекты: большие количества NCS, снижение температуры и более быстрое добавление раствора NCS, а также применение сухих растворителей, оказывали наиболее благоприятный эффект на подавление количества примеси 4 (фиг.1). Применяли метилацетат, содержащий менее чем 500 частей на миллион воды, перед корректировкой, как требуется в подходящем эксперименте в DoE. Кроме того, сильное взаимодействие наблюдали между количеством NCS и растворителя в том, что метилацетат был предпочтительным, когда применяли только небольшой избыток NCS. Для того чтобы подавить какое-либо избыточное хлорирование 2, 1,05 эквивалента NCS было предпочтительным и, следовательно, метилацетат выбирали в качестве предпочтительного растворителя для данной стадии. Более подробный анализ можно найти на фиг.4, фиг.5a, 5b, 5c, 5d, 5e и 5f, фиг.6a и 6b, фиг.7 и фиг.8a, 8b, 8c, 8d, 8e, 8f и 8g.
С точки зрения механизма реакции, авторы изобретения пришли к выводу, что примесь 4 могла бы возникать в результате первоначальной катализируемой кислотой активации азетидинового кольца, которая вызывает изобутировый эфир/хлорид индуцированную последовательность раскрытия до 16. В процессе последующего омыления 16 реагирует с промежуточным соединением гидролиза 17 или 3 до 4 (Схема 4). Омыление и последующее образование эпоксида 16 перед конденсацией с 3 или 17 нельзя исключать. Обоснованность данной последовательности дополнительно усиливалась последующим HPLC-MS анализом неочищенной реакционной смеси хлорирования перед омылением. В нем примесь с молекулярным весом 574 Да, которая соответствует 16, обнаруживали в приблизительно равных количествах по сравнению с 4 после омыления.
Схема 4: Предлагаемый механизм образования примеси 4
На основании данного гипотетического механизма, временная зависимость для образования 4 в процессе хлорирования не может исключаться, и так как время реакции сохраняется постоянным в DoE исследовании, было решено оценить данный параметр независимо. Реакцию хлорирования проводили, применяя 3,5% H2SO4 и метилацетат в качестве растворителя при 15°C, и образец гасили после того, как считали, что реакция завершилась. Дополнительные образцы гасили через 2 ч и 6 ч, омыляли и анализировали ВЭЖХ. Вполне закономерно, наблюдали непрерывное увеличение количества примеси 4 с течением времени. Данный результат влияет на контроль процесса хлорирования в том, что адекватное изменение относительно времени для ВЭЖХ контроля данной реакции могло бы быть необходимо для того, чтобы снизить до минимума образование 4. Однако последующие эксперименты показали, что снижение количества H2SO4 до 1% уменьшает количество примеси 4, полученной с течением времени без значительного влияния на время реакции хлорирования или качество 3 (фиг.2). Таким образом, приемлемое изменение времени для технологического контроля можно достигнуть, когда концентрацию 1% H2SO4 применяют в качестве катализатора.
После установления критических параметров, касающихся образования данной примеси, проводили второе DoE изучение для исследования устойчивости реакции в предполагаемом эксплуатационном диапазона способа. В нем DoE изучение разложения IV конструировали следующими факторами, подвергающимися изменению: температура (13-21°C), количество NCS (1,04-1,07 экв.), скорость добавления NCS (30-75 мин) и H2SO4 (0,8-1,2 моль %). Проводили всего 10 реакций хлорирования в MultiMaxTM реакторе. В каждом случае образцы гасили и омыляли после прохождения контроля в процессе обработки. Полученную в результате площадь в процентах 4 обрабатывали и анализировали, применяя DoE программное обеспечение. Как и ожидалось, температура, количество NCS и H2SO4 имели статистически значимый эффект на количество примеси 4 в изучаемых диапазонах параметров. Однако принимая наихудший вариант в предполагаемом профиле, примесь 4 имела величину 0,11 площади в проц