Вакцина против гриппа
Иллюстрации
Показать всеИзобретение относится к биотехнологии. Описаны вакцины против гриппа, содержащие антиген штамма А/Калифорния/7/09 (H1N1) и адъювант, представляющий собой сферические аморфные наночастицы бетулина, или модифицированный фуллерен, или наночастицы гидроксиапатита. Изобретение расширяет арсенал средств предупреждения эпидемий гриппа. Вакцины по изобретению позволяют получать повышенный иммунитет по сравнению с вакцинами со стандартными адъювантами, такими как гидроксиалюминий. Вакцины по изобретению обладают высокой протективной активностью, при этом указанное свойство сохраняется и после шестимесячного хранения. 8 табл., 1 ил., 3 пр.
Реферат
Изобретение относится к биотехнологии, точнее к новым вакцинам против гриппа. Конкретнее изобретение относится к трем вакцинам против гриппа. Изобретение расширяет арсенал средств для предупреждения эпидемий гриппа. Вакцины по изобретению позволяют получать повышенный иммунитет по равнению с вакцинами со стандартными адъювантами, такими как гидроксиалюминий. Вакцины по изобретению обладают высокой протективной активностью, при этом указанное свойство сохраняется и после шести месячного хранения.
Инактивированные вирусные вакцины в течение последних 50 лет широко используются в борьбе с вирусными заболеваниями. Однако некоторые из них обладают серьезными недостатками. Так, в частности, гриппозные вакцины являются недостаточно эффективными для лиц пожилого возраста [Gross P. et al. 1995, Kobiyama K et al. 2009] и не способны защищать от дрейфовых вариантов вируса гриппа [Belshe R. et al. 2000]. Проблема повышения иммуногенности и защитной эффективности противогриппозных вакцин может быть решена путем использования адъювантов.
В настоящее время для повышения эффективности вакцин в экспериментальных и клинических исследованиях применяют адъюванты различного происхождения: минеральные (гидроксид или фосфат алюминия и др.); растительные (сапонины - Qui1A, QS21); микробные (убитые бактерии, липополисахарид и его производные, CpG-мотивы ДНК) и др. [Kositanont U. et al, 2012].
Вследствие токсичности или недостаточной эффективности большинства адъювантов для широкого клинического использования разрешены только соли и гель гидроокиси алюминия, водно-масляная эмульсия MF-59, а в некоторых странах вирусоподобные частицы (VLP - virus-like particles) и иммуностимулирующий комплекс (ISCOM - immunostimulating complex) [Baudner В et al., 2009, 6. Uematsu S. et al., 2005]. Зарубежные коммерческие гриппозные вакцины выпускаются лишь с одним адъювантом MF-59, и такие вакцины оказались более иммуногенными при вакцинации пожилых лиц, однако, обладали повышенной реактогенностью [Illum L., 1998]. Изучение новых адъювантов вакцин, обладающих высокой иммуногенностью и низкой реактогенностью, является одним из актуальных направлений совершенствования инактивированных вакцин [Zacharow et al., 2007; Ghendon et al, 2011].
Стандартным адъювантом для вакцин на основе вирусов является гидроксиалюминий. Вакцины против гриппа, содержащие данный адъювант хорошо известны специалисту, давно используются в повседневной практике и широко представлены в уровне технике. Такие вакцины известны, например, из RU 2493255 С2 20.09.13.
Из уровня техники известна публикация, сообщающая о возможном применении наночастиц гидроксиапатита в качестве адъюванта для вакцин против гриппа (RU 2010147941 А 27.05.12). Однако в данной публикации отсутствуют какие-либо сведения, раскрывающие достоверность этого утверждения. Кроме того, в указанной публикации отсутствуют сведения, раскрывающие концентрации антигена вируса гриппа и конкретный антиген, а также отсутствуют сведения об уровне защиты и сохранении протективных свойств после длительного хранения вакцины, такого как шесть месяцев.
Новым адъювантом, представленным в уровне технике, является фуллерен. Так в RU 2124022 С1 27.12.1998 предполагается наличие адъвантных свойств у одного из производных фуллерена. Однако в указанном источники отсутствуют какие-либо сведения о возможности использования данного вещества в качестве адъюванта для антигенов вирусной природы. Известно использование производного фуллерена в качестве адъюванта для бактериальных антигенов (RU 2184556 10.07.2002). В публикации Масалова О.В. Иммуностимулирующее действие водорастворимых производных фуллеренов перспективных адъювантов вакцин нового поколения //Доклады РАН.- 1999.- т. 369, №3. - С. 411 - 413 также сообщалось об адъвантной активности производных фуллерена. Однако данная активность касалась антигенов гепатита С. Ни в одном из обнаруженных источников не сообщалось о возможном использовании производных фуллерена в качестве адъюванта именно для антигена вируса гриппа, тем более нельзя предположить эффективность адъюванта при сочетании его со столь малыми дозами антигена.
Новым адъювантом представленным в уровне технике только одним примером (RU 2355423 С1 20.05.09) является бетулин. Для бетулина доказаны адъювантные свойства только для двух видов вирусов - вирусов гепатита В, при использовании его для усиления ответа на рекомбинантный поверхностный антиген и инактивированного антигена клещевого энцефалита. Однако разные вирусы могут иметь специфичность в иммунном ответе при использовании одного и того же адъюванта. Как известно вирус гриппа имеет целый ряд особенностей, которые не позволяют экстраполировать результаты полученные на одном виде вирусов на вирус гриппа. В указанном документе достоверно доказан устойчивый протективный эффект при концентрации антигена гепатита - 50 мкг/мл и антигена энцефалита - 10 мкг/мл. Однако такое количество антигена является нежелательным, т к увеличивает реактивность вакцины. Желательной концентрацией антигенов вируса гриппа А, используемой в вакцина, является 6 мкг/мл, т к при такой концентрации понижается реактивность вакцины. Таким образом, из уровня техники нельзя предположить, что бетулин может быть использован для получения вакцин против гриппа, тем более нельзя предположить эффективность адъюванта при сочетании его со столь малыми дозами антигена.
Адъюванты
САНЧ - сферические аморфные наночастицы на основе природного пентациклического тритерпенового вещества - бетулина. Произведен ПГФА (Пермская государственная фармакадемия). Препарат наночастиц берестяного экстракта сухого (БЭС), полученный путем следующих операций:
- растворение бересты экстракта сухого (БЭС-65) в органическом растворителе при концентрации 2,5-5 г/л. В качестве растворителей могут использоваться смешивающиеся с водой органические растворители, такие как тетрагидрофуран, ацетон, диоксан;
- добавление (впрыскивание) к указанному раствору большого количества воды (до 25 объемов воды по отношению к объему раствора);
- удаление растворителя и основной части воды лиофилизацией, перед лиофилизацией добавление криопротектора (например, сорбита).
Композиция биологически активных веществ в сухом САНЧ, мас.%:
| Бетулин | 65-71; |
| Лупеол | 12-16; |
| 3-O-кофеат бетулина | 5-15; |
сопутствующие вещества, остальнле до 100%.
Соединение 3-O-кофеата бетулина (далее для краткости «кофеат бетулина», другие менее употребляемые названия этого вещества - 3-O-кофеоилбетулин и 3-O-(3,4-дигидроксициннамоил) бетулин. Как показали исследования авторов, именно наличие этого вещества в композиции позволило получить ее в водорастворимой форме, в форме нанодисперсий.
Исследования показали, что смеси, содержащие кофеат бетулина, в отличие от композиций, не содержащих его или содержащих в незначительных количествах, образуют стабильные нанодисперсии, причем увеличение содержания кофеата бетулина приводит к уменьшению размера частиц. Дисперсии со значительным содержанием кофеата бетулина (5 и более процентов) по данным электронной микрографии состоят в основном из сферических частиц диаметром от 30 до 300 нм. Смеси, содержащие меньше кофеата бетулина или не содержащие вовсе, в тех же условиях образуют кристаллы разнообразной формы с размерами более 1 мкм, склонные к агрегации. Наиболее совершенные дисперсии с наименьшим размером частиц образует чистый кофеат бетулина.
ФР - модифицированный фуллерен
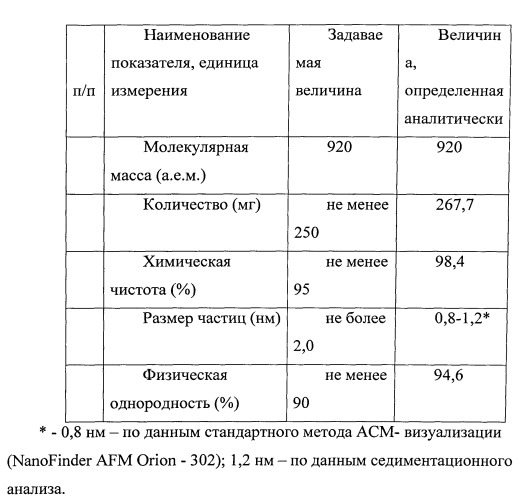
Наночастицы размерами 1,2 нм. Препарат был приготовлен в лаборатории МГУ.
Основу разработанной методики синтеза ФР, поэтапно описанной ниже, составила функционализация фуллереновой С60-сферы с помощью использования реакции нуклеофильного циклоприсоединения Диес-Алдера в модификации авторов работы.
Методика синтеза состоит из четырех последовательных этапов синтеза интермедиатов и целевого продукта:
1. 4-Вос-1-(5-этоксикарбонил-пентил)-пиперазин
24.3 г (90 мМоль) этилового эфира 6-Иодкапроновой кислоты и 16.79 г 1-Вос-пиперазина растворяли в 75 мл ТГФ, к раствору добавляли 16.95 мл (99 мМоль) диизопропилэтиламина. Реакционную смесь кипятили 6 часов. Затем растворитель упаривали в вакууме, остаток растворяли в этилацетате, органический слой 3 раза промывали раствором гидрокарбоната натрия и 1 раз водой, затем сушили над сульфатом магния и отгоняли растворитель. Полученное масло очищали хроматографически на колонке 80×400 мм с силикагелем SL200, растворитель/элюент - этилацетат. Выход: 27.6 г (93%).
2. 6-(пиперазин-1-ил)-капроновой кислоты этиловый эфир
26.3 г (80 мМоль) 4-Вос-1-(5-этоксикарбонил-пентил)-пиперазина растворяли в 150 мл 2Н HCl и раствор упаривали на роторном испарителе при 50 оС под вакуумом. рН остатка доводили до значения 10,0 15%-ным раствором гидроксида натрия. Продукт экстрагировали этилацетатом, органический слой сушили над сульфатом магния и упаривали. Выход: 12 г (66%).
3. Этиловый эфир 1,2-дигидрофуллерен-1-(6-пиперазин-1-ил)-капроновой кислоты
В стеклянный реактор объемом 100 мл, установленный на магнитной мешалке, помещали 0.056 мМоль фуллерена-С60 в 50 мл толуола, перемешивали до полного растворения, вводили 0.0112 мМоль Cp2TiCl2 и 0.056 мМоль этилового эфира 6-(пиперазин-1-ил)-капроновой кислоты. Перемешивали при комнатной температуре. Реакционную массу пропускали через колонку, заполненную силикагелем марки L (100×250 мм). Продукт выделяли элюированием смесью гексан: хлороформ (6:1). Выход: 2,8 г (21%).
4. 1,2-дигидрофуллерен-1-(6-пиперазин-1-ил)-капроновая кислота
Этиловый эфир 1,2-дигидрофуллерен-1-(6-пиперазин-1-ил)-капроновой кислоты растворяли в этиловом спирте и добавляли 33% раствор NaOH, смесь нагревали при перемешивании до полной гомогенизации. Реакционную смесь доводили до нейтрального рН, выпавшую в осадок кислоту отделяли микрофильтрацией на фиберглассовых фильтрах Millipore RX7M и затем тщательно отмывали преципитантным раствором этанол - NaOH(pH 7,0), пропуская не менее 70 мл его через 1,0 см2 поверхности фильтра. Выход: 62,5 мг (2,3%).
Содержащие итоговый продукт фиберглассовые фильтры тщательно высушивали при комнатной температуре (аэрация феном), после чего находящиеся на них осадки наночастиц (наноадъювант) смывали 100-кратным объемом деминерализованной воды и упаривали в роторном испарителе до объема 2,5-3,0 мл. Полученные таким образом порции стокового раствора продукта объединяли и использовали для качественного анализа состава, идентификации структуры и количественного определения наночастиц.
Физико-химические характеристики на фуллереновый наноадъювант С60 [C10H19N2O2] представлены ниже.
Способ хранения: в герметичной укупорке.
Температура хранения: при комнатной температуре (25±2)°С.
Срок хранения: 12 месяцев.
Гель алюминия гидроксида
Получен от производителя, произведен по ПР №16-35-05.
Предназначен для производства медицинских иммунобиологических препаратов.
Выпускается в жидком виде в бутылях по 4,0-12,5 л.
Получают осаждением из раствора алюминия сульфата раствором натрия карбоната.
Гель представляет собой стерильную гомогенную суспензию голубовато-белого или белого цвета, разделяющуюся при стоянии на прозрачную надосадочную жидкость и рыхлый осадок, не дающую при встряхивании неразбивающихся хлопьев и конгломератов.
Подлинность определяется по содержанию алюминия гидроксида.
Содержание гидроксида алюминия (по алюминию) - (2,5+0,5) мг/мл.
Механические включения должны отсутствовать.
рН. От 7,5 до 8,0.
Показатель дисперсности. От 0,6 до 1,4.
Сульфат-ионы. Не более 0,2 мг/мл.
Относительная вязкость. От 1,2 до 4,0.
Оседаемость. Не более 50%.
Сорбционная активность. Сорбент алюминия гидроксида в пересчете на 1 мг алюминия должен сорбировать не менее 1 мг красителя конго-красного.
Стерильность. Препарат должен быть стерильным.
Токсичность. Препарат должен быть нетоксичным.
Упаковка. От 4,0 до 12,5 л в бутылях стекла НС-2 объемом от 5,0 до 15,0 л.
Транспортирование при температуре от 4 до 8°С в условиях, исключающих замораживание.
Хранение при температуре от 4 до 8°С.
Срок годности 9 месяцев.
Адъювант на основе наночастиц гидроксиапатита
Получен от фирмы Sigma-Aldrich, каталожный номер 702153, CAS-No. 12167-74-7.
Са10(PO4)6(ОН)2
Водная суспензия. Массовая доля 10 об.%.
рН-4-6.
Плотность - 1,038 г/мл при 25°С.
Стерильность. Препарат должен быть стерильным.
Хранение при комнатной температуре.
Растворы адъювантов, пошедших на сведение компонентов образцов вакцин.
Перед сведением компонентов образцов вакцин готовились стандартные растворы адъювантов со следующими параметрами:
1. Лиофилизированные САНЧ разводились в 0,1 М фосфатном буфере рН 7,5, содержащем 0,01% Tween 80 до конечной концентрации САНЧ 10 мг/мл.
2. Лиофилизированные САНЧ разводились в 0,1 М фосфатном солевом буферном растворе (ФСБР) рН 7,5, содержащем 0,01% ПВП до конечной концентрации САНЧ 10 мг/мл.
3. Исходный образец Фр разводили 0,1 М ФСБР рН 7,5 до конечной концентрации Фр 10 мг/мл.
4. Из концентрата адъюванта на основе наночастиц гидроксиапатита получали разведением в 0,1 М ФСБР рН 7,5 препарат с концентрацией 10 мг/мл.
5. Из концентрата геля гидроокиси алюминия получали разведением в 0,1М ФСБР рН 7,5 препарат с концентрацией Al(ОН)3 10 мг/мл.
Техническим результатом заявленного изобретения является повышение титров антител в сравнении со стандартным адъювантом - гидроксиалюминий, при низкой концентрации антител. Данный технический результат оказался неожиданным, поскольку из существующего уровня техники нельзя было предположить, что сочетание использованного антигена гриппа с производным фуллерена или гидроксиапатита будет давать такой эффект. Вторым техническим результатом является сохранение протективных свойств вакцины даже после длительного хранения, такого как шесть месяцев. Данный технический результат является очень значимым, так как позволяет готовить вакцину на заводе, а не производить смешивание компонентов перед вакцинацией, что уменьшает вероятность влияния «человеческого фактора» на результат вакцинации.
Материалы и методы
Концентрат субъединичной вакцины, адъюванты и образцы вакцин.
Концентрат субъединичной вакцины, использовавшийся для приготовления образцов вакцин с различными адъювантами, получен по стандартной технологии (промышленный регламент производства гриппола (субъединичная вакцина) Р N 003865/01-271112). Исходный вирус гриппа H1N1, (штамм А/Калифорния /07/09). Антиген гриппозный аллантоисный инактивированный субъединичный. Компонент вакцин для специфической профилактики гриппа у людей.
Показатели качества концентрата субъединичной вакцины.
Описание. Слегка опалесцирующая бесцветная жидкость. Определяют визуально.
Подлинность. Препарат в виде монокомпонента вакцины должен быть подтипе- и типоспецифичным, нейтрализоваться гомологичной сывороткой. Определение проводят методом РТГА по МУ 3.3.2.1758-03 с. 8.
Прозрачность. Слегка опалесцирующая жидкость. Должна соответствовать эталону №1. ГФ XII, ч. 1, ОФС 42-0051-07, с. 124.
Цветность. Должна быть бесцветной. Определяют визуально по ГФ XII, ч. 1, ОФС 42-0050-07, с. 93.
Механические включения. Препарат должен выдерживать требования, изложенные в «Инструкции по контролю на механические включения инъекционных лекарственных средств» РД 42-501-98. Определение проводят визуально по МУК 4.1/4.2.5.88-96 с. 126.
рН. От 7,2 до 7,6. Потенциометрический метод (ГФ XII, ч. 1, ОФС 42-005348-07 с.
Герметизация. Емкости с антигеном должны быть герметичны.
Белок. Не более 250 мкг/мл. Определение по Лоури (ГФ XII, ч. 1, с. 105, ОФС 42-0053-07).
Стерильность. Препарат должен быть стерильным. Определение проводят в соответствии с ГФ XII, ч. 1, ОФС 42-0066-07, с. 150..
Аномальная токсичность. Препарат должен быть нетоксичным. ГФ XII, ч. 1, ОФС 42-0060-07, с. 124
Специфическая безопасность. Препарат должен быть безопасным, не должен содержать живого вируса гриппа. Определяют по МУ 3.3.2.1758-03, с. 35.
Специфическая активность. Препарат должен содержать в 1 мл (30,0±4,5) мкг гемагглютинина штамма вируса гриппа подтип A(H1N1). Определяют по МУ 3.3.2.1758-03, с. 17 в реакции одиночной радиальной иммунодиффузии (ОРИД).
Антигенная активность. Препарат должен вызывать нарастание антител в титрах не ниже 1:40 к штамму вируса гриппа А, после двукратного введения с интервалом 14 сут внутрибрюшинного введения 0,5 мл вакцины беспородным белым мышам массой 18-20 г.
Через 12-14 суток после повторной иммунизации полученные сыворотки мышей исследуют с гомологичными антигенами вакцины в реакции торможения гемагглютинации (РТГА) по МУ 3.3.2.1758-03, с. 8.
Упаковка. От 4,0 до 12,5 л в бутылях стекла НС-2 объемом от 5,0 до 15,0 л.
Транспортирование В соответствие с СП 3.3.2.1248-03 при температуре от 2 до 8°С. Замораживание не допускается.
Хранение. В соответствии с СП 3.3.2.1248-03 при температуре от 2 до 8°С. Замораживание не допускается.
Срок годности. 1 год.
Образцы вакцин
Опытный образец вакцины 1в
Антиген субъединичной вакцины на основе штамма А/Калифорния/7/09 (H1N1) разводили 0,1 М ФСБР рН 7,5 и добавляли адъювант САНЧ до конечной концентрации вируса 6 мкг/мл и адъюванта 100 мкг/мл. Полученный препарат стерильно разливали во флаконы по 10 мл.
Опытный образец вакцины 2в
Концентрат субъединичной вакцины на основе штамма А/Калифорния/7/09 (H1N1) разводили 0,1 М ФСБР рН 7,5 и добавляли адъювант САНЧ до конечной концентрации вируса 6 мкг/мл и адъюванта 400 мкг/мл. Полученный препарат стерильно разливали во флаконы по 10 мл.
Опытный образец вакцины 3а
Концентрат субъединичной вакцины на основе штамма А/Калифорния/7/09 (H1N1) разводили 0,1 М ФСБР рН 7,5 и добавляли адъювант ФР до конечной концентрации вируса 6 мкг/мл и адъюванта 100 мкг/мл. Полученный препарат стерильно разливали во флаконы по 10 мл.
Опытный образец вакцины 3в
Концентрат субъединичной вакцины на основе штамма А/Калифорния/7/09 (H1N1) разводили 0,1 М ФСБР рН 7,5 и добавляли адъювант ФР до конечной концентрации вируса 6 мкг/мл и адъюванта 400 мкг/мл. Полученный препарат стерильно разливали во флаконы по 10 мл.
Опытный образец вакцины 4в
Концентрат субъединичной вакцины на основе штамма А/Калифорния/7/09 (H1N1) разводили 0,1 М ФСБР рН 7,5 и добавляли адъювант на основе наночастиц гидроксиапатита до конечной концентрации вируса 6 мкг/мл и адъюванта 400 мкг/мл. Полученный препарат стерильно разливали во флаконы по 10 мл.
Опытный образец вакцины 5в
Концентрат субъединичной вакцины на основе штамма А/Калифорния/7/09 (H1N1) разводили 0,1 М ФСБР рН 7,5 и добавляли адъювант на основе наночастиц гидроксиапатита до конечной концентрации вируса 6 мкг/мл и адъюванта 100 мкг/мл. Полученный препарат стерильно разливали во флаконы по 10 мл.
Опытный образец вакцины 7а
Концентрат субъединичной вакцины на основе штамма А/Калифорния/7/09 (H1N1) разводили 0,1М ФСБР рН 7,5 и добавляли адъювант гель гидроокиси алюминия до конечной концентрации вируса 6 мкг/мл и адъюванта 100 мкг/мл. Полученный препарат стерильно разливали во флаконы по 10 мл.
Опытный образец вакцины 7в
Концентрат субъединичной вакцины на основе штамма А/Калифорния/7/09 (H1N1) разводили 0,1М ФСБР рН 7,5 и добавляли адъювант гель гидроокиси алюминия до конечной концентрации вируса 6 мкг/мл и адъюванта 400 мкг/мл. Полученный препарат стерильно разливали во флаконы по 10 мл.
Контроль - 6в
Концентрат субъединичной вакцины А/Калифорния/7/09 (H1N1) разводили 0,1 М ФСБР рН 7,5 до конечной концентрации 6 мкг/мл и разливали стерильно во флаконы по 10 мл.
В исследованиях использовали образцы указанные выше, они же были заложены на хранение для проведения дальнейших экспериментов.
Экспериментальные животные и куриные эмбрионы
Для изучения антигенных и протективных свойств композиций использовали белых беспородных мышей (самки) массой 12-14 г. Всех мышей получали из питомника НЦ Биомедицинских технологий FAMH «Андреевка» (Московская обл.) и содержали на стандартном рационе в регламентированных условиях вивария. Содержание животных соответствовало правилам по устройству, оборудованию и содержанию экспериментально-биологических клиник (вивариев). Кормили животных брикетированными кормами в соответствии с утвержденными нормами. Маркировка животных по группам производилась с помощью окраски красителями (эозин) поверхности тела.
Для получения аллантоисного вируса для заражения животных, а также для получения эритроцитов для постановки РТГА, использовали 9-дневные куриные эмбрионы, полученные из питомника «Птичное».
Наработка и характеризация пула вируса А /Калифорния /07/09 (H1N1).
Вирус гриппа А/Калифорния /07/09 (пндм H1N1 2009), полученный из ВОЗ, был адаптирован к мышам нами самостоятельно путем 5 последовательных пассажей через легкие мышей. Для этого мышей первый раз заражали интраназально аллантоисным вирусом, после проявления признаков болезни их забивали и в стерильных условиях получали гомогенат легочной ткани, далее этот гомогенат использовали для интраназального заражения мышей. Гомогенат легких 5 пассажа через легкие мышей, использовали для заражения 10-дневных куриных эмбрионов, из которых получали аллантоисный вирус и после титрования его на мышах использовали для инфицирования животных. Для экспериментов был получен новый пул аллантоисного вируса, который был охарактеризован по всем параметрам (Табл. 1 и 2).
Титрование вируса проводилось следующим образом. Для определения дозы вируса, содержащей 100 ЛД5о группы, состоящие из 4-6 мышей, заражали полученным цельным аллантоисным вирусом и последовательными 10-кратными его разведениями (от 10-1 до 10-5). Пример данных по наблюдению за животными в течение 16 дней представлены в табл. 1. Из этих данных видно, что 50% гибель животных вызывает заражение вирусом 10-3, следовательно, 50 мкл разведения 10-1 будет содержать примерно 100 ЛД50 (средняя доза вещества, вызывающая гибель половины испытуемой группы).
Характеристика (определение инфекционного титра вируса различными методами) использованных пулов адаптированного к мышам вируса гриппа А/Калифорния /07/09 приведена в табл. 2.
Примеры
Пример 1. Определение антигенной активности препаратов вакцины Иммунизация мышей. Исследования проведены в соответствии с нормативными документами, действующими на территории РФ, а также, принимая во внимание рекомендации ВОЗ и МУ 3.3.2.1758-03 (Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ, 2012, Приказ Минздрава России от 23.08.2010 №708н "Об утверждении правил лабораторной практики в Российской Федерации», WHO Manual on Animal Influenza Diagnosis and Surveillance. World Health Organization Department of Communicable Disease Surveillance and Response, 2011, WHO Global Influenza Surveillance Network Manual for the laboratory diagnosis and virological surveillance of influenza, 2011.
Мыши (самки, средний вес 12-16 г) были разделены по группам особей. Группы 2в, 3в, 4в состояли каждая из 45 животных, остальные группы состояли каждая из 30 животных. Контрольная группа, содержала 45 мышей. Предварительно у 5 мышей, полученных в той же партии, была получена сыворотки крови для проверки на наличие антител к вирусам гриппа. Все животные иммунизировались приготовленными препаратами вакцин по 0,25 мл внутрибрюшинно. Животным из контрольной группы вместо препаратов вакцины в соответствующие дни вводили по 0,25 мл стерильного физиологического раствора внутрибрюшинно. После этого все мыши были возвращены в клетки и находились под наблюдением. На 14 день после первой иммунизации у 15 животных из каждой группы, включая контрольную, была получена сыворотка крови. После подготовки полученных сывороток крови была проведена реакции торможения гемагглютинации (РТГА).
В этот же день оставшиеся мыши из каждой группы были повторно иммунизированы соответствующими препаратами вакцин по 0,25 мл внутрибрюшинно и затем опять возвращены в клетки. Сыворотки крови от каждого из 15 животных в каждой группе были получены на 14 день после второй иммунизации. После подготовки новых полученных сывороток крови была проведена реакции торможения гемагглютинации (РТГА).
Приготовление 1% суспензии куриных эритроцитов. Суспензию эритроцитов из куриных эмбрионов (15 - дневные) помещали во флакон, добавляли буферно-солевой раствор БСР (рН 7,2 Na-фосфатный буфер 0,01 М с 0,16 М NaCl) (на 1 объем крови - 4 объема БСР), центрифугировали при 800 об/мин, в течение 15 мин. После третьего центрифугирования надосадочную жидкость удаляли, и из осадка, принимаемого за 100%, готовили 1%-ную суспензию.
Проведение реакции торможения гемагглютинации. Исследуемые сыворотки разводили в БСР в соотношении 1:5 и прогревали в водяной бане при 56°С в течение 30 мин. Далее готовили стандартизованный антиген (Диагностикумы гриппозные для РТГА ДИГ тип A(HlNl)pdm09, Штамм А /Калифорния/07/09 серия 69, ООО «ППДП», Санкт-Петербург), содержащий 8 ГАЕ/50 мл.
Далее из каждой сыворотки готовили серию двукратных разведении (от 1:10 до 1:1280) в БСР в объеме 50 мкл следующим образом. В 8 лунок каждого ряда вносили по 50 мкл БСР. В первую лунку внесли 50 мкл исследуемой сыворотки, разведенной в 5 раз и прогретой при 56°С. После 3-х кратного перемешивания переносили 50 мкл разведенной сыворотки в следующую лунку, процедуру продолжали, титруя сыворотку, из последней лунки избыток (50 мкл) разведенной до 1:1280 сыворотки сбрасывали. К каждому разведению сыворотки добавили по 50 мкл стандартизованного гриппозного антигена (8 ГАЕ). В качестве отрицательного контроля брали 5 лунок панели, в которые вместо антигена вносили БСР. Панели встряхивали и инкубировали в течение 1 часа при комнатной температуре. Затем в каждую лунку, включая контрольные (по 100 мкл БСР), добавляли по 100 мкл 0,5% куриных эритроцитов. Результаты реакции учитывали после оседания эритроцитов в контрольных лунках в течение 45 минут при комнатной температуре.
Пример 2. Определение протективной активности препаратов вакцины
В этот же день после получения сывороток крови (28 день после первой иммунизации) было проведено заражение оставшихся животных из групп 2в, 3в, 4в (по 15 мышей) вирусом гриппа А/Калифорния/04/09 (H1N1) адаптированным к мышам как описано ранее в разделе 3. Методы в дозе 100ЛД50 на мышь. Мышей заражали интраназально под легким эфирным наркозом аллантоисным вирусом в объеме 50 мкл на обе ноздри. Группа невакцинированных животных (5а, 15 мышей) в этом эксперименте также была заражена вирусом и служила группой контроля вирусной инфекции. За животными велось ежедневное наблюдение в течение последующих 21 дня, в первые 5 дней после инфицирования мыши взвешивались каждый день, далее - через день. Протективную активность образцов на модели гриппозной пневмонии мышей оценивали по трем критериям: показатель защиты от смертельной вирусной инфекции, увеличение средней продолжительности жизни и уменьшение снижение веса в группах животных, леченных препаратами по сравнению с контрольной группой. Средняя продолжительность жизни мышей высчитывалась по формуле:
MSD=∑f(d-1)/n,
где f - количество мышей, умерших на день d, выжившие мыши также включены в f и d в этом случае равно 21,
n-количество мышей в группе.
Уменьшение или увеличение веса рассчитывалось отдельно для каждой мыши и выражалось в процентах. При этом за 100% принимался вес животного перед инфицированием. Для всех мышей одной группы определялось среднее значение процента потери или увеличения веса.
Пример 3. Статистическая обработка
Статистическая обработка данных проводилась с использованием интегрированного пакета статистического анализа StatSoft 7.0 (Windows 2007) с применением параметрических (t-критерия Стьюдента) и непараметрических (критерия Вилкоксона) методов сравнения.
Изучение антигенных свойств образцов адъювантов в концентрации 100 мкг/мл с антигенами вируса гриппа после 6 месяцев хранения.
Определение антигенной активности препаратов после первой иммунизации.
Изучение антигенной активности различных образцов адъювантов с антигеном вируса гриппа А/Калифорния/07/09 (H1N1), которые были заложены на хранение, где сыворотки крови были получены на 14 день после первой иммунизации, а в качестве контрольных в этих опытах были использованы животные, которым вместо препаратов вакцинных препаратов вводили по 0,25 мл стерильного физиологического раствора внутрибрюшинно показало, что за весь период наблюдения за животными после первой иммунизации, ни в одной из групп не было выявлено отклонений в поведении животных, признаков заболевания у них, а также падежа мышей. После получения и обработки сывороток (как описано в Методах) в каждой сыворотке с использованием реакции торможения гемагглютинации (РТГА) был определен титр антител к вирусу гриппа А/Калифорния/07/09 (H1N1). Результаты испытаний образцов представлены в табл. 3.
Хотя мыши при обычных условиях не инфицируются вирусом гриппа, перед началом эксперимента из полученных в той же партии мышей мы выделили группу из 5 мышей, у которой была получена сыворотка крови для проверки на наличие антител к вирусам гриппа. Реакция РТГА, проведенная с этими сыворотками не выявила у них наличие антител к вирусу гриппа А/Калифорния/07/09 (H1N1). Представленные данные показывают также, что в группе контрольных животных, которым вместо препаратов вакцины был введен физиологический раствор, антитела также отсутствовали, не наблюдалось прироста антител. Антитела также отстутствовали в группах животных, вакцинированных опытными образцами вакцины 1в, 3а, и 6в (концентрат субъединичной вакцины без адъюванта). В группе животных, вакцинированных опытным образцом вакцины, содержащим в качестве адъюванта гель гидроокиси алюминия, также не наблюдалось образование антител.
В группе животных, вакцинированных образцом 5в, наблюдалось образование антител, однако в незначительных титрах, (средний титр 1: 5,3±7,4). Таким образом, полученные в этой серии экспериментов данные позволяют сделать вывод о том, что однократная вакцинация образцами опытных вакцин, содержащих адъюванты в концентрации 100 мкг/мл и хранившиеся в течение 6 месяцев, практически не приводит к образованию антител.
Определение антигенной активности препаратов после второй иммунизации.
В следующей серии опытов была изучена антигенная активность различных образцов антигенов вируса гриппа А/Калифорния/07/09 (H1N1) и адъювантов в концентрации 100 мкг/мл и хранившиеся в течение 6 месяцев, после повторной иммунизация, которая проводилась на 14 день после первой иммунизации. Сыворотки крови от животных были получены на 14 день после второй иммунизации. В качестве контрольных (по специфичности) были использованы животные, которым вместо препаратов вакцины в соответствующие дни вводили по 0,25 мл стерильного физиологического раствора внутрибрюшинно.
Также как и после первой иммунизации, после второй иммунизации проводилось наблюдение за животными, при этом ни в одной из групп не было выявлено отклонений в поведении животных, признаков заболевания у них, а также падежа мышей. После получения и обработки сывороток (как описано в Методах) в каждой сыворотке с использованием реакции торможения гемагглютинации (РТГА) был определен титр антител к вирусу гриппа А/Калифорния/07/09 (H1N1). Результаты испытаний образцов представлены в табл. 4. В группе контрольных животных, которым вместо препаратов вакцины в соответствующие дни вводили физиологический раствор, не наблюдалось прироста антител. В остальных группах все изученные образцы вызывали образование антител в отношении вируса гриппа А/Калифорния/07/09 (H1N1), при этом диапазон титра антител колебался от 1:40 до 1:640. При введении субъединичной вакцины без адъюванта, используемой в качестве контроля, наблюдалось образование антител в титре 81,3±115,2. Из препаратов с адъювантами максимальную наработку антител вызвала иммунизация вакцинной композицией 3а, включающая фуллереновый адъювант в дозе 100 мкг/мл. Следующей по приросту титра антител была композиция 7а, включающая в качестве адъюванта гидроокись алюминия. Сходной антигенной активностью обладала композиция 5в, включающая в качестве адъюванта наночастицы гидроксиапатита в дозе 100 мкг/мл. Титр антител при введении всех перечисленных композиций был также выше, чем при введении аналогичной вакцины без адъюванта и составлял 165,0±62,1, 72±16,56 и 69,3±18,3 для композиций 3а, 7а и 5в соответственно. Наименьший прирост антител (25,3±9,15) наблюдался после двойной иммунизации животных композицией 1в, содержащей адъювант САНЧ в дозе 100 мкг/мл.
Таким образом, полученные в этой серии экспериментов данные позволяют сделать вывод о том, что адъювантными свойствами в концентрации даже 100 мкг/мл обладает фуллереновый адъювант, при этом антигенная активность превышает активность геля гидроокиси алюминия, что совпадает с данными полученными на первом этапе исследования.
Изучение антигенных и протективных свойств образцов антигенов вируса гриппа с адъювантами в высоких концентрациях (400 мкг/мл)
Определение антигенной активности препаратов после первой иммунизации
Изучение антигенной активности различных образцов адъювантов высокой концентрации с антигеном вируса гриппа А/Калифорния/07/09 (H1N1) после первой вакцинации показало следующее. Сыворотки крови получены на 14 день после первой иммунизации. В качестве контрольных в этих опытах были использованы животные, которым вместо препаратов вакцинных препаратов вводили по 0,25 мл стерильного физиологического раствора внутрибрюшинно. Весь период после первой иммунизации проводилось наблюдение за животными, при этом ни в одной из групп не было выявлено отклонений в поведении животных, признаков заболевания у них, а также падежа мышей. После получения и обработки сывороток (как описано в Методах) в каждой сыворотке с использованием реакции торможения гемагглютинации (РТГА) был определен титр антител к вирусу гриппа А/Калифорния/07/09 (H1N1). Результаты испытаний образцов представлены в табл.5. Также как и в первой серии опытов перед началом эксперимента из полученных в той же партии мышей мы выделили группу из 5 мышей, у которой была получена сыворотка крови для проверки на наличие антител к вирусам гриппа. Реакция РТГА, проведенная с этими сыворотками не выявила у них наличие антител к вирусу гриппа А/Калифорния/07/09 (H1N1). Представленные данные показывают также, что в группе контрольных животных, которым вместо препаратов вакцины был введен физиологический раствор, антитела также отсутствовали, не наблюдалось прироста антител. Полученные данные показали, что в группах животных, вакцинированных композициями антигена с адъювантами в высоких концентрациях наблюдалось образование антител, однако в незначительных титрах, при этом диапазон титра антител не отличался между группами и колебался от 0 до 1:40 (средний титр 1:4±5,1 до 1:6±8,3). Таким образом, увеличение концентрации адъюванта от 100 до 400 мкг/мл практически не влияла на антигенную активность образцов при однократной иммунизации, и позволяют сделать вывод о том, что однократная вакцинация с использованием адъювантов в высоких дозах 400 мкг/мл практически не приводит к образованию антител.
Определение антигенной активности препаратов после второй иммунизации.
В следующей серии опытов была изучена антигенная активность образцов, включающих вирус гриппа А/Калифорния/07/09 (H1N1) и адъюванты в высокой концентрации 400 мкг/мл после повторной иммунизации, которая проводилась на 14 день после первой иммунизации. Сыворотки крови от животных были получены на 14 день после второй иммунизации. В качестве контрольных (по специфичности) были использованы животные, которым вместо препаратов вакцины в соответствующие дни вводили по 0,25 мл стерильного физиологического раствора внутрибрюшинно.
Также как и после первой иммунизации, после второй иммунизации проводилось наблюдение за животными, при этом ни в одной из групп не было выявлено отклонений в поведении животных, признаков заболевания у них, а также падежа мышей. После получения и обработки сывороток (как описано в Методах) в каждой сыворотке с использованием реакции торможения гемагглютинации (РТГА) был определен титр антител к вирусу гриппа А/Калифорния/07/09 (H1N1). Результаты испытаний образцов представлены в табл.6. В группе контрольных животных, которым вместо препаратов вакцины в соответствующие дни вводили физиологический раствор, не наблюдалось прироста антител. В остальных группах все изученные образцы вызывали образование антител в отношен