Технология регенеративной биопластики дефектов покровных тканей
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к хирургии, и может быть использовано при лечении дефектов покровных тканей. Проводят подготовку раны. Накладывают пластину биопластического материала. В качестве биопластического материала используют гистоэквивалент-биопластический материал. В его состав входит гидроколлоид нативной формы гиалуроновой кислоты и пептидный комплекс. В перфорации гистоэквивалент-биопластического материала наносят жизнеспособные округлые лоскуты аутотканей. Накрывают второй пластиной биоматериала. Способ позволяет сократить сроки регенерации покровных тканей и обеспечивает заживление раны без перевязок, защиту от инфекций и потери влаги за счет использования гистоэквивалент-биопластического материала, его перфорации и нанесения лоскутов аутотканей. 1 з.п. ф-лы, 13 ил., 1 табл., 2 пр.
Реферат
Область техники
Изобретение относится к медицине, а именно к общей хирургии, комбустиологии, эстетической хирургии, косметологии, и может найти применение при лечении дефектов покровных тканей различной этиологии, в том числе на фоне сахарного диабета.
Уровень техники
Лечение дефектов покровных тканей, вызванных повреждениями (механические травмы, ожоги) и заболеваниями сосудов (трофические язвы нижних конечностей), является актуальной проблемой современной медицины (Савельев B.C., 2001). Заболевания вен, составляющие основную причину развития язв (Журавлева О.В., 2004; Эмиров Г.Н., 2004), чрезвычайно широко распространены (Родоман Г.В. и соавт., 2004). Их возникновение приводит к временной утрате трудоспособности, а нередко является причиной инвалидности (Лымарь А.Г. и соавт., 2004). Лечение трофических язв у больных сахарным диабетом вызывает особенные затруднения ввиду низкой сопротивляемости инфекции и замедленной регенерации тканей, в связи с чем течение процесса нередко прогрессирует по площади и глубине, затягивая страдания пациентов на годы, и проводит к формированию гигантских циркулярных язв нижних конечностей. Вместе с тем, существуют определенные трудности в лечении язв, в том числе из-за имеющей место сенсибилизации кожи к большинству местно применяемых препаратов и раневых покрытий (Петров С.В. и соавт., 2002).
Известен способ восстановления дефектов покровных тканей с помощью нетканого тканевого материала (Tajima K. Regeneration through nerve allografts in cynomologus monkey (Macaca fascicularis), J. Bone Joint Surgery. - 1991, P.172), содержащего волокна, по крайней мере, одного сложного эфира гиалуроновой кислоты, или волокна гиалуроновой кислоты, или сложного эфира гиалуроновой кислоты в комбинации с другим полимером, включающий получение нетканого холста из слоев прочеса указанного материала, холст дополнительно опрыскивают раствором гиалуроновой кислоты, или сложного эфира гиалуроновой кислоты, или биосовместимого полимера для химической коагуляции волокон холста. Терапевтический способ лечения патологических состояний кожи осуществляется путем наложения на кожу нетканого тканевого материала, содержащего волокна из, по крайней мере, одного сложного эфира гиалуроновой кислоты, или волокна гиалуроновой кислоты, или сложного эфира гиалуроновой кислоты в комбинации с другим полимером.
Методика применения полимерного материала HYAFF заключается в следующим. Проводят очистку раны (туалет раны). Затем накладывают сетчатый материал HYAFF, который закрывают полимерной перфорированной пленкой. Накладывают прямоугольные пластины химически модифицированной полимеризованной гиалуроновой кислоты, после чего накладывают легкую марлевую повязку для фиксирования пластин химически модифицированной полимеризованной гиалуроновой кислоты. При последующих перевязках необходимо обязательное удаление всей повязки с раневой поверхности, что приводит к дополнительной травме раны и болезненным ощущениям. Полное заживление при использовании данной методики происходит к 14-16 суткам после начала лечения (в зависимости от тяжести патологии срок заживления может увеличиваться).
Недостатком этого способа является низкая клиническая эффективность, так как в основе материала HYAFF имеется химически модифицированная гиалуроновая кислота и при перевязках постоянно приходится травмировать рану.
Раскрытие изобретения
Техническим результатом предлагаемого способа регенеративной биопластики покровных тканей является ведение раневого процесса для заживления раны без перевязок (восстановления покровных тканей) и сокращение сроков регенерации покровных тканей.
Задача решается следующим образом.
I. Подготовка раны.
Предварительно осуществляется тщательный туалет раны с использованием раствора мирамистина и 3% пероксида водорода, удаляются нежизнеспособные участки тканей, дно раны скальпелем освежается до появления т.н. «кровяной росы». Омозолелые края раны также иссекаются, отдельно с краев раны формируют округлые фрагменты жизнеспособного эпидермиса с базальной мембраной размером 2-3 мм в диаметре, которые затем помещаются в стерильный физиологический раствор температурой от 36 до 37°С.
II. Укладка биопластического материала.
По форме раны моделируется пластина гистоэквивалент-биопластический материала, которая затем укладывается гладкой поверхностью на подготовленную поверхность раны. Благодаря наличию в составе материала гиалуроновой кислоты происходит впитывание раневого экссудата, материал приобретает вид эластичной мембраны и плотно прилипает к подлежащим тканям. Влажной турундой материал расправляется и дополнительно увлажняется. Критерием правильного наложения биоматериала считается отсутствие воздушных карманов и затеков с полным повторением рельефа.
III. Частичная аутопластика.
Округлые фрагменты тканей, взятые на этапе подготовки раны, извлекаются из физиологического раствора и помещаются в область перфораций на материале. После того как все перфорации будут заполнены кусочками тканей, на поверхности биоматериала располагают вторую пластинку так, чтобы перфорации подлежащего слоя были закрыты пластинкой второго листа биоматериала. Предполагается, что аутоткани, помещенные в область перфораций биоматериала, станут источником для т.н. островчатой эпителизации. Избыток влаги промокается марлевой салфеткой, перфорации служат для дренирования раневого экссудата, поэтому менять наружную повязку необходимо ежесуточно. Поскольку внешняя поверхность материала инертна, то перевязочный материал к ней не прилипает. Дают ране подсохнуть в течение 10 мин, затем наносят тонким слоем на биоматериал антимикробный гель или мазь, укладывается стерильная салфетка и повязка. Рану ведут до полного заживления без смены биоматериала, лишь меняя наружную повязку.
Гистоэквивалент-биопластический материал остается в ране и рассасывается (метаболизируется) по мере ее заживления.
В состав гистоэквивалент-биопластического материала входит гидроколлоид нативной формы гиалуроновой кислоты и пептидный комплекс, обеспечивающие формирование полноценного биологического струпа.
Нативная форма гиалуроновой кислоты создает оптимальные условия для миграции и пролиферации клеток, источником которых являются кусочки жизнеспособных тканей, помещенных в области перфораций (своего рода клеточные ячейки) гистоэквивалент-биопластического материала.
Таким образом, предлагаемый способ «технология регенеративной биопластики дефектов покровных тканей» обеспечивает оптимальные условия для эффективного заживления (защита от инфекции, потерь влаги, стимуляция клеточной миграции и пролиферации).
Краткое описание графических материалов
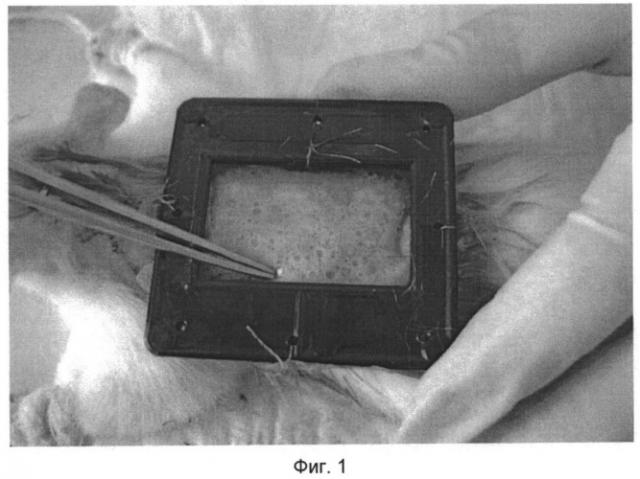
Фиг. 1: Выполнение технологии регенеративной биопластики.
Фиг. 2: Ожог IIIБ степени. 3 сутки после выполнения ТРБ (технология регенеративной биопластики). Окраска гематоксилином и эозином. Увеличение 100 (об. 10, ок. 10).
Фиг. 3: 7-е сутки после выполнения ТРБ. Окраска пикрофуксином по Ван Гизон. Ув.; ок. 10: об. 10.
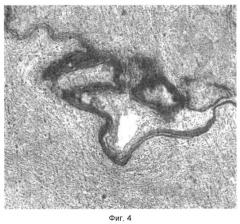
Фиг. 4: 14-е сутки после выполнения ТРБ. Окраска пикрофуксином по Ван Гизон. Ув.; ок. 10: об. 10.
Фиг. 5: 21-е сутки после использования ТРБ. Окраска пикрофуксином по Ван Гизон. Ув.; ок. 10: об. 10.
Фиг. 6: 30-е сутки после использования ТРБ. Окраска альциановым синим. Ув.: Об. 10.; Ок. 10.
Фиг. 7: Контрольная группа, 45-е сутки после применения ТРБ. Окраска пикрофуксином по Ван Гизон. Ув.: Об. 10.; Ок. 10.
Фиг. 8: Больная А., 65 лет. Вид трофической язвы перед выполнением биопластики.
Фиг. 9: Больная А., 65 лет. Контроль биосовместимости на следующие сутки после биопластики.
Фиг. 10: Больная А., 65 лет. Вид трофической язвы на 6-е сутки. Частичная метаболизация материала, краевая и очаговая эпителизация.
Фиг. 11: Больная А., 65 лет. Вид области язвенного дефекта трофической язвы (1 год после выполнения регенеративной биопластики).
Фиг. 12А: Больная N. Вид участка объемного некроза дермы с мокнущей поверхностью и слабыми грануляциями по краю.
Фиг.12Б: Больная N. Вид раны на 5-7-е сутки после регенеративной пластики, уменьшение объемов раневого дефекта и формирование грануляционной ткани.
Фиг.13A: Больная N. Вид раны через 1,5 месяца после регенеративной пластики, объемный дефект полностью заполнился грануляциями.
Фиг.13Б: Больная N. Полная эпителизация раны через 3,5 месяца после регенеративной пластики.
Осуществление изобретения
Экспериментальное исследование эффективности регенеративной биопластики дефектов покровных тканей in vivo проводились на 48 белых лабораторных крысах обоего пола с соблюдением всех этических требований, предъявленных к работе с экспериментальными животными (Приказ №755 М3 СССР от 12.08.77 г.). Вес животных в начале эксперимента был от 170 до 190 граммов.
Всем крысам был произведен ожог IIIБ степени площадью 6% от поверхности тела по отработанному способу (Патент на полезную модель №91518 от 22.06.2009 г., Л.Т. Волова, В.В. Болтовская, А.В. Болтовский и др.). Для нанесения термического ожога использовали устройство, состоящее из цилиндрического плоскодонного стеклянного стакана, воду в котором доводили до кипения с помощью кипятильника. Температуру воды контролировали при помощи термометра.
Модель ожоговой раны воспроизводили следующим образом. У крыс под эфирным наркозом в межлопаточной области выстригали тщательно шерсть. Операционное поле обрабатывали 70% спиртом. Стеклянный стакан диаметром дна 5 см с кипящей водой прикладывали к операционному полю на 35 секунд. После моделирования ожога крысы были разделены на 2 группы: опытную и контрольную. Крысам опытной группы в первые пять минут была произведена регенеративная биопластика дефектов покровных тканей (Фиг.1). После к краям раны подшивалась рамка с целью предотвращения констрикции.
Контрольная группа представляла собой животных с нелеченным ожогом (в соответствии с таблицей 1).
| Таблица 1 | ||||||
| Характеристика эксперимента | ||||||
| Группы/сроки | 3 сут | 7 сут | 14 сут | 1 мес | 1.5 мес | 3 мес |
| Опытная (ожог + технология регенеративной биопластики) | 4 | 4 | 4 | 4 | 4 | 4 |
| Контрольная (нелеченный ожог) | 4 | 4 | 4 | 4 | 4 | 4 |
В течение всего эксперимента животных ежедневно осматривали, отмечали их общее состояние, активность, характер шерстяного покрова, состояние раны и окружающих тканей.
Животных выводили из эксперимента при помощи гильотины на 3, 7, 14, 30, 45-е сутки и на 3 месяц после воспроизведения ожога. Во все указанные сроки забирали материал для гистологического исследования.
Область раневого дефекта с прилежащей кожей вырезали с захватом прилежащих мышц и фиксировали в 12% растворе нейтрального формалина, затем проводили в спиртах возрастающей крепости и заливали в парафин.
Серийные парафиновые срезы окрашивали гематоксилином и эозином, пикрофуксином по Ван Гизон для верификации коллагеновых волокон. Всего было изготовлено и изучено 96 гистологических препаратов. Гистологические срезы толщиной 7 мкм изучали, анализировали и фотографировали с помощью системы анализа изображений на базе Pentium 4, состоящей из светового микроскопа Olympus и цифровой фотокамеры Olympus C 310.
Результаты эксперимента.
На первые сутки у опытной группы после выполнения ТРБ наблюдалась полная адгезия биопластического материала к раневой поверхности. Наблюдается отек тканей и подкожной клетчатки в области поражения.
Через 3-е суток сформировался толстый плотный струп, спаянный с подлежащими тканями (Фиг.2).
Биоматериал после выполнения ТРБ плотно адгезировался и стал основой для формирования гомогенного вещества (по типу биологического струпа). Явлений воспаления и плазморреи не отмечается. Гистологически отмечено, что на поврежденном участке кожи в гиподерме наблюдаются расширенные полнокровные сосуды, начинают формироваться фибробласты, но активной пролиферации нет. В пограничной зоне между сетчатым слоем и гиподермой довольно обширное кровоизлияние с большим количеством макрофагов. Наблюдается отек остатков сетчатого слоя с расширенными полнокровными сосудами. Большой участок кожи пропитан некротическими массами с остатками биоматериала. Крысы активны, аппетит присутствует.
В контрольной группе - размягчение экссудата и выделение серозно-гнойного экссудата. К концу 3-х суток погибли 20% животных. В опытной - все живы.
На 7-е сутки после первичной хирургической обработки ожоговой раны и применения ТРБ отмечается формирование нежных фуксинофильных соединительно-тканных волокон по периферии материала, отмечаются «зачатки» неоэпидермиса (Фиг.3).
В контрольной группе - в ране выраженный сухой струп с выраженной нейтрофильной инфильтрацией и начальной краевой эпителизацией.
На 14-е сутки отмечено значительное уменьшение размеров экспериментальной раны. Струп состоит из высохшего экссудата и биоматериала. Гистологически в очаге поражения наблюдается практически сформированная соединительная ткань с большим количеством сосудов, остатками некротической массы. Некротическая масса разделена от регенерирующей части лейкоцитарным валом и на границе некроза с вновь образованной рубцовой тканью со стороны регенерирующей ткани большое количество фагоцитирующих макрофагов. Некротизированная часть начинает отслаиваться. Ближе к неповрежденному участку кожи отслойка некротизированных тканей произошла и началась краевая эпителизация. Начинает образовываться базальный и шиповатые слои. Дистрофические изменения мышечных волокон выражаются смещением ядра к центру и округлением самих волокон. Биоматериал адсорбирует на себя фагоцитирующие нейтрофилы (Фиг.14).
На 21-е сутки наблюдается оформленная зрелая соединительная ткань с большим количеством сосудов. Продолжается процесс краевой эпителизации (Фиг.5). Поверхность раны очищена. Некротических масс не наблюдается. Воспаления не наблюдается. Активно идет процесс эпителизации, образование камбиального слоя.
На 30-е сутки от начала эксперимента эпителизация закончена. Гиподерма спокойная без пролиферирующих фибробластов с большим количеством образующихся волосяных фолликулов и сальных желез. Дерма представлена зрелой соединительной тканью с небольшим количеством сосудов (по сравнению с 1 месяцем), соответствующих строению нормальной кожи. Сосочковый слой сглажен, базальный слой четко контурирует. Шиповатый слой представлен 2-4 рядами клеток.
Окраска альциановым синим также подтверждает замещение материала соединительной тканью без рубцовых изменений. Важно отметить, что в структуре сформированной соединительной ткани отмечается выраженная васкуляризация (наличие множества тонкостенных сосудов с расширенным просветом) (Фиг.6).
В контрольной группе на 1-е сутки ожоговая поверхность была открыта, отмечались ее кровоточивость, наблюдался выраженный отек подлежащих тканей. К 3-м суткам сформировался выраженный струп. Струп заходит за края раны, наслаиваясь на кожу на расстоянии 2 мм. Размер раны больше чем в опытной группе на 0,4-0,6 см. Крысы неактивны, отказываются от еды.
На 14-е сутки отмечалась краевая эпителизация, в центре раны находилась грануляционная ткань в виде тонких тяжей и пролиферирующие фибробласты. Окончательное заживление раны произошло лишь на 45-50-е сутки, тогда как в опытной группе - на 30-е сутки от начала эксперимента.
В контрольной группе отмечается закрытие экспериментального дефекта, однако оно сопровождается формированием воспалительного инфильтрата с очагами деструкции и выраженной рубцовой тканью (Фиг.7).
Анализ полученных данных говорит о том, что выполнение технологии регенеративной биопластики дефектов покровных тканей обеспечивает формирование полноценного биологического струпа с созданием оптимальной микросреды для миграции и пролиферации собственных клеток.
Использование данной технологии позволят избежать использования дополнительных перевязочных средств. Заживление раны происходит под биопластическим материалом, который по мере образования новой ткани подвергается биодеградации.
Предлагаемый способ регенеративной биопластики дефектов покровных тканей реализуется следующим образом.
Предварительно проводится этап санации трофической язвы посредством ежедневных перевязок с растворами антисептиков (хлоргексидин, гипохлорит натрия, йодопирон) до полного очищения и гранулирования с выравниванием по глубине в плоский раневой дефект. Затем выполняется туалет раны: иссечение краев раны с получение округлых кусочков жизнеспособной ткани кожи размером 0,5 на 1 мм, которые помещаются в стерильный физиологический раствор температурой 36-37 градусов Цельсия. На подготовленную рану накладывают гистоэквивалент-биопластический материал, имеющий в своей структуре перфорации диаметром 1,5 мм, после того как биоматериал прилипнет к ране и превратится в эластичную пластинку, в его перфорации укладываются извлеченные из физиологического раствора кусочки жизнеспособных тканей самого пациента. После того как все перфорации будут заполнены кусочками тканей, на поверхности биоматериала располагают вторую пластинку так, чтобы перфорации подлежащего слоя были закрыты пластинкой второго листа биоматериала. Дают ране подсохнуть в течение 10 мин, затем наносят тонким слоем на биоматериал антимикробный гель или мазь, укладывается стерильная салфетка и повязка. Критерием правильного наложения является отсутствие воздушных карманов, пленка должна полностью повторять рельеф раны. После этого материал на ране фиксируется стерильной повязкой.
Дальнейшее ведение раны осуществляется посредством этапных перевязок, в ходе которых проводится контроль процесса заживления (эпителизации) язвы. В участках биодеградации материала выполняется дополнительная аппликация биоматериала до полного замещения раневого дефекта.
Использование данного способа биопластики трофических язв нижних конечностей осуществлялось в 30 клинических случаях. При анализе полученных данных отмечено, что у 75% наблюдаемых больных происходило приживление биопластического материала в течение 5-7 дней с последующей фрагментацией раневых дефектов, эпителизацией и заживлением язв.
Ниже мы приводим клинические примеры использования технологии регенеративной пластики, которые демонстрируют решения неординарных клинических ситуаций, при которых традиционные методы лечения были малоэффективными.
Клиническое наблюдение 1
Данный клинический случай демонстрирует эффективность технологии регенеративной пластики G-derm у больных с обширными трофическими язвами на фоне заболевания вен. Кроме того, у пациента был длительный «язвенный анамнез» с неэффективной традиционной терапией, в том числе с неудачной аутопластикой.
Больная A. 65 лет, находилась на лечении в 4 хирургическом отделении НУЗ «ОКБ на ст. Оренбург» ОАО «РЖД» с диагнозом: «Варикозная болезнь правой нижней конечности с рефлюксом по большой подкожной вене бедра и перфорантным венам голени. ХВН правой нижней конечности III степени, осложненная обширной трофической язвой задневнутренней поверхности левой голени».
Страдает варикозной болезнью левой нижней конечности более 20 лет, последние 10 лет в области левой голени сформировалась обширная трофическая язва. Традиционная терапия неэффективна, выполненная три года назад аутопластика также была без эффекта. При поступлении трофическая язва площадью 156 см2, с гнойным отделяемым. При бактериологическом исследовании был выявлен Staphylococcus aureus, 106 микробных тел в 1 г ткани. Назначена комплексная консервативная терапия. На 5-е сутки от начала лечения, после купирования местной воспалительной реакции и появления признаков перехода трофической язвы во II фазу раневого процесса (Фиг.8), больной предложена оперативная коррекция венозного кровотока, от которой она отказалась.
С целью стимуляции регенераторных процессов в язве на 6-е сутки от начала лечения была выполнена биопластика трофической язвы с использованием материала. На следующий день после биопластики больная отмечает значительное уменьшение боли в области язвы. В первые сутки осуществлен контроль бисовместимости: материал находился в области язвы, стал немного темнее и плотнее, признаков воспалительных изменений не отмечалось, осуществлена смена наружной повязки (Фиг.9).
В последующем осуществлялась смена наружной повязки ежесуточно, на 6-е сутки была отмечена частичная метаболизация материала, выраженная краевая и очаговая эпителизация с прогрессивным уменьшение язвенного дефекта в размерах (Фиг.10). В нижней части раны отмечается дефект ткани с формированием кармана. В этот участок материал был уложен в несколько слоев с целью стимулирования роста грануляций.
В участки лизиса был дополнительно уложен пластический материал. В дальнейшем рана велась по разработанной методике. В течение последующих 15 суток удалось достичь эпителизации области язвенного дефекта.
На 21-е сутки от начала лечения больная выписана из стационара. При выписке больной рекомендовано продолжить компрессионную терапию нижних конечностей, прием флеботропных препаратов и лечебную физкультуру. Дальнейшее наблюдение за больной осуществлялось в условиях поликлинического отделения НУЗ «ОКБ на ст. Оренбург» ОАО «РЖД».
При контрольном осмотре через 1 год рецидива трофической язвы не выявлено (Фиг.11). Больная ведет активный образ жизни. Рекомендовано продолжить ношение компрессионных чулков, курсовой прием флеботропных препаратов, лечебную физкультуру.
Таким образом, представленное клиническое наблюдение демонстрирует возможность не только эпителизации «застарелых» трофических язв, но и восстановление дефектов ткани в области язвы.
Клиническое наблюдение 2
Представленный клинический случай показывает эффективность технологии регенеративной пластики у пациентов с объемным дефектом мягких тканей на фоне лучевой терапии.
Больная N. Диагноз: Рак левой молочной железы T2N0M0. 25.09.12 больной выполнена операция радикальная подкожная мастэктомия слева с одномоментной пластикой эндопротезом.
С первых суток после операции у больной отмечалась гипоксия кожи молочной железы в медиальных квадрантах на площади 8×6 см. Получала комплексное консервативное лечение. Однако в послеоперационном периоде возник участок объемного некроза дермы 7×6 см с мокнущей поверхностью и слабыми грануляциями по краю (Фиг.12А).
Больной была показана лучевая терапия, но из-за возникшего осложнения ее выполнение стало невозможным.
При планировании дальнейшей тактики лечения учитывалось следующее:
1. необходимость сохранить жизнеспособность кожных лоскутов, чтобы избежать удаление импланта (обычно некрозы на такой площади этим и заканчиваются);
2. соблюдение сроков для выполнения лучевой терапии - 2 месяца, т.к. за этот период участок некроза должен сократиться до таких размеров, чтобы он не попадал в зону облучения.
На основании данных аргументов было принято решение применить технологию регенеративной пластики G-derm.
На 5-7-е сутки наблюдения было отмечено ускорение процесса очищения раны от некротических масс, уменьшение объемов раневого дефекта и формирование грануляционной ткани (Фиг.12Б).
Через 1,5 месяца от начала применения технологии регенеративной пластики G-derm объемный дефект полностью заполнился грануляциями (Фиг.13А).
Полная эпителизация раны зафиксирована через 3,5 месяца (Фиг.13Б).
Особенностью данного клинического наблюдения является то, что при выполнении операции подкожной мастэктомии с одномоментным эндопротезированием формируют довольно большие по площади кожные лоскуты, питание которых не всегда бывает достаточным. После установки импланта между ним и кожей остается только лоскут большой грудной мышцы. Эта мышца пересекается у места прикрепления к грудной стенке и имплант помещается под нее. Мышца только на время изолирует кожу от протеза, так как впоследствии она полностью рассасывается.
Из-за нарушенного питания кожных лоскутов часто возникает их некроз (особенно на такой площади), что практически всегда приводит к удалению импланта, несмотря на проводимое лечение. В данном случае не только удалось сохранить имплант, но и провести лучевую терапию, которая, как известно, резко ухудшает репаративные процессы.
Таким образом, разработанная технология регенеративной биопластики покровных тканей имеет следующую научно-техническую новизну:
1. В эксперименте и в клинике показано формирование полноценного биологического струпа на основе заданного периода биодеградации гистоэквивалент-биопластического материала, совпадающего с динамикой регенеративных процессов в ране. Это позволяет вести раневой процесс без перевязок.
2. В предлагаемой технологии впервые применен принцип сочетанного использования аутотканей и гистоэквивалент-биопластического материала (в перфорации биоматериала укладываются округлые жизнеспособные фрагменты аутотканей). В результате аутопластики тканей на биоматериал в центральные участки регенерирующих тканей вносится дополнительный клеточный материал, что приводит к формированию нежноволокнистой соединительной ткани с последующей центробежной полноценной эпителизацией раны.
3. Использование разработанной технологии регенеративной биопластики дефектов покровных тканей обуславливает появление феномена стягивания (контракции) краев раны, что приводит к сокращению площади раны и ускорению ее последующего заживления. Обычно контракция раны достигается хирургическим способом (метод механического ушивания краев раны). Таким образом, использование технологии регенеративной биопластики дефектов покровных тканей позволяет избежать дополнительного хирургического воздействия. По сути, разрабатываемый метод биопластики может стать альтернативой хирургической аутопластики и технологиям клеточной аутотрансплантации, поскольку материал в условиях раневого процесса выполняет часть функций покровных тканей (газообмен, защита от испарения и микробной агрессии) и служит эффективной матрицей для мигрирующих собственных клеток (внеклеточный матрикс "in vivo").
4. Новизной предлагаемой технологии является также формирование на этапе заживления раны особой нежной грануляционной ткани, состоящей из множества сосудов капиллярного типа. Этот факт обуславливает профилактику цикатризации (рубцовых изменений тканей), что принципиально важно для достижения высокого функционального и эстетического результата.
1. Способ восстановления дефектов покровных тканей, включающий подготовку раны и наложение пластины биопластического материала, отличающийся тем, что в качестве биопластического материала используют гистоэквивалент-биопластический материал, в состав которого входит гидроколлоид нативной формы гиалуроновой кислоты и пептидный комплекс, при этом в перфорации гистоэквивалент-биопластического материала наносят жизнеспособные округлые лоскуты аутотканей и накрывают второй пластиной биоматериала.
2. Способ восстановления дефектов покровных тканей по п.1, отличающийся тем, что рану ведут бесперевязочным способом.