Способ цитологической диагностики рака мочевого пузыря
Иллюстрации
Показать всеИзобретение относится к области медицины и может быть использовано в онкологии, урологии, клинической лабораторной диагностике для цитологического и/или иммуноцитохимического анализа спиртового смыва мочевого пузыря для диагностики рака мочевого пузыря. В предлагаемом способе, включающем фиброцистоскопию, получение промывных вод мочевого пузыря спиртовым смывом, путем его катетеризации, после чего спиртовой смыв помещают в центрифужную пробирку и центрифугируют при скорости 1500 об/мин в течение 10 минут, после этого надосадочную жидкость сливают, к полученному осадку добавляют 4 мл питательной среды 199 для получения клеточной суспензии, которую затем помещают в фильтр-концентратор, центрифугируют в цитофуге, при этом происходит удаление фоновых элементов и разделение на фракции клеточных элементов для получения монослойного препарата, который после этого сушат на воздухе при комнатной температуре и используют для цитологического и/или иммуноцитохимического исследования. Оптимальный объем клеточной суспензии составляет от 100 до 400 мкл. Способ позволяет получить монослойные tospin-препараты с равномерным, тонкослойным (монослойным) распределением клеточного материала на небольшом участке предметного стекла. Изобретение обеспечивает повышение диагностических возможностей цитологической диагностики рака мочевого пузыря и его рецидивов. 1 з.п. ф-лы, 3 ил.
Реферат
Изобретение относится к области медицины, в частности для диагностики физиологических состояний человеческого организма путем исследования биологического материала (смыва из мочевого пузыря) in vitro для цитологического и/или иммуноцитохимического анализа. Изобретение может быть использовано в онкологии, урологии, в клинической лабораторной диагностике.
Известные традиционные способы цитологической диагностики рака мочевого пузыря по осадку мочи или по смыву мочевого пузыря по В.Г. Кузьмину (1963) [6]. Традиционное цитологическое исследование мочи имеет ряд недостатков:
- загрязнение фона исследуемого препарата воспалительными элементами, кристаллами мочевых солей, слизью, эритроцитами, бактериями;
- плохая сохранность и повреждение клеток;
- клеточный материал на предметном стекле располагается неравномерно;
- имеются участки многослойности, что создает невозможность быстрого обзора препарата.
Диагностическая ценность традиционного цитологического исследования невелика и составляет не более 40-54% [3; 5].
Известная среда накопления образцов клеток для последующего цитологического исследования на основе раствора Хенкса, полиглюкина и альбумина 10% (1:1:1) [1; 2]. Особенность описываемой среды для жидкостной цитологии в диагностике опухолей состоит в том, что она используется для накопления, сохранения и промывания образцов клеток, изъятых у пациентов для последующего цитологического и/или иммуноцитохимического анализа максимально приближенной к естественным физиологическим условиям их существования. Данная среда обладает недостатком, который заключается в том, что эту среду необходимо предварительно готовить путем смешивания трех компонентов, в связи с чем увеличивается стоимость исследования.
Известна питательная среда №199, которая содержит соли Хенкса, с глютамином и представляет собой смесь в очищенной воде неорганических солей, аминокислот, витаминов, глюкозы, которая благодаря сохранению постоянства pH, осмотического давления и обеспечения клеток необходимыми питательными веществами предназначена для консервирования образцов клеток в промежутке между отбором материала и его анализом. Питательная среда 199 в отличие от среды Хенкса, в которой недостаточное количество энергетического материала для поддержания жизнеспособности клеток, обеспечивает значительно более длительное сохранение исследуемых клеток без изменения их морфологической структуру [7].
Известен способ жидкостной цитологии для диагностики патологии шейки матки на основе использования питательной среды 199. Этот способ принят за прототип. Суть способа заключается в том, что материал, полученный с поверхности влагалищной порции шейки матки и цервикального канала, переносится в жидкую среду накопления, при этом питательная среда 199 обеспечивает сохранность клеточного материала без разрушения и потери клеток. Из этой клеточной суспензии с помощью цитоцентрифуги готовится монослойный tospin-препарат, который способствует устранению неоптимальных мазков как источника сомнительных результатов. При этом весь клеточный материал сохраняется без изменения своих морфологических и иммуноцитохимических свойств. Выраженное уплощение клеток значительно улучшает качество образцов для выполнения иммуноцитохимических реакций и гибридизации in situ. Чувствительность описанного цитологического метода составляет 91,3%, специфичность - 93,5% [4].
Цель изобретения - повышение диагностических возможностей цитологической диагностики рака мочевого пузыря и его рецидивов.
Для достижения указанной цели в способе цитологической диагностики рака мочевого пузыря, включающем фиброцистоскопию, получение промывных вод мочевого пузыря спиртовым смывом, путем его катетеризации, помещение спиртового смыва в центрифужную пробирку и центрифугирование при скорости 1500 об/мин в течение 10 минут, слив надосадочной жидкости, согласно изобретению к полученному осадку добавляют питательную среду 199 для получения клеточной суспензии, которую затем помещают в фильтр-концентратор, центрифугируют в цитофуге, при этом происходит удаление фоновых элементов и разделение на фракции клеточных элементов для получения монослойного препарата, который после этого сушат на воздухе при комнатной температуре и используют для цитологического и иммуноцитохимического исследования.
Поставленная цель достигается также тем, что оптимальный объем клеточной суспензии составляет от 100 до 400 мкл, а оптимальный объем питательной среды 199 соответствует 4 мл.
Заявляемое изобретение направлено на решение задачи подбора оптимальной среды для накопления и сохранения клеток, полученных у пациентов путем смыва мочевого пузыря, и приготовление жидкостным методом монослойных tospin-препаратов для цитологического и/или иммуноцитохимического анализа.
Технический результат достигается получением монослойных препаратов с равномерным, тонкослойным (монослойным) распределением клеточного материала на небольшом участке предметного стекла.
Сущность заявляемого изобретения заключается в том, что жидкостная цитология с использованием питательной среды 199, в отличие от традиционного цитологического исследования осадка мочи или смыва мочевого пузыря, значительно повышает чувствительность цитологического метода исследования за счет получения монослойных tospin-препаратов. Полученные tospin-препараты характеризуются равномерным, тонкослойным (монослойным) распределением клеточного материала на небольшом участке предметного стекла, хорошей визуализацией деталей ядра и цитоплазмы, значительным снижением числа элементов воспаления, эритроцитов, слизи, бактерий, кристаллов мочевых солей, артефактов.
Использование в клинической онкологической, урологической и лабораторной практике заявляемого способа обеспечивает:
- возможность получения жидкостных tospin-препаратов для цитологического исследования;
- возможность сохранения и транспортировки клеточного материала, полученного из мочевого пузыря, до 72 часов;
- возможность сохранения морфологических и иммуноцитохимических свойств клеток;
- сокращение времени и повышение производительности исследования;
- повышение чувствительности метода цитологического исследования при опухолях мочевого пузыря.
Преимущество изобретения заключается в том, что использование питательной среды 199 значительно повышает сохранность клеток, а приготовление tospin-препаратов способом жидкостной цитологии значительно повышает возможности цитологической диагностики.
Способ заключается в следующем. Перед получением промывных вод мочевого пузыря выполняли цистоскопию гибким фиброрцистоскопом. Для получения промывных вод мочевого пузыря был использован метод спиртового смыва для цитологической диагностики опухолей мочевого пузыря.
После окончания диагностической цистоскопии проводили катетеризацию мочевого пузыря одноразовым катетером Нейлотона. Через катетер в полость мочевого пузыря вводили раствор, содержащий 50 мл раствора новокаина 0,5% и 3 мл этилового спирта 95°. Затем дистальный конец катетера пережимали зажимом. Через 10-15 минут раствор собирали во флакон.
После перемешивания спиртового смыва во флаконе 10 мл смеси наливали в центрифужную пробирку и центрифугировала в центрифуге при скорости 1500 об/мин 10 минут. Надосадочную жидкость сливали, к осадку добавляли 4 мл питательной среды 199, все перемешивали. Данный клеточный образец может храниться до 72 часов при температуре +4°C. Затем исследуемый клеточный образец помещали в фильтр-концентратор в количестве 100-400 мкл и центрифугировали в цитоцентрифуге при скорости 1000 об/мин 8 минут, где происходило удаление фоновых элементов (слизь, лейкоциты, эритроциты, кристаллы мочевых солей, бактерии) и разделение на фракции клеточных элементов по размеру с целью получения монослойного препарата. Препарат сушили на воздухе при комнатной температуре. Полученный tospin-препарат может быть использован в дальнейшем для цитологического и/или иммуноцитохимического исследования. Фиксация цитологического препарата проводилась фиксатором Май-Грюнвальда. Окраску фиксированного препарата проводили по методу Романовского-Гимзе.
Заявленный способ для цитологической диагностики рака мочевого пузыря является оптимальным и отвечает всем указанным требованиям.
Качественный и количественный состав питательной среды 199 при использовании в диагностике рака мочевого пузыря является адекватным для нормального метаболизма клеток, способен поддерживать их нормальное осмотическое давление и необходимый уровень кислотно-щелочного равновесия. Полученные tospin-препараты характеризуются равномерным, тонкослойным (монослойным) распределением клеточного материала на небольшом участке предметного стекла, хорошей визуализацией деталей ядра и цитоплазмы, значительным снижением числа элементов воспаления, эритроцитов, слизи, бактерий, кристаллов мочевых солей, артефактов. Все это значительно повышает диагностические возможности цитологической диагностики рака мочевого пузыря.
Заявляемый способ цитологической диагностики рака мочевого пузыря представляет собой жидкостное цитологическое исследование образцов клеток мочевого пузыря на основе приготовления tospin-препаратов и среды.
Используемая питательная среда 199 выпускается отечественной промышленностью, что обуславливает невысокую себестоимость, а также обеспечивает соответствие заявляемого способа критерию промышленной применяемости.
Сущность изобретения поясняется графическими материалами, которые представлены на:
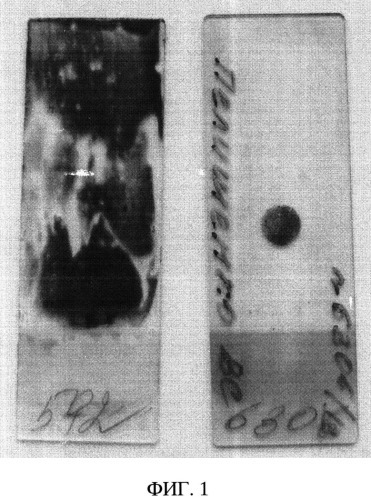
ФИГ.1. Внешний вид микропрепаратов на предметном стекле, приготовленный при традиционном цитологическом и способом жидкостной цитологии;
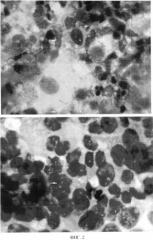
ФИГ.2. Цитологический препарат, приготовленный традиционным цитологическим методом (микрофотография); видны фоновые элементы (слизь, лейкоциты, эритроциты, клетки эпителия), затрудняющие визуализацию раковых клеток.
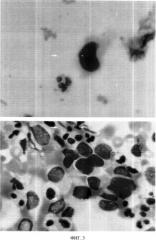
ФИГ.3. Цитологический препарат, приготовленный способом жидкостной цитологии (микрофотография); в связи с тем, что фоновые элементы (слизь, лейкоциты, эритроциты, клетки эпителия), отцентрифугированы, раковые клетки отчетливо видны в маленьком окне.
Примеры использования способа
Больной М., 67 лет, мужского пола. Обратился в ГБУЗ «Онкологический диспансер №3» (г. Новороссийск) 18.04.13 г. по направлению врача-уролога из участковой поликлиники с жалобами на рези при мочеиспускании, примесь крови в моче.
Первые признаки заболевания почувствовал 2 месяца назад, когда появились рези при мочеиспускании и примесь крови в моче. Обратился к урологу в поликлинику по месту жительства, где ему было проведено клинико-лабораторное и инструментальное обследование. УЗИ мочевого пузыря - признаки объемного образования задней стенки мочевого пузыря с неровными контурами размером 25×20 мм. В общем анализе мочи признаки микрогематории (эритроциты 15-20 в поле зрения); традиционное цитологическое исследование мочи - опухолевых клеток не выявлено.
В онкологическом диспансере больному выполнено обследование по заявляемому способу - фиброцистоскопия с получением спиртового смыва мочевого пузыря. Цитологическое исследование, выполненное методом жидкостной цитологии с использованием питательной среды 199. В результате использования заявляемого способа был диагностирован рак мочевого пузыря (клетки переходно-клеточного рака).
В дальнейшем 02.05.2013 г. выполнена операция трансуретральная резекция стенки мочевого пузыря. ПГИ №2345-08 переходно-клеточный рак. При этом было зафиксировано полное совпадение заявляемого цитологического способа с гистологическим диагнозом.
Заключительный клинический диагноз: Рак мочевого пузыря pTINxM0 I стадия.
Больной П., 62 лет, мужского пола. Наблюдается в ГБУЗ «Онкологический диспансер №3» (г. Новороссийск) с 23.06.13 г. по поводу рака мочевого пузыря. 04.06.13 г. была выполнена операция трансуретральная резекция стенки мочевого пузыря. ПГИ №2134-07 переходно-клеточный рак. В послеоперационном периоде получил 7 курсов внутрипузырной химиотерапии (препарат доксорубицин 50 мг еженедельно). Больной находился под диспансерным наблюдением.
При контрольном обследовании 02.09.13 г. проведена фиброцистоскопия. При эндоскопическом исследовании обнаружен подозрительный участок в области послеоперационного рубца. Полученный спиртовой смыв мочевого пузыря был разделен на 2 порции. Цитологическое исследование первой порции было проведено традиционным методом (ФИГ.2). В результате традиционного цитологического исследования в исследуемом материале опухолевых клеток не обнаружено. Вторая порция смыва мочевого пузыря была исследована на основе заявляемого способа жидкостной цитологии с использованием питательной среды 199.
В результате использования заявляемого способа обнаружены клетки переходно-клеточного рака (ФИГ.3). По результатам выполненного обследования у больного диагностирован рецидив рака мочевого пузыря.
Приведенные примеры могут служить подтверждением в описании указанных в изобретении преимуществ заявляемого способа, а именно:
- возможность получения жидкостных tospin-препаратов для цитологического исследования (ФИГ.1);
- возможность сохранения и транспортировки клеточного материала, полученного из мочевого пузыря до 72 часов;
- возможность сохранения морфологических и иммуноцитохимических свойств клеток;
- сокращение времени и повышение производительности исследования;
- повышение чувствительности метода цитологического исследования при опухолях мочевого пузыря.
Источники информации
1. Волченко Н.Н., Савостникова М.В. Питательная среда накопления образца клеток для последующего цитологического и/или иммуноцитохимического анализа. - М., 2003. Патент РФ №2246110. Опубликован 10.02.2005 г. Аналог.
2. Волченко Н.Н., Славнова Е.Н., Тугуликова А.А. Жидкостная цитология в онкологии // Онкология. Журнал им. П.А. Герцена. - 2013. - №5. - С.26-31. Аналог.
3. Клиническая онкоурология / под ред. Б.П. Матвеева. - М., 2011. - 934 с.
4. Леонов М.Г., Шелякина Т.В. Современные возможности профилактики и ранней диагностики рака шейки матки. - М.: «Вузовская книга», 2012. - 288 с. Прототип.
5. Переверзев А.С., Петров С.Б. Опухоли мочевого пузыря. - Харьков: «Факт», 2002. - 303 с.
6. Руководство по цитологической диагностики опухолей человека / под ред. А.С. Петрова. - М.: «Медицина», 1976. - 301 с. Аналог.
7. Справочник по микробиологическим и вирусологическим методам исследования / Под ред. М.О. Биргера. - М.: «Медицина», 1982. - 464 с. Прототип.
1. Способ цитологической диагностики рака мочевого пузыря, включающий фиброцистоскопию, получение промывных вод мочевого пузыря спиртовым смывом и путем его катетеризации, помещение смыва в центрифужную пробирку и центрифугирование при скорости 1500 об/мин в течение 10 минут, слив надосадочной жидкости, отличающийся тем, что к полученному осадку добавляют питательную среду 199 для получения клеточной суспензии, которую затем помещают в фильтр-концентратор, центрифугируют в цитофуге, при этом происходит удаление фоновых элементов и разделение на фракции клеточных элементов для получения монослойного препарата, который после этого сушат на воздухе при комнатной температуре и используют для цитологического и иммуноцитохимического исследований.
2. Способ цитологической диагностики рака мочевого пузыря по п.1, отличающийся тем, что оптимальный объем клеточной суспензии составляет от 100 до 400 мкл, а оптимальный объем питательной среды 199 составляет 4 мл.