Способ выявления белков в разных типах клеток млекопитающих и человека с помощью флуоресцеин-5-изотиоцианата на микроскопическом уровне
Иллюстрации
Показать всеИзобретение относится к биотехнологии и может быть использовано для анализа локализации и содержания белкового компонента в клетках млекопитающих с различным уровнем синтетических процессов. Предлагается способ выявления внутриклеточных белков с помощью флуоресцеин-5-изотиоционата (ФИТЦ) в клетках разных типов млекопитающих, которые характеризуются различным уровнем синтетических процессов, с применением метода конфокальной лазерной микроскопии. Клетки млекопитающих фиксируют параформальдегидом (ПФА), предотвращающим экстракцию белков на последующих стадиях окрашивания, пермеабилизуют детергентом, затем в течение 2 ч окрашивают ФИТЦ в концентрации 1 мкг/мл. Клетки заключают в Мовиол 4-88 с добавлением DABCO (1,4-диазобицикло [2.2.2] октан). Полученные препараты используют для анализа локализации и содержания белкового компонента клеток с помощью конфокальной микроскопии. Изобретение позволяет получить информацию и исследовать расположение белков внутри клеток и производить сравнительный анализ содержания белков в клетках с разным уровнем метаболизма. 7 ил., 7 пр.
Реферат
Изобретение относится к биотехнологии и может быть использовано для анализа локализации и содержания белкового компонента в клетках млекопитающих с различным уровнем синтетических процессов.
Известно, что флуоресцеин-5-изотиоцианат (ФИТЦ, химическая формула C21H11NO5S; fluorescein-5-isothiocyanate) - это флуоресцентный краситель желто-зеленого цвета, который широко используется для мечения белков (в первую очередь, антител) и пептидов in vitro (Harlow Е., Lane D. Antibodies: A Laboratory Manual. // Cold Spring Harbor Laboratory Press. 1988. 726 p.). Установлено, что в составе белков и пептидов ФИТЦ прочно связывается с α-аминогруппами аминокислот (Jullian М., Hernandez A., Maurras А., Puget К., Amblard М., Martinez J., Subra G. N-terminus FITC labeling of peptides on solid support: the truth behind the spacer. // Tetrahedron Letters. 2009. V. 50. P. 260-263).
Известно также, что ФИТЦ используют в качестве красителя на белки для последующего анализа клеток методами проточной цитофлуориметрии (Rodriguez-Sainz С., Valor L., Hernandez D.C., Gil J., Carbone J., Pascual-Bernaldez M., Rodriguez-Alcantara F., Martinez I., Vicario J.L., Mallal S., Fernandez-Cruz E. Flow cytometry analysis with a new FITC-conjugated monoclonal antibody-3E12 for HLA-B*57:01 rapid screening in prevention of abacavir hypersensitivity in HIV-1-infected patients. // HIV Clin. Trials. 2013. V. 14. N. 4. P. 160-164). Однако этот подход не позволяет оценить расположение белка в отдельных клетках, включая ооциты и эмбрионы млекопитающих.
Известно также, что в системе in vitro содержание белков может быть количественно оценено методами белковой химии (например, по методу Лоури и по методу Бредфорд) (Lowry О.Н., Rosebrough N.J., Farr A.L. Protein measurement with the Folin phenol reagent. // J. Biol. Chem. 1951. V. 193. P. 265-275; Bradford M.M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. // Anal. Biochem. 1976. V. 72. P. 248-254). Однако данные подходы требуют разрушения (лизирования) клеток и потому не позволяют получить информацию о расположении белков внутри клеток.
Таким образом, на сегодняшний день подходы для выявления суммарных внутриклеточных белков методами микроскопического анализа отсутствуют, несмотря на их востребованность в современной биологии и медицине.
Задачей изобретения является разработка способа качественного и количественного выявления белков в клетках разных типов млекопитающих и человека, которые характеризуются различным уровнем синтетических процессов, методами микроскопического анализа.
Поставленная задача решается за счет окрашивания клеток красителем ФИТЦ («Biotium», США) после их фиксации параформальдегидом (ПФА) и пермеабилизации детергентом Тритоном Х-100. Фиксация клеток ПФА предотвращает экстракцию белков на последующих стадиях окрашивания, а пермеабилизация детергентом облегчает доступ красителя к внутриклеточным белкам. ПФА разводят в фосфатно-солевом буфере ФСБ (140 мМ NaCl, 2.7 мМ KCl, 1.5 мМ KH2PO4 и 8.1 мМ Na2HPO4, рН 7.2-7.4). ФИТЦ используют в рабочей концентрации 1 мкг/мл на ФСБ.
Условия окраски соматических клеток ФИТЦ описывает Пример 1.
Пример 1.
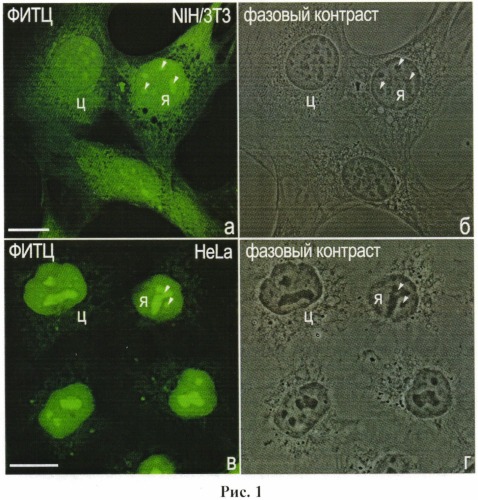
Нормальные фибробласты мыши линии NIH/3T3 или опухолевые клетки человека линий HeLa и НЕр-2 культивируют на стеклах в стандартных условиях, т.е. в культуральной среде, содержащей 90% среды DMEM (модифицированная среда Дульбекко, ″ПанЭко″, Россия), 10% телячьей эмбриональной сыворотки (″HyClone″, США), 2 мМ L-глутамина и по 250 ЕД пенициллина и стрептомицина, при 37°C и 5% CO2. Клетки отмывают в ФСБ и фиксируют в 3%-ном ПФА в течение 15 минут. После отмывки в ФСБ (3 раза по 10 мин) клетки обрабатывают 0.2%-ным раствором Тритона Х-100 на ФСБ в течение 10 мин при комнатной температуре. Клетки отмывают от детергента в ФСБ (3 раза по 10 мин), переносят в раствор ФИТЦ в концентрации 1 мкг/мл на 60 минут при комнатной температуре. Клетки отмывают в трех сменах ФСБ по 5 мин и заключают в Мовиол 4-88 («Sigma-Aldrich», США) с добавлением DABCO (1,4-диазобицикло [2.2.2] октан, «Sigma-Aldrich»). Окрашенные клетки изучают с помощью конфокального микроскопа LSM510 DuoScanMETA («Carl Zeiss», Германия), используя объектив ×63/1.4 PlanNeofluar при следующих параметрах: возбуждение флуоресценции ФИТЦ светом с длиной волны 488 нм, детекция флуоресценции ФИТЦ - 520 нм. Типичные варианты окраски клеток, полученные в условиях, описанных выше, представлены на рис.1.
Способ, предлагаемый в заявке, позволяет выявлять белки также в ооцитах и ранних эмбрионах млекопитающих, что иллюстрируют Примеры 2 и 3 соответственно.
Пример 2.
Самкам инбредных мышей линии С57В1/6 в возрасте 4-8 недель инъецируют 7.5 ME (Международных Единиц) гонадотропина сыворотки жеребой кобылы (ГСЖК, «Sigma-Aldrich», США) в 100 мкл стерильного физиологического раствора для стимуляции созревания ооцитов. Через 46-48 ч животных умерщвляют путем цервикальной дислокации. Яичники извлекают из брюшной полости и помещают в среду М2 («Sigma-Aldrich», США), содержащей 4 мг/мл бычьего сывороточного альбумина. Для предотвращения преждевременного созревания ооцитов в среду М2 добавляют 10 мкг/мл дбцАМФ (дибутирильная форма цАМФ, натриевая соль, «Sigma-Aldrich», США). Ооциты выделяют под контролем стереомикроскопа Stemi2000 (″CarlZeiss″, Германия), фиксируют 3%-ным ПФА 30 мин при комнатной температуре. Ооциты отмывают ФСБ (3 смены по 15 мин) и инкубируют в 0.2%-ном Тритоне Х-100 в течение 20 мин при комнатной температуре. Ооциты отмывают в ФСБ (3 раза по 10 мин) и помещают в раствор ФИТЦ в концентрации 1 мкг/мл на 2 ч. После окрашивания ооциты отмывают ФСБ (3 раза по 5 мин) и переносят в чашки для прижизненных наблюдений. После отмывки в ФСБ ооциты можно поместить на 20 мин в раствор красителя DAPI («Sigma-Aldrich»), разведенного в ФСБ до конечной концентрации 1 мкг/мл, для выявления хроматина. Окрашенные ооциты изучают с помощью конфокального микроскопа LSM510 DuoScanMETA («CarlZeiss», Германия), используя объективы ×63/1.4 Plan Apochromat или ×40/0.75 Plan Neofiuar.
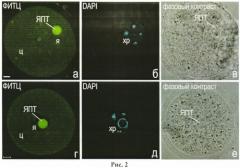
Типичные варианты окраски ооцитов в условиях, описанных выше, представлены на рис.2.
Пример 3.
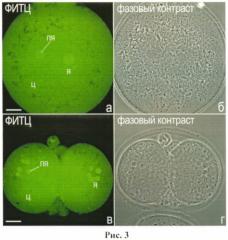
Эмбрионы получают путем введения 7 ME ГСЖК на мышь в 100 мкл стерильного физиологического раствора. Через 48 ч после введения ГСЖК самке вводят 7 ME хорионического гонадотропина человека (ХГЧ), затем самку подсаживают к самцу. Спаривание контролируют по наличию копулятивных пробок, а возраст зародышей отсчитывают от времени инъекции ХГЧ. Одноклеточные эмбрионы извлекают из яйцеводов через 19-26 ч, эмбрионы на стадии двух бластомеров - через 46-48 ч после введения ХГЧ. Фиксацию, окрашивание ФИТЦ и изучение эмбрионов с помощью конфокального лазерного микроскопа производят, как описано в Примере 2. Типичный вариант окраски эмбрионов показан на рис.3.
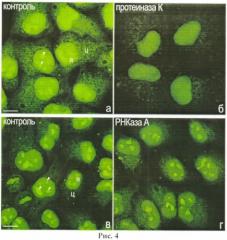
Для доказательства специфичности связывания ФИТЦ с белками производят ферментативную обработку клеток HeLa или NIH/3T3 протеиназой К или РНКазой А, как описано в Примере 4.
Пример 4.
Клетки первой опытной группы помещают в раствор протеиназы К («Amresco», США) в концентрации 1 мкг/мл на ФСБ и инкубируют 15 минут при комнатной температуре. Контрольные клетки к первой опытной группе инкубируют то же время в ФСБ. Клетки второй опытной группы помещают в раствор РНКазы A («Sigma-Aldrich») в концентрации 2 мг/мл на ФСБ и инкубируют 3 ч при 37°C. Контролем служат клетки, которые инкубируют в ФСБ то же время при той же температуре. Все контрольные и все опытные клетки окрашивают ФИТЦ, как описано в Примере 1. Результаты, подтверждающие чувствительность окраски ФИТЦ клеток к обработке протеиназой К и нечувствительность к обработке РНКазой А, показаны на рис.4.
Окрашивание внутриклеточных белков с помощью ФИТЦ не препятствует иммуноцитохимическому выявлению определенных (отдельных) белков с помощью специфических антител к этим белкам и окраски хроматина DAPI, как иллюстрирует Пример 5.
Пример 5.
Нормальные фибробласты мыши линии NIH/3T3 и опухолевые клетки человека линии НЕр-2 культивируют, как описано в Примере 1. Клетки отмывают в ФСБ и фиксируют в 3%-ном ПФА в течение 15 минут. После отмывки в ФСБ (3 раза по 10 мин) клетки обрабатывают 0.2%-ным раствором Тритона Х-100 на ФСБ в течение 10 мин при комнатной температуре, отмывают от детергента в ФСБ (3 раза по 10 мин) и переносят в раствор первичных антител, взятых в оптимальных разведениях. Окрашивание производят во влажной камере 60 мин при комнатной температуре. В качестве первичных антител используют, например, кроличьи поликлональные антитела к фактору сплайсинга SC35 («Abcam», США), кроличьи поликлональные антитела к β-тубулину («Sigma-Aldrich») или мышиные моноклональные антитела к ядрышковому антигену A3 (Григорьев А.А., Булычева Т.И., Шеваль Е.В., Калинина И.А., Зацепина О.В. Цитологические признаки подавления общего синтеза белка, выявляемые с помощью нового моноклонального антитела. Цитология. 2008. Т. 50. С. 338-346). Клетки отмывают в ФСБ (3 раза по 10 мин) и переносят в раствор вторичных антител, взятых в разведениях, рекомендуемых производителем, на 40 мин при комнатной температуре. В качестве вторичных антител используют козьи антитела к иммуноглобулинам кролика или мыши, конъюгированные с Alexa Fluor 568 («Molecular Probes Inc.», США). Клетки отмывают в ФСБ (3 раза по 10 мин) и инкубируют с ФИТЦ 60 мин при комнатной температуре. Клетки быстро отмвают в ФСБ и помещают в 0.5 мкг/мл раствор DAPI для окрашивания хроматина. Клетки отмывают в ФСБ (2 раза по 5 мин), заключают в Мовиол и изучают на микроскопе, как описано в Примере 1. Результаты окрашивания клеток ФИТЦ и мечения разными антителами показаны на рис.5.
Предлагаемый способ позволяет также производить сравнительный анализ содержания белков в клетках с разным уровнем метаболизма, как иллюстрируют Примеры 6 и 7.
Пример 6.
Клетки HeLa инкубируют в присутствии циклогексимида - универсального ингибитора синтеза белка (концентрация ингибитора - 100 мкг/мл) в течение 120 мин. Ингибитор приобретен у фирмы «Sigma-Aldrich». Клетки, инкубированные с циклогексимидом, и контрольные клетки окрашивают ФИТЦ и изучают с помощью конфокального лазерного микроскопа LSM510 DuoScanMETA, как описано в Примере 1. Типичные варианты окрашивания показаны на рис.6, где (а) - клетки контрольной группы и (б) - клетки, обработанные циклогексимидом. Хорошо видно, что инкубация клеток с циклогексимидом приводит к уменьшению интенсивности их окрашивания ФИТЦ.
Для количественной оценки изменения интенсивности флуоресценции в контрольных и опытных образцах используют программное обеспечение, прилагаемое к конфокальному микроскопу, или программу для анализа изображений Image J, предоставляемую Национальным Институтом Здоровья (NIH, США по интернет адресу http://rsbweb.nih.gov/ij/features.html). Обе программы позволяют строить профили распределения интенсивностей флуоресценции красителя вдоль прямой линии, проведенной исследователем через любой участок изображения, и позволяют получать сходные результаты.
Результаты, полученные с помощью программы Image J, представлены на рис.6 (в, г). Исходя из значений интенсивностей общего уровня флуоресценции ФИТЦ в контрольных клетках (рис.6, в) и клетках, инкубированных с циклогексимидом (рис.6, г), можно заключить, что ингибирование синтеза белка при инкубации клеток с циклогексимидом приводит к уменьшению интенсивности флуоресценции ФИТЦ более чем в два раза.
Пример 7.
В качестве второй модели используют фибробласты мыши линии NIH/3T3, которые в течение 2 суток культивируют, как описано в Примере 1, а затем переносят в среду DMEM, содержащую 0.1% эмбриональной сывороткой теленка, на 72 ч. Это приводит к выходу клеток из пролиферативного клеточного цикла в G0-период - период, который характеризуется пониженным уровнем метаболизма по сравнению с клетками, находящимися в экспоненциальной фазе роста (Geyer P.K., Meyuhas О., Perry R.P., Johnson L.F. Regulation of ribosomal protein mRNA content and translation in growth-stimulated mouse fibroblasts. // Mol Cell Biol. 1982. V. 2. №6. P.685-693). Клетки контрольной группы (т.е. клетки, находящиеся в экспоненциальной фазе роста) и клетки, находящиеся в G0-периоде фиксируют, окрашивают ФИТЦ и изучают с помощью конфокального лазерного микроскопа LSM510 DuoScanMETA, как описано в Примере 1. Изображения обрабатывают, как описано в Примере 6. На рисунке 7 (а, б) видно, что яркость флуоресценции клеток, находящихся в G0-периоде, ниже, чем в контроле. Рисунки 7 (в, г) показывают, что интенсивность флуоресценции ФИТЦ в клетках в G0-периоде понижается по сравнению с контрольными значениями почти в два раза.
Изобретение иллюстрируют следующие графические материалы:
Рис.1. Окрашивание клеток мыши NIH/3T3 и клеток человека HeLa флуоресцентным красителем ФИТЦ. Левый ряд - окраска ФИТЦ; правый ряд - соответствующие фазово-контрастные изображения клеток. Масштабная линия, 10 мкм.
Наиболее ярко ФИТЦ окрашивает ядрышки (указаны головками стрелок), что соответствует литературным данным о повышенной концентрации белка именно в этом компартменте клетки (Ahmad Y., Boisvert F.М., Gregor P., Cobley A., Lamond A.I. Nucleolar ProteomeDatabase--2008 update // Nucleic Acids Res. 2009. V. 37. P. 181-184). Значительные количества белка выявляются также в ядре (я) и цитоплазме (ц), где белок располагается неравномерно. Зоны, свободные от белка, вероятно, соответствуют внутрицитоплазматическим вакуолям.
Рис.2. Окрашивание преовуляторных ооцитов мыши ФИТЦ (а, г) и DAPI (б, в), (в, е) - фазово-контрастные изображения ооцитов. я - ядро; ц - цитоплазма; ЯПТ - ядрышко-подобное тельце, или ядрышко. Масштабная линия, 10 мкм.
Хорошо видно, что ядрышки ооцитов окрашиваются ФИТЦ. Окраска ядрышек ФИТЦ не препятствует окрашиванию хроматина красителем DAPI (возбуждение флуоресценции светом с длиной волны 359 нм, детекция флуоресценции - 461 нм) и выявлению ядрышек в режиме фазового контраста.
Рис.3. Окрашивание одноклеточного эмбриона мыши (а, б) и эмбрионов мыши на стадии двух бластомеров (в, г) красителем ФИТЦ. Масштабная линия, 10 мкм.
Хорошо видно, что ФИТЦ позволяет выявлять внутриклеточную локализацию белков в цитоплазме (ц) и ядрах (я) ранних эмбрионов млекопитающих. Наиболее высокая концентрация белков характерна для предшественников ядрышек (ПЯ).
Рис.4. Окрашивание клеток NIH/3T3 ФИТЦ в контроле (а, в) и после обработки протеиназой К (б) или РНКазой А (г), ц - цитоплазма; я - ядро; головки стрелок - ядрышки. Масштабная линия, 10 мкм.
Видно, что обработка протеиназой К ослабляет интенсивность окрашивания клеток (особенно, ядрышек) ФИТЦ (сравнить а и б), тогда как инкубация клеток с РНКазой А заметно не снижает интенсивность их флуоресценции (сравнить в и г).
Рис.5. Окрашивание клеток мыши NIH/3T3 (а-е) и человека НЕр-2 (ж-и) красителем ФИТЦ и антителами к белку цитоплазматических микротрубочек β-тубулину (б), ядерному фактору сплайсинга мРНК SC-35 (д), ядрышковому белку A3 (з); (в, е, и) - окраска клеток красителем DAPI. ц - цитоплазма; я - ядро; головки стрелок - ядрышки. Масштабная линия, 10 мкм.
Видно, что ФИТЦ не препятствует иммуноцитохимическому выявлению белков с локализацией внутри цитоплазмы (б), ядра (д) и ядрышек (з), а также окрашиванию хроматина в клетках мыши (в, е) и человека (и) с помощью DAPI. В клетках мыши отчетливо видны многочисленные ярко окрашенные блоки гетерохроматина - хромоцентры.
Рис.6. Окрашивание клеток HeLa красителем ФИТЦ в контроле (а) и после обработки циклогексимидом в концентрации 100 мкг/мл в течение 120 минут; (в, г) - профили распределения интенсивности флуоресценции ФИТЦ вдоль произвольной прямой, проведенной через клетки, в контроле (в) и после обработки циклогексимидом (г). Горизонтальная ось - расстояние (в пикселах) от начала прямой (нижний угол), вертикальная ось - профили интенсивности флуоресценции ФИТЦ (в условных единицах, УЕ) вдоль этой прямой. Белые стрелки на рисунках (а) и (б) указывают на положение участков, обладающих максимальной флуоресценцией; соответствующие показатели интенсивности флуоресценции обозначены на рисунках (в) и (г) черными стрелками. Масштабная линия, 10 мкм.
Видно, что инкубация клеток с циклогексимидом приводит к визуальному уменьшению интенсивности флуоресценции (сравнить а и б). Рисунки (в) и (г) показывают, что максимальные значения флуоресценции ФИТЦ в контроле достигают 80 УЕ, а после обработки циклогексимидом составляют около 25 УЕ, т.е. уменьшаются более чем в два раза.
Рис.7. Окрашивание красителем ФИТЦ пролиферирующих фибробластов линии NIH/3T3 (а, контроль) и фибробластов, синхронизованных в G0-периоде (б); (в, г) - профили распределения интенсивности флуоресценции ФИТЦ вдоль произвольной прямой в контроле и после синхронизации в G0-периоде, соответственно. Горизонтальная ось - расстояние (в пикселах) от начала прямой (нижний угол), вертикальная ось - профили интенсивности флуоресценции ФИТЦ (в условных единицах, УЕ) вдоль этой прямой. Белые стрелки на рисунках (а) и (б) указывают на положение участков, обладающих максимальной интенсивностью флуоресценции; соответствующие показатели интенсивности флуоресценции обозначены на рисунках (в) и (г) черным стрелками. Масштабная линия, 10 мкм.
Видно, что синхронизация клеток в G0-периоде приводит к визуальному уменьшению интенсивности флуоресценции ФИТЦ по сравнению с асинхронно делящимися клетками (сравнить а и б). Рисунки (в) и (г) показывают, что максимальные значения флуоресценции ФИТЦ в асинхронных клетках достигают 60 УЕ, а контрольных клетках - 35 УЕ, т.е. уменьшаются почти в два раза.
Способ выявления белков в разных типах клеток млекопитающих и человека с помощью флуоресцентного красителя флуоресцеин-5-изотиоционата (ФИТЦ), включающий фиксацию клеток 3%-ным параформальдегидом, приготовленным на 0.1 М фосфатно-солевом буфере (ФСБ), в течение 15 минут при комнатной температуре, обработку клеток 0.2%-ным раствором Тритона Х-100 на ФСБ в течение 10 минут при комнатной температуре, окрашивание клеток ФИТЦ в течение 2 часов при комнатной температуре и заключение клеток в Мовиол 4-88 («Sigma-Aldrich», США) с добавлением DABCO (1,4-диазобицикло [2.2.2] октан, «Sigma-Aldrich») для последующего анализа методами конфокальной микроскопии.