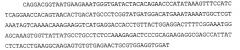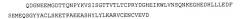Pscaxcd3, cd19xcd3, c-metxcd3, эндосиалинxcd3, epcamxcd3, igf-1rxcd3 или fap-альфаxcd3 биспецифическое одноцепочечное антитело с межвидовой специфичностью
Иллюстрации
Показать всеНастоящее изобретение относится к области иммунологии. Предложена молекула биспецифического одноцепочечного антитела, содержащая первый связывающий домен, способный связываться с эпитопом CD3-эпсилон-цепи человека и Callithrix jacchus (игрунка), Saguinus oedipus (эдипов тамарин) и Saimiri sciureus (беличья обезьяна), и второй связывающий домен, способный связываться с антигеном, выбранным из группы, состоящей из: PSCA, CD19, С-МЕТ, эндосиалина, EGF-подобного домена 1 ЕрСАМ, кодируемого экзоном 2, FAP-альфа или IGF-IR (или IGF-1R) человека и/или примата. Эпитоп СD3ε включает аминокислотную последовательность, раскрытую в описании. Раскрыта нуклеиновая кислота, кодирующая указанную молекулу биспецифического одноцепочечного антитела, экспрессирующий вектор, клетка-хозяин и способ получения антитела, а также полученное способом антитело. Описывается фармацевтическая композиция, содержащая молекулу биспецифического одноцепочечного антитела и способ предупреждения, лечения или ослабления рака или аутоиммунного заболевания на её основе. Предложено применение указанной молекулы биспецифического одноцепочечного антитела для изготовления фармацевтической композиции для предупреждения, лечения или ослабления рака или аутоиммунного заболевания. Использование изобретения обеспечивает клиническое улучшение в отношении перераспределения Т-клеток, уменьшая его, и улучшенный профиль безопасности. 9 н. и 14 з.п. ф-лы, 74 ил., 17 табл., 33 пр.
Реферат
Настоящее изобретение относится к молекуле биспецифического одноцепочечного антитела, содержащей первый связывающий домен, способный связываться с эпитопом CD3-эпсилон-цепи человека и примата, не являющегося шимпанзе, где указанный эпитоп является частью аминокислотной последовательности, входящей в группу, состоящую из SEQ ID NO: 2, 4, 6 и 8, и второй связывающий домен, способный связываться с антигеном, выбранным из группы, состоящей из антигена стволовых клеток предстательной железы (PSCA), антигена В-лимфоцитов CD19 (CD19), рецептора фактора роста гепатоцитов (С-МЕТ), эндосиалина, EGF (эпидермальный фактор роста)-подобного домена 1 молекулы адгезии эпителиальных клеток (ЕрСАМ), кодируемого экзоном 2, белка активации фибробластов альфа (FAP-альфа) и рецептора инсулиноподобного ростового фактора I (IGF-IR или IGF-1R). Согласно изобретению предложены также нуклеиновые кислоты, кодирующие указанную молекулу биспецифического одноцепочечного антитела, а также векторы и клетки-хозяева и способ их получения. Изобретение также относится к фармацевтическим композициям, содержащим указанную молекулу биспецифического одноцепочечного антитела, и к медицинским применениям указанной молекулы биспецифического одноцепочечного антитела.
Т-клеточное распознавание опосредовано клонотипически распределенными альфа-бета и гамма-дельта Т-клеточными рецепторами (TcR), которые взаимодействуют с пептид-нагруженными молекулами пептид-МНС (главный комплекс гистосовместимости) (рМНС) (Davis & Bjorkman, Nature 334 (1988), 395-402). Антиген-специфические цепи TcR не содержат сигнальных доменов, а вместо этого связываются с консервативным мультисубъединичным аппаратом передачи сигнала CD3 (Call, Cell 111 (2002), 967-979; Alarcon, Immunol. Rev. 191 (2003), 38-46; Malissen Immunol. Rev. 191 (2003), 7-27). Механизм, посредством которого TcR-лигирование напрямую связано с аппаратом передачи сигнала, остается фундаментальным вопросом Т-клеточной биологии (Alarcon, см. выше; Davis, Cell 110 (2002), 285-287). Кажется очевидным, что в устойчивые Т-клеточные ответы вовлечены контактирование с корецептором, олигомеризация TcR и организация комплексов TcR-pMHC более высокого порядка в иммунологическом синапсе (Davis & van der Merwe, Curr. Biol. 11 (2001), R289-R291; Davis, Nat. Immunol. 4 (2003), 217-224). Однако самая ранняя передача сигнала посредством TcR происходит в отсутствие этих событий и может приводить к лиганд-индуцированному изменению в CD3-эпсилон (Alarcon, см. выше; Davis (2002), см. выше; Gil, J. Biol. Chem. 276 (2001), 11174-11179; Gil, Cell 109 (2002), 901-912). Эпсилон-, гамма-, дельта- и зета-субъединицы сигнального комплекса ассоциируются друг с другом с образованием CD3-эпсилон-гамма гетеродимера, CD3-эпсилон-дельта гетеродимера и CD3-зета-зета гомодимера (Call, см. выше). Различные исследования выявили, что молекулы CD3 важны для надлежащей экспрессии на клеточной поверхности альфа-бета TcR и нормального развития Т-клеток (Berkhout, J. Biol. Chem. 263 (1988), 8528-8536; Wang, J. Exp.Med. 188 (1998), 1375-1380; Kappes, Curr. Opin. Immunol. 7 (1995), 441-447). Исследование структуры фрагментов эктодоменов мышиного CD3-эпсилон-гамма гетеродимера показало, что эпсилон-гамма-субъединицы представляют собой C2-set lg-домены, которые взаимодействуют друг с другом с образованием необычной поперечной (side-to-side) димерной конфигурации (Sun, Cell 105 (2001), 913-923). Хотя богатый цистеиновыми остатками "стебель", по-видимому, играет важную роль в запуске димеризации CD3 (Su, см. выше, Borroto, J. Biol. Chem. 273 (1998), 12807-12816), взаимодействие посредством внеклеточных доменов CD3-эпсилон и CD3-гамма является достаточным для образования комплекса этих белков с TcR-бета (Manolios, Eur. J. Immunol. 24 (1994), 84-92; Manolios & Li, Immunol. Cell Biol. 73 (1995), 532-536). Несмотря на продолжающуюся дискуссию по этому вопросу, преобладающая стехиометрия TcR вероятней всего содержит один альфа-бета TcR, один CD3-эпсилон-гамма гетеродимер, один CD3-эпсилон-дельта гетеродимер и один CD3-зета-зета гомодимер (Call, см. выше). С учетом центральной роли человеческого CD3-эпсилон-гамма гетеродимера в иммунном ответе не так давно была установлена кристаллическая структура этого комплекса, связанного с терапевтическим антителом ОКТ3 (Kjer-Nielsen, PNAS 101, (2004), 7675-7680).
Многие терапевтические стратегии основаны на модулировании Т-клеточного иммунитета путем направленного воздействия на передачу сигнала посредством TcR, в частности на моноклональные антитела (mAb) против CD3 человека, которые широко используются в клинических схемах введения иммунодепрессантов. CD3-специфическое мышиное mAb ОКТ3 было первым mAb, разрешенным для применения у людей (Sgro, Toxicology 105 (1995), 23-29), и оно находит широкое клиническое применение в качестве иммунодепрессанта при трансплантации (Chatenoud, Clin. Transplant 7 (1993), 422-430; Chatenoud, Nat. Rev. Immunol. 3 (2003), 123-132; Kumar, Transplant. Proc. 30 (1998), 1351-1352), при диабете типа 1 (Chatenoud (2003), см. выше) и при псориазе (Utset, J. Rheumatol. 29 (2002), 1907-1913). Более того, анти-CD3 mAb могут индуцировать частичную Т-клеточную передачу сигнала и клональную толерантность (Smith, J. Exp.Med. 185 (1997), 1413-1422). ОКТ3 описано в литературе как мощный Т-клеточный митоген (Van Wauve, J. Immunol. 124 (1980), 2708-18) и как мощный Т-клеточный киллер (Wong, Transplantation 50 (1990), 683-9). ОКТ3 проявляет эти виды активности время-зависимым образом, и после ранней активации Т-клеток, приводящей к высвобождению цитокинов, последующее введение ОКТ3 блокирует все известные Т-клеточные функции. Благодаря этому последующему блокированию Т-клеточной функции ОКТ3 нашло такое широкое применение в качестве иммунодепрессанта в курсах терапии с целью снижения или даже аннулирования отторжения тканевого аллотрансплантата.
ОКТ3 реверсирует отторжение тканевого аллотрансплантата вероятней всего путем блокирования функции всех Т-клеток, которые играют главную роль в остром отторжении. ОКТ3 взаимодействует с CD3-комплексом и блокирует функцию CD3-комплекса в мембране Т-клеток человека, который ассоциирован с антиген-распознающей структурой Т-клеток (TCR) и является важным для сигнальной трансдукции. Предметом множества исследований был вопрос о том, с какой субъединицей TCR/CD3 связывается ОКТ3. Некоторые факты все же свидетельствуют о специфичности ОКТ3 к эпсилон-субъединице комплекса TCR/CD3 (Tunnacliffe, Int. Immunol. 1 (1989), 546-50; Kjer-Nielsen, PNAS 101, (2004), 7675-7680). Дополнительные данные свидетельствуют о том, что для связывания ОКТ3 с комплексом TCR/CD3 необходимо присутствие других субъединиц этого комплекса (Salmeron, J. Immunol. 147 (1991), 3047-52).
Другие общеизвестные антитела, обладающие специфичностью к молекуле CD3, перечислены в Tunnacliffe, Int. Immunol. 1 (1989), 546-50. Как указано выше, такие CD3-специфические антитела способны индуцировать различные Т-клеточные ответы, такие как продуцирование лимфокинов (Von Wussow, J. Immunol. 127 (1981), 1197; Palacious, J. Immunol. 128 (1982), 337), пролиферация (Van Wauve, J. Immunol. 124 (1980), 2708-18) и индукция Т-клеточных супрессоров (Kunicka, "Lymphocyte Typing II" 1 (1986), 223). То есть, в зависимости от условий эксперимента CD3-специфическое моноклональное антитело может либо ингибировать, либо индуцировать цитотоксичность (Leewenberg, J. Immunol. 134 (1985), 3770; Phillips, J. Immunol. 136 (1986) 1579; Platsoucas, Proc. Natl. Acad. Sci. USA 78 (1981), 4500; Itoh, Cell. Immunol. 108 (1987), 283-96; Mentzer, J. Immunol. 135 (1985), 34; Landegren, J. Exp.Med. 155 (1982), 1579; Choi (2001), Eur. J. Immunol. 31, 94-106; Xu (2000), Cell Immunol. 200, 16-26; Kimball (1995), Transpl. Immunol. 3, 212-221).
Хотя известно, что многие антитела против CD3, описанные в данной области, распознают CD3-эпсилон-субъединицу CD3-комплекса, большинство из них в действительности связываются с конформационными эпитопами и, следовательно, распознают CD3-эпсилон только в нативном окружении TCR. Конформационные эпитопы характеризуются наличием двух или более отдельных аминокислотных остатков, которые обособлены в первичной последовательности, но объединяются на поверхности молекулы, когда полипептид сворачивается в нативный белок/антиген (Sela, (1969) Science 166, 1365; Laver, (1990) Cell 61, 553-6). Конформационные эпитопы, связывающиеся с антителами против CD3-эпсилон, описанными в данной области, можно разделить на две группы. В основной группе указанные эпитопы представляют собой эпитопы, образованные двумя субъединицами CD3, например CD3-эпсилон-цепью и CD3-гамма- или CD3-дельта-цепью. Например, в результате проведения нескольких исследований было установлено, что наиболее широко используемые моноклональные антитела против CD3-эпсилон, а именно ОКТ3, WT31, UCHT1, 7D6 и Leu-4, не связываются с клетками, однократно трансфицированными CD3-эпсилон-цепью. Однако эти антитела окрашивали клетки, двукратно трансфицированные комбинацией CD3-эпсилон плюс либо CD3-гамма, либо CD3-дельта (Tunnacliffe, см. выше; Law, Int. Immunol. 14 (2002), 389-400; Salmeron, J. Immunol. 147 (1991), 3047-52; Coulie, Eur. J. Immunol. 21 (1991), 1703-9). Во второй, меньшей группе конформационный эпитоп образуется в пределах самой CD3-эпсилон субъединицы. Членом этой группы является, например, mAb АРА 1/1, индуцированное против денатурированной CD3-эпсилон-цепи (Risueno, Blood 106 (2005), 601-8). В совокупности, большинство антител против CD3-эпсилон, описанных в данной области, распознают конформационные эпитопы, расположенные на двух или более субъединицах CD3. Отдельные аминокислотные остатки, образующие трехмерную структуру этих эпитопов, могут быть локализованы при этом либо на самой CD3-эпсилон субъединице, либо на CD3-эпсилон субъединице и других субъединицах CD3, таких как CD3-гамма или CD3-дельта.
Другая проблема, связанная с антителами против CD3, заключается в том, что многие антитела против CD3, как было установлено, являются видоспецифическими. Моноклональные антитела против CD3 функционируют путем высокоспецифического распознавания свих молекул-мишеней, что справедливо, как правило, для любых других моноклональных антител. Они распознают только один сайт, или эпитоп, на их целевой молекуле CD3. Например, одним из наиболее широко используемых и лучше всего охарактеризованных моноклональных антител, специфичных к CD3-комплексу, является ОКТ-3. Это антитело взаимодействует с CD3 шимпанзе, но не с гомологом CD3 других приматов, таких как макаки, или с CD3 собаки (Sandusky et al., J. Med. Primatol. 15 (1986), 441-451). Аналогично, в WO 2005/118635 или WO 2007/033230 описаны человеческие моноклональные антитела против CD3-эпсилон, которые взаимодействуют с CD3-эпсилон человека, но не с CD3-эпсилон мыши, крысы, кролика или примата, не являющегося шимпанзе, такого как макак-резус, яванский макак или павиан. AHTH-CD3 моноклональное антитело UCHT-1 также взаимодействует с CD3 шимпанзе, но не с CD3 макака (собственные данные). С другой стороны, есть также примеры моноклональных антител, которые распознают антигены макака, но не их человеческие копии. Одним из примеров этой группы является моноклональное антитело FN-18, направленное на CD3 макака (Uda et al., J. Med. Primatol. 30 (2001), 141-147). Интересес представляет тот факт, что обнаружено, что периферические лимфоциты от примерно 12% яванских макаков не взаимодействуют с моноклональным антителом против CD3 макака-резуса (FN-18) из-за полиморфизма антигена CD3 у макаков. Uda с соавторами описали замену двух аминокислот в последовательности CD3 яванских макаков, которые не взаимодействуют с антителами FN-18, по сравнению с CD3 животных, которые взаимодействуют с антителами FN-18 (Uda et al., J. Med. Primatol. 32 (2003), 105-10; Uda et al., J. Med. Primatol. 33 (2004), 34-7).
Эта различающая способность, т.е. видовая специфичность, свойственная не только моноклональным антителам против CD3 (и их фрагментам), но и моноклональным антителам вообще, существенно затрудняет их разработку в качестве терапевтических агентов для лечения заболеваний человека. Для того чтобы получить разрешение на продажу, любое новое лекарство-кандидат должно пройти строгое тестирование. Это тестирование можно подразделить на доклиническую и клиническую фазы, причем клиническая фаза дополнительно подразделяется на общеизвестные клинические фазы I, II и III, которые проводят на пациентах-людях, а доклиническую фазу проводят на животных. Цель доклинического тестирования состоит в том, чтобы доказать, что лекарственное средство-кандидат обладает желаемой активностью и, что очень важно, является безопасным. Только после установления безопасности и возможной эффективности лекарственного средства-кандидата в доклинических испытаниях на животных это лекарственное средство-кандидат будет одобрено соответствующим регулирующим органом для клинических испытаний на людях. Лекарственные средства-кандидаты могут быть протестированы в отношении безопасности на животных следующими тремя путями: (1) на релевантном виде, т.е. на виде, в организме которого лекарственные средства-кандидаты могут распознавать ортологические антигены, (2) на трансгенном животном, содержащем человеческие антигены, и (3) путем использования имитатора лекарственного средства-кандидата, который может связываться с ортологическими антигенами, присутствующими в организме животного. Ограничения по трансгенным животным заключаются в том, что эта технология обычно ограничивается грызунами. Между грызунами и человеком имеются значительные различия в физиологии, и результаты по безопасности нельзя с легкостью экстраполировать на людей. Ограничениями по имитатору лекарственного средства-кандидата являются другой состав вещества по сравнению с реальным лекарственным средством-кандидатом, и часто используемыми животными являются грызуны с тем ограничением, которое обсуждается выше. Следовательно, доклинические данные, полученные на грызунах, имеют ограниченную прогностическую способность в отношении лекарственного средства-кандидата. Подход к решению проблемы выбора тестирования безопасности заключается в использовании релевантного вида, предпочтительно низшего примата, В настоящее время ограничение, касающееся моноклональных антител, подходящих для терапевтического вмешательства у человека и описанных в данной области, заключается в том, что релевантными видами являются высшие приматы, в частности шимпанзе. Шимпанзе считаются исчезающим видом, и в связи с их человекоподобной природой использование таких животных для тестирования безопасности лекарственного средства запрещено в Европейских странах и в значительной степени ограничено в других странах. CD3 был также успешно использован в качестве мишени для биспецифических одноцепочечных антител с той целью, чтобы перенаправлять цитотоксические Т-клетки к патологическим клеткам и, в результате, выводить больные клеток из соответствующего организма (WO 99/54440; WO 04/106380). Например, Bargou с соавторами (Science 321 (2008): 974-7) недавно сообщили о клинической активности конструкции CD19×CD3 биспецифического антитела, названной блинатумомабом, которая обладает потенциалом контактировать со всеми цитотоксическими Т-клетками у пациентов-людей для лизиса раковых клеток. Низкие дозы, такие как 0,005 миллиграммов на квадратный метр в сутки, у пациентов с неходжкинской лимфомой приводили к истощению клеток-мишеней в крови. Частичные и полные регрессии опухолей впервые наблюдались при уровне дозы 0,015 миллиграммов, и у всех семи пациентов, которых лечили дозами 0,06 миллиграммов, наблюдалась регрессия опухоли. Блинатумомаб также приводил к клиренсу опухолевых клеток из костного мозга и печени. Несмотря на то, что это исследование дало клиническое доказательство концепции для терапевтической эффективности формата биспецифического одноцепочечного антитела в лечении рака клеток крови, все еще существует потребность в успешных концепциях для терапий других видов рака.
По оценкам, в Соединенных Штатах Америки в 2008 году у 186320 мужчин будет впервые диагностирован рак предстательной железы, и примерно 28660 мужчин умрут от этой болезни. Согласно большинству предыдущих отчетов по смертности от рака в 2004 году общий уровень смертности от рака предстательной железы среди американских мужчин составлял 25 на 100000. В конце 1980-х годов широкое применение теста на специфический антиген предстательной железы (PSA) сыграло большую роль в улучшении лечения рака предстательной железы. Этот тест позволяет измерять количество PSA-белка в крови, которое часто бывает повышенным у пациентов с раком предстательной железы. В 1986 году Управление по контролю пищевых продуктов и лекарственных средств США (U.S. Food and Drug Administration) одобрило применение теста на PSA для мониторинга пациентов с раком предстательной железы и в 1994 году дополнительно одобрило его применение в качестве скрининг-теста в отношении этого заболевания. Благодаря всеобщему проведению тестирования на PSA в США, в настоящее время приблизительно 90 процентов всех случаев рака предстательной железы диагностируется на ранней стадии, и, следовательно, мужчины живут дольше после установления диагноза. Однако чтобы определить, действительно ли скрининг PSA спасает жизни, потребуются результаты двух проводящихся в настоящее время клинических испытаний, а именно спонсируемого Национальным институтом рака (NCI) Скринингового испытания в отношении предстательной железы, легкого, ободочной и прямой кишки и яичника (PLCO) и Европейского исследования со скринингом в отношении рака предстательной железы (ERSPC). В проводившихся в течение последних 25 лет клинических испытаниях исследовалась эффективность природных и синтетических соединений в предупреждении рака предстательной железы. Например, в Испытании в отношении предупреждения рака предстательной железы (РСРТ), в котором участвовало около 19000 здоровых мужчин, было обнаружено, что финастерид, лекарственное средство, разрешенное для лечения доброкачественной гиперплазии предстательной железы (ВРН), которая представляет собой доброкачественное увеличение предстательной железы, снижает риск развития рака предстательной железы на 25 процентов. Еще одно испытание, Испытание по предупреждению рака с использованием селена и витамина Е (SELECT), в котором участвуют более 35000 мужчин, проводится с целью определения, могут ли ежедневные добавки селена и витамина Е снижать инцидентность рака предстательной железы у здоровых мужчин. В других испытаниях по предотвращению рака предстательной железы, которые проводятся в настоящее время, оценивается защитный потенциал поливитаминов, витаминов С и D, сои, зеленого чая и ликопена, который является природным соединением, обнаруженным в томатах. Одно исследование, о котором сообщалось в 2005 году, показало, что специфические гены были слитыми в 60-80 процентах проанализированных опухолей предстательной железы. Это исследование представляет собой первое наблюдение неслучайных генных перестроек при раке предстательной железы. Это генетическое изменение может быть использовано, в конечном счете, в качестве биомаркера для диагностики и, возможно, для лечения этого заболевания. Другие исследования показали, что генетические вариации в специфической области хромосомы 8 могут увеличивать риск развития рака предстательной железы у человека. Эти генетические вариации объясняют приблизительно 25 процентов случаев рака предстательной железы, которые имеют место у белых мужчин. Они являются первыми достоверными генетическими вариантами, которые увеличивают риск развития рака предстательной железы и могут помочь ученым лучше понять генетические причины этого заболевания. Проводится также исследование, направленное на выяснение, как белки, циркулирующие в крови пациента, могут быть использованы для улучшения диагностики рака предстательной железы и других видов рака. В 2005 году ученые идентифицировали группу специфических белков, продуцируемых иммунной системой пациента в ответ на опухоли предстательной железы. Эти белки, типа аутоантитела, способны обнаруживать присутствие клеток рака предстательной железы в образцах крови с точностью свыше 90 процентов. При использовании в комбинации с PSA эти белки и другие белки крови могут, в конечном счете, быть использованы для сокращения количества ложноположительных результатов, получаемых только тестированием на PSA, и, следовательно, для сокращения многочисленных ненужных биопсий предстательной железы, выполняемых каждый год из-за ложноположительных результатов теста на PSA.
Помимо PSA было идентифицировано несколько других маркеров рака предстательной железы, включая, например, шестидоменный трансмембранный эпителиальный антиген предстательной железы (STEAP) (Hubert et al, PNAS 96 (1999), 14523-14528), специфический мембранный антиген предстательной железы (PSM/PSMA) (Israeli et al., Cancer Res. 53 (1993), 227-230) и антиген стволовых клеток предстательной железы (PSCA) (Reiter et al„ Proc. Nat. Acad. Sci. 95: 1735-1740, 1998). Антиген стволовых клеток предстательной железы (PSCA) представляет собой белок из 123 аминокислот, впервые идентифицированный при поиске генов, экспрессия которых повышается при прогрессировании рака в модели с использованием ксенотрансплантата LAPC-4 (линия клеток рака предстательной железы) (Reiter et al., см. выше). Он представляет собой гликозил-фосфатидилинозитол-заякоренный белок клеточной поверхности, который принадлежит семейству поверхностных антигенов Thy-1/Ly-6. PSCA имеет 30%-ную гомологию с антигеном стволовых клеток типа 2. Хотя функция PSCA все еще дискутируется, гомологи PSCA обладают разными видами активности и сами вовлечены в канцерогенез. Было показано, что антиген стволовых клеток типа 2 предотвращает апоптоз в незрелых тимоцитах (Classon and Coverdale, PNAS 91 (1994), 5296-5300). Thy-1 активирует Т-клетки путем передачи сигнала через src-тирозинкиназы (Amoui et al., Eur. J. Immunol. 27 (1997), 1881-86). Гены Ly-6 участвуют в опухолегенезе и клеточной адгезии (Schrijvers et al., Exp.Cell. Res. 196 (1991), 264-69). Начальные исследования информационных РНК (иРНК) и последующее окрашивание моноклональным антителом (mAb) выявили, что PSCA экспрессируется на клеточной поверхности нормальных и злокачественных клеток предстательной железы (Reiter et al., см. выше; Gu et al., Опсодепе 19 (2000), 1288-96; Ross et al., Cancer Res. 62 (2002), 2546-53). В нормальной предстательной железе иРНК PSCA обнаружена в субпопуляции базальных и секреторных клеток. В карциноме предстательной железы экспрессия иРНК PSCA обнаружена приблизительно в 50-80% случаев первичного и приблизительно в 70% случаев метастатического рака (Reiter et al., см. выше). Имеются сведения об иммуногистохимии 112 случаев первичного рака предстательной железы и девяти случаев рака предстательной железы с метастазами в кость (Gu et al., см. выше). Экспрессия PSCA обнаружена в 94% случаях и сверхэкспрессия обнаружена в 40% случаев клинически установленного рака предстательной железы. Высокие уровни экспрессии белка PSCA обнаружены также в девяти случаях из девяти исследованных костных метастазов рака предстательной железы. За пределами предстательной железы PSCA обнаруживается в покровном слое клеток переходного эпителия, в некоторых ренальных собирающих протоках, в нейроэндокринных клетках желудка и в плацентарных трофобластах. Важно то, что согласно данным недавних исследований сверхэкспрессия PSCA наблюдается в большинстве раковых опухолей поджелудочной железы и инвазивных и неинвазивных переход но-клеточных карциномах (Amara et al., Cancer Res. 61 (2001), 4660-4665; Argani et al., Cancer Res. 61 (2001), 4320-24). Поскольку PSCA экспрессируется на клеточной поверхности и сверхэкспрессируется в значительной части различных видов рака, его рассматривают в качестве мишени для разработки стратегий лечения рака. Однако для обоснования этой возможности потребуется дополнительная клиническая корреляция.
Экспрессия некоторых CD-антигенов в высокой степени ограничена линиеспецифическими лимфогемопоэтическими клетками, и в течение последних нескольких лет антитела против лимфоид-специфических антигенов, эффективные либо in vitro, либо в животных моделях, использовали для разработки способов лечения. В связи с этим, было доказано, что CD19 является очень полезной мишенью. CD19 экспрессируется во всей В-клеточной линии дифференцировки от про-В-клетки до зрелой В-клетки, он не "слущивается", равномерно экспрессируется на всех лимфомных клетках и отсутствует на стволовых клетках (Haagen, Clin Exp Immunol 90 (1992), 368-75, 14; Uckun, Proc. Natl. Acad. Sci. USA 85 (1988), 8603-7). CD19 вовлечен в развитие некоторых опосредованных В-клетками заболеваний, таких как различные формы неходжкинской лимфомы, опосредованные В-клетками аутоиммунные заболевания или истощение В-клеток.
Еще одним примером молекулы, которая вовлечена в прогрессирование и распространение многочисленных типов рака человека, является рецептор фактора роста гепатоцитов MET (C-MET). Онкоген MET, кодирующий рецепторную тирозинкиназу (RTK) для фактора роста гепатоцитов (HGF) и рассеивающего фактора (SF), контролирует генетические программы, приводящие к росту клеток, инвазии и защите от апоптоза. Не регулируемая активация MET является критической не только для выработки онкогенных свойств, но и для достижения инвазивного фенотипа (Trusolino, L & Comoglio, Р.М. (2002) Nat. Rev, Cancer 2, 289-300). Роль MET в опухолях человека выяснилась экспериментально и четко доказана открытием МЕТ-активирующих мутаций в унаследованных формах карцином (Schmidt et al., Nat. Genet. 16 (1997), 68-73; Kim et al., J. Med. Genet. 40 (2003), e97). Конститутивная активация MET часто имеет место при спорадических видах рака, и несколько исследований показали, что онкоген MET сверхэкспрессируется в опухолях специфических гистоцитов или активируется посредством аутокринных механизмов (список смотри на сайте http://www.vai.org/met/). Кроме того, ген MET амплифицируется в гемопоэтических метастазах колоректальных карцином (Di Renzo et al., Clin. Cancer Res. 1 (1995), 147-154).
Оказалось, что секретируемый в культуре фибробластами рассеивающий фактор (SF), который имеет способность вызывать внутриклеточную диссоциацию эпителиальных клеток, и фактор роста гепатоцитов (HGF), мощный митоген для гепатоцитов в культуре из тромбоцитов или из крови пациентов с острой печеночной недостаточностью, независимо идентифицированные как лиганды Met, представляют собой одну и ту же молекулу. Met и SF/HGF в значительной степени экспрессируются в различных тканях. Экспрессия Met (рецептор) в норме ограничена в своем распространении клетками эпителиального происхождения, а экспрессия SF/HGF (лиганд) ограничена клетками мезенхимального происхождения.
Met представляет собой трансмембранный белок, продуцируемый в виде одноцепочечного предшественника. Этот предшественник протеолитически расщепляется в фуриновом сайте с образованием в высокой степени гликозилированной и полностью внеклеточной α-субъединицы 50 кДа и β-субъединицы 145 кДа с большой внеклеточной областью (участвующей в связывании лиганда), трансмембранного сегмента и внутриклеточной области (обладающей каталитической активностью) (Giordano (1989) 339: 155-156). α- и β-цепи связаны дисульфидными мостиками. Внеклеточный участок Met содержит область гомологии с семафоринами (домен Sema, который содержит полную α-цепь и N-концевую часть β-цепи Met), богатую цистеиновыми остатками Met-родственную последовательность (MRS), за которой следуют богатые глицинпролиновыми остатками (G-P) повторы, и четыре иммуноглобулин-подобные структуры (Birchmeier et al., Nature Rev. 4 (2003), 915-25). Внутриклеточная область Met содержит три области: (1) юкстамембранный сегмент, который содержит: (а) остаток серина (Ser 985), который, когда он фосфорилирован протеинкиназой С или Са2+-кальмодулин- зависимыми киназами, понижает активность рецепторной киназы (Gandino et al., J. Biol. Chem. 269 (1994), 1815-20); и (б) тирозин (Tyr 1003), который связывает убиквитин-лигазу Cbl, ответственную за полиубиквитирование Met, эндоцитоз и деградацию (Peschard et al., Mol. Cell 8 (2001), 995-1004); (2) тирозинкиназный домен, который при активации рецептора подвергается трансфосфорилированию на Tyr1234 и Tyr1235; (3) С-концевую область, которая содержит два ключевых тирозина (Tyr-1349 и Tyi-1356), вставленных в вырожденный мотив, который представляет собой мультисубстратный стыковочный (docking) сайт, способный рекрутировать несколько расположенных ниже адаптеров, содержащих Src гомологичные-2 (SH2)-домены рецептора Met, так как большинство рецепторных тирозинкиназ (RTK) используют разные тирозины для связывания специфических сигнальных молекул. Было продемонстрировано, что два тирозина стыковочных сайтов необходимы и достаточны для сигнальной трансдукции как in vitro, так и in vivo (Maina et al., Cell 87 (1996), 531-542; Ponzetto et al., Cell 77 (1994), 261-71).
Хотя мощные и селективные доклинические лекарственные средства-кандидаты были разработаны с использованием С-МЕТ в качестве опухолевой мишени, последующие клинические испытания должны выявить, действительно ли эти лекарственные средства безопасны и демонстрируют терапевтическую эффективность у людей. В свете этих неопределенностей, все еще существует потребность в новых терапевтических концепциях для рака.
Рак опережает сердечное заболевание в качестве основной причины смерти американцев в возрасте до 85 лет в 2005 году. В настоящее время рак является второй лидирующей причиной смерти в Германии после сердечнососудистых заболеваний. Если значительные прорывы в предупреждении рака, сравнимые с достижениями в области сердечно-сосудистых заболеваний, не будут достигнуты в следующие несколько лет, то рак станет лидирующей причиной смерти в Германии за 15-20 лет. Ингибирование ангиогенеза опухоли является одной из противораковых стратегий, которая вызывала большой интерес среди клиницистов и исследователей рака в последние несколько лет. В ходе этих исследовательских усилий было идентифицировано несколько опухолевых эндотелиальных маркеров. Эндотелиальные маркеры опухолей (ТЕМ), подобные эндосиалину (= ТЕМ1 или CD248), сверхэкспрессируются в процессе ангиогенеза опухоли (St. Croix et al., Science 289 (2000), 1197-1202).
Несмотря на то, что их функции до сих пор детально не изучены, в исследованиях развивающихся эмбрионов и опухолей четко установлено, что они экспрессируются строго на сосудистых эндотелиальных клетках (Carson-Walter et al., Cancer Res. 61: 6649-6655, 2001). Соответственно, эндосиалин, трансмембранный белок типа I 165 кДа, экспрессируется на клеточной поверхности эндотелия кровеносных сосудов опухоли при самых разнообразных видах рака человека, но не обнаруживается в кровеносных сосудах или других типах клеток во многих нормальных тканях. Он представляет собой лектиноподобную молекулу С-типа сигнального лидерного пептида, состоящую из 757 аминокислот, пяти глобулярных внеклеточных доменов (включая домен пектина С-типа, причем один домен, сходный с паттерном Sushi/ccp/scr, и три EGF повтора), за которыми следует муциноподобная область, трансмембранный сегмент и короткий цитоплазматический хвост (Christian et al., J. Biol. Chem. 276: 7408-7414, 2001). Коровый белок эндосиалина несет на себе в значительной степени сиалилированные O-связанные олигосахариды и чувствителен к O-сиалогликопротеинэндопептидазе, что позволяет отнести его к группе сиаломуциноподобных молекул. N-концевые 360 аминокислот эндосиалина демонстрируют гомологию с тромбомодулином, рецептором, вовлеченным в регуляцию коагуляции крови, и с комплементарным рецептором C1qRp. Эта структурная взаимосвязь указывает на то, что эндосиалин функционирует в качестве опухолевого эндотелиального рецептора. Хотя иРНК эндосиалина повсеместно экспрессируется на эндотелиальных клетках в нормальных человеческих и мышиных соматических тканях, белок эндосиалин в значительной степени ограничивается желтым телом и высокоангиогенными тканями, такими как гранулярная ткань заживающих ран или опухолей (Opavsky et al., J. Biol. Chem. 276 (2001, 38795-38807; Rettig et al., PNAS 89 (1992), 10832-36). Экспрессия белка эндосиалина подвергается повышающей регуляции на опухолевых эндотелиальных клетках карцином (молочной железы, почки, легкого, колоректальных, ободочной кишки, поджелудочной железы, мезотелиом), сарком и нейроэктодермальных опухолей (меланом, глиом, нейробластом) (Rettig et al., см. выше). Кроме того, эндосиалин экспрессируется на низком уровне на субпопуляции опухолевых стромальных фибробластов (Brady et al., J. Neuropathol. Exp.Neurol. 63 (2004), 1274-83; Opavsky et al., см. выше). Благодаря его ограниченному распределению в нормальной ткани и распространенной экспрессии на опухолевых эндотелиальных клетках многих разных типов солидных опухолей, эндосиалин рассматривается как мишень для антительных антиангиогенных стратегиях лечения рака. Однако до сих пор все еще не существует эффективных терапевтических подходов с использованием эндосиалина в качестве опухолевой эндотелиальной мишени.
Молекулой, которая очень часто и в значительной степени экспрессируется на большинстве клеток аденокарциномы и нескольких сквазмозно-клеточных карцином, является ЕрСАМ (CD326) (Went et al., Br. J. Cancer 94 (20006), 128-135). Недавние исследования показали, что ЕрСАМ представляет собой сигнальную молекулу, которая может активировать нуклеарную экспрессию протоонкогена с-Мус и циклинов (Munz et al., Oncogene 23 (2004), 5748-58). При сверхэкспрессии в покоящихся Т-клетках ЕрСАМ индуцирует клеточную пролиферацию, независимость от факторов роста и рост колоний в мягком агаре, которые являются признаками онкогенных белков. При блокировании экспрессии ЕрСАМ малой интерферирующей РНК (миРНК) в клетках рака молочной железы такие клетки прекращают пролиферировать, мигрировать и быть инвазивными (Osta et al., Cancer Res. 64 (2004), 5818-24). Эта онкогенная сигнализация ЕрСАМ может объяснить, почему сверхэкспрессия ЕрСАМ коррелирует с плохой общей выживаемостью при многих злокачественных образованиях человека, включая рак молочной железы и рак яичника (Spizzo et al., Gynecol. Oncol. 103 (2006), 483-8). ЕрСАМ уже используется в качестве антигена-мишени в нескольких терапевтических подходах с использованием антител, включая антитело человека (Obemeder et al., Eur. J. Cancer 42 (2006), 2530-8) и ЕрСАМ×CD3 биспецифическое одноцепочечное антитело, названное МТ110. Характеристики МТ110 недавно были подробно описаны (Brischwein et al., 43 (2006), 1129-43). Это антитело обладает активностью против различных клеточных линий карциномы человека, экспрессирующих антиген-мишень, и в настоящее время проходит тестирование в фазе I испытаний в отношении безопасности и начальных признаков эффективности.
Более конкретно, рак опережает сердечное заболевание в качестве основной причины смерти американцев до 85 лет в 2005 году. В настоящее время рак является второй лидирующей причиной смерти в Германии после сердечно-сосудистых заболеваний. Если значительные прорывы в предупреждении рака, сравнимые с достижениями в области сердечнососудистых заболеваний, не будут достигнуты в следующие несколько лет, то рак станет лидирующей причиной смерти в Германии за 15-20 лет. Среди более 100 типов различных видов рака эпителиальный рак является лидирующей причиной смерти от рака в Германии. При эпителиальном раке инвазия и метастазирование злокачественных эпителиальных клеток в нормальные ткани сопровождается адаптивными изменениями в мезенхимальной поддерживающей строме органов-мишеней. Измененная экспрессия гена в этих нетрансформированных стромальных клетках обсуждалась в отношении обеспечения потенциальных мишеней для терапии. Клеточный поверхностный протеазный белок активации фибробластов альфа (FAP-альфа) является одним из примеров такой мишени активированных опухолевых фибробластов. Белок активации фибробластов альфа представляет собой индуцибельный клеточный поверхностный гликопротеин, который первоначально был идентифицирован в культуре фибробластов с использованием моноклонального антитела F19. Иммуногистохимические исследования показали, что FAP-альфа временно экспрессируется в некоторых нормальных фетальных мезенхимальных тканях, но нормальные ткани взрослых, а также злокачественные эпителиальные, нервные и гематопоэтические клетки обычно являются FAP-альфа-отрицательными. Однако большинство распространенных эпителиальных раковых опухолей содержат большое количество FAP-альфа-реактивных стромальных фибробластов. Scanlan и др. (Proc. Nat. Acad. Sci. 91: 5657-5661, 1994) клонировали кДНК (комплементарная ДНК) FAP-альфа из библиотеки экспрессии кДНК человеческих фибробластов WI-38 путем иммуноселекции с использованием антитела F19. Спрогнозированный белок FAP-альфа человека, состоящий из 760 аминокислот, представляет собой интегральный мембранный белок типа II с большим С-концевым внеклеточным доменом, который содержит 6 сайтов потенциального М-гликозилирования, 13 цистеиновых остатков и 3 сегмента, которые соответствуют высококонсервативным каталитическим доменам серинпротеаз, гидрофобный трансмембранный сегмент и короткий цитоплазматический хвост. FAP-альфа демонстрирует 48%-ную аминокислотную идентичность с дипептидилпептидазой IV (DPP4) и 30%-ную идентичность с DPP4-родственным белком (DPPX). В Нозерн-блот-анализе обнаружили в фибробластах иРНК FAP-альфа 2,8 т.п.н. Сепраза представляет собой интегральную мембранную желатиназу 170 кДа, чья экспрессия коррелирует с инвазивнностью клеток меланомы и карциномы человека. Goldstein с соавторами (Biochim. Biophys. Acta 1361: 11-19, 1997) клонировали и охарактеризовали соответствующую кДНК сепразы. Авторы установили, что сепраза и FAP-альфа представляют собой один и тот же белок и продукты одного и того же гена. Pineiro-Sanchez с соавторами (J. Biol. Chem. 272: 7595-7601, 1997) выделили белок сепразу/FAP-альфа из клеточных мембран и "отшнуровывающихс